海州湾潮间带大型底栖动物多样性研究
2017-08-22李军季相星姜玲姜毅
李军,季相星,姜玲,姜毅
(连云港市环境监测中心站,江苏 连云港 222001)
海州湾潮间带大型底栖动物多样性研究
李军,季相星,姜玲,姜毅
(连云港市环境监测中心站,江苏 连云港 222001)
2015年10月和11月调查了海州湾潮间带A、B 2个断面的大型底栖动物,共发现大型底栖动物29种,其中A断面发现19种,B断面23种;潮间带大型底栖动物的总平均丰度为1 790 m-2,总平均生物量185.11 g/m2。A、B 2断面的丰度生物量差异较大,主要是由于2个断面底质类型不同造成的。潮间带Shannon-Wiener多样性指数平均值为2.90,波动为2.44~3.45,其沉积物环境存在轻度有机质污染。
海州湾;潮间带;大型底栖动物;多样性
潮间带生态环境复杂多变,生物资源丰富,是海岸带的重要组成部分。在底质相对疏松的泥砂质滩涂,常适合于较多经济物种的养殖,其产量在海产品中常占相当大的份额。海州湾位于中国黄海中南部,为典型的开敞式海湾,呈新月形,是砂质-岩石海岸和泥质海岸的交汇地带。近年来,国内学者已对渤海湾、黄河口、长江口等典型的潮间带进行了较系统的研究[1-7],但对砂质、岩石和泥质交汇地带的海州湾潮间带却鲜见报道[8-9]。现于2015年10—11月调查分析海州湾潮间带大型底栖动物的丰度、生物量及生物多样性,以期为该海域潮间带生态系统的深入研究提供参考。
1 研究方法
1.1 站位设置
在海州湾潮间带共设置2个断面,A断面为典型的砂质潮间带,B断面为泥质潮间带。在每个断面上分别按高潮带、中潮带和低潮带依次设置3个站位,共计6个站位,见图1。

图1 海州湾潮间带大型底栖动物调查站位
1.2 分析方法
使用GPS定位,在潮位适合的时候到设置的站点处进行采样。采用25 cm×25 cm取样框随机取样,每次取3个平行样。取样后当场用0.5 mm的网筛进行筛选,将筛选后所留物装入塑料瓶中,加等体积10%甲醛溶液固定后,置于常温保存。
实验室内使用0.5 mm网筛进行样品分选后,解剖镜下进行样品种类鉴定及计数。样品的采集、保存、计数和称量均按照《海洋调查规范》和《海洋监测规范》进行[10-11]。
1.3 数据处理
优势种采用相对重要性指数IRI(Index of Relative Importance)[12]进行确定。计算公式如下:
IRI=(W+N)×F
式中:W——每种的生物量占总生物量的百分比;
N——每种的丰度占总丰度的百分比;
F——该种出现的频率。
生物多样性采用Shannon-Wiener多样性指数(H’)[13]、Margalef丰富度指数(d)[14]及Pielou’s均匀度指数(J’)[15]进行分析。公式如下:

式中:Pi——第i种的个体数与总个体数的比值;
N——总个体数;
S——总种数。
2 结果分析
2.1 大型底栖动物种类组成
调查共发现大型底栖动物29种,分属于5个门类,各门类种数及所占比例见图2。其中A断面共发现19种,包括多毛类11种,甲壳动物4种,软体动物2种,纽行动物及腕足动物各1种;B断面共发现23种,包括多毛类11种,甲壳动物5种,软体动物5种,纽形动物及腕足动物各1种。
表1分列出了各断面相对重要性指数(IRI)前5位的种。由表1可见,10种生物中包括多毛类5种和软体动物4种,说明这2种生物类群在调查潮间带的大型底栖动物群落中有着重要作用。A、B两断面优势种差别较大,IRI前5位没有相同的种类;A断面以多毛类为主,而B断面软体动物的优势较明显,特别是中国绿螂(G.chinenesis)的优势度远高于其他种类。

图2 各门类种数及所占比例
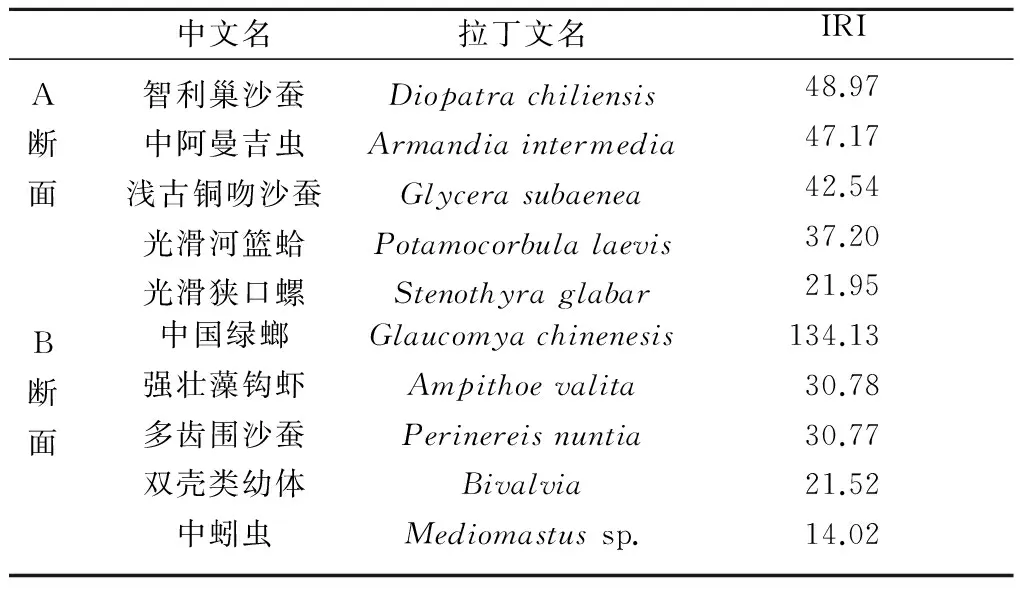
中文名拉丁文名IRIA智利巢沙蚕Diopatrachiliensis48.97断中阿曼吉虫Armandiaintermedia47.17面浅古铜吻沙蚕Glycerasubaenea42.54光滑河篮蛤Potamocorbulalaevis37.20光滑狭口螺Stenothyraglabar21.95B中国绿螂Glaucomyachinenesis134.13断强壮藻钩虾Ampithoevalita30.78面多齿围沙蚕Perinereisnuntia30.77双壳类幼体Bivalvia21.52中蚓虫Mediomastussp.14.02
2.2 大型底栖动物的丰度和生物量
2.2.1 丰度
表2列出了各站位大型底栖动物的丰度。由表2可见,大型底栖动物总平均丰度为1 790 m-2。丰度的波动范围较大(368~5 488 m-2),这主要是由于A、B两断面的丰度差异较大造成的,A断面的平均丰度为507 m-2,B断面的平均丰度为3 072 m-2。造成A、B两断面丰度差异较大的主要原因可能是底质类型的不同。 A断面为砂质潮间带,除高潮带A1含少量泥外,中潮带A2和低潮带A3均为砂质底质。B断面为泥质潮间带,除高潮带B1含少量粗砂外,中潮带B2和低潮带B3均为泥质底质。泥质潮间带有机质含量丰富,砂质潮间带有机质含量低,造成了A、B 2断面的丰度差异。
2.2.2 生物量
表3列出了各站位大型底栖动物的生物量。由表3可见,此次调查大型底栖动物的总平均生物量为185.11 g/m2,范围为0.39~608.71 g/m2。生物量的波动范围也较大,A、B 2个断面生物量差异较大,A断面的平均生物量为1.58 g/m2,B断面的平均生物量为368.64 g/m2。A断面丰度较低且未发现大个体的生物,导致其生物量也较低。B断面发现了大量的大个体生物,如多齿围沙蚕(P.nuntia)、绒毛近方蟹(Hemigrapsuspenicillatus)等,特别是高潮带B1及中潮带B2均发现了大量的中国绿螂(G.chinenesis,高潮带493.08 g/m2,中潮带376.20 g/m2)。A断面低潮带生物量最高,其次为高潮带,而中潮带最低。B断面生物量由高潮带至低潮带逐渐降低。
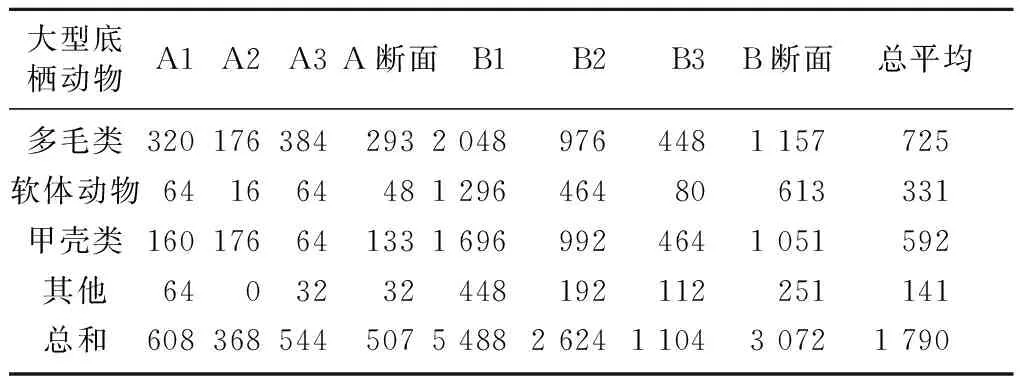
表2 各站位大型底栖动物丰度 m-2
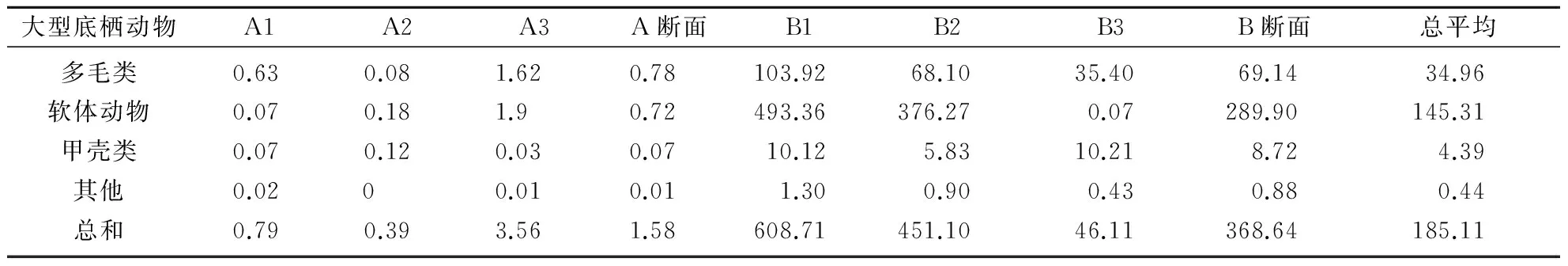
表3 各站位大型底栖动物生物量 g/m2
2.3 大型底栖动物的多样性
表4列出了各站位大型底栖动物多样性指数。由表4可见,调查潮间带种数平均值为12.2种,波动范围为7~15种;H’ 平均值2.90,波动范围2.34~3.45;J’ 平均值0.87,波动范围0.68~1.00;d平均值1.10,波动范围0.70~1.51。A、B两断面多样性相差不大,B断面发现的种数略多于A断面,多样性略高于A断面。H’能够较好地指示沉积物环境有机质污染状况[16-17],调查潮间带H’ 平均值为2.90,6个调查站位中有3个站位H’<3,认为调查潮间带的沉积物环境存在着轻度的有机质污染,但并不严重。
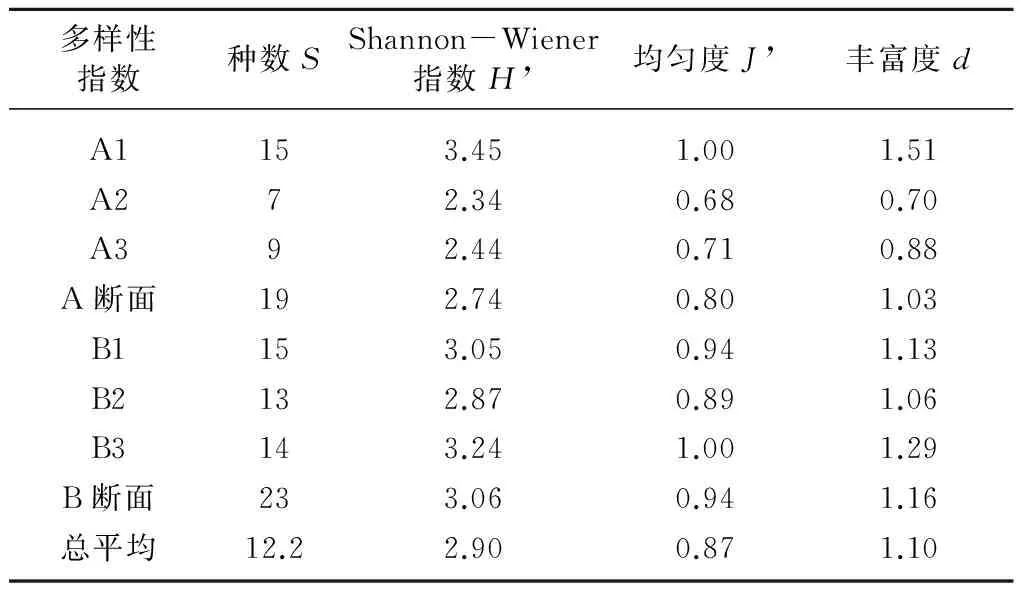
表4 各站位大型底栖动物多样性指数
3 讨论
表5为该次调查与其他海域潮间带大型底栖动物调查结果的对比。由表5可见,调查发现的种类数最少,H’仅次于福建海坛海峡潮间带,丰度仅次于烟台潮间带,生物量仅次于黄河三角洲和烟台潮间带。
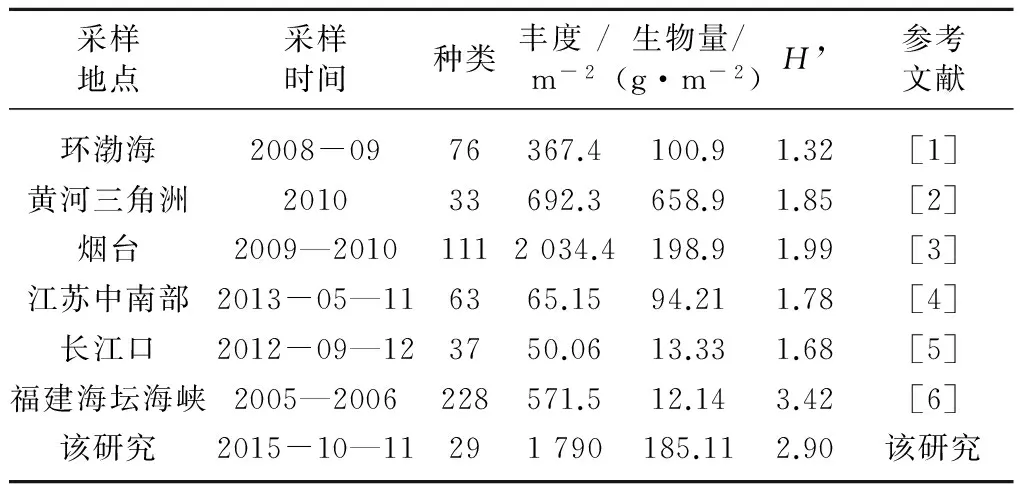
表5 与其他海域潮间带调查结果比对
调查发现的种类较少可能是由于调查的点位和次数都比较少造成的。如环渤海调查共发现76种,但其调查点位多,实际波动范围为2~23种,烟台潮间带共发现111种,但其调查次数多,实际波动范围为3~36种。文章进行了2个断面的一次调查,未来还需多断面多次数的调查才能更好地反映海州湾潮间带大型底栖动物的种类组成。
虽然发现的种类较少,但丰度及生物量并不低,这主要是由B断面的高丰度高生物量造成的。对比A、B 2个断面,B断面的丰度是A断面的6倍,生物量是A断面的233倍。造成A、B两个断面丰度生物量差异较大的主要原因是底质类型的不同。同其他几个潮间带相比,海州湾潮间带H’ 较高,仅次于福建海坛海峡潮间带,说明海州湾潮间带沉积物环境要优于除福建海坛海峡外的其他几个潮间带,但也存在着轻度的有机质污染。
[1] 王海博,蔡文倩,林岿璇,等.环渤海潮间带秋季大型底栖动物生态学研究[J].环境科学研究,2011,24(12):1339-1345.
[2] 董贯仓,李秀启,刘峰,等.黄河三角洲潮间带底栖动物群落结构分析及环境质量评价[J].海洋环境科学,2012,31(3):370-374.
[3] 韩庆喜,袁泽轶,陈丙见,等.烟台潮间带大型底栖动物群落组成和结构研究[J].海洋科学,2014,38(9):59-68.
[4] 张虎,汤晓鸿,郭仲仁,等.江苏中南部潮间带大型底栖动物时空分布特征[J].海洋渔业,2014,36(3):208-215.
[5] 陈强,郭行磐,周轩,等.长江口及其邻近水域滩涂底栖动物多样性的研究[J].大连海洋大学学报,2016,31(1):103-108.
[6] 吕小梅,方少华,张跃平,等.福建海坛海峡潮间带大型底栖动物群落结构及次级生产力[J].动物学报,2008,54(3):428-435.
[7] 姜晟.滨海湿地环境评价方法研究[J].环境监控与预警,2015,7(5):52-56.
[8] 高爱根,杨俊毅,曾江宁,等.海州湾潮间带大型底栖动物的分布特征[J].海洋学研究,2009,27(1):22-29.
[9] 季相星,姜毅,李军,等.连云港市泥砂质潮间带大型底栖动物群落调查[J].环境监控与预警,2014,6(6):41-44.
[10] 国家质量监督局.海洋调查规范 第6部分:GB/T 12763.6—2007 [S].北京:中国标准出版社,2007:41-44.
[11] 国家质量监督局.海洋监测规范 第7部分:GB 17378.7-2007 [S].北京:中国标准出版社,2007:12-22.
[12] PINKAS L,OLIPHANT M S,IVERSON I L K. Food habits of albacore,bluefin tuna,and bonito in california waters[J].California Department of Fish and Game Fish Bulletin,1971 (152):1-105.
[13] SHANNON C E, WEAVER W. The mathematical theory of communication[J]. Urbana: University of Illinois Press, 1949.
[14] MARGALEF R. Temporal succession and spatial heterogeneity in phytoplankton. In: Buzzati~Traverso A A. ed. Perspectives in marine biology[J]. University of California, press,1958:323-349.
[15] PIELOU E C. Ecological diversity[M]. New York: John Wiley, 1975:16-51.
[16] 蔡立哲,马丽,高阳,等.海洋底栖动物多样性指数污染程度评价标准的分析[J].厦门大学学报,2002,41(5):641-646.
[17] 陈志宁,张红高, 周崴,等.滆湖大型底栖动物群落分布和氮磷因子的相关分析[J].环境监控与预警,2016,8(1):41-44.
Biodiversity of Macrobenthos in the Intertidal Zone of Haizhou Bay
LI Jun, JI Xiang- xing, JIANG Ling, JIANG Yi
(Lianyungang Environmental Monitoring Central Station, Lianyungang Jiangsu 222001,China)
Macrobenthos were investigated at 2 sections in the intertidal zone of Haizhou Bay in Oct. and Nov. 2015. We identified a total of 29 species, of which 19 species in section A and 23 species in section B. The average abundance of macrobenthos was 1 790m-2, and the average biomass was 185.11g/m2. There were great differences in the abundance and biomass of section A and B, which was mainly caused by the different sediment of the two sections. The mean Shannon-Wiener index was 2.90, with a range of 2.44~3.45. Our results indicated that the sediment has been slightly polluted.
Haizhou Bay;The intertidal zone; Macrobenthos; Biodiversity
10.3969/j.issn.1674-6732.2017.04.012
2016-08-04;
2017-02-04
李军(1974—),男,高级工程师,本科,从事环境监测与管理工作。
X835
B
1674- 6732(2017)04- 0045- 04
