64Cu-DOTA-SPIONs-PEG-FA:靶向叶酸受体阳性肿瘤的PET/MRI双模态显像探针
2017-08-22孙钰林申一鸣梁积新陈玉清沈浪涛
孙钰林,申一鸣,梁积新,陈玉清,沈浪涛,*
1.中国原子能科学研究院 国家同位素工程技术研究中心,北京 102413;2.原子高科股份有限公司,北京 102413
64Cu-DOTA-SPIONs-PEG-FA:靶向叶酸受体阳性肿瘤的PET/MRI双模态显像探针
孙钰林1,2,申一鸣1,2,梁积新1,陈玉清1,2,沈浪涛1,2,*
1.中国原子能科学研究院 国家同位素工程技术研究中心,北京 102413;2.原子高科股份有限公司,北京 102413
报道了一种可用于叶酸受体阳性肿瘤显像的PET/MRI双模态显像探针(64Cu-DOTA-SPIONs-PEG-FA)的合成、初步的生物学评价及PET/CT和MRI显像结果。该探针由包覆了生物相容性的聚乙二醇(poly ethylene glycol, PEG)、超顺磁氧化铁纳米粒子(superparamegnetic iron oxide nanoparticles, SPIONs)、叶酸(folic acid, FA)、1,4,7,10-四乙酸-1,4,7,10-四氮杂环十二烷(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)和正电子放射性核素64Cu组成。经纯化后,64Cu-DOTA-SPIONs-PEG-FA放化纯大于98%。荷KB裸鼠体内分布显示:64Cu-DOTA-SPIONs-PEG-FA在肝脏、脾脏和肺中的放射性摄取较高,与非靶向标记物64Cu-DOTA-SPIONs-PEG-OH比较,其对KB细胞瘤有明显的靶向作用。在MRI和PET/CT模式下,KB肿瘤能被较清晰地显像。64Cu-DOTA-SPIONs-PEG-FA作为KB细胞肿瘤的PET/MRI双模态显像剂,有待于进一步深入研究以改善其标记率、稳定性和比活度等。
PET/MRI双模态显像探针;超顺磁性氧化铁纳米粒子;叶酸;DOTA;64Cu
近期的研究报告指出,2012年全球新增1 400万癌症病人并有820万病人死亡。其中,中国新增307万癌症病人并约有220万人死亡。癌症的早期诊断和有效治疗可以降低大约每年1/3至1/2(即240万~370万)癌症病人的死亡[1]。肿瘤早期诊断和靶向治疗药物的设计是利用各种肿瘤生物标志物(如特异性受体、单克隆抗体及其片段、多肽等)来实现的[2]。在许多肿瘤(如卵巢癌、宫颈癌、子宫内膜癌、肺癌、肾癌、乳腺癌、结肠癌和脑癌)中叶酸受体(folate receptor,FR)被过度表达。因此,叶酸受体是与这些肿瘤密切相关的靶标。人们已开展了以叶酸受体为靶向的各种肿瘤放射性显像药物的研究[3-4]。然而,无论是单光子发射计算机断层成像(SPECT)还是正电子发射断层成像(PET)的单模态显像技术,尽管它们具有高灵敏度等优点,但其空间分辨率较低。因此,融合了两种显像模态的SPECT/电子计算机断层扫描(CT)、PET/CT已在临床中得到了广泛应用。PET/磁共振成像(MRI)双模态显像技术既具有高灵敏度和高软组织对比度,而且与PET/CT相比,还显著降低了辐射剂量,已成为具有广阔应用前景的双模态医学影像技术。目前,全球约有70台PET/MRI已投入临床使用[5]。用于PET/MRI的双模态显像探针也正在研发中[6-8]。
PET/MRI双模态显像探针既要含有MRI成像组分,还要含有能用于PET显像的组分,还可能含有靶向分子。表面包覆有聚乙二醇(poly ethylene glycol, PEG)等聚合物的超顺磁氧化铁纳米粒子(superparamagnetic iron oxide nanoparticles, SPIONs)本身既可以作为MRI造影剂,还可以作为构建双(或多)模态分子影像探针和其它生物医学应用的平台[9-10]。以叶酸受体为靶向的MRI肿瘤对比剂已有一些研究[11-13],但其PET/MRI双模态显像探针鲜见报导。
本工作拟先合成表面接有3-氨基丙基三乙氧基硅烷的超顺磁氧化铁纳米粒子(SPIONs-APTES);然后,把预先与叶酸偶联的聚乙二醇(FA-PEG)与SPIONs-APTES连接,得到SPIONs-PEG-FA;接着,再将能与正电子核素64Cu牢固结合的双功能螯合剂1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1, 4, 7, 10-tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid, DOTA)连接到SPIONs-PEG-FA上,获得DOTA-SPIONs-PEG-FA,进行核素64Cu标记后得到标记物(64Cu-DOTA-SPIONs-PEG-FA)(图1)。最后分别用靶向探针64Cu-DOTA-SPIONs-PEG-FA和非靶向探针64Cu-DOTA-SPIONs-PEG-OH对荷KB细胞裸鼠进行体内生物分布以及PET和MRI显像的研究。
1 实验部分
1.1 试剂和仪器
N,N′-二环己基碳二亚胺(dicyclohexylcarbodiimide, DCC),上海沃凯化学试剂有限公司;1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride, EDC),N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS),Alfa Aesar公司;氨基羧基聚乙二醇(NH2-PEG2000-COOH),北京希凯创新科技有限公司;叶酸(folic acid, FA)、3-氨基丙基三乙氧基硅烷(3-aminopropyltriethoxysilane, APTES)、二乙基三胺五乙酸(diethylene triamine pentacetate acid, DTPA)、醋酸铵及其它化学试剂均为分析纯,国药集团试剂有限公司;1,4,7,10-四乙酸-1,4,7,10-四氮杂环十二烷由本实验室制备;Whatman 1号层析纸、超滤浓缩离心管(Vivaspin 500, 10 kDa),美国GE公司;透析袋(MWCO:8 000~14 000),国药集团试剂有限公司;透析袋(MWCO:1 000),佰聚生物;64CuCl2溶液由北京原子高科股份有限公司提供。
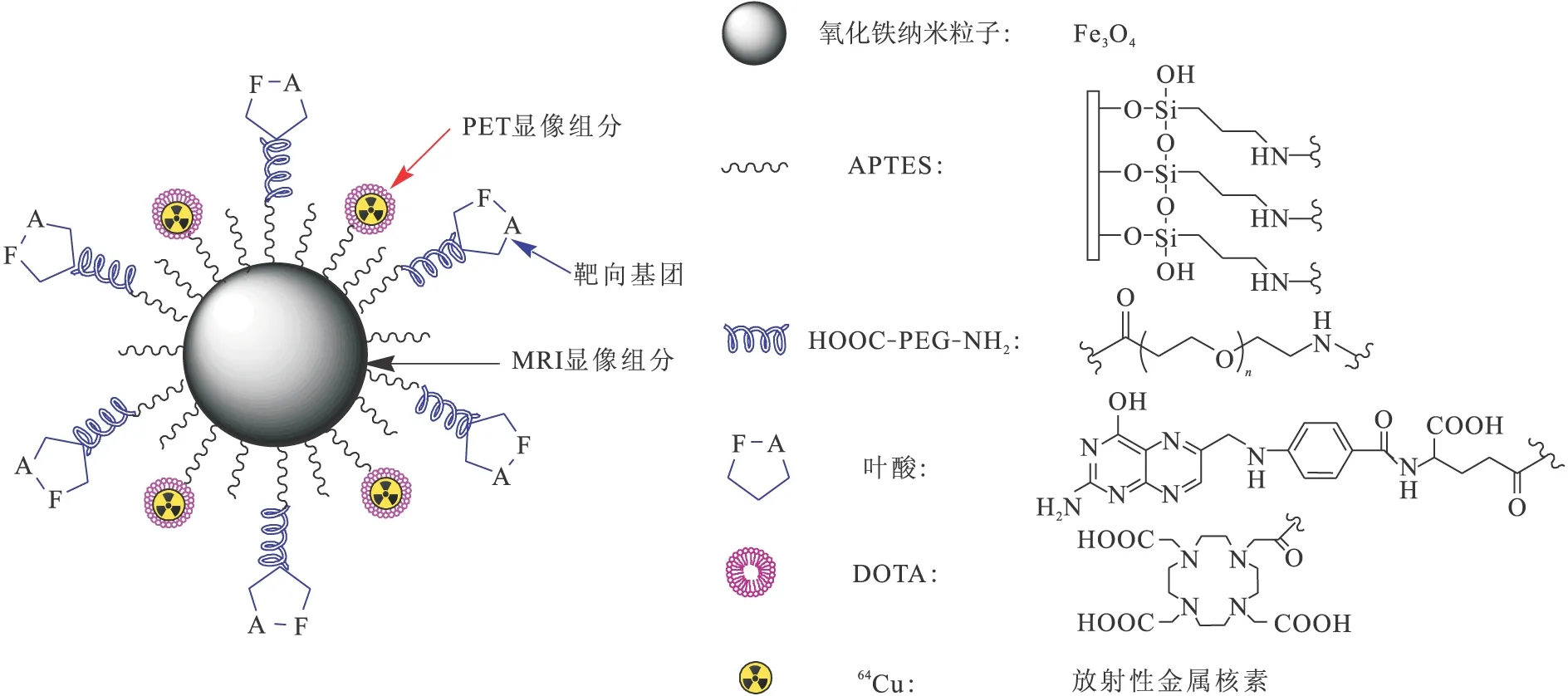
图1 64Cu-DOTA-SPIONs-PEG-FA的结构示意图Fig.1 Structure of 64Cu-DOTA-SPIONs-PEG-FA
荷KB人口腔表皮样癌细胞裸鼠,SPF级,中国医学科学院肿瘤研究所。取4~5周龄Balb/c雌性裸鼠,右前肢腋下接种5×106个KB细胞,待肿瘤平均直径达到8~10 mm时用于实验。
FD-80型真空冷冻干燥机,北京博医康实验仪器有限公司;JEM2100F型透射电子显微镜、JMS-T100CS质谱仪,日本电子株式会社;Nano ZS动态光散射粒度分析仪,英国Malvern公司;Affinity-1傅里叶变换红外光谱仪、UV-2700紫外-可见吸收光谱仪,日本SHIMADAZU公司;BKT-4500Z型振动样品磁强计,美国Quantum Design公司;ADVANCE Ⅲ 400 MHz核磁共振波谱仪,德国Bruker公司;AR-2000放射性薄层扫描仪,德国Eckert Ziegler公司;1470-002 γ 计数器,美国Perkin Elmer公司;7.0 T小动物磁共振成像仪,美国Varian公司;Inveon 小动物PET/CT成像仪,德国Siemens公司。
1.2 纳米粒子的合成与表征
从超顺磁氧化铁纳米粒子核心的合成开始,经六步反应合成DOTA-SPIONs-PEG-FA,其反应路线示于图2。
1.2.1 SPIONs的制备 合成反应在N2保护下进行。将549 mg FeCl3·6H2O和282 mg FeSO4·7H2O溶于40 mL氮气饱和水中,搅拌溶解。滴加氨水将pH调至 9,再将温度升高到50 ℃,继续反应1 h。反应完毕后,用50 mL除氧水洗涤,磁铁吸附倾倒,除去铵盐,重复3次。产物在60 ℃下真空干燥,得到黑色块状固体SPIONs 123 mg(产率为53%),于4 ℃下保存。
1.2.2 SPIONs-APTES的制备 移取0.5 mL氮气饱和水和10 mL无水乙醇混合,制备含水量为3%~5%(体积比)的水-乙醇混合溶液,并用冰醋酸调节pH 为4.5~5.5。然后,加入200 μL 3-氨基丙基三乙氧基硅烷,活化5 min。再加入86 mg SPIONs,机械搅拌,反应过夜。反应结束后,以20 mL 95%乙醇洗涤,磁铁吸附倾倒,除去未反应的APTES,重复5次。产物在60 ℃下真空干燥,得到黑色粒状固体SPIONs-APTES 100 mg,于4 ℃下保存。
1.2.3 FA-NHS的合成 本反应在室温、N2保护和避光下进行。将502 mg 叶酸加入到10 mL无水二甲基亚砜(DMSO)中,搅拌至溶解。再加入250 mg DCC反应2 h。将150 mg NHS溶于1 mL无水DMSO中,然后滴加到上述反应液中,5 min滴加完毕,在室温下反应过夜。将粗产物过滤除去沉淀,在40 ℃下将滤液减压浓缩30 min,再向滤液中滴加无水乙醚∶丙酮=7∶3(体积比,下同)的混合液,至不再生成沉淀为止。过滤,所得固体以50 mL无水乙醚∶丙酮=7∶3的混合液洗涤,重复3次,于30 ℃下真空干燥,获得黄色粒状固体FA-NHS 322 mg(产率为53%),装瓶封口后在-20 ℃下保存。
1.2.4 FA-PEG的合成 在室温、N2保护下,将300 mg NH2-PEG-COOH加入到10 mL DMSO中,再将162 mg FA-NHS溶于2 mL DMSO中,滴加到上述反应液中,5 min滴加完毕,再加入150 mgN,N-二异丙基乙基胺,于避光条件下反应24 h。粗产物在去离子水中透析(截留分子量(MWCO)=1 000 Da)48 h后冻干,得到黄色泡沫状固体FA-PEG 267 mg(产率为76%),装瓶封口后-20 ℃下保存。
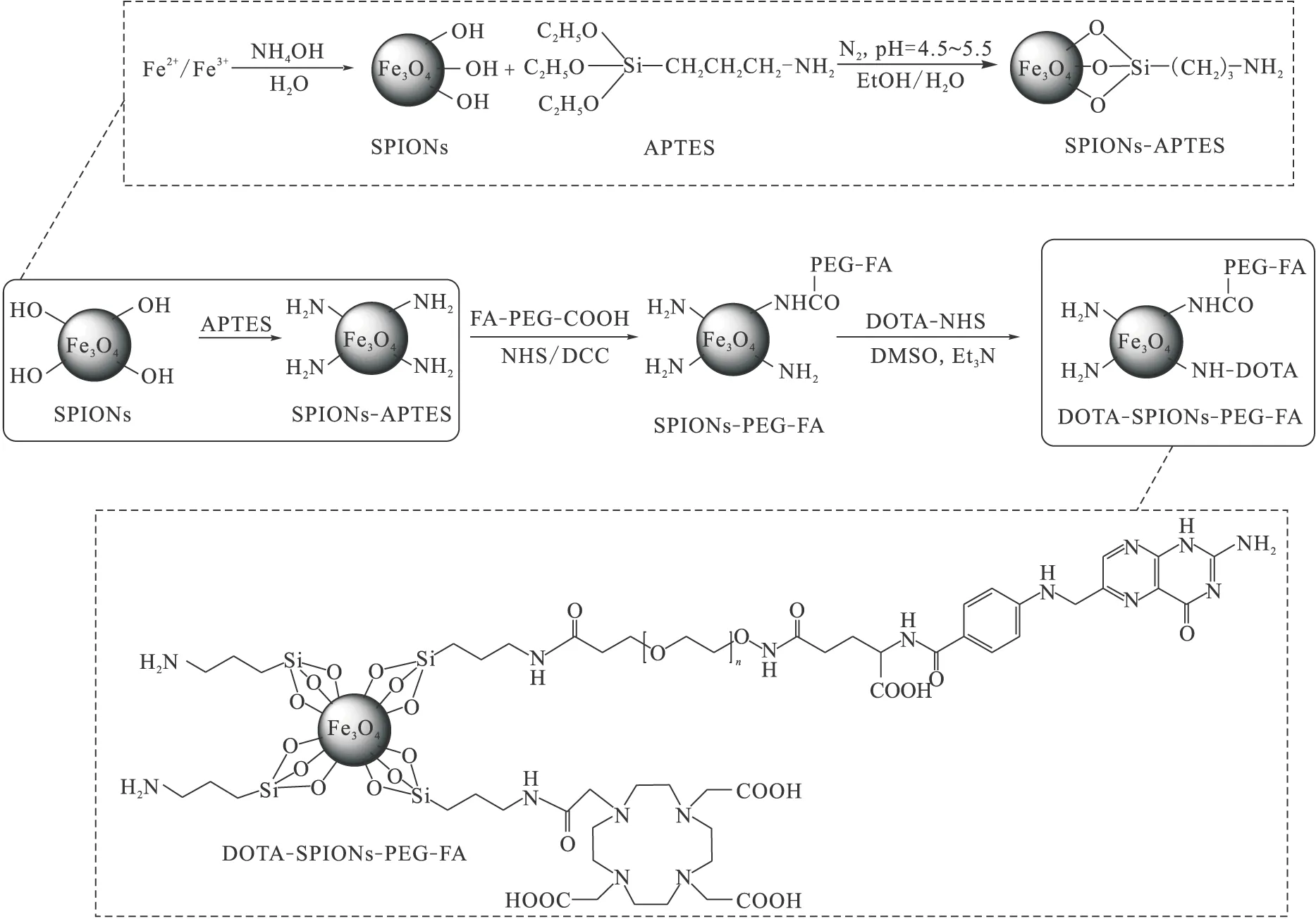
图2 DOTA-SPIONs-PEG-FA的合成路线示意图Fig.2 Synthetic scheme of DOTA-SPIONs-PEG-FA
1.2.5 SPIONs-PEG-FA的制备 在N2保护下,将160 mg FA-PEG溶于20 mL无水DMSO中,加入84.8 mg EDC搅拌10 min,再加入24.8 mg NHS搅拌30 min。然后,将50 mg SPIONs-APTES溶于5 mL无水DMSO中,加入上述反应液中,反应过夜。反应结束后,经透析(MWCO=8 000~14 000)、冻干,得到黑色固体SPIONs-PEG-FA 169 mg,装瓶封口后在-20 ℃下保存。
1.2.6 DOTA-SPIONs-PEG-FA的制备 称取50 mg DOTA溶于5 mL水中,9.5 mg EDC溶于1 mL水中,将两者混合。用0.1 mol/L NaOH将pH值调至5,反应10 min。将反应瓶移至冰浴中,加入9 mg NHS,再用0.1 mol/L NaOH将pH值调至5.5,继续反应30 min。称取25 mg SPIONs-PEG-FA溶于3 mL水中,加入上述反应液中,再用0.1 mol/L NaOH将反应液pH值调至8.5,反应过夜。反应结束后,经透析(MWCO=8 000~14 000)、冻干,得到黑色固体DOTA-SPIONs-PEG-FA 28 mg,装瓶封口后在-20 ℃下保存。
1.2.7 纳米粒子的表征 采用傅里叶红外光谱仪(FTIR)测定纳米粒子的红外光谱。通过动态光散射(DLS)的方法测量纳米粒子的水合动力学直径分布。用透射电子显微镜(TEM)观察纳米粒子的形貌。采用振动样品磁强计(VSM)测定纳米粒子的饱和磁化强度、矫顽力和剩磁。用紫外-可见吸收光谱仪(UV)测定各样品中铁元素的含量。用小动物核磁共振成像仪扫描不同浓度的样品,根据各浓度信号强度拟合出DOTA-SPIONs-PEG-FA的弛豫率。
1.364Cu的标记反应
1.3.1 配体浓度对标记率的影响 分别取100 μL溶有1 μg、10 μg、100 μg、1 mg DOTA-SPIONs-PEG-FA的0.1 mol/L醋酸铵缓冲溶液(pH=6.5),加入到2 mL EP管中,再加入100 μL(约52 MBq)的64CuCl2,涡旋混匀,在40 ℃下孵育45 min,然后用快速薄层层析法测定标记率。
1.3.2 温度对标记率的影响 取100 μL溶有10 μg DOTA-SPIONs-PEG-FA的0.1 mol/L醋酸铵缓冲溶液,加入到2 mL EP管中,再分别加入70 μL (约37 MBq)的64CuCl2,涡旋混匀,分别在40、60、80、100 ℃下孵育45 min,然后用快速薄层层析法测定标记率。
1.4 标记物的纯化和体外稳定性
取5 mg的DOTA-SPIONs-PEG-FA溶于500 μL醋酸铵缓冲溶液(pH=6.5),加入到2 mL EP管中,再加入64CuCl2(约296 MBq),涡旋混匀,在60 ℃下孵育45 min。
采用超滤浓缩离心管离心的方法进行纯化。将标记物移至超滤浓缩离心管上层,在5 000 r/min的条件下离心10 min,弃去下层液体,上层残余物分别用500 μL 10 mmol/L DTPA和1 mmol/L DTPA溶液洗涤各一次,离心,至下层滤液基本无放射性活度检出,然后收集上层残余物。
采用快速薄层层析法(instant thin layer chromatography, ITLC)测定64Cu-DOTA-SPIONs-PEG-FA的标记率和放化纯度。取2 μL反应液点样于Whatman 1号层析纸上,用φ=10%醋酸铵/甲醇混合液(体积比为50∶50)配制的15 mmol/L EDTA溶液为展开剂展开并用放射型薄层扫描仪扫描,测定标记率或放化纯度。
非靶向标记物64Cu-DOTA-SPIONs-PEG-OH的标记和纯化方法与64Cu-DOTA-SPIONs-PEG-FA相同。
将100 μL64Cu-DOTA-SPIONs-PEG-FA标记物(约0.37 MBq),加入到200 μL磷酸盐缓冲溶液(PBS)(pH=7.4)中,在37 ℃下温育,用快速薄层层析法测定标记物在4、12 h的放化纯度,观察标记物的体外稳定性。
1.5 荷瘤鼠体内生物分布
取18只荷KB细胞裸鼠,随机分成2组,每组9只。一组经尾静脉注射100 μL溶有64Cu-DOTA-SPIONs-PEG-FA(约0.37 MBq)的生理盐水溶液,另一组经尾静脉注射100 μL溶有64Cu-DOTA-SPIONs-PEG-OH(约0.37 MBq)的生理盐水溶液,并分别在给药后1、3、6 h各个时间点取3只荷瘤鼠摘眼球取血,继而断颈处死,取心、肝、脾、肺、肾、胃、小肠、肌肉、股骨、瘤称重,并用γ计数器测定放射性计数,经衰变校正后,计算百分注射剂量率 (%ID/g)。
1.6 荷瘤鼠的MRI和PET/CT显像
取荷KB细胞裸鼠3只,一只作为空白组;一只先经尾静脉注射50 μL FA-PEG(200 μg)进行叶酸受体阻断,30 min后再注射100 μL DOTA-SPIONs-PEG-FA(20 μg);一只经尾静脉注射100 μL DOTA-SPIONs-PEG-FA(20 μg)。在给药后4 h进行MRI显像。
取荷KB细胞裸鼠3只,一只经尾静脉注射100 μL非叶酸受体靶向标记物64Cu-DOTA-SPIONs-PEG-OH(约18.5 MBq);一只先经尾静脉注射50 μL FA-PEG(200 μg)进行叶酸受体阻断,30 min后再注射100 μL64Cu-DOTA-SPIONs-PEG-FA(约18.5 MBq);一只经尾静脉注射100 μL64Cu-DOTA-SPIONs-PEG-FA(约18.5 MBq)。在给药后4 h进行PET/CT显像。
2 结果与讨论
2.1 纳米粒子的合成与表征
首先在N2保护和避光的条件下,将叶酸与过量的DCC和NHS反应生成叶酸的活性酯FA-NHS。然后,用一端含有羧酸基团,另一端含有氨基基团的PEG在N,N-二异丙基乙基胺存在下,与FA-NHS偶联得到FA-PEG的粗产物并进行透析纯化。FA-PEG的1H NMR谱结果如下:δ= 8.60(1H,N=CH-C,pteridine(a));7.68,6.62(4H,—C4H4—,Ph(c,d));4.55(2H,—CH2—(b) );4.31(1H,CH(e));3.31~3.50(182H,—CH2CH2O—,PEG(h,i));2.19~2.38(6H,—CH2—(f,g,j));2.50(DMSO)[12]。核磁共振氢谱表明,叶酸已与PEG偶联。
采取化学共沉淀法合成氧化铁纳米粒子核心。然后,使用APTES对纳米粒子表面进行修饰,利用APTES上的氨基与FA-PEG上的羧基反应,得到SPIONs-PEG-FA。最后,将DOTA中的一个羧基活化,并与纳米粒子表面剩余的氨基反应,得到标记物前体DOTA-SPIONs-PEG-FA。

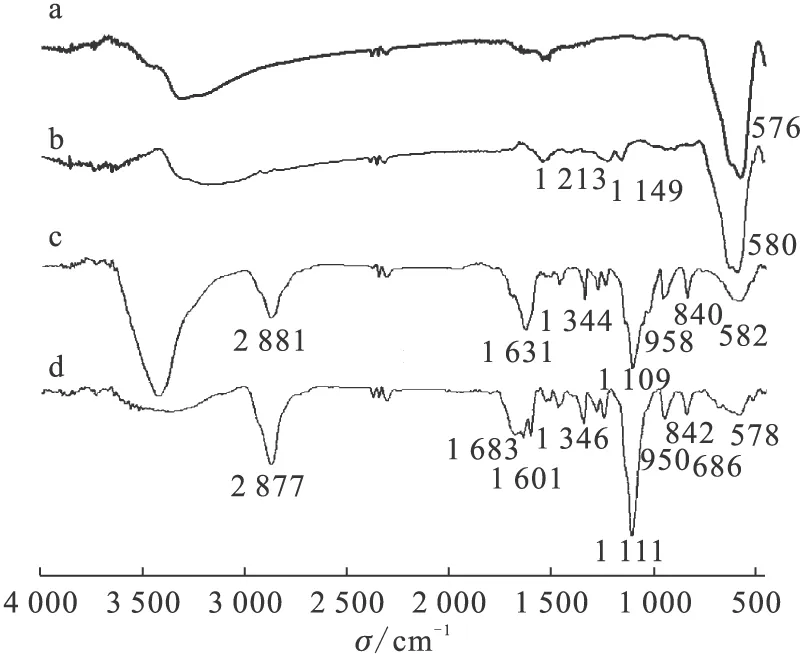
图3 SPIONs(a)、SPIONs-APTES(b)、SPIONs-PEG-FA(c)、DOTA-SPIONs-PEG-FA(d)的FTIR光谱Fig.3 FTIR spectra of SPIONs(a), SPIONs-APTES(b),SPIONs-PEG-FA(c), DOTA-SPIONs-PEG-FA(d)
纳米粒子的粒径用透射电镜进行了观测。SPIONs-APTES和SPIONs-PEG-FA的TEM图示于图4。由图4可知:SPIONs-APTES为不规则颗粒,有团聚现象,粒径介于50~100 nm;与SPIONs-APTES比较,包覆PEG后的纳米粒子SPIONs-PEG-FA的分散性和均匀性较好,粒径明显增大,粒径介于100~200 nm。
纳米粒子在溶液状态中的粒径分布情况用动态光散射法进行研究。在水溶液中,SPIONs-APTES和SPIONs-PEG-FA的DLS测定结果示于图5。由图5可知,强度权重的DLS显示均为单峰,平均水合动力学粒径分别为86 nm和133 nm。其结果与TEM结果一致。
通过磁滞回线的研究可以揭示纳米材料是否具有超顺磁性。SPIONs和DOTA-SPIONs-PEG-FA的磁性测定结果示于图6。由图6可知:其磁滞回线显示,纳米粒子的磁化强度随外加磁场强度的增大而增大,当外加磁场强度增大到一定值(10 G)后,磁化强度的增加趋于平缓并逐渐达到饱和;SPIONs和DOTA-SPIONs-PEG-FA的饱和磁化强度分别为35.6 emu/g和7.9 emu/g,DOTA-SPIONs-PEG-FA的剩磁为0.2 emu/g,几乎可以忽略不计,说明其具有超顺磁性[14-15]。

图4 SPIONs-APTES(a)和SPIONs-PEG-FA(b)的TEM图Fig.4 TEM images of SPIONs-APTES(a) and SPIONs-PEG-FA(b)
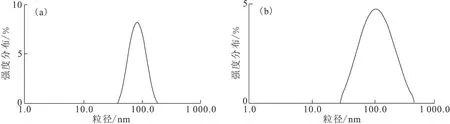
图5 SPIONs-APTES(a)和SPIONs-PEG-FA(b)的水合动力学直径分布Fig.5 Hydrodynamic size distribution of SPIONs-APTES(a) and SPIONs-PEG-FA(b)
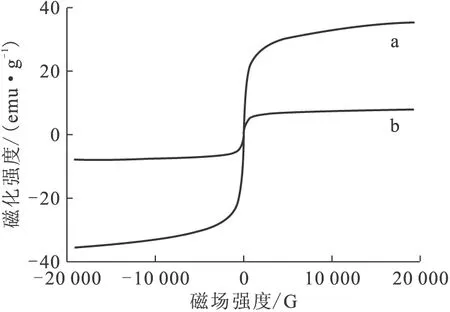
图6 SPIONs(a)和DOTA-SPIONs-PEG-FA(b)的磁滞回线Fig.6 Hysteresis loops of SPIONs(a) and DOTA-SPIONs-PEG-FA(b)
T2对比剂降低横向弛豫时间,通过减少组织信号来辨别组织正常与否。有外加磁场时,信号强度减弱,影像变黑,从而产生信号对比,可以辨别组织间的差异。DOTA-SPIONs-PEG-FA中不同铁浓度时,T2权重MR的显像结果示于图7。由图7可知,随着DOTA-SPIONs-PEG-FA中Fe浓度的增加,MRI图像的负对比效果越来越明显,信号强度逐渐减弱,影像逐渐变黑。
根据不同浓度下弛豫时间的差异拟合获得两者之间的线性关系[16],其线性方程为y=50.404x+5.514。据此计算得到该纳米粒子的弛豫率R2=55.9 L/(mmol·s)。采用邻菲罗啉分光光度法测定样品中铁的含量[17]。每毫克样品SPIONs、SPIONs-APTES、SPIONs-PEG-FA、DOTA-SPIONs-PEG-FA中铁含量分别为667、531、151、129 μg。

图7 DOTA-SPIONs-PEG-FA中不同铁浓度时,T2权重MR的显像结果Fig.7 T2-weighted MRI scan of DOTA-SPIONs-PEG-FA at different iron concentrations
上述超顺磁性和T2对比效果研究表明,DOTA-SPIONs-PEG-FA可以作为MRI显像的组分。
2.264Cu的标记
由于64Cu的制备比较复杂,国内64Cu药物的研究很少。本研究组曾进行了64Cu标记超顺磁性氧化铁纳米粒子SPION-DOPA-DOTA/RGD的研究[18]。
2.2.1 配体质量对标记率的影响 标记反应在醋酸铵缓冲溶液(pH=6.5)、40 ℃下进行,反应时间为45 min,考察用52 MBq的64Cu标记时,不同配体(DOTA-SPIONs-PEG-FA)质量对标记率的影响,结果示于图8(a)。由图8(a)可知,随着配体质量的增加,标记率显著提升。当配体质量为1 μg时,标记率并不理想,仅为2.2%;当配体质量增加到1 mg时,标记率显著提高,达到13.2%,但标记率曲线并没有出现平缓的趋势。由此推测,造成标记率不高的原因可能是结合在纳米粒子表面的双功能螯合剂(DOTA)有限,并且结合的螯合剂还可能被PEG所覆盖,不利于与64Cu的结合。考虑到后续可能进行的小动物PET显像实验,必须控制注射液的体积不能过大,选择100 μL醋酸铵缓冲溶液溶解配体可满足体积要求。增加配体质量可以使标记率显著提高,但是考虑到配体在醋酸铵缓冲溶液中的溶解度,100 μL的醋酸铵缓冲溶液只能溶解1 mg配体。因此,选择配体质量为1 mg标记52 MBq的64Cu。
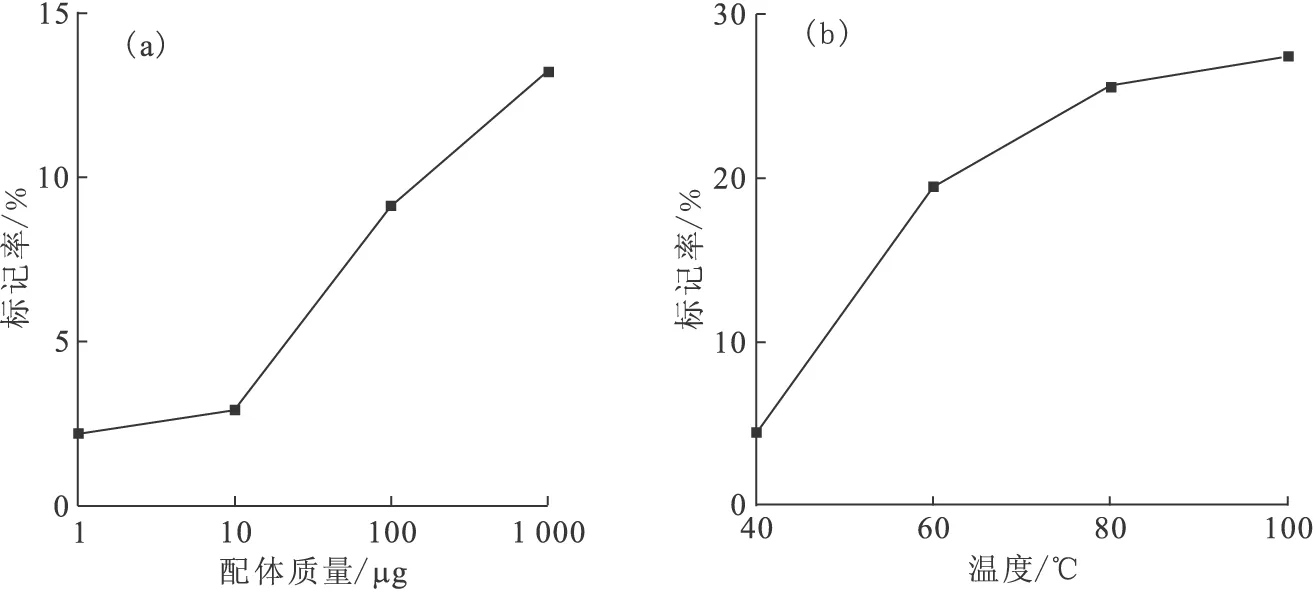
(a)——醋酸铵缓冲溶液(pH=6.5),40 ℃,反应时间为45 min,A(64Cu)=52 MBq;(b)——A(64Cu)=37 MBq,m(配体)=10 μg,反应时间为45 min图8 配体质量(a)和反应温度(b)对标记率的影响Fig.8 Influences of ligand mass(a) and reaction temperature(b) on labeling efficiency
2.2.2 反应温度对标记率的影响 以37 MBq的64Cu标记10 μg配体,反应时间为45 min条件下,考察不同温度对标记率的影响,结果示于图8(b)。参照文献[19]进行了温度对标记率影响的研究,将初始温度设为40 ℃,标记率仅为4.5%。当温度升至60 ℃时,标记率提高到19.5%。温度在80~100 ℃,标记率增加不大。考虑到较高的温度可造成纳米粒子的团聚或表面包覆物的脱落,降低纳米粒子的稳定性。在实验中也发现,在80 ℃时,纳米粒子在水溶液中出现了沉淀现象。因此,经综合考虑,选择60 ℃为标记温度。
2.3 标记化合物的纯化
利用纳米粒子具有较大分子量的特点,采取超滤浓缩离心法纯化64Cu纳米材料的标记物。选取10 kDa的超滤浓缩离心管,经离心分离后,64Cu-DOTA-SPIONs-PEG-FA在离心管的上层,而游离的64Cu随滤液到达离心管的下层。在上层残余物中加入DTPA溶液,以络合残留的游离64Cu和与纳米粒子非特异性结合的64Cu,离心分离至下层滤液中基本无放射性检出为止,收集所有滤液。上层残余物的放射性活度除以上层残余物和所有滤液的活度之和,即可得到该反应的标记率,在优化条件下,其标记率为23%。经DTPA溶液洗涤纯化后的产物用薄层层析法检测其放射性化学纯度,标记物集中在原点附近,Rf=0~0.1,而游离的64Cu(Rf=0.6~0.7)很少。这说明64Cu已成功标记到DOTA-SPIONs-PEG-FA,且放化纯大于98%。
刚开始进行标记物纯化时,按文献[20]进行超滤浓缩离心法纯化,采用生理盐水洗涤上层残余物,但实验中发现用500 μL生理盐水洗涤5次,纯化效果仍不理想,放化纯只能达到90%。后由文献[21-22]知,DTPA能与64Cu形成稳定的配合物,竞争络合与纳米材料非特异性结合的64Cu。因此,最后采用DTPA溶液进行洗涤,显著提高了分离效果。本研究中分别用10 mmol/L和1 mmol/L的DTPA溶液500 μL各洗涤1次,放化纯即可达98%。
2.4 标记化合物的体外稳定性
64Cu-DOTA-SPIONs-PEG-FA在PBS中的体外稳定性结果示于图9。由图9可知,在37 ℃下,PBS体系中放置4 h,该标记物的放化纯从初始的98%下降至93%,而一个半衰期(12 h)后,放化纯降至85%。这表明该标记物在4 h内基本稳定。
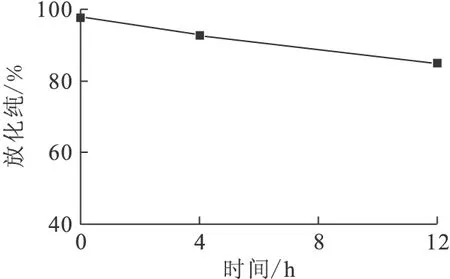
θ=37 ℃图9 64Cu-DOTA-SPIONs-PEG-FA的体外稳定性Fig.9 In vitro stability of 64Cu-DOTA-SPIONs-PEG-FA
2.5 荷瘤鼠体内生物分布
人口腔表皮样KB肿瘤细胞系被认为是进行叶酸靶向研究的“金标准”。由于KB细胞具有高且稳定的叶酸受体表达水平,传统上KB细胞常被用于叶酸靶向研究[23]。因此,以荷KB细胞瘤的裸鼠为对象进行了体内生物分布及MRI和PET/CT的显像研究。靶向标记物64Cu-DOTA-SPIONs-PEG-FA和非靶向标记物64Cu-DOTA-SPIONs-PEG-OH在荷KB细胞裸鼠体内的生物分布结果列于表1。由表1可知:两种标记物在肝脏中((21.04±3.39)%ID/g,(25.03±3.07)%ID/g;6 h)的放射性摄取都很大;64Cu-DOTA-SPIONs-PEG-FA在脾((15.04±2.68)%ID/g,6 h)和肺((29.83±3.92)%ID/g,6 h)中的放射性摄取也较大。64Cu-DOTA-SPIONs-PEG-FA在肝、脾和肺的高摄取主要与巨噬细胞的吞噬作用有关。体内的网状内皮系统(RES,包括肝、脾、肺和骨髓等组织)具有丰富的吞噬细胞,可将一定大小的纳米颗粒作为异物而摄取,较大的颗粒由于不能滤过毛细血管,而被截留于某些部位。
与未连接叶酸的标记物相比,64Cu-DOTA-SPIONs-PEG-FA在肿瘤中的摄取明显增高。64Cu-DOTA-SPIONs-PEG-FA和64Cu-DOTA-SPIONs-PEG-OH在给药1 h的放射性摄取率分别为(9.76±5.27)%ID/g和(1.41±0.36)%ID/g;给药3 h的放射性摄取率分别为(8.81±8.30)%ID/g和(1.52±0.60)%ID/g;给药6 h的放射性摄取率分别为(8.90±3.31)%ID/g和(2.09±0.63)%ID/g。这表明连接叶酸后,纳米粒子对KB细胞瘤具有明显的主动靶向作用。
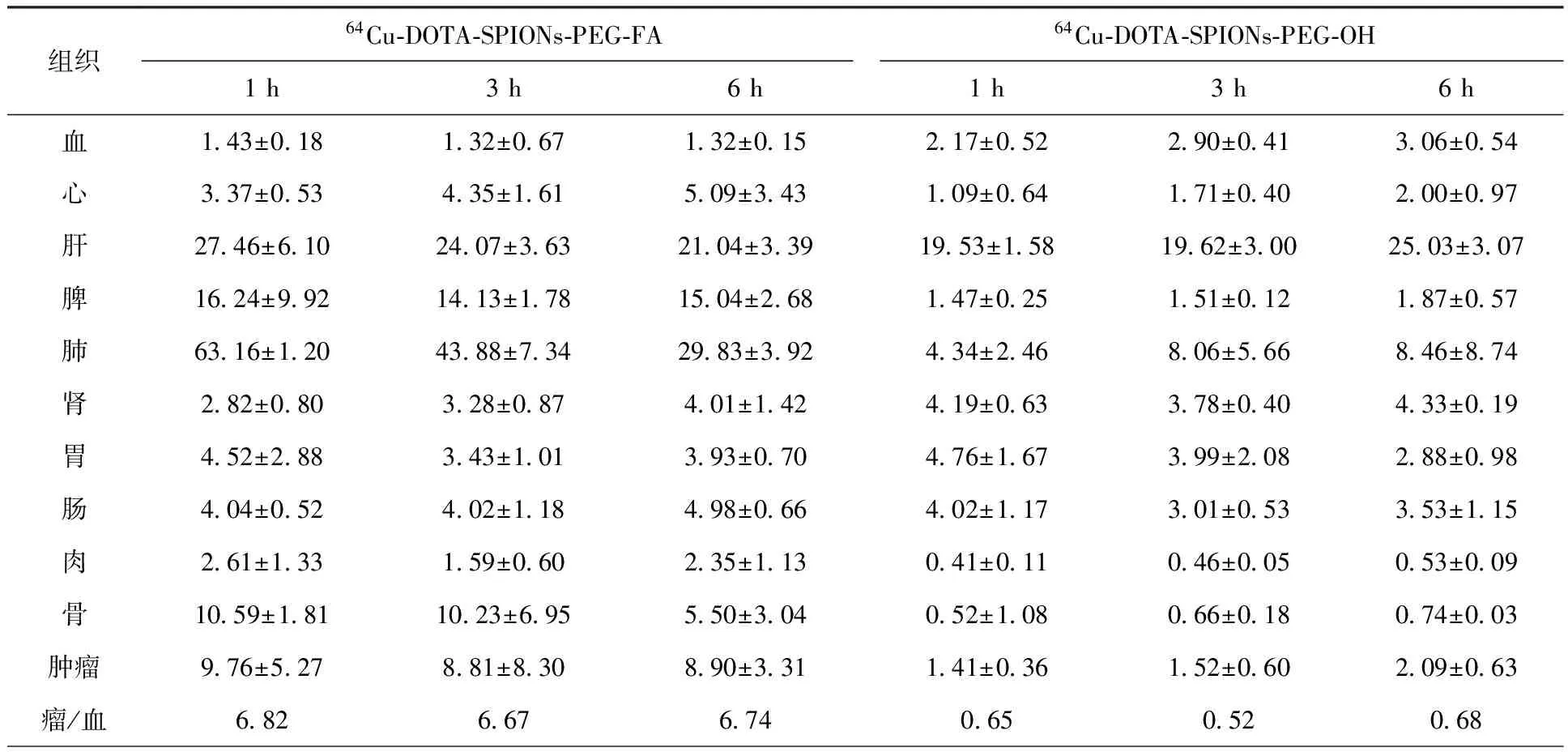
表1 64Cu-DOTA-SPIONs-PEG-FA和64Cu-DOTA-SPIONs-PEG-OH在荷KB细胞裸鼠体内的生物分布
注:n=3
在给药1、3、6 h时,64Cu-DOTA-SPIONs-PEG-FA的肿瘤和血液的放射性摄取率比(T/B)分别为6.82、6.67、6.74;而64Cu-DOTA-SPIONs-PEG-OH的T/B分别为0.65、0.52、0.68。连有叶酸纳米粒子的T/B明显高于无叶酸连接的纳米粒子,并且在1~6 h内T/B均大于6,这表明64Cu-DOTA-SPIONs-PEG-FA在肿瘤中具有较长的滞留时间,靶与非靶组织反差明显,可在较宽的时间范围内对肿瘤进行显像。
2.6 荷瘤鼠的MRI和PET/CT显像
荷KB裸鼠给药4 h后的MRI和PET/CT图像示于图10。超顺磁性氧化铁纳米粒子在MRI成像中作为T2造影剂,通过网状内皮系统中的吞噬细胞吞噬SPIONs后使相应的区域信号减弱。由图10(a)可知,空白组中KB细胞肿瘤部位最为明亮;当对叶酸受体进行阻断后(图10(b)),图像也稍变暗,这可能是因为尽管叶酸受体已被阻断,DOTA-SPIONs-PEG-FA的主动靶向不起作用,但该纳米粒子仍可能通过实体瘤的高通透性和滞留效应(enhanced permeation and retenting, EPR)被肿瘤少量摄取[24],因此,使得MRI信号减弱。图10(c)显示,注射DOTA-SPIONs-PEG-FA 4 h后肿瘤部位信号减弱幅度大,MRI图像变得最暗。这表明DOTA-SPIONs-PEG-FA在肿瘤部位有最大摄取,其摄取是与叶酸受体密切相关的,DOTA-SPIONs-PEG-FA可作为叶酸受体主动靶向的KB肿瘤MRI造影剂。
从PET/CT图像可知(图10(d, e)),注射了未含有叶酸的非靶向标记物64Cu-DOTA-SPIONs-PEG-OH以及先经叶酸阻断后再注射叶酸受体靶向标记物64Cu-DOTA-SPIONs-PEG-FA,药物在肿瘤部位的放射性摄取均较少,与肌肉相比没有显示出大的差异。而直接注射叶酸受体靶向标记物64Cu-DOTA-SPIONs-PEG-FA后,药物在肿瘤部位的摄取明显增高(图10(f))。这说明64Cu-DOTA-SPIONs-PEG-FA对KB细胞肿瘤确有靶向性,这种靶向是通过与叶酸受体的作用而实现,是主动靶向。作为KB细胞肿瘤的PET/MRI双模态显像剂,64Cu-DOTA-SPIONs-PEG-FA有待于进行更深入的研究。在三种情形下,给药4 h后,药物在肝脏中的摄取都较高(图10(d,e,f))。这与纳米材料在肝中被巨噬细胞吞噬有关。
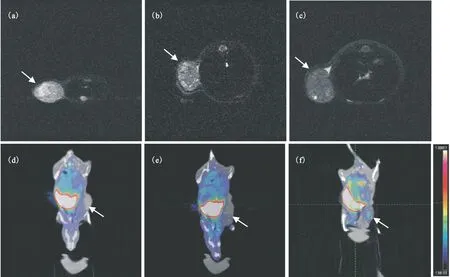
箭头所指为肿瘤部位(a)——空白对照组,(b)——叶酸阻断后再注入DOTA-SPIONs-PEG-FA,(c) ——DOTA-SPIONs-PEG-FA,(d)——64Cu-DOTA-SPIONs-PEG-OH,(e)——叶酸阻断后再注入64Cu-DOTA-SPIONs-PEG-FA,(f)——64Cu-DOTA-SPIONs-PEG-FA图10 荷KB裸鼠给药4 h后的MRI (a—c)和PET/CT图像(d—f)Fig.10 MRI images(a-c) and PET/CT images(d-f) of nude mice bearing KB cells tumor after 4 h injection
3 结 论
以化学共沉淀法先合成了超顺磁氧化铁纳米核心,并用APTES、FA-PEG-COOH和DOTA对纳米粒子表面逐次进行了修饰,获得了DOTA-SPIONs-PEG-FA。接着,用正电子核素64Cu对其进行了标记并纯化,制备了可用于PET/MRI双模态分子显像的64Cu-DOTA-SPIONs-PEG-FA探针,经过分离纯化得到了放化纯大于98%的标记物,并对其体外稳定性、在荷KB细胞裸鼠的体内生物分布及在MRI和PET/CT模式下的显像进行了研究。结果表明,与64Cu-DOTA-SPIONs-PEG-OH相比,连接有叶酸的标记物64Cu-DOTA-SPIONs-PEG-FA对KB细胞肿瘤表现出明显的主动靶向作用,MRI和PET/CT肿瘤成像较清晰。作为KB细胞肿瘤的PET/MRI双模态显像剂,64Cu-DOTA-SPIONs-PEG-FA在向临床医学转化之前还需要解决许多问题,如合成过程中更精密的控制(64Cu标记率的提高、放射性比活度和稳定性的改善)、合成中间产物更严密的分析鉴定和定量检测、体外细胞结合实验研究、代谢产物分析研究以及纳米材料的毒理学研究等。后续的工作将围绕这些问题而展开。
[1] Stewart B W, Wild C P. World cancer report 2014[R]. Lyon, France: International Agency for Research on Cancer, 2014.
[2] Madduri S, Galliford C V, Low P S. Principles in the design of ligand-targeted cancer therapeutics and imaging agents[J]. Nature Reviews Drug Discovery, 2015, 14(3): 203-219.
[3] Low P S, Henne W A, Doorneweerd D D. Discovery and development of folic-acid-based receptor targeting for imaging and therapy of cancer and inflammatory diseases[J]. Acc Chem Res, 2008, 41(1): 120-129.
[4] Muller C, Schibli R. Folic acid conjugates for nuclear imaging of folate receptor-positive cancer[J]. J Nucl Med, 2011, 52(1): 1-4.
[5] Spick C, Herrmann K, Czernin J.18F-FDG PET/CT and PET/MRI perform equally well in cancer: evidence from studies on more than 2,300 patients[J]. J Nucl Med, 2016, 57(3): 420-430.
[6] Rosales R T M. Potential clinical applications of bimodal PET-MRI or SPECT-MRI agent[J]. J Label Compd Radiopharm, 2014, 57(4): 298-303.
[7] 沈浪涛.放射性药物化学领域中的重要事件和前沿[J].核化学与放射化学,2015,37(5):355-365.
[8] Joel G, Tang T, Louie A Y. Nanoparticle-based multimodal PET/MRI probes[J]. Nanomedicine, 2015, 10(8): 1343-1359.
[9] Yallapu M M, Foy S P, Jain T K, et al. PEG-functionalized magnetic nanoparticles for drug delivery and magnetic resonance imaging application[J]. Pharm Res, 2010, 27(11): 2283-2295.
[10]Harivardhan R L, Arias J L, Julien N, et al. Magnetic nanoparticles: design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications[J]. Chem Rev, 2012, 112(11): 5818-5878.
[11]Chen T J, Cheng T H, Hung Y C, et al. Targeted folic acid-PEG nanoparticles for noninvasive imaging of folate receptor by MRI[J]. J Biomed Mater Res A, 2008, 87(1): 165-175.
[12]Yoo M K, Park I K, Lim H T, et al. Folate-PEG-superparamagnetic iron oxide nanoparticles for lung cancer imaging[J]. Acta Biomaterialia, 2012, 8(8): 3005-3013.
[13]Jiang Q L, Zhang S W, Hong R Y, et al. Folic acid-conjugated Fe3O4magnetic nanoparticles for hyperthermia and MRIinvitroandinvivo[J]. Appl Surf Sci, 2014, 307(1): 224-233.
[14]王晓,崔海平,史旭东,等.SPECT/MRI双模态显像剂SPION-DMSA-99Tcm的制备及其性质研究[J].原子能科学技术,2015,49(9):1557-1564.
[15]王晓,崔海平,史旭东,等.新型SPECT/MRI双模态显像剂SPION-DMSA-RGD-99Tcm的合成和生物学评价[J].原子能科学技术,2015,49(11):1932-1938.
[16]Lee H Y, Li Z, Chen K, et al. PET/MRI dual-modality tumorimaging using arginine-glycine-aspartic(RGD)-conjugated radiolabeled iron oxide nanoparticles[J]. J Nucl Med, 2008, 49(8): 1371-1379.
[17]中华人民共和国机械行业标准.JB/T 6237.3-2008,第三部分:邻菲罗啉分光光度法测定铁量[M].北京:机械工业出版社,2008.
[18]史旭东,王晓,申一鸣,等.超顺磁性氧化铁纳米粒子SPION-dopa-PEG-DOTA/RGD的64Cu标记、纯化及生物学初步评价[J].核化学与放射化学,2015,37(4):250-256.
[19]Stockhofe K, Postema J M, Schieferstein H, et al. Radiolabeling of nanoparticles and polymers for PET imaging[J]. Pharmaceuticals, 2014, 7(4): 392-418.
[20]Rosales R T M, Tavaré R, Paul R L, et al. Synthesis of64CuⅡ-bis (dithiocarbamate-bisphosphonate) and its conjugation with superparamagnetic iron oxide nanoparticles:invivoevaluation as dual-modality PET-MRI agent[J]. Angew Chem Int Ed, 2011, 50(24): 5509-5513.
[21]Fukukawa K, Rossin R, Hagooly A, et al. Synthesis and characterization of core-shell star copolymers forinvivoPET imaging applications[J]. Biomacromolecules, 2008, 9(4): 1329-1339.
[22]Pressly E D, Rossin R, Hagooly A, et al. Structural effects on the biodistribution and positron emission tomography (PET) imaging of well-defined64Cu-labeled nanoparticles comprised of amphiphilic block graft copolymers[J]. Biomacromolecules, 2007, 8(10): 3126-3134.
[23]Müller C, Schubiger P A, Schibli R.Invitroandinvivotargeting of different folate receptor-positive cancer cell lines with a novel99mTc-radiofolate tracer[J]. Eur J Nucl Med Mol Imaging, 2006, 33(10): 1162-1170.
[24]Maeda H. Tumor-selective delivery of macromolecular drugs via the EPR effect: background and future prospects[J]. Bioconjugated Chemistry, 2010, 21(5): 797-802.
64Cu-DOTA-SPIONs-PEG-FA as a Potential PET/MRI Dual-Modal Imaging Tumor Probe Used for Targeting Folate Receptor-Positive Cancer
SUN Yu-lin1,2, SHEN Yi-ming1,2, LIANG Ji-xin1, CHEN Yu-qing1,2, SHEN Lang-tao1,2,*
1.China Institute of Atomic Energy, P. O. Box 275(58), Beijing 102413, China;2.Atom-Hitech Company, Beijing 102413, China
The synthesis, preliminary biological evaluation and PET/CT and MRI imaging results of a potential PET/MRI dual-modal imaging tumor probe,64Cu-DOTA-SPIONs-PEG-FA, used for targeting folate receptor-positive cancer, have been reported in this investigation. This probe was composed of a superparamagnetic iron oxide nanoparticles(SPIONs) coated with the biocompatible polymer poly(ethylene glycol)(PEG), folic acid, 1, 4, 7, 10-tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid(DOTA) and positron-emitter copper-64. This radioactive probe has high radiochemical purity(greater than 98%) after purification. The bio-distribution in the nude mice bearing KB cells tumor shows that64Cu-DOTA-SPIONs-PEG-FA has a higher uptake in liver, spleen and lung, respectively, and has an obvious effect of active targeting toward the KB tumor in contrast to64Cu-DOTA-SPIONs-PEG-OH. Under the modes of both MRI and PET/CT, the KB tumor can be observed clearly. As a PET/MRI dual-modal imaging tumor probe,64Cu-DOTA-SPIONs-PEG-FA is worthy to be further studied to improve its labeling yield, stability, specific activity and so on.
PET/MRI dual-modal probe; superparamagnetic iron oxide nanoparticles; folic acid; DOTA;64Cu
2016-05-12;
2016-06-13
孙钰林(1982—),男,辽宁本溪人,博士研究生,放射性同位素技术专业,E-mail: alinzaixian@163.com
*通信联系人:沈浪涛(1963—),男,浙江永康人,研究员,博士生导师,主要从事药物化学和有机合成化学研究,E-mail: shenlt@yahoo.com
O615.4
A
0253-9950(2017)04-0298-11
10.7538/hhx.2017.39.04.0298
