天然维生素E的检测技术研究进展
2017-08-22王石王峻肖志明王燕妮邓涛樊霞
王石,王峻,肖志明,王燕妮,邓涛,樊霞*
检测分析
天然维生素E的检测技术研究进展
王石1,王峻2,肖志明1,王燕妮1,邓涛1,樊霞1*
(1.中国农业科学院农业质量标准与检测技术研究所国家饲料质量监督检验中心(北京),北京海淀100081;2.湖北省饲料监测所,湖北武汉430070)
天然维生素E是植物油中普遍存在的一类抗氧化剂,因其具有安全、高效、无毒等优点被人们广泛关注。近年来,随着天然维生素E在食品、饲料、医药、化妆品等领域的逐步应用,其检测和品控技术也在不断发展,研究人员根据维生素E的物理、化学性质开发了多种检测方法。本文主要简述了色谱技术、光谱技术以及电化学分析技术等在天然维生素E检测中的应用,探讨了这些分析方法的基本原理以及优缺点,比较了各方法的灵敏度、准确性和检测极限等指标,便于在分析实际样品时选择最合适的测定方法。
天然维生素E;生育酚;生育三烯酚;检测技术
维生素E又被称为抗不育维生素,是人体所必需的一种脂溶性维生素,其按照来源可以分为天然维生素E和合成维生素E。天然维生素E中含有8种异构体,即4种生育酚(α-T,β-T,γ-T,δ-T)和4种生育三烯酚(α-T3,β-T3,γ-T3,δ-T3),其广泛存在于自然界中,在植物的杆、茎、叶、种子胚、植物油脂、奶和蛋黄中均有存在,尤以小麦胚芽中含量最高(张彩丽等,2005)。市售的天然维生素E就是以富含维生素E的植物油或精炼副产品的脱臭馏分为原料,经提取、纯化制得,现已被广泛应用在药品、化妆品、保健品以及饲料等领域(田少云,1995)。
1 天然维生素E的应用
维生素E能够促进性激素分泌,提高生育能力,并具有预防流产等作用。同时作为重要的生物抗氧化剂,维生素E还能提高机体中的抗氧化酶的活性,降低机体中的脂质过氧化产物的含量。研究表明,在维生素E的众多异构体中,α-生育酚具有最高的生物活性,在生物体内更容易吸收且具有更高的利用率(吴金龙,2009),但是其他维生素E的异构体在人体中也有着很重要的作用。例如,γ-生育酚(γ-T)具有抗癌的功能,并能有效地预防由中枢脑动脉阻塞引起的脑梗死(Jiang等,2004)。δ-生育酚(δ-T)对人乳腺癌细胞的抑制作用明显强于其他生育酚单体(Yu等,1999)。生育三烯酚(T3)能够抑制胆固醇合成,减少血浆胆固醇含量,以减少心脑血管病发的可能性,有效抑制肿瘤细胞的增殖(Das等,2007;Sen等,2006)。因此建立天然维生素E的检测方法,分析样品中的不同生育酚和生育三烯酚的含量及分布,有利于指导人们更加有效、合理的使用天然维生素E,使天然维生素E产生更高的应用价值。另一方面,天然维生素E是从植物油中提取得到,具有很小的毒害,而合成维生素E则是由化工原料经化学合成制得,难免有化学物质残留。天然维生素E无论是从生理活性还是抗氧化能力均优于合成维生素E,更重要的是天然维生素E对人体没有任何毒副作用,长期使用的安全性远高于合成维生素E。由于以上诸多原因,天然维生素E的市售价格要远高于合成维生素E。因此市场上难免会出现在天然维生素E中掺入合成维生素E,以次充好,非法谋取利润的现象。完善天然维生素E的检测方法,分析天然维生素E中各种异构体的含量,对建立天然维生素E产品的真实属性图谱库,有效的规范天然维生素E的销售市场,促进天然维生素E行业的发展意义重大。
2 天然维生素E的检测方法
2.1 色谱法与色-质联用法
2.1.1 气相色谱与气-质联用技术气相色谱技术主要是利用物质的沸点、极性及对固定相吸附性质的差异来实现混合物的分离。由于样品中各组分的沸点、极性或吸附性能不同,每种组分都在流动相和固定相之间进行反复多次的分配或吸附/解吸,在载气中浓度大的组分先流出色谱柱,而在固定相中分配浓度大的组分后流出,从而达到了分离的目的(齐景杰,2012)。由此可见,气相分离主要受目标物的汽化难易程度和分子对固定相的吸附影响,跟分子的化学结构密切相关。在天然的维生素E中含有α、β、γ、δ-生育酚以及生育三烯酚等8种结构类似物,其中β、γ-生育酚和β、γ-生育三烯酚在苯环的邻位和间位皆有1个甲基取代,只是取代基团的位置不同,互为同分异构体。因此β与γ-生育酚,β、γ-生育三烯酚沸点相近,极性相似,从而造成气相色谱很难将这两组同分异构体分离(魏雪缘等,2016)。
国际标准方法(AOAC Official Method 988.14,First Action 1988)和国家标准(GB 19191-2003)作为现行有效的天然维生素E的检测标准,均选择以正己烷或吡啶为提取溶剂,非极性柱作为固定相,十六酸十六酯为内标物,通过气相色谱对天然维生素E进行检测,测定了天然维生素E粉中的生育酚,该法可很好的对各组分进行定量检测,但β、γ-生育酚不能分离检测。鲍忠定等(2009)通过皂化法对油脂样品进行前处理,之后通过毛细管气相色谱法测定了样品中的D-α-生育酚和L-α-生育酚含量。罗赟等(2013)以石油醚-乙醚提取维生素E,通过超声浸提法前处理后,HP-5毛细管柱分离,并以三十二烷为内标物,检测了食品中的4种生育酚。该法最低检出限分别为:α-VE 4 ng,β-VE 12 ng,γ-VE 12 ng,δ-VE 24 ng,回收率为83.4%~100.2%,方法精密度良好,但β-VE与γ-VE无法达到完全分离。同时,也有研究人员使用MSTFA作为衍生化试剂,对维生素E进行硅烷化处理,检测植物油中的4种生育酚,生育酚可达到基线分离,方法的重复性及准确性良好,回收率为75%~111%(Lechner等,1999)。Lu课题组(2015)以二苯蒽作为内标物,使用甲醇-正己烷作为溶剂处理功能食品和保健品,通过质谱检测器进行选择离子扫描,该方法可以检测功能食品中的8种维生素E和α-生育酚乙酸酯,方法检出限为0.09~0.46 ng/mL。同样的,Zerbinati等(2015)通过气质结合衍生化处理方法,测定了血液血浆中的α、γ-生育酚,实现α、γ-生育酚的定量检测。
2.1.2 液相色谱与液-质联用技术高效液相色谱法(HPLC)是目前应用最为广泛的分离、分析、纯化有机化合物的方法之一。不同结构物质在流动相与固定相之间的分配比不同,造成不同组分在色谱柱上的出峰时间顺序不同。利用该原理,HPLC实现了目标物分离、检测的目的。目前,天然维生素E的检测方法中以该法应用最为广泛,众多HPLC检测方法见表1。
生育酚和生育三烯酚皆是由13个碳原子的长脂肪链和色满环组成的化学分子,只是在色满环上的取代基不同。在通过反相色谱进行分离时(如C18为填料),长脂肪链易于吸附在固定相上,洗脱溶剂对生育酚的作用效果差别不大,造成用反相色谱很难分离。而使用正相色谱,以硅胶为固定相,色满环上的酚羟基易于吸附在固定相表面,甲基的取代结果将影响苯环上π电子云密度以及吸附基团的空间位阻,从而影响色满环上酚羟基对硅羟基的吸附。由DFT泛函理论计算得到α、β、γ、δ-生育酚中色满环酚羟基上氧原子的密立根电荷分别为-0.587<-0.577<-0.576<-0.572,而4种生育酚在正相柱上的保留分别为δ-生育酚>γ-生育酚>β-生育酚>α-生育酚,由此可见,甲基取代产生的化学结构差异可以很容易的使4种生育酚在正相色谱柱上有效分离。
根据以上的讨论可以总结出:(1)基于反相色谱建立的多种维生素异构体分离检测方法,操作简单,重现性好,但β、γ-生育酚很难得到分离,要得到较好的分离效果则必须在方法中使用更加高效的色谱柱(特殊填料或者较小的粒径)以及精确控制的梯度洗脱程序。(2)基于正相色谱建立的多种维生素异构体分离检测方法,8种维生素E很容易得到基线分离,但正相色谱的保留时间不稳定,操作复杂,需要更长的平衡时间以及更大的溶剂毒性也限制了该方法的使用(徐响等,2008)。
2.1.3 超高效合相色谱技术超高效合相色谱(UPC2TM)是分离科学的一个新类别。该技术将SFC与UPLC技术相结合,通过调节压力、温度以及选择适合的流动相和固定相类型,可以有效地分离、检测结构类似物、同分异构体、对映异构体和非对映异构体等现有方法难以处理的样品。该方法目前已被用于分析水果中α-生育酚的含量(Gong等,2014),同时Gee(2016)和Ningli课题组(2016)还分别使用UPC2技术分离了天然维生素E中的8种生育酚。Ningli课题组(2016)使用BEH 2-EP型色谱柱作为固定相,超临界CO2为流动相,甲醇/异丙醇(1∶1,v/v)作为改性剂,在倍压1800 psi下对样品进行分离。DAD检测器的检出限为23~49 ng/L,建立方法可准确检测辣木枝叶中的天然维生素E,方法重现性良好(RSD 0.62%~3.16%)。UPC2使用超临界CO2作为主要流动相,其流体黏度小,比HPLC中所使用的液体流动相扩散率更高、更有利于传质。而与GC相比,CO2作流动相可在低温下实现物质分离,特别适合热敏性化合物的样品分析。因而超高效合相色谱法很适合分离,检测蔬菜、水果及食用油中的天然维生素E。
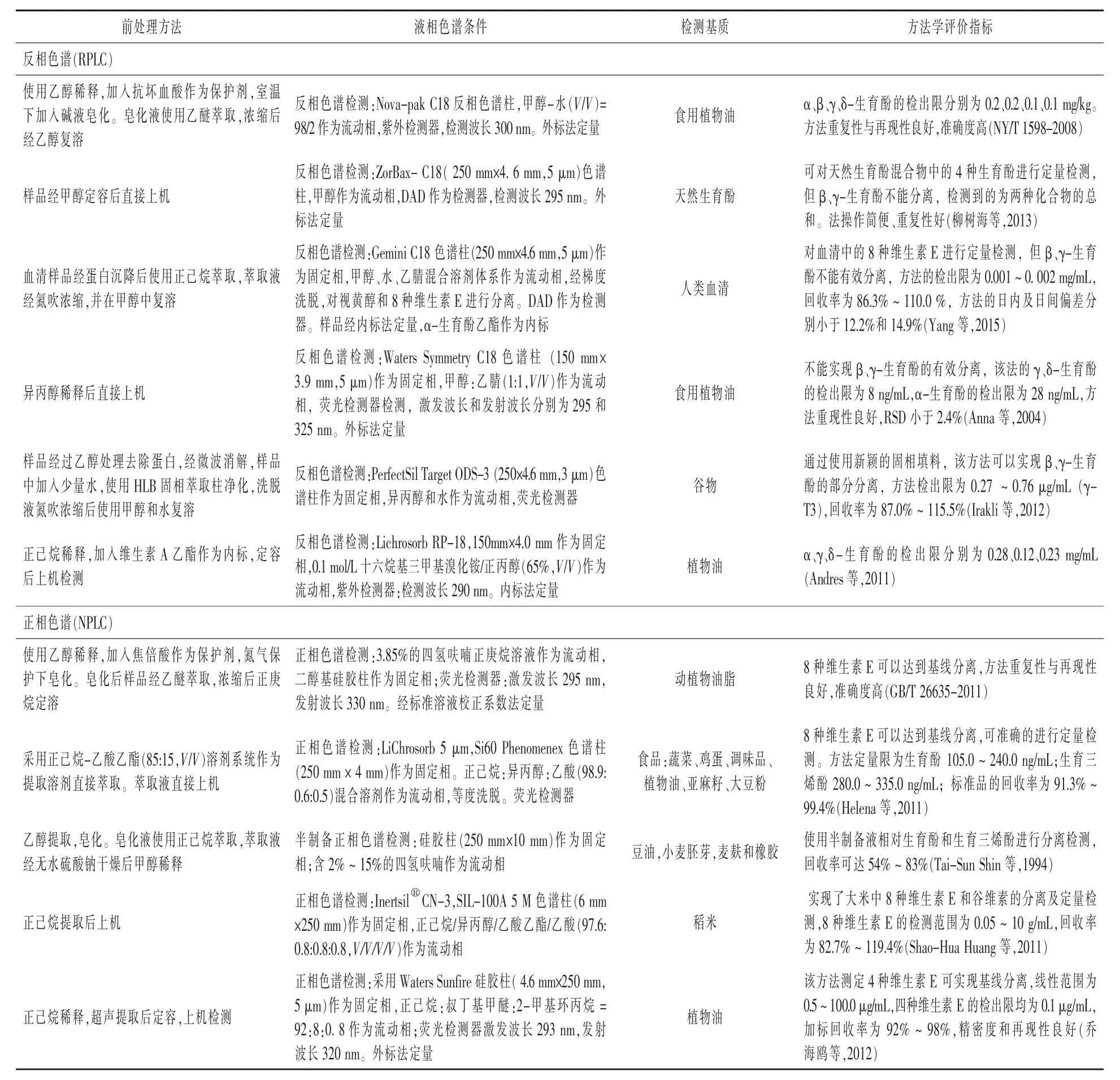
表1 高效液相色谱法检测不同基质中的天然维生素E
2.1.4 毛细管电泳技术毛细管电泳技术是以高压电场为驱动力,毛细管为分离通道,依据样品中各组分在毛细管中迁移速度的不同而实现分离的一类液相分离技术。而在此基础上进一步发展的非水毛细管电泳技术(NACE),由于使用有机溶剂作电泳缓冲液,可增加疏水性物质的溶解度,特别适用于在水中难溶或在水溶液中性质相似的物质分离。Galeano-Día扎(2012)基于此项技术建立了植物油中4种天然维生素E的检测方法。其以无水甲醇溶液为电泳介质,硼酸盐缓冲液、胆酸钠溶液和氢氧化钠溶液作为改性剂,熔融石英毛细管为分离通道对天然维生素E进行分离,其迁移顺序为:α-生育酚<(β+γ)-生育酚<δ-生育酚。进一步利用该法对玉米胚芽油、橄榄油及葵花籽油中的生育酚进行测定,发现在定量范围1.0~50.0μg/mL,其与RPLC法的测定结果相近。由于NACE法可承受更大的进样量,产生很好的样品堆积效应,因此适合天然维生素E各单体的分离制备;但该法还不能达到HPLC分离效果,无法实现β与γ-生育酚的有效分离。
2.1.5 TLC薄层色谱技术草粉是家禽日粮中天然维生素E的重要来源。早在1978年,乌克兰家禽研究所为了测定草料中的α-生育酚含量,建立了基于TLC色谱技术的快速检测方法。该方法以苯作为提取溶剂,硅胶板作为固定相,氯仿为流动相,同时以氯化铁与2,2-联吡啶混合溶液作为显色剂,可对草粉中天然维生素E进行分离,并对α-生育酚进行快速半定量检测(盛蕴纯等,1987)。TLC法前处理简单,操作方便,且目前TLC技术已完全实现自动化,更加快速、高效、准确。然而薄层色谱理论塔板数较低,分离效率差,很难实现天然维生素E各异构体之间的分离,目前已基本不再应用。
2.2 光谱法快速检测技术因具有实验操作简化、检测用品易得、分析方法快速、准确等特点,应用前景十分广阔。通过快速检测技术对食品、饲料、医药化妆品的质量进行有效的评价已成为目前检测领域的研究热点,也是未来的发展方向。光谱法由于不需要对样品进行复杂的前处理,操作简单,响应快,因而更容易实现快速检测。然而光谱法没有色谱技术的分离功能,所以很难检测到天然维生素E的各种单体,只能测量得到总维生素E的含量。
2.2.1 紫外分光光度法维生素E结构中含有游离的酚羟基,可被强氧化剂氧化生成醌。生育酚可以将三价铁离子还原成二价铁离子,二价铁离子可与1,10-菲绕啉发生有色反应,于某一波长下具有最大吸收,在一定浓度范围内,其吸收值与生育酚含量成正比(刘云等,2005)。利用该原理,刘云等(2005)建立了油脂中天然维生素E的紫外分光光度检测方法,研究了显色剂、反应剂及终止剂浓度、反应时间、最大吸收波长等参数对天然维生素E检测的影响,确定了最佳检测条件。检测结果与HPLC结果相比,最大偏差不超过5%。崔恩惠在单因素实验的基础上,采用响应曲面实验,优化了分光光度法测定天然维生素E时的显色反应条件,得到了最佳反应条件。在此条件下,该法可实现1~21μg/mL浓度范围内维生素E的定量检测回收率高于97%。通过多次实验发现,分光光度法测定天然维生素E效果良好,而对于工业合成的dl型维生素E,其显色反应活性较低,测定效果不理想。
2.2.2 近红外光谱法近红外光谱(NIR)是介于可见光和中红外光之间的电磁波谱,波数约为10000~4000 cm-。在近红外区域产生的特征吸收主要为化合物极性官能团化学键的伸缩振动倍频和合频。通过适当的化学计量学多元校正方法,把校正后样品的近红外吸收光谱与其成分浓度或性质数据进行关联,建立校正样品吸收光谱与其成分浓度或性质间的关系-校正模型(石冬冬等,2015)。应用该模型,人们可对待测样品进行定性或定量检测。Silva等(2005)采用近红外光谱技术结合化学计量学工具对植物油中的天然维生素E进行了定量检测。首先通过光谱扫描获得了α-生育酚的红外光谱信息,之后建立了不同特征波段的偏最小二乘法(PLS)回归模型,通过优化条件,最终选择以1472~1078 cm-波段的图谱信息建立了校正模型。该课题组在衰减全反射模式下对混合油、菜籽油、花生油、大豆油及葵花籽油等5种食用植物油中的α-生育酚进行定量检测,并将测定结果与RPLC比较,结果表明,两种方法的测定结果无显著差异。FTIR测定植物油中的α-生育酚不需对样品进行复杂前处理,方法快速、准确、不消耗化学试剂,但检测结果易受基质干扰,不能用于成分复杂样品中的α-生育酚的测定,且校正模型的优劣决定了定量和定性分析的准确性,因此近红外光谱分析需要持续添加样本对模型进行校正。
2.2.3 拉曼光谱法拉曼光谱有其独特的检测特性,可对有机物结构上的基团的振动和转动产生相应的信号,利用该信息可以进行相应的定性与定量分析(Cimpiu等,2005)。拉曼光谱对有机分子中的C=C键、C=N键、C=O键等基团具有很强的响应,而且其谱峰相对较窄,受到基质的干扰更小,可避免近红外光谱中存在光谱重叠、无特征吸收的特点,可作为近红外技术的补充技术,用于对天然维生素E等一些常规指标进行评价。同时,该法具有无损、便携和快速检测的特点与优势,是一种绿色环保的分析测定方法。
2.2.4 荧光光谱法维生素E同系物具有相同的共轭双键体系,因此其激发光谱和发射光谱非常相近(相差±2 nm),通过该原理,人们可通过荧光法测定样品中总维生素E含量。李英丽等(2009)以石油醚作为萃取溶剂,通过同步荧光检测了蔬菜中天然维生素E,消除了萃取溶剂对目标物的荧光干扰。该法定量限为0.01 mg/L,操作较为简便、快速,如遇到样品中同时含有维生素E和其他维生素时,也可使用荧光法实现不分离测定混合物中的维生素E。阚健全(1990)建立了食品中维生素E和维生素A的荧光检测方法,分别在Ex340、Em480 nm和Ex295、Em340 nm处同时测定了试样中的维生素A和维生素E,结果表明,在浓度为0.05~10.00μg/mL时,维生素E的回收率为90.7%~95.9%。荧光法测定维生素E含量时,需要防止样品中某些干扰荧光强度的物质的存在,因此对样品前处理,特别是样品净化步骤有着严格的要求。一般在检测植物油中的天然维生素E时,都需要对样品进行皂化,以减少样品基质对检测的干扰。
2.3 电化学分析法电化学法测定植物提取物中的维生素E,是利用维生素E结构中的酚羟基可在电极上发生不可逆氧化,通过测定氧化峰电流计算植物提取物中的维生素E含量。但由于维生素E各异构体的氧化电位差别小,电化学图谱上各生育酚氧化峰发生重叠,电化学分析法只能测定植物油中维生素E的总量,无法获取各生育酚单体的定量信息。而Robledo等(2013)通过电化学法结合非线性人工神经网络建立校正模型,成功的从生育酚重叠的信号中获取各生育酚异构体的定量信息,实现了对植物油中α-,γ-和δ-生育酚的测定。该法测定植物油中维生素E,具有检测速度快,灵敏度高的优点,但该法在检测中易受到复杂基质的干扰,同时该法需要建立校正模型,将耗费较多的费用和时间进行模型建立与维护。
2.4 滴定法(铈量法)铈量法也称硫酸铈法,是采用四价铈盐溶液作滴定剂,在酸性条件下测定还原性物质的滴定方法。用邻二氮菲作指示剂时,要求待测组分的还原性比指示剂强。张乃明等(2002)通过研究影响维生素E测定结果的因素,优化了饲料添加剂维生素E粉的铈量法检测条件,通过与气相方法的检测结果进行比较,发现所建立铈量法方法简便,数据可靠,重现性好。铈量法属于总含量测定方法,不能测定天然维生素E中的单体含量,且由于天然维生素E提取物中含有一些还原性物质,会在铈量法中参加反应,导致VE含量测定结果高于其在产品中的实际含量,因此铈量法测定天然维生素E含量时,无法保证其特异性及准确性。
3 展望
在近年开发的众多检测方法中,正相色谱法对天然维生素E各异构体具有较高的分离效率,更易实现8种异构体的基线分离检测;超高效合相色谱技术因使用超临界CO2作为流动相,且具有较大的载样能力,较适用于维生素E单体样品的分离制备;而快速检测技术是未来检测技术的发展方向,近红外光谱或拉曼光谱技术结合化学计量学工具用以对天然产物中的活性成分进行快速分析将会成为未来研究关注的重点。因此,建立适合的天然维生素E检测方法,分析样品中不同生育酚和生育三烯酚的含量及分布,有利于指导人们更加有效、合理的使用天然维生素E,使天然维生素E产生更高的应用价值
[1]鲍忠定,魏颖栋,丁献荣,等.毛细管气相色谱法测定油脂中d-α-生育酚和l-α-生育酚[J].粮油食品科技,2009,17(5):24~25.
[2]崔恩惠,方亮,李维林,等.响应面法优化分光光度法测定天然维生素E [J].食品工业科技,2010,31(2):326~328.
[3]阚健全.荧光法同时测定食品中的维生素E和维生素A[J].营养学报,1990,10:46~49.
[4]李英丽,邓连琴,果秀敏,等.同步荧光法测定蔬菜中维生素E含量[J].河北大学学报(自然科学版),2009,29(4):412~415.
[5]刘云,丁霄霖,胡长鹰.分光光度法测定天然维生素E总含量[J].粮油食品科技,2005,13(4):47~49.
[6]柳树海,杜金宝,连峰,等.高效液相色谱法测定天然生育酚中生育酚同系物含量的研究[J].粮食与食品工业,2013,20(5):71~75.
[7]罗赟,孙成均.气相色谱法同时测定食品中四种维生素E异构体[J].中国卫生检验杂志,2013,23(4):824~826.
[8]田少云.人工合成VE与天然VE[J].粮食与油脂,1995,1:37.
[9]齐景杰.气相色谱法在煤化工分析中的应用[J].广东化工,2012,39(3):168~171.
[10]乔海鸥,王辛,王敏娟.正相高效液相色谱-荧光检测法同时测定植物油中的四种维生素E异构体[J].中国卫生检验杂志,2012,22(6):1271~1274. [11]盛蕴纯,П.Сурай.草粉中维生素E含量的快速测定法[J].国外畜牧学(猪与禽),1987,3:56~57.
[12]石冬冬,刘志英,常淑平,等.利用近红外图谱技术同时检测预混料中多种维生素含量的研究[J].粮食与饲料工业,2015,8:61~65.
[13]魏雪缘,沈伟健,张睿,等.食用植物油中生育酚和生育三烯酚检测方法的研究进展[J].食品安全质量检测学报,2016,7(2):687~692.
[14]吴金龙.解密不同形式天然维生素E的生理活性[J].中国畜牧杂志,2009,45(18):54~57.
[15]徐响,刘光敏,高彦祥.基于正相高效液相色谱法的维生素E异构体含量测定[J].中国农学通报,2008,24(4):135~138.
[16]张彩丽,贺学礼.天然生育酚的结构、生物合成和功能[J].生物学杂志,2005,4(22):38~40.
[17]张乃明,陈艺青.铈量法测定VE粉含量的探讨[J].兽药与饮料添加剂,2002,7(1):11~12.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 19191-2003[S].食品添加剂天然维生素E.北京:中国标准出版社,2003-06-13.
[19]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 26635-2011/ISO 9936:2006[S].动植物油脂生育酚及生育三烯酚含量测定高效液相色谱法.北京:中国标准出版社,2011-06-16.
[20]中华人民共和国农业部.NY/T 1598-2008[S].食用植物油中维生素E组分和含量测定高效液相色谱法.北京:中国农业出版社,2008-05-16.
[21]Andrés M P S,Otero J,Vera S.High performance liquid chromatography method for the simultaneous determination ofα-,γ-andδ-tocopherol in vegetable oils in presence of hexadecyltrimethylammonium bromide/npropanol in mobile phase[J].Food Chem.,2011,126(3):1470~1474.
[22]AOAC Official Method 988.14[S].Tocopherol Isomers in Mixed Tocopherols Concentrate Gas Chromatographic Method First Action 1988,1988.
[23]Cimpiu C,Casoni D,Hosu A,et al.Separation and identification of eight hydrophilic vitamins using a new TLC method and Raman spectroscopy[J].Journal of liquid chromatography and related technologies. 2005,28(16):2551~2559.
[24]Das S,Nesaretnam K,Das D K.Tocotrienolsincardioprotection[J].Vitam. Horm.,2007,76:419~433.
[25]Galeano-Díaz T,Acedo-Valenzuela M I,Silva-Rodríguez A.Determination of tocopherols in vegetable oil samples by non-aqueous capillaryelectrophoresis(NACE)with fluorimetric detection[J].J Food Compos Anal,2012,25(1):24~30.
[26]Gee P T,Liew C Y,Thong M C,et al.Vitamin E analysis by ultraperformance convergence chromatography and structural elucidation of novelαtocodienol by high-resolution mass spectrometry[J].Food Chemistry,2016,196:367~373.
[27]Gliszczyńska-ˊSwigfo A,Sikorska E.Simple reversed-phase liquid chromatography method for determination of tocopherols in edible plant oils[J]. Journalof Chromatography A,2004,1048:195~198.
[28]Gong X,QiN,Wang X,Li J,etal.A new method for determination ofαtocopherol in tropical fruits by ultra performance convergence chromatography with diode array detector[J].Food AnalyticalMethods,2014,7:1572~1576.
[29]Huang S H,Ng L T.An improved high-performance liquid chromatographic method for simultaneous determination of tocopherols,tocotrienols and oryzanolin rice[J].Journalof Chromatography A,2011,1218:4709~4713.
[30]Irakli M N,Samanidou V F,Papadoyannis I N.Optimization and validation of the reversed-phase high-performance liquid chromatography with fluorescence detection method for the separation of tocopherol and tocotrienol isomers in cereals,employing a novel sorbent material[J].J Agric Food Chem,2012,60(9):2076~2082.
[31]Jiang Q,Wong J,Fyrst H,et al.γ-Tocopherolor combinations of vitamin E forms induce cell death in humanprostate cancer cells by interrupting sphingolipidsynthesis[J].Proc.Natl.Acad.Sci.USA,2004,101(51):17825~17830.
[32]Lechner M,Reiter B,Lorbeer E.Determination of tocopherols and sterolsin vegetable oils by solid-phase extraction and subsequent capillary gas chromatographic analysis[J].JChromatogr A,1999,857(1):231~238.
[33]Lu D,Yang Y,Wu X,et al.Simultaneous determination of eight vitamin E isomers and alpha-tocopherol acetate in functional foods and nutritional supplements by gas chromatography-mass spectrometry[J].Analytical Methods,2015,7(8):3353~3362.
[34]Pinheiro-Sant’Ana H M,Guinazi M,Oliveira D D S,et al.Method for simultaneous analysis of eight vitamin E isomers in various foods by high performance liquid chromatography and fluorescence detection[J].Journal of Chromatography A,2011,1218:8496~8502.
[35]Qi N L,Gong X,Feng C P,,et al.Simultaneous analysis of eight vitamin E isomers in Moringaoleifera Lam.leaves by ultra performance convergence chromatography[J].Food chemistry,2016,207:157~161.
[36]Robledo S N,Zachetti V G L,Zon M A,et al.Quantitative determination of tocopherols in edible vegetable oils using electrochemical ultra-microsensors combined with chemometric tools[J].Talanta,2013,116(22):964~971.
[37]Sen C K,Khanna S,Roy S.Tocotrienols:Vitamin E beyond to copherols [J].Life Sci,2006,78(18):2088~2098.
[38]Silva S D,Rosa N F,Ferreira A E,et al.Rapid determination ofα-tocopherolin vegetable oils by fourier transform infrared spectroscopy[J].Food Anal Method,2009,2(2):120~127.
[39]Shin T S,Godber J S.Isolation of eight vitamin E isomers from a variety of natural sources by semi-preparative high performance liquid chromatography[J].Journalof Chromatography A,1994,678:49~58.
[40]Yang Y,Lu D,Zhang J,et al.Simultaneous HPLC-DAD Determination of Retinol and Eight Vitamin E Isomers in Human Serum[J].Chromatographia,2015,78:1359~1366.
[41]Yu W,Simmons-Menchaca M,Gapor A,et al.Induction of Apoptosis in Human Breast Cancer Cells by Tocopherols and Tocotrienols[J].Nutr.Cancer,1999,33(1):26~32.
[42]Zerbinati C,Galli F,Regolanti R,et al.Gas chromatography-mass spectrometry microanalysis of alpha-and gamma-tocopherol in plasma and whole blood[J].Clinicachimica ACTA,2015,446:156~162.■
Natural vitamin E(VE)is a kind of antioxidant which exists in plant oils.VE was found to possess unique features,such as safety,high efficiency,non-toxic.Therefore,it has been widespread concerned and used in foods,feeds,medicines,and cosmetics.In order to control the quality of nature VE,several analysis methods have been developed based on its physical and chemical properties.This article reviewed the natural VE detection technologies,such as chromatography,spectrum,and electrochemical detection techniques.At the same time,the basic principle and relative merits of the analysis methods have also been discussed.The sensitivity,accuracy and detection limit of each method were compared,in order to selectthe mostsnitable method to determine the samples.
naturalvitamin E;tocopherol;tocotrienol;detection techniques
S816.17
A
1004-3314(2017)15-0028-06
10.15906/j.cnki.cn11-2975/s.20171507
“十三五”国家重点研发计划项目课题(2016YFF0201802)
*通讯作者
