百里醌对2型糖尿病大鼠脑内氧化应激及细胞因子表达的影响
2017-08-21冯永浩陈英辉施晓红
冯永浩 陈 龙 陈英辉 施晓红△
(1复旦大学附属金山医院内分泌科,2神经内科 上海 201508)
百里醌对2型糖尿病大鼠脑内氧化应激及细胞因子表达的影响
冯永浩1陈 龙2陈英辉2施晓红1△
(1复旦大学附属金山医院内分泌科,2神经内科 上海 201508)
2型糖尿病; 百里醌; 氧化应激; 炎症; 细胞因子; 大鼠
2型糖尿病是常见的内分泌紊乱疾病之一,其长期并发症可影响眼、肾脏、血管、心脏,甚至导致神经变性及中枢神经系统功能紊乱[1]。在过去的10年里,2型糖尿病中枢神经系统并发症发病率已有显著的升高[2]。目前,中枢神经系统的长期慢性并发症称为糖尿病脑病(diabetic encephalopathy,DE),该并发症可致患者学习、记忆能力下降等认知功能障碍[3]。大量研究证实糖尿病脑病与炎性反应、氧化应激密切相关。百里醌(thymoquinone ,TQ)作为一种从黑草种子中提炼出的有效生物活性单体,具有多种生物学作用,目前已用于中枢神经系统疾病的治疗[4],但关于TQ对糖尿病脑病治疗效果的研究少之又少。同时,由于TQ分子结构的特殊性,使其可以通过血脑屏障,为治疗糖尿病脑病提供了天然优势[5]。为了初步探究TQ对糖尿病脑病的治疗效果及发现其潜在的机制,本研究将观察TQ对2型糖尿病大鼠脑内氧化应激相关蛋白及细胞因子表达的影响。
材 料 和 方 法
试剂 TQ和链脲佐菌素(streptozocin,STZ)购自美国Sigma公司。水合氯醛购于上海工硕生物科技有限公司。血红素加氧酶-1 (heme oxygenase-1,HO-1)抗体、核因子E2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)抗体购自英国Abcam公司,环加氧酶-2 (cyclo-oxygenase 2,COX-2)抗体购自沈阳万类生物科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自日本株式会社同仁化学研究所。
实验动物及分组 48只6 周龄雄性Wistar大鼠(140~160 g),购自复旦大学实验动物科学部。动物使用符合上海市动物管理委员会管理条例。单笼饲养,保持饲养室安静、温度为(20±2) ℃、相对湿度为60%,光照时间12 h/d,清洁饮水,造模前给予普通饮食并适应性饲养1周。实验分正常对照组、模型组和百里醌组(n=16)。模型组和百里醌组为造模成功的2型糖尿病大鼠。根据本课题组前期的研究成果[6],造模成功后百里醌组给予腹腔注射无水乙醇溶解的TQ(5 mg/kg),隔天1次共6周,模型组腹腔注射等量无水乙醇,期间继续高糖、高脂饲料(正常饲料∶猪油∶蔗糖=7∶2∶1)喂养。各组大鼠在测定取材时,月龄处于相同水平,而且模型组和百里醌组血糖差异无统计学意义。
2型糖尿病大鼠模型的建立 正常对照组大鼠食用清洁级普通饲料12周。模型组和百里醌组大鼠食用高糖、高脂饲料。饲料由北京博泰宏达生物技术有限公司提供。在高脂、高糖饲料喂养6 周后,模型组和百里醌组禁食12 h以上(不禁水),然后腹腔注射STZ 35 mg/kg。腹腔注射STZ 72 h后检测大鼠空腹血糖(测试前禁食12 h,不禁水),以血糖含量>16.7 mmol/L者为2型糖尿病大鼠造模成功,纳入实验。造模过程中,模型组有2只死亡,百里醌组有1只死亡,造模成功率为87%。
血糖测定 分别于腹腔注射STZ 72 h后和标本取材前,尾静脉采血,采用葡萄糖氧化酶法,用德国罗氏公司ACCU-CHEK®血糖仪及试纸条测定各组大鼠空腹血糖。
Western blot 10%水合氯醛(0.4 mL/100 g)腹腔注射,麻醉大鼠,断头法处死大鼠,获取脑组织,然后分离出海马组织。RIPA裂解液与PMSF按100∶1的比例配成蛋白质提取液,每1 mL蛋白质提取液加入100 mg新鲜的脑组织提取蛋白质。以微管蛋白作为内参照,按照制胶、上样、电泳、转膜、封闭、抗体孵育、ECL发光的顺序进行电泳,转膜后显像。
SOD测定 用生理盐水清洗脑组织,尽可能将血液去除。用无菌纸巾将脑组织上的水分吸干,然后称取100 mg脑组织,加入900 μL蔗糖缓冲液(0.25 mol/L 蔗糖,10 mmol/L HEPES,1 mmol/L EDTA,pH 7.4),用匀浆器将样品匀浆。再用冰浴器将样品超声粉碎(60 W,0.5 s间隔,15 min)。 随后按照SOD试剂盒的操作步骤测定各组SOD活性。
结 果
TQ干预前后对血糖水平的影响 造模成功时百里醌组[(23.37±6.45)mmol/L]和模型组[(22.76±4.17)mmol/L]空腹血糖水平均较正常对照组[(5.46±0.49)mmol/L]显著升高,差异具有统计学意义(F=59.6,P<0.001);而模型组和百里醌组之间比较差异无统计学意义(P=0.995,P>0.05)。TQ治疗6周后,百里醌组[(16.81±3.15)mmol/L]和模型组[(20.40±5.15)mmol/L]空腹血糖水平均仍较正常对照组[(5.96±0.29)mmol/L]高,差异具有统计学意义(F=37.3,P<0.001);百里醌组血糖下降,但与模型组相比,差异无统计学意义(P=0.095,P>0.05)。表明TQ无明显降低糖尿病大鼠血糖的作用。
大鼠海马组织中Nrf2,HO-1和COX-2的蛋白质水平Westernblot检测结果(表1,图1A)显示,Nrf2的水平在各组之间差异有统计学意义(F=77.3,P<0.001)。与正常对照组相比,模型组海马组织中Nrf2的水平明显降低(P<0.001);与模型组相比,百里醌组海马组织中Nrf2水平升高(P<0.001,表1,图1B)。提示TQ提高了糖尿病大鼠海马组织中Nrf2的水平。HO-1水平在各组之间差异有统计学意义(F=18.5,P=0.003)。与正常对照组相比,模型组海马组织中HO-1的水平明显降低(P=0.011);与模型组相比,百里醌组海马组织中HO-1水平升高(P=0.001,表1,图1C)。TQ提高了糖尿病大鼠海马组织中HO-1的水平。
综上表明,百里醌组的氧化应激水平较模型组有明显下降,且Nrf2与HO-1的变化趋势一致,证明了TQ可能通过激活Nrf2/HO-1通路来缓解2型糖尿病大鼠海马组织的氧化应激反应。Westernblot结果亦表明,COX-2水平在各组之间差异具有统计学意义(F=28.9,P=0.001)。与正常对照组相比,模型组海马组织中COX-2的水平明显升高(P<0.001),百里醌组海马组织中COX-2水平也明显升高(P=0.022);与模型组相比,百里醌组海马组织中COX-2的水平降低(P=0.004)(表1,图1D)。表明经过TQ治疗后,百里醌组大鼠海马组织的炎性反应程度较模型组有明显下降,但仍高于正常对照组,提示TQ可能在一定程度上改善糖尿病大鼠海马组织的炎性反应。

表1 各组大鼠海马组织中Nrf2,HO-1和COX-2的蛋白质相对水平
大鼠海马组织中SOD的活性 根据SOD试剂盒检测原理,SOD抑制率可以反映SOD活性的强弱。SOD试剂盒检测结果显示,正常对照组SOD抑制率为73.6%±3.3%,模型组SOD抑制率为17.8%±2.0%,百里醌组SOD抑制率为25.3%±4.4%,各组间SOD活性的差异具有统计学意义(F=242.3,P<0.001)。与正常对照组相比,模型组海马组织中SOD活性明显降低(P<0.001);与模型组相比,百里醌组SOD活性明显升高(P=0.034)。表明TQ提高了海马组织中的SOD活性,进而改善氧化应激,提示TQ在糖尿病大鼠脑组织中可能通过提高SOD活性来改善氧化应激。
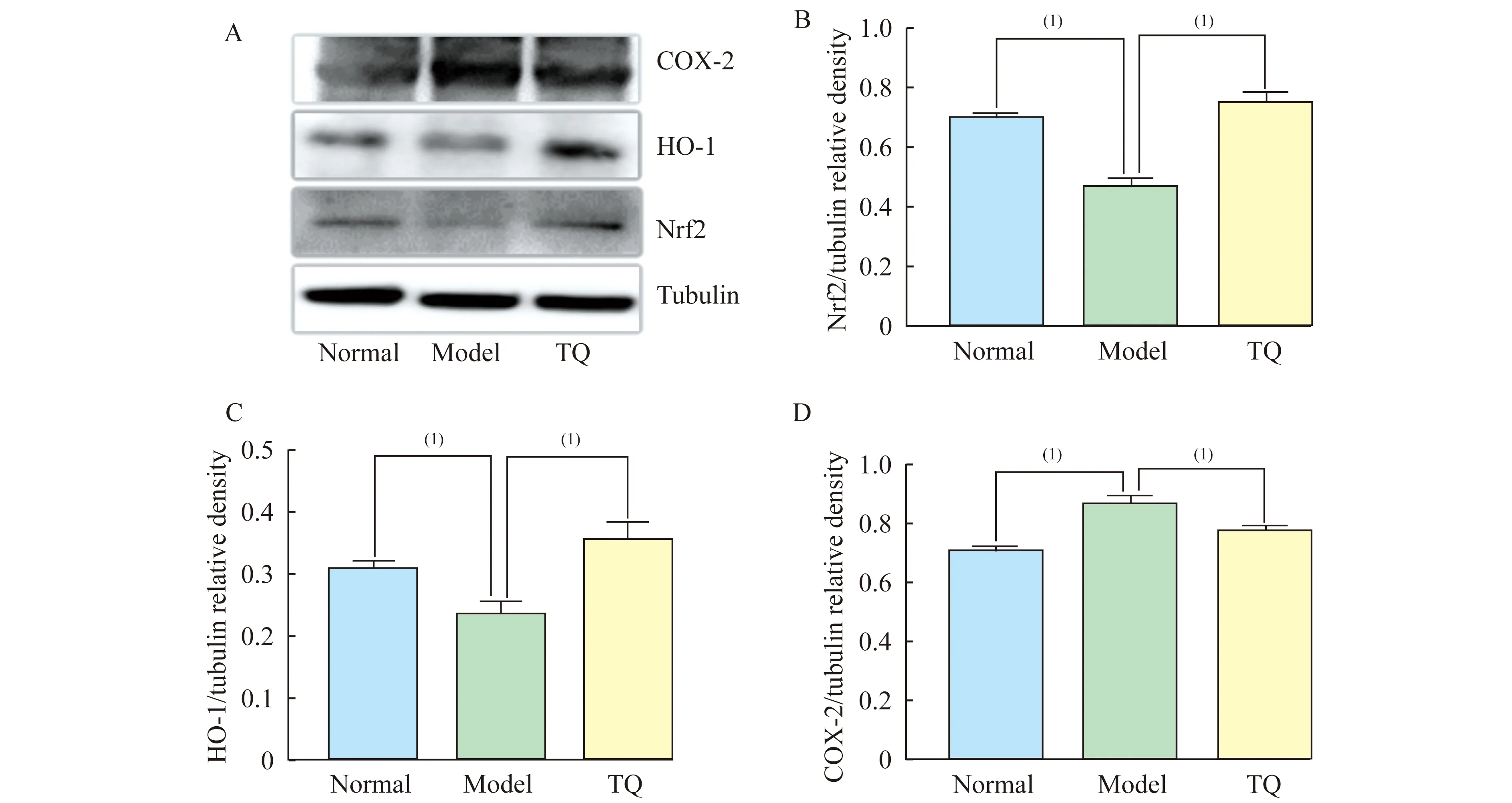
A:Representative protein bands; B:Nrf2/tubulin protein ratio according to band density; C:HO-1/tubulin protein ratio according to band density; D:COX-2/tubulin protein ratio according to band density.Data was shown as mean±SE.TQ:Thymoquinone.(1)P<0.01.
图1 TQ对各组大鼠氧化应激及炎症的影响
Fig 1 Effect of TQ on oxidative stress and inflammation in rats
讨 论
2型糖尿病时,糖代谢的急性和慢性紊乱可损害中枢神经系统[7]。常见的急性紊乱有低血糖所致的神经损害及其精神症状,高血糖所致的酮症酸中毒和高渗性昏迷。长期慢性糖代谢紊乱可在结构、神经生理及神经精神等方面对脑组织产生不良影响,进而导致糖尿病相关认知障碍,故又称作糖尿病脑病(diabetic encephalopathy,DE)[8]。1966年Nielon定义了DE的概念[9],主要表现为记忆能力消退,语言表达、理解能力降低,同时可能伴有神情淡漠、动作迟缓等,病理变化可表现为大脑萎缩、脑室扩大、神经脱髓鞘、脑血管改变等。考虑到海马组织与认知功能障碍密切相关,故本研究选取海马组织作为实验标本。
目前尚无典型的DE动物模型,对于DE的研究大都建立在糖尿病动物模型基础上。腹腔注射STZ是目前经典的诱发糖尿病的方法。STZ对一定种属动物的胰岛β细胞具有选择性破坏作用,能诱发动物产生糖尿病[10]。小剂量(25~40 mg/kg)注射STZ时,由于其只是破坏一部分胰岛β细胞的功能,造成外周组织对胰岛素不敏感,同时给予高脂高糖饲料喂养,两者结合便诱导出病理、生理改变都接近于人类2型糖尿病的动物模型[11]。STZ注射法具有稳定性强、对全身各器官毒性小、造模成功率高等优点,而且STZ 不会直接影响脑组织的代谢,因而适用于糖尿病神经系统并发症的研究[12]。
DE的病理生理机制较为复杂,目前认为氧化应激是DE发生的重要机制之一[13]。机体在正常情况下的氧化和抗氧化处于相对平衡状态。氧化应激是指机体受到各种有害刺激时,体内氧化与抗氧化作用失衡,倾向于氧化,导致活性氧(reactive oxygen species,ROS)生成过多,抗氧化物水平相对不足,活性下降,使氧化与抗氧化系统失衡,产生氧化应激,从而导致组织的损伤。在持续高糖条件下,脑组织的线粒体功能障碍[14],导致ROS的生成超出脑组织的清除能力,使ROS在脑组织逐渐积累,进而导致神经细胞变性、坏死,发生中枢神经系统慢性、进行性、退行性疾病,最终导致糖尿病脑损伤,在大脑发生结构、神经生理及神经精神等方面的病理改变[15]。
近年来越来越多的研究证明,炎性反应亦参与了DE的发病机制[16]。有临床证据表明,在存在认知功能减退的2型糖尿病患者中,血清中的炎症因子白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α TNF-α)、C反应蛋白(C-reactive protein,CRP)、IL-10水平均明显高于不存在认知功能障碍的糖尿病患者[17-18]。已有实验证实IL-6、 TNF-α、IL-10等炎性因子在2型糖尿病大鼠脑组织中表达升高,从而损害认知功能[19]。以上研究表明炎性因子参与了DE的发病过程。
TQ的化学结构为2-异丙基-5-甲基-1,4-苯并醌,是从黑种草籽中分离出来的主要有效单体[20]。黑种草属毛茛科黑种草属植物,分布于中东、中亚及我国新疆等地区,全草均可入药,无明显毒性作用和不良反应,几乎完全用于食用和医疗,千百年来被广泛应用于多种疾病的治疗。20世纪60年代,科学家首次从黑种香草的种子中提取并分离出TQ,并将其应用于各种疾病模型实验。近年来大量实验结果证明TQ具有显著的抗氧化及抗炎作用[21]。
目前研究表明Nrf2/ARE/HO-1通路作为机体对抗氧化应激的主要机制之一[22],而SOD作为一种抗氧化酶可在脑组织中表达[23]。故Nrf2、HO-1及SOD可以反映糖尿病大鼠脑组织中的氧化应激水平。本研究发现,模型组大鼠海马组织的Nrf2和HO-1水平低于正常对照组大鼠,而百里醌组大鼠脑组织中Nrf2和HO-1水平高于模型组。表明模型组大鼠海马组织内发生了显著的氧化应激反应,且超出了机体的承受能力。但经过TQ治疗后,大鼠海马组织的抗氧化应激能力较模型组有显著上升。同时,模型组SOD活性低于正常对照组,百里醌组海马组织中SOD活性高于模型组。表明经TQ治疗后可以提高海马组织抗氧化应激相关酶的活性,进而改善海马组织内的氧化应激反应。本研究发现,经TQ治疗6周后,百里醌组和模型组之间的血糖无明显差异,表明百里醌组大鼠高表达的Nrf2、HO-1、SOD并未降低血糖。这些结果表明,糖尿病大鼠海马脑组织内发生了氧化应激反应,而TQ可能通过激活Nrf2/ARE通路提高抗氧化酶HO-1和SOD的水平从而减轻氧化应激对2型糖尿病大鼠海马组织的损伤。
COX-2作为环加氧酶同工酶的一种,主要特异性表达于炎性组织,在炎性反应中发挥重要作用[24]。本研究通过检测脑组织中的COX-2来评估脑组织中的炎性水平。实验结果显示,模型组中的COX-2的水平明显均高于正常对照组,而百里醌组脑组织中的COX-2的水平明显低于模型组,表明糖尿病大鼠的脑组织中存在明显的炎性反应。由于百里醌组和模型组之间的血糖无明显差异,表明TQ并非通过降低血糖来减轻糖尿病大鼠的炎性反应,而是直接抑制了糖尿病海马组织中的炎性反应。
DE由多因素、多环节、多靶点共同作用所致,随着社会老龄化进程的推进,其作为糖尿病的又一重要并发症对人们生活质量的威胁越来越大。由于其病因及发病机制复杂,西医治疗以控制血糖、减轻胰岛素抵抗、增加胰岛素敏感性为主,缺乏明确的药物干预方法。因此,积极寻找特异性药物控制以进行性认知障碍为主的DE已不容忽视。TQ作为黑草种子的一种提取物,具有广泛的生物学活性。本文仅简单研究了炎症及氧化应激相关蛋白质的水平,未进一步同步做定量PCR、组织形态学、功能学研究,如脑组织病理及大鼠学习记忆能力改变等。但实验结果证明TQ可以明显直接抑制2 糖尿病大鼠脑组织的炎性反应以及改善脑组织的氧化应激水平,初步说明TQ作为特异性药物治疗DE具有一定的价值。
[1] SIMS-ROBINSON C,BAKEMAN A,ROSKO A,etal.The role of oxidized cholesterol in diabetes-induced lysosomal dysfunction in the brain[J].MolNeurobiol,2016,53(4):2287-2296.
[2] BIESSELS GJ,VAN DER HEIDE LP,KAMAL A,etal.Ageing and diabetes:implications for brain function[J].EurJPharmacol,2002,441(1-2):1-14.
[3] ZILLIOX LA,CHADRASEKARAN K,KWAN JY,etal.Diabetes and cognitive impairment[J].CurrDiabRep,2016,16(9):87.
[4] GÖKCE EC,KAHVECI R,GÖKCE A,etal.Neuroprotective effects of thymoquinone against spinal cord ischemia-reperfusion injury by attenuation of inflammation,oxidative stress,and apoptosis[J].JNeurosurgSpine,2016,24(6):949-959.
[5] AHMAD MZ,AHMAD J,AMIN S,etal.Role of nanomedicines in delivery of anti-acetylcholinesterase compounds to the brain in Alzheimer's disease[J].CNSNeurolDisordDrugTargets,2014,13(8):1315-1324.
[6] CHEN L,LI B,CHEN B,etal.Thymoquinone alleviates the experimental diabetic peripheral neuropathy by modulation of inflammation[J].SciRep,2016,6:31656.
[7] SELVARAJAH D,TESFAYE S.Central nervous system involvement in diabetes mellitus[J].CurrDiabRep,2006,6(6):431-438.
[8] KIM DJ,YU JH,SHIN MS,etal.Hyperglycemia reduces efficiency of brain networks in subjects with type 2 diabetes[J].PLoSOne,2016,11(6):e0157268.
[9] RESKE-NIELSEN E,LUNDBK K,RAFAELSEN OJ.Pathological changes in the central and peripheral nervous system of young long-term diabetics :I.Diabetic encephalopathy[J].Diabetologia,1966,1(3-4):233-241.
[10] SRINIVASAN K,VISWANAD B,ASRAT L,etal.Combination of high-fat diet-fed and low-dose streptozotocin-treated rat:a model for type 2 diabetes and pharmacological screening[J].PharmacolRes,2005,52(4):313-320.
[11] REED MJ,MESZAROS K,ENTES LJ,etal.A new rat model of type 2 diabetes:the fat-fed,streptozotocin-treated rat[J].Metabolism,2000,49(11):1390-1394.
[12] DAVIDSON E,COPPEY L,LU B,etal.The roles of streptozotocin neurotoxicity and neutral endopeptidase in murine experimental diabetic neuropathy[J].ExpDiabetesRes,2009,2009:431980.
[13] WANG X,ZHAO L.Calycosin ameliorates diabetes-induced cognitive impairments in rats by reducing oxidative stress via the PI3K/Akt/GSK-3beta signaling pathway[J].BiochemBiophysResCommun,2016,473(2):428-434.
[14] KUHAD A,CHOPRA K.Curcumin attenuates diabetic encephalopathy in rats:behavioral and biochemical evidences[J].EurJPharmacol,2007,576(1-3):34-42.
[15] YAN S,DU F,WU L,etal.F1F0 ATP synthase-cyclophilin D interaction contributes to diabetes-induced synaptic dysfunction and cognitive decline[J].Diabetes,2016,65(11):3482-3494.
[16] ZHOU X,ZHANG F,HU X,etal.Inhibition of inflammation by astaxanthin alleviates cognition deficits in diabetic mice[J].PhysiolBehav,2015,151:412-420.
[17] 杨帆,杨立,许旌,等.老年2型糖尿病患者的炎症因子水平与认知功能障碍的关系[J].卒中与神经疾病,2014,21(3):169-173.
[18] 李新玲,朱向阳,黄怀宇,等.2型糖尿病认知功能障碍患者血清IL-6、TNF-α的水平[J].脑与神经疾病杂志,2012,20(1):40-43.
[19] MIAO Y,HE T,ZHU Y,etal.Activation of hippocampal CREB by rolipram partially recovers balance between TNF-α and IL-10 levels and improves cognitive deficits in diabetic rats[J].CellMolNeurobiol,2015,35(8):1157-1164.
[20] HOSSEINZADEH H,PARVARDEH S.Anticonvulsant effects of thymoquinone,the major constituent of Nigella sativa seeds,in mice[J].Phytomedicine,2004,11(1):56-64.
[21] OJHA S,AZIMULLAH S,MOHANRAJ R,etal.Thymoquinone protects against myocardial ischemic injury by mitigating oxidative stress and inflammation[J].EvidBasedComplementAlternatMed,2015,2015:143629.
[22] HUANG WY,CHAO XJ,OUYANG Y,etal.Tacrine-6-ferulic acid,a novel multifunctional dimer against Alzheimer′s disease,prevents oxidative stress-induced neuronal death through activating Nrf2/ARE/HO-1 pathway in HT22 cells[J].CNSNeurosciTher,2012,18(11):950-951.
[23] FAIZ M,ACARIN L,PELUFFO H,etal.Antioxidant Cu/Zn SOD:expression in postnatal brain progenitor cells[J].NeurosciLett,2006,401(1-2):71-76.
[24] ALHOUAYEK M,MUCCIOLI GG.COX-2-derived endocannabinoid metabolites as novel inflammatory mediators[J].TrendsPharmacolSci,2014,35(6):284-292.
Effects of thymoquinone on oxidative stress and cytokine expression in brain of type 2 diabetic rats
FENG Yong-hao1, CHEN Long2, CHEN Ying-hui2, SHI Xiao-hong1△
(1DepartmentofEndocrinology,2DepartmentofNeurology,JinshanHospital,FudanUniversity,Shanghai201508,China)
type2diabetesmellitus;thymoquinone;oxidativestress;inflammation;cytokines;rat
R
Adoi: 10.3969/j.issn.1672-8467.2017.04.015
2016-11-27;编辑:张秀峰)
△Corresponding author E-mail:shixh80301@163.com
