乳酸片球菌对肥育猪生长性能及肠道抗氧化能力、形态结构和菌群的影响
2017-08-16车向荣李敏华蔡传江
秦 红 赵 燕 车向荣* 李敏华 蔡传江 郭 亮
(1.山西农业大学动物科技学院,山西优势肉用家畜高效安全生产协同创新中心,太谷030801;2.西北农林科技大学,杨凌712100;3.天津农学院,天津300384)
乳酸片球菌对肥育猪生长性能及肠道抗氧化能力、形态结构和菌群的影响
秦 红1赵 燕1车向荣1*李敏华1蔡传江2郭 亮3
(1.山西农业大学动物科技学院,山西优势肉用家畜高效安全生产协同创新中心,太谷030801;2.西北农林科技大学,杨凌712100;3.天津农学院,天津300384)
本试验旨在研究乳酸片球菌对肥育猪生长性能及肠道抗氧化能力、形态结构和菌群的影响。选取48头体重为(62.46±1.20) kg的“杜×长×大”肥育猪,将其随机分为2组,每组4个重复,每个重复6头猪(公母各占1/2)。对照组饲喂基础饲粮,试验组饲喂基础饲粮中添加0.1 g/kg乳酸片球菌制剂(1.0×1010CFU/g)的试验饲粮。试验期56 d。结果表明,与对照组相比:1)饲粮添加乳酸片球菌对肥育猪平均日采食量、平均日增重、料重比无显著影响(P>0.05)。2)饲粮添加乳酸片球菌显著提高了肥育猪十二指肠谷胱甘肽过氧化物酶(GSH-Px)活性、空肠总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活性以及回肠过氧化氢酶(CAT)活性(P<0.05)。3)饲粮添加乳酸片球菌显著降低了肥育猪十二指肠隐窝深度(P<0.05),显著提高了黏膜厚度(P<0.05)、肠壁厚度(P<0.05)以及绒毛高度/隐窝深度(P<0.05);显著降低了空肠隐窝深度(P<0.05),显著增加了绒毛高度/隐窝深度(P<0.05);显著增加了回肠绒毛高度(P<0.05)。4)饲粮添加乳酸片球菌显著增加了肥育猪空肠乳酸菌数量、定植抗力(P<0.05),显著降低了大肠杆菌数量(P<0.05)。由此可见,饲粮添加0.1 g/kg乳酸片球菌(1.0×1010CFU/g)能改善肥育猪肠道菌群和肠道形态结构,增强肠道抗氧化能力,进而促进肥育猪的肠道健康。
乳酸片球菌;生长性能;抗氧化功能;肠道形态结构;菌群
近年来抗生素用作饲料添加剂所引起的药物残留、细菌耐药性等问题已经引起公众的严重不安。联合国粮农组织(FAO)于1997年和1998年先后2次要求禁止和淘汰使用抗生素饲料添加剂,欧盟也于2006年全面停止使用抗生素生长促进剂。抗生素类饲料添加剂在全球范围内的禁用已成为必然趋势。因此,寻找抗生素替代物、完全替代或减少抗生素使用量已经成为当前研究的热点,而以乳酸菌为代表的益生素就是其中重要的一个研究对象。诸多研究发现,饲粮中添加乳酸菌制剂可调节肠道菌群[1],维护肠道结构和功能的完整性[2-3],调节免疫系统,预防和治疗肠道炎症[4-5],改善和提高动物生产性能[6],提高母猪所产仔猪窝重以及增加仔猪存活数[7],提高仔猪抗氧化水平[8]。但乳酸菌在猪方面的研究主要集中在对仔猪生长性能和抗腹泻作用的影响,而关于其对肥育猪生长性能和肠道屏障功能方面的影响却鲜有报道。本试验在无抗饲粮中添加单一菌种——乳酸片球菌,研究其对肥育猪生长性能及肠道抗氧化能力、形态结构和菌群的影响,为乳酸片球菌在肥育猪上的应用提供试验依据。
1 材料与方法
1.1 菌种来源
乳酸片球菌由山东宝来利生物工程股份有限公司提供,活菌数≥1.0×1010CFU/g。
1.2 试验设计
选取体重为(62.46±1.20) kg的“杜×长×大”杂交肥育猪48头,按体重相近、性别比例一致原则,随机分为2组,每组4个重复,每个重复6头猪,公母各占1/2。对照组饲喂基础饲粮,基础饲粮为粉料,参照NRC(2012)猪营养需要配制,其组成及营养水平见表1。试验组饲喂在基础饲粮中添加了0.1 g/kg乳酸片球菌制剂(1.0×1010CFU/g)的试验饲粮。试验期56 d。试验期间,每天喂料4次,自由采食和饮水。第56天每个重复选取1头体重接近平均值的肥育猪,停食、停水12 h后进行屠宰。
1.3 测定指标及方法
1.3.1 生长性能
在试验期开始和结束当天07:00分别对每栏猪逐头空腹称重,结算耗料量,以重复为单位,计算试验猪平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.3.2 肠道抗氧化能力
样品前处理:称取适量肠道组织,置液氮预冷的研钵中研磨成粉末(期间不断加入液氮),然后按质量(g)∶体积(mL)=1∶9加入匀浆介质(冷生理盐水),混匀,4 000 r/min离心10 min,吸取上清于1.5 mL EP管中。采用试剂盒测定上清中总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性,试剂盒购自南京建成生物工程研究所。
1.3.3 组织切片
屠宰后,无菌剪取十二指肠、空肠、回肠段各0.5 cm,用生理盐水漂洗,4%多聚甲醛进行固定,常规制作石蜡切片,苏木精-伊红(HE)染色,用光学显微镜(RM2235 LEICA)对切片进行观察测量,每个样本观察2个非连续切片,从不同的视野中选取6根完整的绒毛进行长度测量,测定绒毛高度以及隐窝深度,绒毛高度是指从其顶端至根部的距离,隐窝深度是指从相邻2根绒毛根部至基底部的距离。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 8 800 IU,VB14 mg,VB28 mg,VB630 mg,VB120.020 mg,VD31 800 IU,VE 20 IU,VK34 mg,生物素 biotin 0.08 mg,泛酸钙 calcium pantothenate 14 mg,烟酸 nicotinic acid 28 mg,Cu (as copper sulfate) 20 mg,Fe (as ferrous sulfate) 60 mg,Mn (as manganese sulfate) 40 mg,Zn (as zinc sulfate) 60 mg,I (as potassium iodide) 0.50 mg,Se (as sodium selenite) 0.30 mg。
2)粗蛋白质、钙、总磷为实测值,其余为计算值。CP, Ca and TP were measured values, while other nutrient levels were calculated values.
1.3.4 肠道菌群培养及计数
试验结束时,将肥育猪禁食(自由饮水)12 h后,颈静脉放血致死,剖腹后,立即用棉线结扎空肠、回肠和盲肠中段约5 cm各1段,无菌剪下放入自封袋,4 ℃冰箱保存,待取样结束后,立即运回实验室进行肠道菌群培养及计数。在无菌操作台上称取0.5~1.0 g的食糜,按质量比为1∶9加入已除氧的灭菌生理盐水,振荡摇匀后静置,此为10-1倍稀释液;直至稀释到10-7倍。将食糜样的10-5~10-7稀释液分别涂布于BL琼脂培养基计数双歧杆菌、MRS肉汤培养基计数乳酸菌。10-4~10-6稀释液涂布于伊红美蓝琼脂(EMB)培养基计数大肠杆菌。双歧杆菌和乳酸菌均37 ℃厌氧培养48 h,大肠杆菌于37 ℃有氧培养24 h。每个稀释梯度重复2次,最后取2次计数的平均值。粪便细菌的数量用lg(CFU/g)表示,即每克粪便中含菌落总数的自然对数[9]。
1.4 数据统计与分析
所有试验数据先用Microsoft Office 2013中的Excel程序进行整理,运用SPSS 19.0中的独立样本t检验,结果以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 乳酸片球菌对肥育猪生长性能的影响
由表2可知,与对照组相比,试验组平均日采食量、平均日增重及料重比均差异不显著(P>0.05)。

表2 乳酸片球菌对肥育猪生长性能的影响
2.2 乳酸片球菌对肥育猪肠道抗氧化能力的影响
由表3可知,与对照组相比,试验组十二指肠GSH-Px活性显著增加(P<0.05),而T-AOC、T-SOD以及CAT活性均差异不显著(P>0.05);试验组空肠T-AOC、T-SOD活性显著提高(P<0.05),而GSH-Px以及CAT活性均差异不显著(P>0.05);试验组回肠CAT活性显著增高(P<0.05),而T-AOC、T-SOD以及GSH-Px活性均无显著差异(P>0.05)。
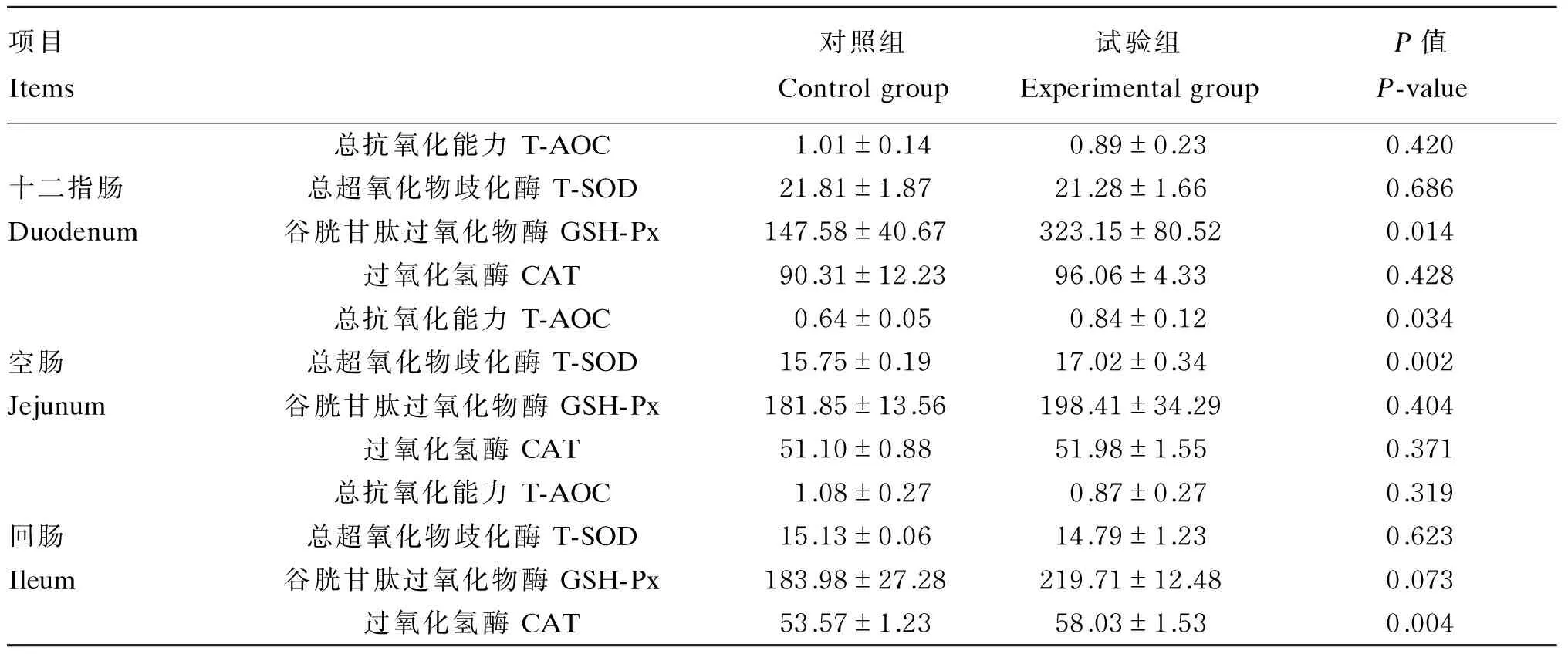
表3 乳酸片球菌对肥育猪肠道抗氧化能力的影响
2.3 乳酸片球菌对肥育猪肠道形态结构的影响
由表4可知,与对照组相比,试验组十二指肠中隐窝深度显著降低(P<0.05),黏膜厚度、肠壁厚度以及绒毛高度/隐窝深度显著增加(P<0.05),绒毛高度差异不显著(P>0.05);试验组空肠隐窝深度显著降低(P<0.05),绒毛高度/隐窝深度显著升高(P<0.05),绒毛高度、黏膜厚度以及肠壁厚度均差异不显著(P>0.05);在回肠中,试验组绒毛高度显著升高(P<0.05),但隐窝深度、黏膜厚度、肠壁厚度以及绒毛高度/隐窝深度均差异不显著(P>0.05)。

表4 乳酸片球菌对肥育猪肠道形态结构的影响
2.4 乳酸片球菌对肥育猪肠道菌群的影响
由表5可知,在肥育猪空肠中,试验组双歧杆菌数量与对照组相比没有显著差异(P>0.05),乳酸菌数量以及定植抗力显著增加(P<0.05),大肠杆菌数量显著降低(P<0.05)。在回肠、盲肠中试验组双歧杆菌、乳酸菌、大肠杆菌以及定植抗力均与对照组相比没有显著差异(P>0.05)。
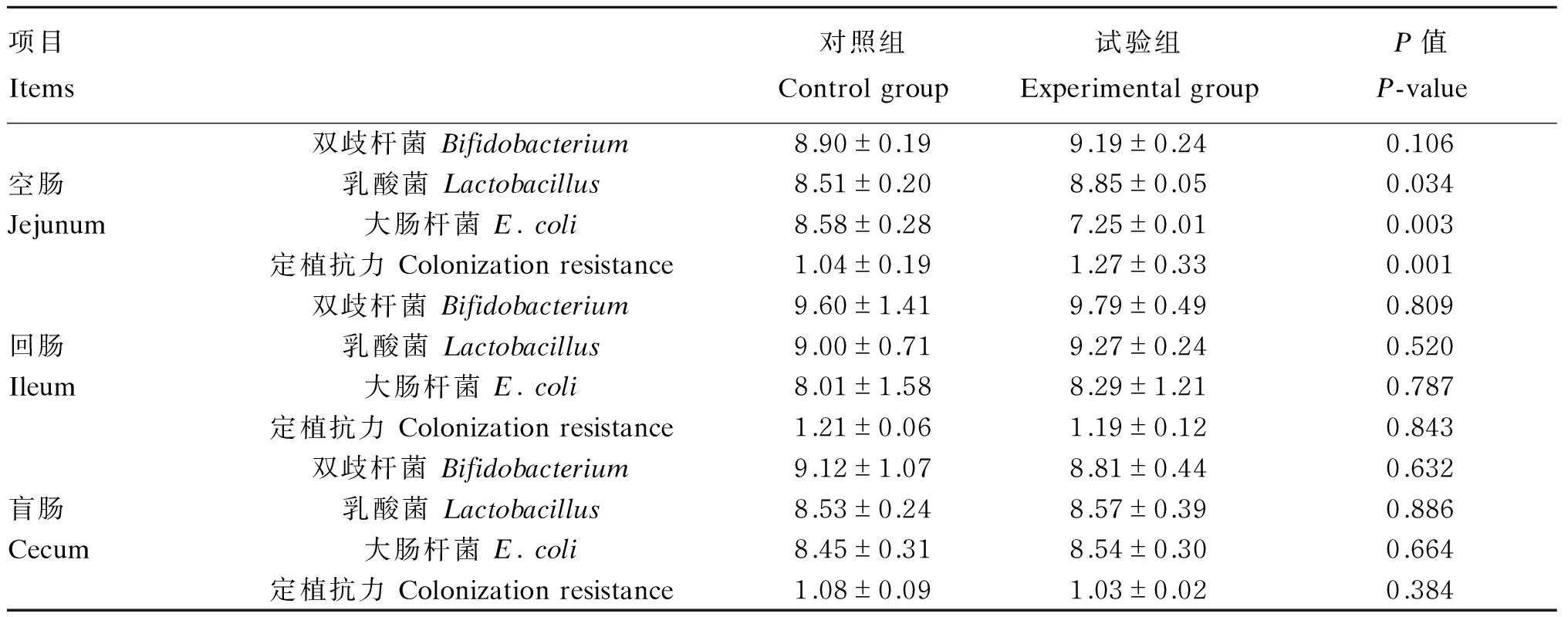
表5 乳酸片球菌对肥育猪肠道菌群的影响
3 讨 论
3.1 乳酸片球菌对肥育猪生长性能的影响
早在1947年就有研究人员证实,用乳酸乳杆菌饲喂仔猪可有效改善猪的健康状况,增加猪的体重[10]。何颖等[11]研究结果显示,NS复合乳酸菌对63~150日龄段肉猪的平均日增重具有一定调节作用并提高其饲料报酬。张天阳等[12]研究表明,饲喂乳酸菌可以促进生长肥育猪的生长发育,提高饲料转化率。李涛[13]研究表明,饲喂乳酸菌发酵的饲料后可显著提高仔猪平均日增重并降低料重比。曹玮娜等[14]研究表明,在饮水中添加植物乳酸菌能提高獭兔生长性能。本试验中,在饲粮中添加0.1 g/kg的乳酸片球菌后,试验组平均日增重提高了2.3%、料重比降低了1.8%,与上述研究结果基本一致。这可能是由于乳酸片球菌进入肠道后改善肥育猪肠道形态结构以及菌群结构,进而促进营养物质的消化吸收,促进其生长[8]。
3.2 乳酸片球菌对肥育猪肠道抗氧化能力的影响
在正常情况下,机体内自由基的产生和清除是处于动态平衡的状态。但由于各种原因导致机体自由基产生增多或机体清除自由基的能力下降时,机体就会出现氧化应激[15]。尽管机体的各个部位都有可能发生氧化应激,但由于肠道是机体消化吸收食物中营养物质的主要场所,消化酶将食物分解成小分子物质的同时也会产生铁、铜、醛以及脂质过氧化物等多种致氧化因子,使得肠道成为最易受到自由基攻击的部位[16-17]。目前,关于乳酸菌的抗氧化机制主要有2种观点:1)乳酸菌在肠道中裂解并释放出胞内物质,而乳酸菌胞内含有超氧化物歧化酶(SOD)和GSH-Px,当乳酸菌裂解后,这些抗氧化酶向周围环境释放并发挥抗氧化功能[18-20]。2)过氧化氢可与铜铁离子作用产生有毒性的羟自由基,而乳酸菌具有清除过渡族金属离子的作用,从而阻断氧化反应的发生[21-22]。
SOD、CAT和GSH-Px是生物机体内重要的抗氧化酶,发挥着活性氧自由基清除剂的作用,T-AOC可作为衡量动物机体抗氧化能力的综合指标。李涛[13]研究表明,饲喂乳酸杆菌可显著提高仔猪血清中SOD以及GSH-Px活性,显著降低MDA含量。胡晓丽[23]给饲喂高铁饲粮的小鼠灌服乳酸菌后可提高小鼠结肠T-AOC、CAT、SOD和GSH-Px活性。本试验表明,添加乳酸片球菌可增加十二指肠GSH-Px活性、空肠T-AOC和T-SOD活性以及回肠CAT活性,与李涛[13]、胡晓丽[23]研究的试验结果基本一致,说明添加乳酸片球菌可提高肥育猪肠道的抗氧化能力。
3.3 乳酸片球菌对肥育猪肠道形态的影响
小肠是动物机体消化吸收的主要场所,对营养物质的消化、吸收和转运起着重要的作用[24]。肠道黏膜由黏膜上皮、固有膜和黏膜肌层共同构成[25]。肠道绒毛高度、隐窝深度和绒毛高度/隐窝深度是衡量肠道消化吸收的重要指标[26]。绒毛增长,其与营养物质的接触面积增大,有利于营养物质的吸收;隐窝深度则反映了肠上皮细胞的更新速度,隐窝变浅则说明肠上皮细胞生成率降低,更新减慢;绒毛高度/隐窝深度则综合反映了小肠的功能状态,比值增大说明肠内膜面积大,单位面积绒毛细胞数增多,消化吸收的功能增强[27-29]。
崔志文[30]研究表明,给断奶仔猪饲喂鼠李糖乳杆菌后其空肠绒毛高度/隐窝深度、绒毛高度分别极显著增加了34.93%和13.92%,隐窝深度降低了14.53%。庞敏等[31]研究表明,唾液乳酸菌主要通过降低肠隐窝深度、增加肠绒毛高度/隐窝深度来抵御大鼠急性腹泻。侯改凤等[32]报道,在饲粮中添加0.1%德氏乳杆菌后肥育猪小肠绒毛高度增加,十二指肠和回肠的隐窝深度降低,小肠的绒毛高度/隐窝深度增加。本试验中,添加0.1 g/kg乳酸片球菌可提高十二指肠、空肠、回肠绒毛高度,其中显著提高回肠绒毛高度;显著降低十二指肠和空肠的隐窝深度;十二指肠、空肠和回肠绒毛高度/隐窝深度增加,其中十二指肠、空肠绒毛高度/隐窝深度增加显著。这说明乳酸菌具有改善肥育猪肠道黏膜形态以及维护肠道结构完整性的作用。
3.4 乳酸片球菌对肥育猪肠道菌群的影响
肠道微生物通过参与动物机体多种生理功能而对宿主产生影响。肠道致病菌大量繁殖可能会对肠道造成一系列的损伤,因此,防止致病菌和条件致病菌在肠道的定植,形成定植抗力非常重要[33],且大肠杆菌和乳酸菌被认为是指示肠道健康的主要菌群[34]。研究表明,乳酸杆菌在肠道中可产生乳酸、过氧化氢和细菌素等抗菌物质,通过竞争营养物质以及黏附位点来抑制致病菌,诱导黏附素分泌来增强肠道屏障作用,进而保护机体肠道[35]。何冬梅等[36]研究发现,在饮用活性乳酸菌饮料后可显著提高人体肠道内双歧杆菌以及乳酸菌的数量,降低产气荚膜梭菌的数量,具有调节肠道菌群的作用。李涛[13]研究表明,添加乳酸菌后可提高猪肠道菌群的多样性,维持肠道微生物区系稳态。刘辉等[37]研究表明,乳酸菌可降低生长猪粪便中大肠杆菌的数量,提高乳酸菌数量。楚青惠等[38]研究表明,在水中添加300 mL的乳酸菌液可使母猪粪便中的大肠杆菌、沙门氏菌的数量显著减少。王四新等[39]研究表明,猪源发酵乳酸杆菌可降低保育猪粪便中大肠杆菌的数量。本试验结果表明,添加乳酸片球菌可以增加空肠和回肠乳酸菌和双歧杆菌的数量及空肠的定植抗力、降低空肠中大肠杆菌数量,这与何冬梅等[36]的试验结果类似,表明添加乳酸片球菌可以促进肠道有益菌生长,抑制有害菌生长,调节肠道菌群平衡,继而改善肠道微生态环境。
4 结 论
饲粮添加0.1 g/kg乳酸片球菌(1.0×1010CFU/g)能改善肥育猪肠道微生物区系和肠道形态结构,增强肠道抗氧化能力,进而促进肥育猪的肠道健康。
[1] XIE N,CUI Y,YIN Y N,et al.Effects of twoLactobacillusstrains on lipid metabolism and intestinal microflora in rats fed a high-cholesterol diet[J].BMC Complementary and Alternative Medicine,2011,11:53.
[2] 邓军,李云锋,杨倩.枯草芽孢杆菌和猪源乳酸杆菌混合饲喂对仔猪肠绒毛发育的影响[J].畜牧兽医学报,2013,44(2):295-301.
[3] 曾东,李涛,倪学勤,等.乳酸杆菌和囊素三肽对肉鸡生长性能、屠宰性能、肉质和血清生化指标的影响[J].动物营养学报,2014,26(5):1320-1326.
[4] VILLENA J,KITAZAWA H.Role of toll-like receptors in the modulation of intestinal inflammation by immunobiotics[M]//ALVAREZ S.Probiotics:immunobiotics and immunogenic.Boca Raton:CRC Press,2013.
[5] VILLENA J,ASO H,ALVAREZ S,et al.Porcine toll-like receptors and their crosstalk with immunobiotics:impact in the regulation of gut inflammatory immunity[M]//SMITH A,JONES C J.Probiotics:sources,types and health benefits.New York:NOVA Science Publishers,2012:53-83.
[6] 李瑞,侯改凤,黄其永,等.德氏乳杆菌对哺乳仔猪生长性能、血清生化指标、免疫和抗氧化功能的影响[J].动物营养学报,2013,25(12):2943-2950.
[7] WANG J,JI H F,HOU C L,et al.Effects ofLactobacillusjohnsoniiXS4 supplementation on reproductive performance,gut environment,and blood biochemical and immunological index in lactating sows[J].Livestock Science,2014,164:96-101.
[8] WANG A N,CAI C J,ZENG X F,et al.Dietary supplementation withLactobacillusfermentumI5007 improves the anti-oxidative activity of weanling piglets challenged with diquat[J].Journal of Applied Microbiology,2013,114(6):1582-1591.
[9] 张芬鹊.细菌脂多糖和地塞米松应激对肉仔鸡肠黏膜功能的影响[D].硕士学位论文.太谷:山西农业大学,2015.
[10] 周庆安,刘文刚,任建存,等.抗生素及其替代品的研究、应用及发展方向[J].饲料广角,2002(16):18-21.
[11] 何颖,陈忠伟,韦明宇,等.NS复合乳酸菌对猪生长性能及其肠道菌群平衡的影响[J].南方农业学报,2012,43(12):2099-2103.
[12] 张天阳,楚青惠,曾勇庆,等.饲喂不同剂量乳酸菌液对生长肥育猪生长性能及胴体性状的影响[J].养猪,2013(5):41-44.
[13] 李涛.乳酸杆菌发酵饲料对猪生长、肉质、血清抗氧化及肠道菌群的影响[D].硕士学位论文.雅安:四川农业大学,2014.
[14] 曹玮娜,任战军,李亚力,等.乳酸菌对獭兔生长性能、肉品质及肌肉胰岛素样生长因子-1、胰岛素样生长因子1受体、生长激素受体mRNA相对表达量的影响[J].动物营养学报,2014,26(9):2902-2910.
[15] IMLAY J A,FRIDOVICH I.Assay of metabolic superoxide production inEscherichiacoli[J].The Journal of Biological Chemistry,1991,266(11):6957-6965.
[16] KUBOW S.Routes of formation and toxic consequences of lipid oxidation products in foods[J].Free Radical Biology and Medicine,1992,12(1):63-81.
[17] KANNER J,LAPIDOT T.The stomach as a bioreactor:dietary lipid peroxidation in the gastric fluid and the effects of plant-derived antioxidants[J].Free Radical Biology and Medicine,2001,31(11):1388-1395.
[18] LIN M Y,CHANG F Y.Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 andLactobacillusacidophilusATCC 4356[J].Digestive Diseases and Sciences,2000,45(8):1617-1622.
[19] LIN M Y,YEN C L.Antioxidative ability of lactic acid bacteria[J].Journal of Agricultural and Food Chemistry,1999,47(4):1460-1466.
[20] ROCHAT T,GRATADOUX J J,GRUSS A,et al.Production of a heterologous nonheme catalase byLactobacilluscasei:an efficient tool for removal of H2O2and protection of Lactobacillus bulgaricus from oxidative stress in milk[J].Applied and Environmental Microbiology,2006,72(8):5143-5149.
[21] HUYCKE M M,JOYCE W,WACK M F.Augmented production of extracellular superoxide by blood isolates ofEnterococcusfaecalis[J].Journal of Infectious Diseases,1996,173(3):743-745.
[22] HUYCKE M M,MOORE D,JOYCE W,et al.Extracellular superoxide production byEnterococcusfaecalisrequires demethylmenaquinone and is attenuated by functional terminal quinol oxidases[J].Molecular Microbiology,2001,42(3):729-740.
[23] 胡晓丽.乳酸菌抗氧化性及其对小鼠结肠氧化还原状态调节的研究[D].硕士学位论文.无锡:江南大学,2009.
[24] EL AIDY S,VAN DEN BOGERT B,KLEEREBEZEM M.The small intestine microbiota,nutritional modulation and relevance for health[J].Current Opinion in Biotechnology,2015,32:14-20.
[25] 印遇龙.仔猪营养学[M].北京:中国农业出版社,2010.
[26] 贺永康.中草药添加剂对肉鸡生产性能及肠道结构的影响[D].硕士学位论文.保定:河北农业大学,2010.
[27] 蒋桂韬,胡艳,王向荣,等.不同来源木聚糖酶对黄羽肉鸡小肠绒毛形态结构和黏膜生长抑素mRNA表达的影响[J].动物营养学报,2011,23(2):266-273.
[28] 徐子涵,许丽.不同剂型乳酸菌对雏鸡生长性能和小肠黏膜形态的影响[J].动物营养学报,2011,23(10):1812-1818.
[29] 成令忠.组织学[M].2版.北京:人民卫生出版社,1993.
[30] 崔志文.鼠李糖乳杆菌影响仔猪肠道屏障功能的研究[D].博士学位论文.杭州:浙江大学,2013.
[31] 庞敏,卢庆萍,朱丽媛,等.益生菌抵御大鼠急性腹泻的效果及其对肠道黏膜屏障的影响[J].动物营养学报,2016,28(5):1462-1470.
[32] 侯改凤,李瑞,刘明,等.德氏乳杆菌对育肥猪生长性能、养分消化率、血清生化指标及肠道结构的影响[J].动物营养学报,2015,27(9):2871-2877.
[33] ROSELLI M,FINAMORE A,BRITTI M S,et al.Alternatives to in-feed antibiotics in pigs:evaluation of probiotics,zinc or organic acids as protective agents for the intestinal mucosa.A comparison ofinvitroandinvivoresults[J].Animal Reasearch,2005,54(3):203-218.
[34] CASTILLO M,MARTIN-ORE S M,MANZANILLA E G,et al.Quantification of total bacteria,enterobacteria and lactobacilli populations in pig digesta by real-time PCR[J].Veterinary Microbiology,2006,114(1/2):165-170.
[35] 章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J].动物营养学报,2012,24(3):389-396.
[36] 何冬梅,朱海明,赖蔚苳,等.活性乳酸菌饮料对人体肠道菌群影响的研究[J].中国微生态学杂志,2006,18(6):454-456.
[37] 刘辉,季海峰,王四新,等.益生菌对生长猪生长性能、粪便微生物数量、养分表观消化率和血清免疫指标的影响[J].动物营养学报,2015,27(3):829-837.
[38] 楚青惠,汪官保,曾勇庆,等.饲喂乳酸菌对母猪和哺乳仔猪生长性能、血清生化指标及粪便微生物数量的影响[J].动物营养学报,2014,26(11):3362-3370.
[39] 王四新,季海峰,刘辉,等.猪源发酵乳酸杆菌对保育猪生长性能、养分表观消化率、粪便微生物数量及血清免疫指标的影响[J].中国畜牧兽医,2016,43(5):1215-1220.
*Corresponding author, professor, E-mail: chexr@163.com
(责任编辑 王智航)
Effects ofPediococcusacidilacticion Growth Performance, Intestinal Antioxidant Function, Morphological Structure and Microflora of Finishing Pigs
QIN Hong1ZHAO Yan1CHE Xiangrong1*LI Minhua1CAI Chuanjiang2GUO Liang3
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,ShanxiCollaborativeInnovationCenterforHigh-ProductiveandSafeLivestock,Taigu030801,China; 2.NorthwestA&FUniversity,Yangling712100,China; 3.TianjinAgriculturalUniversity,Tianjin300384,China)
This study was conducted to investigate effects ofPediococcusacidilacticion growth performance, intestinal antioxidant function, morphological structure and microflora of finishing pigs. Forty-eight crossed-bred (Duroc×Landrace×Yorkshine) finishing pigs with similar body weight [(62.57±1.20) kg] were selected and randomly allotted to 2 groups with 4 replicates per group and 6 pigs per replicate (half male and half female). Control group was fed a basal diet and experimental group was fed the basal diet supplemented with 0.1 g/kgPediococcusacidilactici(1.0×1010CFU/g). The experiment lasted for 56 days. The results showed that, compared with control group: 1) the supplementation ofPediococcusacidilacticihad no significant effects on average daily feed intake, average daily gain, feed to gain ratio (P>0.05). 2) Glutathione peroxidase activity in duodenum, total superoxide dismutase, total antioxidant capacity activity of jejunum, and catalase of ileum were significantly increased by the supplementation ofPediococcusacidilactici(P<0.05). 3) The supplementation ofPediococcusacidilacticisignificantly decreased crypt depth of duodenum, significantly increased mucosal thickness, intestinal thickness and villus height/crypt depth of duodenum (P<0.05); the supplementation ofPediococcusacidilacticisignificantly decreased crypt depth of jejunum (P<0.05), and significantly increased villus height/crypt depth (P<0.05); the supplementation ofPediococcusacidilacticisignificantly increased villus height of ileum (P<0.05). 4) The supplementation ofPediococcusacidilacticisignificantly increased lactobacillus count and colonization resistance, and significantly decreasedE.colicount of jejunum (P<0.05). In conclusion, the supplementation of 0.1 g/kgPediococcusacidilactici(1.0×1010CFU/g) can improve intestinal microflora and morphological structure, enhance oxidation resistance, and improve the intestinal health of finishing pigs.[ChineseJournalofAnimalNutrition, 2017, 29(8):2953-2960]
Pediococcusacidilactici; growth performance; antioxidant function; intestinal morphological structure; microflora
10.3969/j.issn.1006-267x.2017.08.040
2017-02-01
天津市科技计划项目(152XZYNC00100);天津生猪产业技术体系创新团队(ITTPRS2017006);山西省科学技术发展计划项目
秦 红(1989—),女,山西大同人,硕士研究生,从事动物营养与饲料科学研究。E-mail: qhboshi@163.com
*通信作者:车向荣,教授,硕士生导师,E-mail: chexr@163.com
S828
A
1006-267X(2017)08-2953-08
