放射治疗前列腺癌原发灶对远隔骨转移性疼痛缓解的临床观察*
2017-08-16岳芙蓉
张 军,岳芙蓉,张 力,邓 超,李 刚
(重庆三峡中心医院肿瘤分院一病区/重庆市三峡肿瘤防治研究所 404000)
放射治疗前列腺癌原发灶对远隔骨转移性疼痛缓解的临床观察*
张 军,岳芙蓉,张 力,邓 超,李 刚△
(重庆三峡中心医院肿瘤分院一病区/重庆市三峡肿瘤防治研究所 404000)
目的 探讨放射治疗前列腺癌原发灶对远隔骨转移性疼痛缓解的临床效果。方法 选择2010-2013年该院确诊为前列腺癌骨转移伴有疼痛的患者79例分为两组。联合治疗组40例采用前列腺局部放射治疗联合内分泌治疗,对照组39例单用内分泌治疗。按照实体瘤疗效评价标准和疼痛数字评分法评估治疗后两组的疗效,观察不良反应和疼痛生化指标变化。结果 联合治疗组治疗后骨转移疼痛症状明显改善,疼痛缓解率优于对照组(P<0.05)。血清前列腺特异性抗原、Ⅰ型胶原吡啶交联终肽较对照组明显下降(P<0.01)。结论 前列腺癌原发灶放射治疗联合内分泌治疗能有效地缓解前列腺癌骨转移疼痛,改善生活质量。
前列腺肿瘤;骨转移性疼痛;放射疗法;抗雄激素治疗;前列腺特异性抗原
前列腺癌在欧美男性中发病率居第1位,是仅次于肺癌的第2位癌症死因[1]。在我国,随着人们饮食结构的变化及人口平均寿命的延长,近年来前列腺癌的发病率已出现明显上升趋势[2]。由于前列腺癌的症状类同于前列腺增生,发病隐匿,其症状常常被忽视,当确诊时约80%已有局部浸润或远处骨转移。其骨转移发生率达65%~75%, 骨转移可引起疼痛等不适症状,严重影响患者的生活质量[3-5]。
前列腺癌骨转移常因骨质破坏引起疼痛,有病理生理性的也有神经感受性的,经常伴有血清Ⅰ型胶原吡啶交联终肽(carboxyteminal telopeptide of typeⅠcollagen,ICTP)、β-胶原降解产物β-Ⅰ型胶原羧基端肽(β-C-terminal telopeptide of typeⅠcollagen,β-CTx)、骨钙羟基N端中分子片段、碱性磷酸酶(alkaline phosphatase,AKP)等生化指标异常,反映前列腺癌进展的肿瘤标志物还有前列腺特异抗原(prostate specific antigen,PSA)和血睾酮等[6-9]。
前列腺癌骨转移患者最常见症状是不同程度的骨转移部位疼痛,临床上对其有效的治疗包括针对原发灶治疗和局部转移灶的手术治疗和放射治疗,全身治疗主要有内分泌治疗和姑息性化疗等。广泛的转移性病变很难从局部手术和局部放射治疗中获益,更多选择原发灶局部放射治疗和全身内分泌治疗(包括手术去势和药物去势)。放射治疗除了局部明显杀伤效应外,还可产生全身反应和远隔效应[4-5],研究原发灶放射治疗是否会对转移部位疼痛产生影响尚未见文献报道。本研究观察原发灶放射治疗对远隔骨转移性疼痛的缓解,现报道如下。
1 资料与方法
1.1 一般资料 选择本院2010-2013年前列腺癌骨转移伴疼痛症状患者79例,年龄54~79岁,平均68.5岁。纳入标准:无截瘫,无病理性骨折,预期寿命均大于6个月,肝、肾功能检查无明显异常,血钙、磷、镁均在正常范围内,血白细胞大于或等于3.5×109/L,红细胞大于或等于3.5×1012/L,血小板大于或等于100×109/L。均因疼痛就诊,病理活检诊断为前列腺癌,经全身骨扫描显像(single photon emission computed tomography,SPECT)检查证实骨转移,与骨痛部位一致,部分患者经X线片或MRI检查进一步明确。入院前均未接受放化疗,14例曾服用止痛剂者均停药1周以上。排除标准:截瘫或(和)已发生病理性骨折,ECOG评分大于3分,预期寿命小于6个月,前列腺放疗区域有皮肤破损或感染等,骨髓抑制Ⅲ度以上,其他合并放疗禁忌证。所有患者分为联合治疗组40例和对照组39例,两组一般资料比较差异无统计学意义(P>0.05),见表1。所有患者均签署知情同意书,经重庆三峡中心医院医学伦理委员会批准。
1.2 方法 联合治疗组采用放射治疗联合内分泌治疗,对照组采用内分泌治疗。内分泌治疗方案:曲普瑞林针3.75 mg,皮下注射,每月1次,同时服用比卡鲁胺片50 mg,每日1次。放射治疗:仅照射前列腺原发灶(精囊腺受侵时包括精囊腺),采用医科达或西门子直线加速器,使用6MV-X线,每天照射1次,每周照射5 d,总剂量55~72戈瑞/5.5~7.0周。采用化学发光法检测血睾酮和PSA,采用酶联免疫吸附法检测ICTP。其他生化指标检测按照常规方法进行。
1.3 观察指标 在治疗前1周内常规作血常规、肝、肾功能检查及全身骨显像。治疗后1周复查血常规;每3个月复查骨SPECT,了解骨转移病灶的变化情况。治疗前与治疗后每周采血检测ICTP、PSA等生化指标。
1.4 疗效评判 采用疼痛数字评分法(numerical rating scale,NRS)进行疼痛评分。疼痛消失:原先的疼痛消失;疼痛明显减轻:疼痛分级数下降2个等级;疼痛稍减轻:原先的疼痛需要加用止痛药物,治疗后可以不用或少用止痛药物,疼痛分级数下降1个等级;无效:疼痛程度维持原水平或加重。前3种形式作为疼痛治疗有效。按照实体瘤疗效评价标准评价肿瘤治疗效果。

2 结 果
2.1 骨转移病灶疼痛缓解变化 联合治疗组治疗2周后,患者疼痛症状开始逐渐减轻,但有少部分患者在1周左右有局部疼痛加重现象,但几天后疼痛逐渐减轻。治疗1、3、6个月后疼痛程度明显低于对照组(P<0.05)。见表1。
2.2 骨转移灶变化 联合治疗组病例放射性浓聚数目均有减少;放射性浓聚程度较前变得稀疏,治疗3个月后转移灶数减少70.2%,第6个月减少60.4%。对照组个别病例显示病变明显进展。见图1。

表1 两组一般情况对比
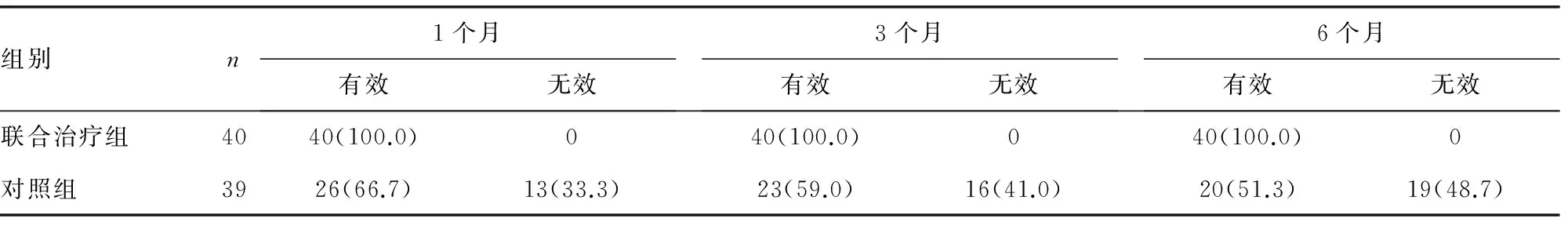
表2 两组治疗后疼痛疗效评估[n(%)]

A:放射治疗联合内分泌治疗前骨显像图片;B:放射治疗联合内分泌治疗后,箭头所示可见转移灶放射性浓聚明显减少;C:单独内分泌治疗前;D:单独内分泌治疗后骨显像图片,箭头所示可见转移灶放射性浓聚明显增多;左为正面图像,右为背面图像
图1 典型病例
2.3 对血PSA及ICTP的影响 联合治疗组患者血PSA、ICTP明显下降,明显优于对照组(t=8.32,P<0.01)。见图2、3。
2.4 治疗不良反应观察 前列腺癌原发灶外照射后不良作用主要为直肠及泌尿系统放射反应,包括腹泻、腹部痉挛性疼痛、大便带血、里急后重、尿频、尿急、尿痛等,对症处理后均可缓解,可完成放疗。治疗后随访,未发现有尿路狭窄和肠瘘。内分泌治疗不良反应为男性乳腺发育、心血管不良反应、肝毒性、胃肠道反应、骨质疏松等,多数患者均能耐受。
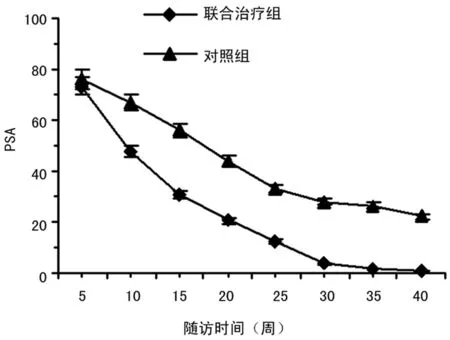
图2 PSA变化曲线

图3 ICTP变化曲线
3 讨 论
放射治疗作为肿瘤治疗的三大方法之一,可单独使用,也可与其他抗肿瘤方法联用,根据世界卫生组织统计,肿瘤患者中近70%患者需要借助放射治疗或配合手术达到根治、姑息治疗的目的。放射治疗已成为前列腺癌主要治疗方法之一,包括原发灶放射治疗和转移灶放射治疗。肿瘤作为一种全身性疾病,治疗需标本兼治,治疗转移灶同时针对原发灶治疗同样重要[10-12]。本研究治疗方案选择目前常规标准方案,患者依从性高,观察到前列腺癌原发灶放射治疗对远隔骨转移性疼痛有明显效果,局部症状与全身症状明显改善,生活质量提高。
对前列腺癌骨转移患者的治疗目的是防止骨相关事件的发生及止痛。本组研究对象均为前列腺癌骨转移的晚期病例,经综合治疗后,疼痛缓解,生活质量改善。内分泌治疗抗肿瘤作用机制可能为在抗雄激素治疗的早期阶段,雄激素受体阳性癌细胞由于缺乏雄激素刺激而发生凋亡,肿瘤体积可以逐渐缩小;随着治疗的进行,部分雄激素受体阳性细胞渐渐分化转变为雄激素受体阴性细胞[9,13-14]。此时,抗雄激素治疗的效果逐渐下降,出现了难以控制前列腺癌原发病灶和骨转移病灶的发展,行前列腺癌原发灶外照射治疗,进一步控制原发肿瘤细胞及肿瘤细胞分泌细胞因子。
PSA是前列腺细胞上皮表面糖蛋白的变异体,是监测前列腺癌的重要抗原,在反映前列腺癌转移方面有较高的敏感性和特异性,在诊断前列腺癌患者骨转移时有其独特的价值,且转移病灶越多,范围越广,PSA水平越高[12,14-15]。故可用于判断前列腺癌患者的进展与转移并监测治疗和复发,是相关性较高的前列腺癌标志物。研究中观察到PSA等生化指标变化与先前研究一致[10]。放射治疗联合内分泌治疗对前列腺癌血PSA升高的患者非常有效,所有前列腺癌放射治疗患者获得并且维持PSA低限值在5 g/L以下。
由于恶性肿瘤骨转移中大部分是破骨型改变,所以骨吸收生化指标应用价值最大。Ⅰ型胶原是人体最丰富的胶原蛋白形式,是骨组织中唯一的胶原,占骨有机质的90%以上,而ICTP是Ⅰ型胶原降解过程中的特异性成分,也是目前唯一知道从构成胶原纤维分子中释出的胶联。只来源于破坏的成熟骨基质,不会在新骨形成过程中从新形成的骨质中产生,以完整的免疫源性肽形式进入血中,不再进一步分解,是新发现的溶骨指标,能直接反映溶骨的范围,且不受摄入食物的影响。ICTP在生理性骨代谢中的反应迟缓,它的变化反映骨质病理性破坏[8-10]。ICTP诊断骨转移的准确性、特异性、灵敏度均较骨显像好。ICTP升高说明可能有早期的亚临床骨转移,随访研究表明ICTP至少比骨显像早半年以上发现骨转移[13-14]。若ICTP低于正常值则骨转移的可能性较低,相反,高于正常值则骨转移可能性大。ICTP值在多发转移较单发转移中明显增高,差异显著,且ICTP能反映骨转移的进展程度。此方法是骨转移方法的必要补充,且有助于确定骨扫描的检测时间。但ICTP对骨转移不能定位,而临床定位方法主要有X线片、CT、MRI、SPECT等,X线片和CT敏感性低,故非首选,MRI敏感性和特异性较高,尤其对骨髓腔内转移灶有优势,但对四肢长骨,尤其骨皮质病变作用较差,SPECT是目前常用手段,现有的血生化指标不足以取代骨扫描的地位[10-11]。所以笔者选择疼痛评分与骨扫描联合生化指标评估治疗效果。
尿羟脯氨酸、N-氮端肽是Ⅰ型胶原的降解产物,但其敏感性及特异性欠佳[13]。吡啶酚(pyridinoline,PYD)和脱氧吡啶酚(deoxypyridinoline,DPD)是在许多组织的胶原成分中存在的成熟交联氨基酸,检测其尿中水平对早期预测前列腺癌骨转移有一定价值[14]。然而PYD和DPD的检测,操作烦琐要求高,难以在临床普及。所以本研究中没有选择这几项检测指标。
治疗后不良反应观察发现血象均有轻度下降,可能与骨转移性病灶的存在影响造血功能或应用放射治疗有关。但总的情况表明,治疗中血象的改变并不影响整体治疗。联合治疗组还出现不同程度的放射性反应,经对症治疗后均能缓解,并完成放射治疗。
本研究中联合治疗组疼痛生化指标明显改善,可能是疼痛缓解的重要机制,也是放射治疗产生远隔效应的主要原因,虽然本组研究对象例数有限,但治疗方法和治疗效果令人满意,取得了初步预期的疗效。通过前列腺癌原发灶放疗,骨转移部位疼痛缓解或消失,骨转移病灶的缩小或消失,减轻了肿瘤患者的痛苦,提高了生存质量。其作用机制尚需进一步研究,由于随访的时间比较短,尚有待于进一步观察和随访。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2]朱清.miRNA-185在前列腺癌中的临床意义研究[J].重庆医学,2015,44(3):399-400.
[3]那彦群.中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2013:49-79.
[4]中华医学会泌尿外科学分会前列腺癌联盟.中国前列腺癌早期诊断专家共识[J].中华泌尿外科杂志,2015,36(8):561-564.
[5]Hayes JH,Barry MJ.Screening for prostate cancer with the prostate-specific antigen test:a review of current evidence[J].JAMA,2014,311(11):1143-1149.
[6]Veltri RW,Christudass CS.Nuclear morphometry,epigenetic changes,and clinical relevance in prostate cancer[J].Adv Exp Med Biol,2014,773(1):77-99.
[7]赵蔚,彭亚琪,任庆兰.狄诺塞麦治疗恶性肿瘤骨转移研究进展[J].重庆医学,2015,44(16):2276-2279.
[8]Schröder FH,Hugosson J,Roobol MJ,et al.Screening and prostate cancer mortality:results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up[J].Lancet,2014,384(9959):2027-2035.
[9]舒泽华,张克勤,王毅.磁共振波谱成像联合fPSA/tPSA、PSAD对PSA灰区前列腺癌的诊断价值[J].重庆医学,2015,44(13):1768-1770.
[10]Armstrong AJ.Biomarkers in castration-resistant prostate cancer[J].Clin Adv Hematol Oncol,2014,12(2):115-118.
[11]Boegemann M,Schrader AJ,Krabbe LM,et al.Present,emerging and possible future biomarkers in castration resistant prostate cancer (CRPC)[J].Curr Cancer Drug Targets,2015,15(3):243-255.
[12]Azad AA,Volik SV,Wyatt AW,et al.Androgen receptor gene aberrations in circulating Cell-Free DNA:biomarkers of therapeutic resistance in Castration-Resistant prostate cancer[J].Clin Cancer Res,2015,21(10):2315-2324.
[13]Sciarra A.Re:serum bone turnover markers (PINP and ICTP) for the early detection of bone metastases in patients with prostate cancer:a longitudinal approach[J].Eur Urol,2007,52(5):1531-1532.
[14]Vinholes J,Coleman R,Lacombe D,et al.Assessment of bone response to systemic therapy in an EORTC trial:preliminary experience with the use of collagen cross-link excretion.European Organization for Research and Treatment of Cancer[J].Br J Cancer,1999,80(1/2):221-228.
[15]Guanabens N,Peris P,Monegal A.Bone tumnover markers:A clinical review[J].Clin Rev Bone Miner Metab,2015,13(2):83-97.
重庆市医学重点研究室建设基金资助项目(2007-14);重庆市万州区科委基金项目(2013-45)。 作者简介:张军(1975-),主治医师,主要从事肿瘤的基础和临床研究。△
,E-mail:zhangjunzyy@163.com。
�验交流·
10.3969/j.issn.1671-8348.2017.20.029
R737.25
B
1671-8348(2017)20-2826-04
2017-02-19
2017-04-24)
