基于SOE-PCR的核酸疫苗pIRES2-MLAA34-HSP70的构建及免疫效果研究
2017-08-16赵佳琪王婉莹范业宁马春平张东红
赵佳琪,王婉莹,范业宁,马春平,张东红,吕 扬,赵 臣
(吉林医药学院检验学院,吉林吉林 132013)
基于SOE-PCR的核酸疫苗pIRES2-MLAA34-HSP70的构建及免疫效果研究
赵佳琪,王婉莹,范业宁,马春平,张东红,吕 扬,赵 臣△
(吉林医药学院检验学院,吉林吉林 132013)
目的 构建pIRES2-MLAA34-HSP70重组质粒,并检测其免疫效果。方法 采用逆转录PCR(RT-PCR)的方法提取急性单核细胞白血病相关抗原基因MLAA-34和热休克蛋白(HSP)70基因,设计特异性重叠引物,以重叠延伸PCR(SOE-PCR)技术扩增MLAA34-HSP70融合基因,构建核酸疫苗pIRES2-MLAA34-HSP70。将核酸疫苗免疫BALB/c小鼠,检测小鼠脾淋巴细胞对U937细胞的杀伤作用及小鼠脾细胞悬液中白细胞介素(IL)-2、IL-4和γ干扰素(IFN-γ)水平。结果 扩增出MLAA34-HSP70融合基因2 956 bp,成功构建了核酸疫苗pIRES2-MLAA34-HSP70,经鉴定与预期结果一致;脾淋巴细胞杀伤活性结果显示,核酸疫苗pIRES2-MLAA34-HSP70对U937细胞的杀伤效率明显高于其他实验组及对照组(P<0.01);核酸疫苗pIRES2-MLAA34-HSP70组细胞因子IL-2、IL-4和IFN-γ水平亦明显高于其他实验组及对照组(P<0.01)。结论 成功构建了pIRES2-MLAA34-HSP70核酸疫苗,该核酸疫苗能诱发强烈的体液免疫,增强机体对肿瘤细胞的免疫应答,对MLAA34阳性细胞具有特异性杀伤作用。
疫苗,DNA;重叠延伸PCR;白血病,单核细胞,急性;MLAA-34;热休克蛋白质类70
核酸疫苗是将编码某种抗原蛋白的外源基因导入动物体细胞内,并通过宿主细胞的表达系统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答反应,以达到预防和治疗疾病的目的[1]。抗原表位基因是核酸疫苗的核心部分,以融合基因为目的基因构建核酸疫苗已是业界的共识。将相同或相似功能的基因融合,可以增强目的蛋白的免疫原性,提高核酸疫苗的免疫保护效应。重叠延伸PCR(gene splicing by overlap extension PCR,SOE-PCR)采用互补末端引物,使PCR产物形成重叠链,从而将来源不同的多个基因片段拼接在一起[2]。利用SOE-PCR技术不需要内切酶消化和连接酶处理即可进行有效的基因重组,因而在构建融合基因、定点突变及基因敲除等方面有着广泛的应用[3]。本研究拟采用SOE-PCR技术将急性单核细胞白血病相关抗原基因MLAA-34及热休克蛋白70(HSP70)融合为MLAA34-HSP70融合基因,进而构建核酸疫苗pIRES2-MLAA34-HSP70,免疫BALB/c小鼠并检测其脾淋巴细胞对U937细胞的杀伤效应,为核酸疫苗的抗肿瘤研究提供实验基础。
1 材料与方法
1.1 材料 U937细胞、pIRES2-EGFP和pIRES2-EGFP-HSP70质粒为本课题组保存。BALB/c鼠[无特定病原体(SPF)级,雌性,6~8周龄]购自北京维通利华实验动物技术有限公司。噻唑蓝(MTT)试剂、限制性内切酶(EcoRⅠ/BamHⅠ)购自美国NEB公司,总RNA提取试剂盒、无内毒素质粒提取试剂盒、逆转录PCR(RT-PCR)试剂盒、T4 DNA连接酶、胶回收纯化和酶联免疫吸附试验(ELISA)等试剂盒购自生工生物工程(上海)股份有限公司,胎牛血清、RPMI 1640(高糖)培养基购自美国Hyclone公司;无水乙醇、氯仿等常规试剂均为国产分析纯。
1.2 引物设计与合成 根据质粒pIRES2-EGFP多克隆位点情况选取EcoRⅠ和BamHⅠ酶切位点进行基因克隆。MLAA-34基因(GenBank:AY288977.2)扩增片段理论长度为1 014 bp,HSP70基因(GenBank:NM_005345.5)扩增片段理论长度为1 927 bp,P2和P3引物设计重叠序列GGC GGC GGC GGC GGC,引物由生工生物工程(上海)股份有限公司合成,见表1。
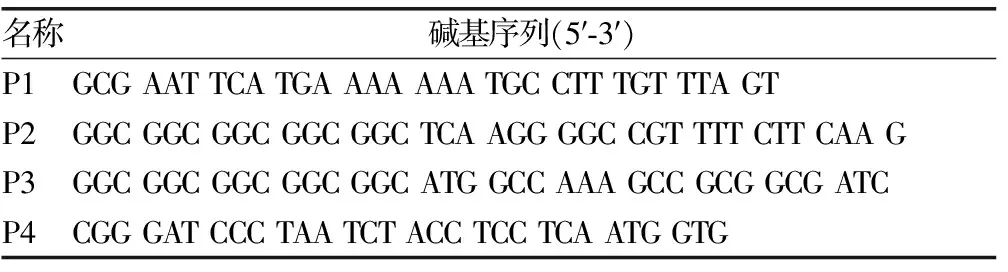
表1 引物碱基序列
1.3 细胞培养及基因提取
1.3.1 U937细胞培养 U937细胞培养于含10%胎牛血清的RPMI 1640培养基中,37 ℃ 5%CO2,收集U937细胞并调整细胞浓度至2×105/mL,接种于96孔细胞培养板中,每孔加U937细胞100 μL作为脾淋巴细胞杀伤活性实验的靶细胞。
1.3.2 MLAA-34基因提取 U937细胞培养于含10%胎牛血清的RPMI 1640培养基中, 37 ℃ 5%CO2,收集培养的U937细胞,Trizol法抽提总RNA,逆转录合成互补RNA(cRNA),分别以P1/P2和P3/P4为引物,严格按照试剂盒说明书进行RT-PCR。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,共30个循环;最后72 ℃ 5 min。RT-PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定,用胶回收试剂盒回收纯化PCR产物。
1.4 SOE-PCR扩增MLAA34-HSP70融合基因 将回收纯化的PCR产物,MLAA-34和HSP70目的基因片段作为模板,以P1、P4为引物,采用SOE-PCR法扩增融合基因MLAA34-HSP70。SOE-PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,共30个循环;最后72 ℃ 5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定,用胶回收试剂盒回收纯化PCR产物。
1.5 核酸疫苗pIRES2-MLAA34-HSP70的构建及鉴定 提取质粒pIRES2-EGFP,与回收的MLAA34-HSP70融合基因片段分别进行EcoRⅠ/BamHⅠ双酶切,37 ℃ 1.5 h,酶切产物经琼脂糖电泳回收纯化,利用T4 DNA连接酶将MLAA34-HSP70融合基因亚克隆至pIRES2-EGFP质粒中,16 ℃连接过夜,构建pIRES2-MLAA34-HSP70重组质粒。将连接产物转化大肠杆菌(E.coli)DH5α感受态细胞,并在卡那霉素抗性LB培养基上涂板培养。将卡那霉素抗性LB培养基上生长的阳性转化克隆子编号,用接种环挑取克隆子(不要完全挑完)于3 mL LB液体培养基中37 ℃过夜培养,次日提取pIRES2-MLAA34-HSP70质粒并进行PCR扩增和酶切鉴定。
1.6 核酸疫苗免疫BALB/c小鼠 质粒DNA大量制备和纯化(按试剂盒说明书进行)并用生理盐水调整至1.0 g/L。BALB/c鼠40只,分为4组,每组10只。对照组(A组)、实验组(B、C、D组)分别在小鼠两侧股四头肌肌内注射空质粒pIRES2、pIRES2-MLAA34、pIRES2-HSP70和pIRES2-MLAA34-HSP70,每只100 μg。小鼠每次接种前24 h,均用0.25%布比卡因100 μL预处理。在0、2、4周进行3次同样剂量免疫。
1.7 脾淋巴细胞悬液的制备 末次免疫后第7天,处死小鼠,置70%乙醇浸泡3~5 min,无菌取脾脏,置于不含胎牛血清的RPMI 1640培养基中,剪去脂肪及筋膜组织,于200目不锈钢网筛上研碎,重悬于含5%胎牛血清的Hank′s液中,2 000 r/min离心5 min,低渗裂解红细胞,用含10%胎牛血清的RPMI 1640培养基清洗3次,并调整浓度为1×107/mL。
1.8 脾淋巴细胞杀伤活性的检测 取步骤1.7制备的脾淋巴细胞悬液,倍比稀释。96孔细胞培养板各反应孔中加脾淋巴细胞100 μL,使效靶比分别为50∶1、25∶1、12.5∶1和6.25∶1(各设3个复孔),在37 ℃ 5%CO2中孵育24 h,测定每组小鼠特异性淋巴细胞杀伤活性。反应结束后,每孔加入20 μL MTT工作液,37 ℃反应4 h,弃去MTT反应液,每孔加入二甲基亚砜(DMSO)200 μL,室温振荡10 min,酶标仪测定570 nm处吸光度值(A570)。脾淋巴细胞杀伤活性(%)=[1-(反应孔A570-效应细胞对照孔A570)/靶细胞对照孔A570]×100%。
1.9 细胞因子水平的检测 将步骤1.7制备的脾淋巴细胞悬液加入96孔细胞培养板,每孔100 μL(各设3个复孔),37 ℃ 5%CO2培养72 h,以纯化的MLAA-34蛋白(20 μg/mL)刺激抗原。以刀豆蛋白A(ConA,10 μg/mL)为阳性对照,未用抗原刺激孔为阴性对照,培养48 h后收集上清液,ELISA法检测细胞因子,包括白细胞介素(IL)-2、IL-4和干扰素-γ(IFN-γ)水平(严格按照试剂盒说明书操作)。
2 结 果
2.1 SOE-PCR扩增MLAA34-HSP70融合基因结果 以MLAA-34基因和HSP70基因为模板,以P1、P4为引物,采用SOE-PCR法扩增MLAA34-HSP70融合基因,经1.0%琼脂糖凝胶电泳鉴定,见图1。
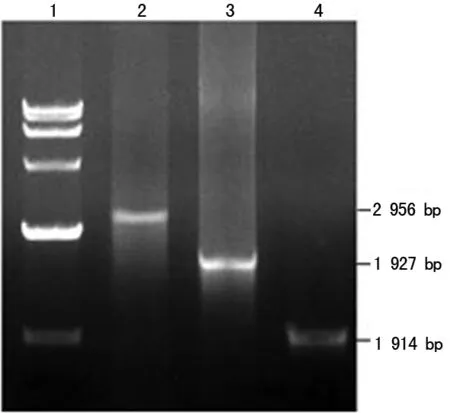
1:标记物;2:MLAA34-HSP70融合基因;3:HSP70基因;4:MLAA34基因
图1 MLAA34-HSP70融合基因扩增结果
2.2 核酸疫苗pIRES2-MLAA34-HSP70的构建及鉴定 将质粒pIRES2-EGFP与MLAA34-HSP70融合基因分别进行EcoRⅠ/BamHⅠ双酶切,采用T4连接酶将MLAA34-HSP70融合基因与pIRES2-EGFP载体连接,构建重组质粒pIRES2-MLAA34-HSP70,挑取阳性克隆菌,扩增后提取重组质粒进行PCR及EcoRⅠ/BamHⅠ双酶切鉴定,经1.0%琼脂糖电泳鉴定,见图2。
2.3 脾淋巴细胞杀伤活性的检测 将核酸疫苗分组免疫小鼠后,检测致敏脾淋巴细胞对U937细胞的杀伤效率,见表2。其中,核酸疫苗D组的杀伤效率明显高于A、B、C组,差异有统计学意义(P<0.01);而A、B、C组杀伤效率比较,差异无统计学意义(P>0.05)。
2.4 细胞因子水平的检测 脾淋巴细胞悬液经纯化的MLAA-34蛋白刺激后,ELISA法检测脾细胞上清液中细胞因子IL-2、IL-4和IFN-γ水平,见表3。核酸疫苗D组的细胞因子IL-2、IL-4和IFN-γ水平明显高于A、B、C组,差异均有统计学意义(P<0.01)。B组和C组上述各细胞因子水平明显高于A组,差异均有统计学意义(P<0.01)。B组和C组间上述各细胞因子水平比较,差异均无统计学意义(P>0.05)。
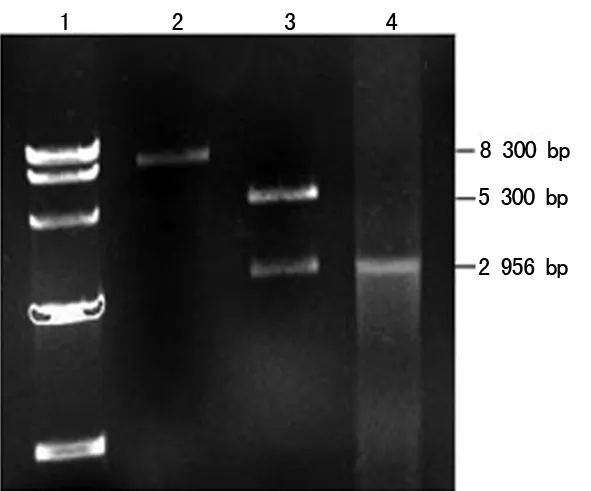
1:标记物;2:pIRES2-MLAA34-HSP70重组质粒;3:双酶切鉴定结果;4:PCR鉴定结果
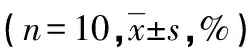
图2 重组质粒pIRES2-MLAA34-HSP70的鉴定
*:P<0.01,与D组比较
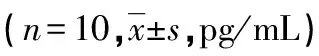
表3 小鼠脾淋巴悬液细胞因子水平比较
*:P<0.01,与A组比较;#:P<0.01,与D组比较
3 讨 论
核酸疫苗制作简单、应用安全,是白血病免疫治疗的策略之一。核酸疫苗导入宿主体内后可被抗原提呈细胞或机体组织细胞摄取,在细胞内表达蛋白抗原,刺激机体产生细胞免疫和体液免疫,免疫保护作用好[4]。在构建核酸疫苗时笔者使用了SOE-PCR技术,将MLAA-34基因和HSP70基因融合在一起,形成MLAA34-HSP70融合基因。MLAA-34基因与急性单核细胞白血病的发生密切相关,其表达下调能显著抑制U937细胞在体外的增殖,同时会诱发白血病细胞的凋亡,是理想的急性白血病免疫治疗的靶基因[5-7]。HSP70参与肿瘤基因调控及细胞增殖,具有抗原递呈功能,能强烈刺激免疫系统针对肿瘤抗原的免疫反应,进而诱导机体产生特异性抗肿瘤免疫应答,以HSP为基础的肿瘤疫苗是目前肿瘤疫苗研究中的热点[8-9]。
SOE-PCR技术的关键主要在于引物的设计,在设计引物时,重叠序列可以是基因序列上的任意位点,不需要考虑融合位点及其附近的特殊序列。通过特定的重叠互补序列的引物作为桥梁,从而使PCR扩增产物末端形成了相同的重叠链,通过重叠链的延伸将PCR扩增片段拼接起来,从而将两个目的基因融合在一起,相比于限制性内切酶的酶切和连接酶的连接更加简便快捷[10]。因此,在融合基因、突变体分子的构建过程中,特别是在人类体细胞敲除、疫苗的研究、多克隆抗体的产生,以及在植物基因工程中具有广泛的应用[11-13]。本研究设计引物时采用柔性肽基因GGC GGC GGC GGC GGC作为重叠序列,融合蛋白MLAA-34和HSP70之间以柔性肽相连接,保证了两个蛋白融合表达且正确折叠,MLAA-34和HSP70皆能发挥其独特功能,从而保证了核酸疫苗的免疫活性。实验表明,核酸疫苗pIRES2-MLAA34-HSP70免疫BALB/c小鼠后,致敏脾淋巴细胞对U937细胞具有较强的杀伤效率,明显高于其他实验组和对照组,说明核酸疫苗pIRES2-MLAA34-HSP70能有效地刺激机体产生针对U937细胞的特异性杀伤作用;此外,致敏小鼠脾细胞培养液中细胞因子IL-2、IL-4和IFN-γ水平明显增高,说明该核酸疫苗能诱发强烈的体液免疫,增强机体对肿瘤细胞的免疫应答,具有明显的免疫保护作用。
[1]宋晓晖,陈洪锁,孙雅楠,等.白血病疫苗的研究进展[J].吉林医药学院学报,2013,34(3):208-212.
[2]Thornton JA. Splicing by overlap extension PCR to obtain hybrid DNA products[J].Methods Mol Biol,2016,1373:43-49.
[3]彭雷,赵艳,马银花.基于巢式PCR的重叠延伸PCR优化[J].安徽农业科学,2016,44(20):126-127.
[4]Donnelly JJ,Wahren B,Liu MA.DNA vaccines:progress and challenges[J].J Immunol,2005,175(2):633-639.
[5]Zhao J,He A,Zhang W,et al.Quantitative assessment of MLAA-34 expression in diagnosis and prognosis of acute monocytic leukemia[J].Cancer Immunol Immunother,2011,60(4):587-597.
[6]Zhang WJ,Zhang WG,Zhang PY,et al.The expression and functional characterization associated with cell apoptosis and proteomic analysis of the novel gene MLAA-34 in U937 cells[J].Oncol Rep,2013,29(2):491-506.
[7]赵天宇,赵佳琪,范业宁,等.pIRES2-MLAA34-EGFP穿梭载体的构建及表达[J].吉林医药学院学报,2016,37(3):184-187.
[8]游朝勇.HSP70与恶性肿瘤关系的研究进展[J].实用癌症杂志,2012,27(1):89-91,94.
[9]Guzhova IV,Margulis BA.HSP70-based anti-cancer immunotherapy[J].Hum Vaccin Immunother,2016,12(10):2529-2535.
[10]Dahm P,Jennewein S.Introduction of the early pathway to taxol biosynthesis in yeast by means of biosynthetic gene cluster construction using SOE-PCR and homologous recombination[J].Methods Mol Biol,2010(643):145-163。
[11]张旻,姜绍通,郑娟,等.潮霉素B抗性为选择标记的整合型表达载体的构建及在米根霉中的遗传转化[J].生物工程学报,2015,31(8):1203-1218.
[12]Yuelan Z,Yiwei L,Liyuan L,et al.Expression and identification of the ADF-linker-3-1E gene of Eimeria acervulina of chicken[J].Parasitol Res,2016,115(4):1641-1647.
[13]Li B,Ye J,Lin Y,et al.Preparation and identification of a single-chain variable fragment antibody against Newcastle diseases virus F48E9[J].Vet Immunol Immunopathol,2014,161(3/4):258-264.
Study on immune effect of DNA vaccine pIRES2-MLAA34-HSP70 constructed by SOE-PCR*
ZhaoJiaqi,WangWanying,FanYening,MaChunping,ZhangDonghong,LvYang,ZhaoChen△
(InspectionCollegeofJilinMedicalUniversity,Jilin,Jilin132013,China)
Objective To construct the DNA vaccine pIRES2-MLAA34-HSP70,and to detect its immune effect.Methods The acute monocytic leukemia associated antigen gene MLAA-34 and heat-shock protein (HSP)70 gene were extracted by using RT-PCR.The specific overlapping primer was designed,and the fusion gene MLAA34-HSP70 was amplified by using SOE-PCR technique.Then the DNA vaccine pIRES2-MLAA34-HSP70 was constructed,and BALB/c mice were immunized with this DNA vaccine.The splenic lymphocyte killing activity was detected by using MTT,levels of IL-2,IL-4 and IFN-γ were also detected by using ELISA.Results The MLAA34-HSP70 gene (2 956 bp) and the DNA vaccine pIRES2-MLAA34-HSP70 was amplified and constructed successfully.The killing efficiency of DNA vaccine pIRES2-MLAA34-HSP70 in U937 cells was significantly higher than that in other experimental groups and control group (P<0.01),and levels of IL-4,IL-2 and IFN-γ in DNA vaccine pIRES2-MLAA34-HSP70 group were significantly higher than those in the other experimental groups and control group (P<0.01).Conclusion The DNA vaccine pIRES2-MLAA34-HSP70 is constructed successfully.It is shown that the DNA vaccine induces strong humoral immunity,which could enhance immune responses to tumor cells and specificlly kill MLAA34 positive cells.
vaccines,DNA;gene splicing by overlap extension PCR;leukemia,monocytic,acute;MLAA-34;heat-shock protein 70
��·基础研究
10.3969/j.issn.1671-8348.2017.19.006
吉林省科技厅自然科学基金资助项目(20160101179JC);吉林省卫生和计划生育委员会项目(2015Z071);吉林省教育厅“十三五”科技项目(JJKH20170416KJ);吉林省大学生创新创业课题(2015024);国家级大学生创新创业训练计划项目(201613706019)。 作者简介:赵佳琪(1996-),在读本科,主要从事血液系统疾病免疫治疗方面的研究。△
,E-mail:s2209503@sina.com。
R733.7
A
1671-8348(2017)19-2612-03
2016-11-18
2017-02-06)
