清肺方对类风湿性关节炎相关间质性肺炎模型大鼠的TGF-β1作用的实验研究*
2017-08-16康范永升
钱 康范永升
(1.浙江中医药大学附属杭州第一医院,浙江 杭州 310000;2.浙江中医药大学,浙江 杭州310000)
·研究报告·
清肺方对类风湿性关节炎相关间质性肺炎模型大鼠的TGF-β1作用的实验研究*
钱 康1范永升2△
(1.浙江中医药大学附属杭州第一医院,浙江 杭州 310000;2.浙江中医药大学,浙江 杭州310000)
目的通过博来霉素诱导建立类风湿性关节炎相关间质性肺炎大鼠模型,探讨清肺方对间质性肺炎大鼠的作用及其对TGF-β1的作用。方法清洁级SD大鼠48只,雄性,体质量为160~180 g,适应性饲养1周后,通过气管内灌注3mg/mL博来霉素诱导建立大鼠间质性肺炎动物模型,分为清肺方组,间质性肺炎模型组,正常对照组,强的松组4组,各12只。用药28 d后,对比清肺方组与间质性肺炎模型组、强的松组、正常对照组之间的肺组织染色及纤维化评分,肺组织染色测量胶原面积,碱水解法检测肺组织含量,检测血清及肺组织TGF-β1。结果1)清肺方组大鼠肺组织纤维化程度、羟脯氨酸浓度均显著低于间质性肺炎模型组(P<0.01)。2)清肺方组大鼠血清TGF-β1浓度低于间质型肺炎模型组(P<0.01)。3)清肺方组大鼠肺组织匀浆TGF-β1浓度低于间质性肺炎模型组(P<0.01)。结论1)清肺方对博来霉素诱导的大鼠间质性肺炎、肺纤维化有抑制作用。2)清肺方对博来霉素诱导的大鼠间质性肺炎的抑制作用机制可能与TGF-β1有关。
清肺方 类风湿关节炎 间质性肺炎 转化生长因子β1
间质性肺炎是类风湿性关节炎并发症,增加了类风湿性关节炎6%的死亡率[1]。其临床表现主要为进行性呼吸困难和刺激性干咳,预后不良,诊断后的中位生存时间为3~5年。大部分患者因肺纤维化导致肺动脉高压、呼吸困难、肺源性心脏病和右心衰竭死亡。目前还缺乏特异有效的治疗手段。糖皮质激素仍作为首选药物广泛用于临床,但其疗效不确切,且副作用大。因此研究治疗具有非常重要的意义。
在探索类风湿性关节炎相关间质性肺疾病治疗的实验研究中,合适的动物模型是成功的重要条件。研究表明,类风湿性关节炎相关间质性肺疾病最常见的病理类型是普通型间质性肺炎(UIP)[2-3]。在实验造模中常参考肺间质纤维化的动物模型。笔者在前期实验研究中研究了多种建立间质性肺炎动物模型的方法,并使用气管内灌注博来霉素成功建立间质性肺炎动物模型。本实验研究清肺方对博来霉素诱导的大鼠间质性肺炎的作用,并初步探讨其可能的作用机制,为临床治疗提供新的角度和思路。现报告如下。
1 材料与方法
1.1 实验动物
清洁级SD大鼠48只,雄性,体质量160~180 g。实验动物许可证号SYXK(浙)2016-0115。饲养于浙江中医药大学实验动物中心。饲养环境:温度24~26℃,湿度50%~60%,24 h循环光照,每个标准饲笼6只,大鼠自由进食饮水,饲料均为普通清洁饲料。
1.2 试药与仪器
1)试药:盐酸博来霉素 (日本化药株式会社,H20090885)、强的松(西安利君沙制药股份有限公司生产,090302)、清肺方(组成为太子参、麦冬、沙参、冬瓜子、桃仁、莪术、山慈菇、浙贝母、僵蚕、石见穿、芦根、蒲公英,浙江中医药大学药剂室提供)、羟脯氨酸测试盒 (南京建成生物工程研究所)、Masson染色试剂盒(南京建成生物工程研究所)、10%水合氯醛(浙江中医药大学校附属医院提供,浙药制字H020100240)、大鼠TGF-β1ELISA试剂盒(Ebioscience公司)。2)仪器:血生化仪器 (日立7020全自动生化分析仪,05007905)、冰冻切片机(德国Leica公司,CM 1850)、全自动干燥箱 (杭州蓝天公司,DHG-9640C)、数显恒温水浴锅,(常州澳华仪器有限公司,HH-2)、台式高速离心机(长沙湘智离心机仪器有限公司,TG-16W)、低温高速离心机(日本日立公司,CR21 G II)、旋涡混合器(海门其林贝尔仪器制造有限公司,QL-901)、超低温冰箱(北京天地精仪科技有限公司,T11-86-340-LA)、超薄切片机(瑞典BROMMA公司LKB-V)、激光共聚焦荧光显微镜(日本Olmpus公司)、电子天平(上海梅特勒一一托利多仪器有限公司,PL203)、高压蒸汽灭菌锅(常州诺基仪器有限公司,YXQ-LS-75G)。
1.3 造模及分组
1)造模 腹腔注射10%水合氯醛0.35mL/100 g体质量麻醉大鼠,气管插管后,向套管针内注射3 mg/mL的博莱霉素溶液,剂量为3mg/kg体质量,即1mL/100 g体质量,正常对照组气管内灌注1mL/100 g体质量生理盐水,注射后立即将大鼠直立并旋转,使药物能够均匀地分布于大鼠的肺内。大鼠清醒后随意进食。2)分组适应性饲养1周后,将大鼠按照随机数字表法抽出12只为正常对照组,其余大鼠用博莱霉素造模后,按照随机数字表法,将动物随机分为间质性肺炎模型组、强的松组、清肺方组,每组各12只。经单因素标准差检验分析,各组大鼠体质量差异无统计学意义。
1.4 干预方法
造模24 h后开始灌胃给药,每日1次。成人每日中浓度清肺方用量为生药208 g,人体质量按60 kg计算,大鼠剂量按照成人剂量的6倍计算,大鼠的等效剂量为每日20.8 g/kg。按照大鼠每日灌胃1mL/100 g的体积计算,清肺方中药浓度为2.08 g/L,故将208 g生药煎煮2次,混合浓缩至100mL。强的松组中强的松经生理盐水溶解后依照6mg/kg的剂量1 mL/100 g体质量灌胃,每日1次。间质性肺炎模型组及正常对照组分别予1mL/100 g体质量生理盐水灌胃,每日1次。连续灌胃给药28 d。
1.5 取材及病理标本制作
造模后连续灌胃给药28 d,末次给药后禁食不禁水。末次给药后24 h,采用腹腔注射10%水合氯醛麻醉大鼠,剂量为0.35mL/100 g体质量。麻醉后,大鼠心尖部取血,离心分离血清,置于 -80℃冰箱保存,以备后续检测。取出并完整分离出双肺,生理盐水冲洗后,右肺置于-80℃冰箱保存,以备后续检测;左肺用10%福尔马林固定后,准备病理切片染色。
1.6 观察项目
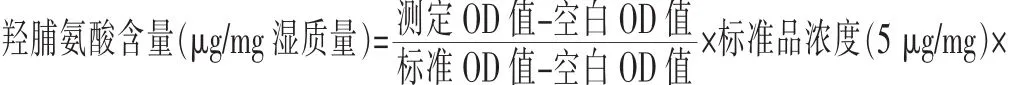
1.7 统计学处理
应用SPSS18.0统计软件。检验数据正态性,符合正态分布,计量资料以(±s)表示。组间比较用单因素的方差分析(One-way ANOVA)。方差齐时用LSD-t检验组间两两比较分析,方差不齐时用Dunnett′s T3检验比较分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组肺组织病理染色比较
2.1.1 HE染色 见图1。正常对照组大鼠肺组织病理HE染色可见肺泡结构清晰完好,肺泡间隔细且均匀,无明显炎性细胞浸润、充血及水肿。间质性肺炎模型组大鼠组织病理HE染色可见明显淋巴细胞、中性粒细胞、嗜酸性粒细胞及巨噬细胞浸润,肺泡结构破坏,肺泡间隔明显增宽增粗,肺间质纤维化明显,可见实变病灶,局部有充血。清肺方组及强的松组大鼠肺组织病理HE染色均可见肺泡间隔增粗,少量炎性细胞浸润,肺泡结构破坏,肺组织轻度纤维化,无实变病灶。说明清肺方及强的松均能抑制大鼠肺间质纤维化。

图1 各组肺组织HE染色比较(HE染色,400倍)
2.1.2 Masson染色 见图2。光镜下可见正常对照组大鼠肺组织病理Masson染色未见肺组织纤维化,肺泡间隔无明显增宽,肺泡结构尚正常。间质性肺炎模型组大鼠肺组织病理Masson染色可见肺组织胶原纤维明显增多,肺泡结构明显破坏甚至消失。清肺方组及强的松组肺组织病理Masson染色可见肺组织胶原纤维较正常对照组增多,肺泡间隔增粗,部分肺泡结构破坏。可见清肺方及强的松均能抑制博来霉素诱导的大鼠肺间质纤维化。

图2 各组肺组织Masson染色比较(Masson染色,400倍)
2.2 各组肺组织羟脯氨酸含量比较
见表1。与正常对照组比较,各模型组大鼠肺组织羟脯氨酸含量明显升高,且差异有显著统计学意义(P<0.01)。与间质性肺炎模型组相比,清肺方组、强的松组大鼠肺组织羟脯氨酸含量明显降低,且差异有统计学意义(P<0.01)。清肺方组与强的松组大鼠肺组织羟脯氨酸含量差异无统计学意义(P>0.05)。说明清肺方及强的松均能抑制博来霉素诱导的大鼠间质性肺纤维化。
表1 各组大鼠肺组织羟脯氨酸含量、血清及肺组织TGF-β1浓度比较(±s)
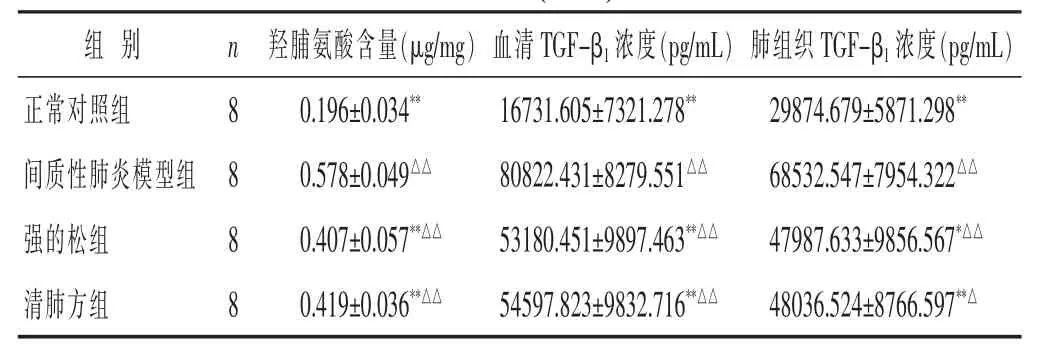
表1 各组大鼠肺组织羟脯氨酸含量、血清及肺组织TGF-β1浓度比较(±s)
与间质性肺炎模型组比较,*P<0.05,**P<0.01;与正常对照组比较,△P<0.05,△△P<0.01。
组 别 n 羟脯氨酸含量(μg/mg)血清TGF-β1浓度(pg/mL)肺组织TGF-β1浓度(pg/mL)正常对照组 8 29874.679±5871.298**间质性肺炎模型组 8 68532.547±7954.322△△强的松组 8 47987.633±9856.567*△△0.196±0.034**16731.605±7321.278**0.578±0.049△△80822.431±8279.551△△0.407±0.057**△△53180.451±9897.463**△△清肺方组 8 48036.524±8766.597**△0.419±0.036**△△54597.823±9832.716**△△
2.3 各组TGF-β1浓度比较
见表1。1)血清TGF-β1浓度比较:与正常对照组比较,清肺方组、强的松组大鼠血清TGF-β1浓度明显升高,差异具有显著统计学意义(P<0.01);与间质性肺炎模型组比较,清肺方组、强的松组大鼠血清TGF-β1浓度明显降低,差异有统计学意义(P<0.01)。清肺方组与强的松组之间差异均无统计学意义(P>0.05)。说明清肺方及强的松均能抑制博来霉素诱导的间质性肺炎大鼠的血清TGF-β1,其抑制大鼠肺纤维化的作用机制与血清TGF-β1有关。2)肺组织TGF-β1浓度比较:与正常对照组比较,清肺方组、强的松组大鼠肺组织匀浆TGF-β1浓度明显升高,且差异具有统计学意义(P<0.05)。与间质性肺炎模型组比较,清肺方组、强的松组TGF-β1浓度均明显降低,且差异有统计学意义 (P<0.01)。清肺方组与强的松组之间肺组织匀浆TGF-β1浓度差异无统计学意义(P>0.05)。可见清肺方及强的松均能抑制博来霉素诱导的间质性肺炎大鼠的肺组织TGF-β1,其抑制大鼠肺纤维化的作用机制与肺组织TGF-β1有关。
3 讨 论
类风湿关节炎并发间质性肺炎的发病机制尚不明确,可能与类风湿关节炎患者的免疫异常有关。美国胸科协会推荐肺纤维化的治疗方案是糖皮质激素加免疫抑制剂。但长期大量应用激素伴有显著、不可逆的毒性作用,包括高血糖、骨质疏松、肌肉萎缩、血管缺血性坏死、诱发和加重感染和胃肠道勃膜损伤等。同时,激素治疗仍缺乏循证医学证据,也有研究者认为,单独应用激素既不能改善病程,也不能提高生存率。当代多数医家认为,类风湿关节炎合并间质性肺炎可以归为中医“肺痹”“肺痿”的范畴[4]。清肺方是根据陈湘君教授在临床治疗风湿病并发间质性肺炎的经验中总结出的方剂,以“培土生金”为主要治法,太子参归脾、肺经,以太子参为君药,益气健脾,生津润肺;麦冬归心、脾、肺经,养阴润肺,益胃生津;沙参归肺、胃经,养阴清肺,益胃生津;冬瓜子归肝经,润肺化痰,消痈利水;三者共为臣药,补益肺胃,养阴生津。桃仁归心、肝、大肠经,活血祛瘀,止咳平喘;莪术入肝、脾经,破血行气,消积止痛;山慈菇归肝、脾经,清热解毒,化痰散结;浙贝母归肺、心经,清热散结,化痰止咳;僵蚕归肝、肺、胃经,息风止痉,祛风止痛,化痰散结;诸药合用化痰散结,活血祛瘀。石见穿归肝经,活血化瘀;清热利湿;散结消肿;芦根归肺经、胃经,清热生津,除烦止呕,利尿;蒲公英入肝、胃经,清热解毒,利尿散结;三药共用清热解毒,利水消肿。全方共奏益气养阴、活血祛瘀、化痰散结之效。正切类风湿关节炎相关间质性肺疾病气阴两虚,痰瘀互结之病机。在临床研究中,风湿性关节炎相关间质性肺疾病患者应用清肺方治疗后,临床症状及肺部CT表现明显改善,治疗效果显著。现代药理研究证明,太子参[5]、北沙参[6]、麦冬[7]、冬瓜子[8]、桃仁[9]等均具有一些明显的抗氧化作用的成分,抑制肺纤维化的形成。
气管内插管灌注博来霉素是建立间质性肺炎动物模型公认的造模方法[10]。轻脯氨酸是胶原纤维中的特有成分,它能直接反应组织胶原纤维的含量变化情况,可作为衡量其胶原组织代谢的重要指标。本实验中清肺方组大鼠肺组织病理结果明显轻于间质性肺炎模型组,且清肺方组大鼠肺组织羟脯氨酸含量低于间质性肺炎模型组,说明清肺方可抑制大鼠肺组织纤维化。
TGF-β1是具有广泛功能的细胞因子,能诱导肌成纤维细胞表型转换,合成细胞外基质(ECM)蛋白如胶原、糖蛋白、纤维结合素产生,调节炎症反应及免疫功能,在肺纤维化发生发展发挥了重要作用[11]。同时,TGF-β1和氧化损伤、炎症因子密切相关[12]。一项研究报道[13],TGF-β1可刺激上皮细胞转化为间质细胞(EMT),从而促进纤维化发展。而且,在TGF-β1等细胞因子的刺激下,成纤维细胞分化形成肌成纤维母细胞 (myofibroblast),不仅仅使产生胶原的能力大大提高,合成大量胶原蛋白,而且具有收缩性,造成ECM调节失衡[14],使肺组织结构破坏[15]。因此抑制TGF-β1可以抑制肺纤维化的形成及发展[16]。在实验中,清肺方组血清及肺组织TGF-β1浓度低于间质性肺炎模型组,说明清肺方对博来霉素诱导的大鼠间质性肺炎的作用机制与血清及肺组织TGF-β1浓度有关。
[1] Bonbartz T,Nannini C,Medina-Velasquez YF,et al.Incidence and mortality of interstitial lung disease in rheumatoid arthritis:a population-based study[J].Arthritis Rheum,2010(62):1583-1591.
[2] Lee H,Kim DS,Yoo B,et al.Histopathologic pattern and Clinical featuresof rheumatoid arthritis-associated interstitial lung disease[J].Chest,2005(127):2019-2027.
[3] Tanaka N,Kim JS,Newell JD,etal.Rheumatoid arthritis-related lung diseases:CT findings[J].Radiology,2004(232):81-91.
[4] 崔红生,邱冬梅,武维屏.肺间质纤维化从络病辨治思路[N].中国中医药报,2004-06-03.
[5] 余国奠,刘峻,陈喻,等.6个不同产地的太子参对超氧自由基清除作用的研究[J].中国野生植物资源,2000,19(4):7-9,19.
[6] Ng TB,Liu F,Wang HX.The antioxidant effects of aqueous and organic extract of panaxquin quefolium,panaxnotogiseng,codonopsis pilosula,pseudostellaria heterophylla and glehnia littoralis[J].JEthno,2004,93(2):285-288.
[7] 袁春丽,孙立,袁胜涛,等.麦冬有效成分的药理活性及作用机制研究进展[J].中国新药杂志,2013,22(21):2496-2502.
[8] 周清,江浩,高云涛,等.冬瓜籽水提物抗氧化作用研究[J].微量元素与健康研究,2010,27(5):22-23.
[9] 王亮.桃仁多糖对OH及O2-的清除研究[J].大连民族学院学报,2009,11(1):96.
[10]Teixeira KC,Soares FS,Rocha LCD,et al.Attenuation of bleomycin-induced lung injury and oxidative stress by N-acetylcysteine plus deferoxamine[J].Pulm Pharmacol Ther,2008,21(2):309-316.
[11]Scotton CJ,Chambers RC.Molecular targets in pulmonary fibrosis:themyofibroblast in focus[J].Chest,2007,132(4):1311-21.
[12]振娟,朱楷,王学彬,等.类风湿关节炎合并间质性肺炎的临床分析[J].青岛医药卫生,2014,46(5):347-349.
[13]Camara J,JaraiG.Epithelial-mesenchymal transition in primary human bronchial epithelial cells is Smad-dependent and enhanced by fibronectin and TNF-alpha[J].Fibrogenesis Tissue Repair,2010,3(1):2.
[14]杨雅茹,黄艳,李俊.TGF-β1介导的Smads与ERK通路在肺纤维化中的作用及相互关系[J].中国药理学通报,2010,25(5):561-563.
[15]Phan SH.Biology of fibroblasts and myofibroblasts[J].Proc Am Thorac Soc,2008,5(3):334-337.
[16]Aytemur ZA,Hacievliyagil SS,IRAZM,et al.Effects of iloproston bleomycin-induceol pulmonary fibrosis in rats compaied withmethy-prednisolome[J].Rev Port Preumol,2012,18(6):272-277.
Experimental Study on the Effect of Qingfei Decoction on TGF-β1in Ratsw ith Rheumatoid Arthritis Associated Interstitial Pneumonia
QIAN Kang,FAN Yongsheng.Hangzhou First People′s Hospital Affiliated toZhejiang Chinese Medical University,Zhejiang,Hangzhou 310000,China.
Objective:To establish a ratmodel of rheumatoid arthritis associated interstitial pneumonia induced by bleomycin,and to explore the effect of Qingfei Decoction on interstitial pneumonia and its effect on TGF-β1.M ethods:48 male SD rats,weight 160~180 g,were fed adaptively for one week and the ratmodel of interstitial lung diseasewere established bymeans of pour 3mg/kg BLM into trachea and divided into 4 groups:Qingfei Decoction group,the interstitial pneumoniamodel group,the normal control group and predmisone group,12 in each. After 28 days′medication,lung tissue staining and fibrosis scores were compared among all groups.The area of collagen wasmeasured by lung staining,and the content of lung tissue was detected by alkaline hydrolysis.TGF-β1 in serum and lung tissues were detected.Results:1)The degree of fibrosis and hydroxyproline concentration in lung tissue in Qingfei Decoction group were obviously lower than those of the interstitial pneumonia model group(P<0.01).2)Concentration of serum TGF-beta1 in Qingfei Decoction group was lower than that of the interstitial pneumoniamodel group(P<0.01).3)Concentration of TGF-beta 1 of Lung homogenate in Qingfei Decoction group was lower than the interstitial pneumoniamodel group(P<0.01).Conclusion:1)Qingfei Decoction has an inhibitory effect on bleomycin induced interstitial pneumonia and pulmonary fibrosis in rats.2)The treatmentmechanism of QingfeiDecoction to BLM-ILDmay be related to TGF-beta1.
QingfeiDecoction;Rheumatoid Arthritis;Interstitial lung Disease;TGF-β1
R285.5
A
1004-745X(2017)07-1163-04
10.3969/j.issn.1004-745X.2017.07.010
2017-05-05)
浙江省杭州市卫生科技计划项目(2017A02)
△通信作者(电子邮箱:fyszjtcm@163.com)
