姜黄素通过IGF-1/Akt/FoxO3a通路保护鱼藤酮诱导PC12细胞的PD模型
2017-08-16李梦楠马振凯白宏英
李梦楠, 马振凯, 白宏英
姜黄素通过IGF-1/Akt/FoxO3a通路保护鱼藤酮诱导PC12细胞的PD模型
李梦楠, 马振凯, 白宏英
目的 探究姜黄素(Cur)对鱼藤酮(Ro)诱导的PC12细胞损伤的保护作用及机制。方法 建立鱼藤酮诱导的PC12细胞的帕金森病模型,利用姜黄素进行干预。实验分组为空白对照组,鱼藤酮模型组(终浓度:0.1 μmol/L),姜黄素干预组(终浓度:0.5 μmol/L、 1.0 μmol/L、 5.0 μmol/L 、10 μmol/L)。MTT比色法检测细胞活力,AO/EB荧光染色法观察细胞的凋亡情况,AnnexinⅤ-FITC/P双染检测细胞凋亡,Western-blot法检测细胞内IGF-1、Akt、FoxO3a的蛋白表达。结果 MTT结果显示:鱼藤酮组较对照组细胞活力明显降低,差异具有统计学意义(P<0.01),0.5 μmol/L和1.0 μmol/L姜黄素干预组可减轻0.1 μmol/L鱼藤酮对PC12细胞增殖活力的影响,明显抑制了鱼藤酮对PC12细胞凋亡的诱导作用,与鱼藤酮组比较差异有统计学意义(P<0.01) Western-blot结果示:鱼藤酮组较对照组明显降低,差异具有统计学意义(P<0.01),0.5 μmol/L和1.0 μmol/L姜黄素干预组IGF-1、磷酸化的Akt(p-Akt)、磷酸化的FoxO3a(p-FoxO3a)表达与鱼藤酮组比明显升高,差异均有统计学意义(均P<0.01)。以上结果均显示5.0 μmol/L和10 μmol/L姜黄素干预组与鱼藤酮组比较差异无统计学意义(P>0.05);结论 适宜浓度的姜黄素对鱼藤酮诱导PC12细胞损伤的PD模型具有保护作用,其保护作用呈浓度依赖性,其保护作用的机制可能与激活IGF-1/Akt/FoxO3a通路有关。
PC12细胞; 姜黄素; 鱼藤酮; 细胞凋亡
帕金森病(PD)是一种老年人常见的神经系统退行性病变疾病,其主要病理特征为脑黑质中多巴胺神经元的死亡和黑质-纹状体通路的退化及部分残存神经元中路易斯小体(Lewy body,LB)的形成。 PD发病机制比较复杂,目前常见因素包括氧化应激损伤、线粒体结构和功能的缺失、暴露环境、饮食、老龄化等。鱼藤酮是最早用来作为一种杀虫剂的神经毒素,可透过血脑屏障选择性的作用于线粒体复合物I和细胞微管[1],引发脂质过氧化和大量自由基生成、细胞内钙超载,最终导致细胞凋亡[2]。PC12细胞具有神经分泌细胞和神经元的性质,且PC12细胞所含的酶类、膜受体、合成的递质等方面很接近中脑多巴胺神经元[3],是国内外研究PD常用的细胞模型。蛋白激酶B(Akt)又称PKB或Rac,在细胞存活和凋亡中起重要作用。磷脂酰肌醇-3羟基激酶(phosphatidylinositol 3-kinase,PI3K)在AKT通路的激活过程起到重要的作用:PI3K在细胞外生长因子的作用下激活并在细胞膜产生3,4二磷酸磷脂酰肌醇和3、4、5三磷酸磷脂酰肌醇,AKT在二磷酸磷脂酰肌醇的作用下产生同二聚体并达到部分激活的状态,进而在3、4、5三磷酸磷脂酰肌醇和PH结构域的协助下AKT与细胞膜的结合并锚着,而二聚体进一步增强了AKT的活性,最后活化的AKT随后由细胞膜上释放下来,使其得以到细胞浆内继续传递生物学信号。IGF-1是胰岛素一号增长因子(insulin-like growth factor 1,IGF-1)。研究发现IGF-1通过激活PI3K/Akt途径调节糖代谢起到抗细胞凋亡的作用。 IGF-1抑制凋亡作用机制:PI3K/Akt信号途径被认为是IGF-1抑制细胞凋亡的经典途径,IGF-1与IGF-1R的胞外域结合后引起跨膜β亚基结构的改变,β亚基内酪氨酸激酶活性即被激活产生自动磷酸化,或者直接活化PI3K,或者通过激活胰岛素受体底物IRS-1,活化的IRS-1通过改变信号分子PI3K两个亚基的比例使之活化[4],从而激活Akt。PIP3与Akt结合,导致Akt从胞浆转位到质膜,并使Akt的Ser473和Thr308位点磷酸化,促进Caspase-3等下游底物发挥广泛的生物学效应,促进细胞生存,抑制细胞凋亡[5]。姜黄素是从姜黄中分离出的多酚化合物,具有抗炎、抗氧化、抗肿瘤等作用,因其成本低廉、副作用小、抗氧化作用强等成为国内外研究的热点。而目前PD的治疗以多巴胺的替代品和多巴胺受体激动剂为主,只能缓解临床症状却不能延缓多巴胺神经元的减少甚至消亡。所以弄清楚PD的发病机制,寻找有效的预防和治疗方案是亟待解决的难题。本实验重点研究姜黄素能否通过调节IGF-1、Akt、FoxO3a的表达直接作用于鱼藤酮诱导的PD模型而发挥保护作用,旨在为PD的临床治疗提供理论依据。
1 材料及方法
1.1 实验材料 PC12细胞(大鼠肾上腺嗜铬细胞瘤细胞),姜黄素,鱼藤酮(北京鼎国昌盛生物技术公司);胰蛋白酶,DMEM-H培养基,磷酸盐缓冲液PBS(美国HyClone公司),小牛血清(美国GEMINI公司);吖啶橙AO、溴化乙锭EB(美国Sigma公司),AnnexinⅤ-FITC 细胞凋亡试剂盒(凯基生物科技发展有限公司);四甲基偶氮唑蓝MTT(美国Amresco公司),兔抗鼠IGF-1抗体、p-AKT抗体、p-FOX3a抗体(美国Santa cruz公司)。
1.2 实验方法
1.2.1 细胞培养和实验分组 PC12细胞置于15%的小牛血清的DMEM-H培养液中,温度37 ℃、5%的CO2培养箱中培养,每隔1~2 d换液,待细胞铺满瓶底70%~80%后,用不含EDTA的胰酶消化后传代培养,取对数期细胞进行实验研究。
本实验分为空白组:不添加任何药物组;鱼藤酮组:只加入鱼藤酮组;鱼藤酮+姜黄素(终浓度分别为0.5 μmol/L、1.0 μmol/L、5.0 μmol/L、10.0 μmol/L)组:终浓度0.1 μmol/L鱼藤酮处理细胞24 h后再加入不同浓度的姜黄素,共同孵育24 h后收集各组细胞分别进行实验。
1.2.2 PD细胞模型的建立 取对数期的PC12细胞,调整细胞密度为1×108~9/L,按照1×105~6接种于96孔板(100 μl/孔),5% CO2、37 ℃培养箱中孵育至铺满孔底约70%。96孔板从第2列至第8列分别为调零孔(无血清培养基填充),空白对照组(不做药物处理),不同浓度的RO(5 nmol/L,20 nmol/L,100 nmol/L,500 nmol/L,1000 nmol/L)组,每组设5个附孔,培养24 h后每孔加5 mg/ml的MTT10 μl,继续培养孵育3~4 h,终止培养弃去孔内液体,每孔加100 μl DMSO后放置于摇床上震荡混匀10 min,待甲臜颗粒完全溶解后,用酶标仪在570 nm处读取吸光度值(OD值)。再按照计算公式姜黄素干预组细胞增殖活力=加药组OD值/对照组OD值进行数据处理。
低剂量(5 nmol/L和20 nmol/L)鱼藤酮处理该细胞24 h内对细胞活性无明显影响(P>0.05);超过 100 nmol/L的鱼藤酮对细胞活性具有明显的抑制作用(P<0.05),并且其抑制作用与所加鱼藤酮浓度呈剂量相关性。而浓度为500 nmol/L和1000 nmol/L时,细胞活力抑制更为明显,这可能与高浓度鱼藤酮有直接损伤细胞导致细胞死亡的作用。
我们选择100 nmol/L的鱼藤酮预处理细胞24 h以成功建立PD的细胞模型,再加入上述浓度的姜黄素进行以下实验研究。
1.2.3 噻唑蓝MTT比色法检测姜黄素对鱼藤酮细胞模型的活力 取对数期的PC12细胞,调整细胞密度为1×108~9/L,按照1×105~6接种于96孔板(100 μl/孔),5% CO2、37 ℃培养箱中孵育至铺满孔底约70%。96孔板从第2列至第8列分别为调零孔(无血清培养基填充),空白对照组(不做药物处理),鱼藤酮模型组(终浓度0.1 μmol/L),姜黄素干预组(终浓度:0.5 μmol/L、 1.0 μmol/L、 5.0 μmol/L 、10 μmol/L),每组设5个附孔,培养24 h后每孔加5 mg/ml的MTT10 μl,继续培养孵育3~4 h,终止培养弃去孔内液体,每孔加100 μl DMSO后放置于摇床上震荡混匀10 min,待甲臜颗粒完全溶解后,用酶标仪在570 nm处读取吸光度值(OD值)。再按照计算公式姜黄素干预组细胞增殖活力=加药组OD值/对照组OD值进行数据处理。
1.2.4 AO/EB荧光染色法观察细胞凋亡 吖啶橙AO是一种具有膜通透性的荧光色素,可通过细胞核使核DNA或RNA染色发出绿色或黄绿色均匀荧光,在凋亡细胞中AO使凋亡小体染上致密的黄绿色荧光或黄绿色碎片颗粒而坏死细胞黄绿色荧光减弱甚至消失,溴化乙锭EB只能使死细胞染色产生橘黄色荧光,由此可区分正常、凋亡和坏死的细胞。步骤:细胞按3×105/ml的密度接种于6孔板上,加入姜黄素使其终浓度为0.5 μmol/L、 1.0 μmol/L、 5.0 μmol/L 、10 μmol/L预处理30 min后,加入鱼藤酮终浓度为0.1 μmol/L,同时设置鱼藤酮组和空白对照组。然后置入37 ℃、5%的CO2培养箱中生长3 h后,离心(1000 r/min、5 min)收集。加入预冷PBS液漂洗,离心,重悬,每20 μl细胞悬液中加1 μl AO/EB工作液,混匀后放置于暗处孵育5 min,每组取一滴悬液滴于载玻片上,荧光显微镜下观察摄像。
1.2.5 AnnexinⅤ-FITC/PI双染细胞凋亡检测 在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜的内侧,但在细胞凋亡的早期,PS可由脂膜内侧翻向外侧,暴露在细胞外环境中,AnnexinⅤ与PS有高度亲和力,故可以通过细胞外侧暴露的PS与凋亡早期细胞的胞膜结合,碘化丙啶(PI)是一种不能通过完整的细胞膜核酸染料,能够透过凋亡中晚期的细胞和死细胞的细胞膜而使细胞核红染。因此将AnnexinⅤ与PI双染色,就可将不同凋亡时期的细胞区分开来。操作步骤:各组细胞按要求处理后离心收集细胞,用PBS洗涤细胞2次收集约(1~3)×105个细胞,加入500 μl的Binding Buffer悬浮细胞,加入5 μl AnnexinⅤ-FITC混匀后加入5 μl PI,混匀;室温、避光、反应5~15 min,在1 h内进行流式细胞仪的观察和检测,激发波长488 nm,发射波长530 nm。重复3次。
1.2.6 Western-blot法检测细胞内IGF-1、Akt、FoxO3a的表达 细胞经过不同的干预处理后收集细胞PBS洗一次,加入适量的细胞裂解液,冰水均匀裂解10 min后,裂解液10000 r/min离心5 min。吸取上清液稀释加入缓冲液,混匀后在沸水浴中加热5 min使之变性,按80V 40 min,120 V 90 min的条件进行SDS-PAGE凝胶电泳后转至PVDF膜上,将膜放在含一抗的5%脱脂奶粉中,一抗稀释比例IGF-1(1∶1000)、p-AKT(1∶1000)、p-FOX3a(1∶1000),4 ℃过夜,用TBST液洗膜4次,每次5 min,二抗(稀释比例1∶4000)室温下孵育1.5 h,TBST洗膜4次,每次5 min后在暗室进行ECL显影,用图像分析软件Quantity One分析条带的积分光密度值。以上实验重复3次。
2 结 果
2.1 MTT法检测细胞活力 姜黄素能减少鱼藤酮诱导的细胞凋亡,增加PC12活细胞的数量。与空白对照组相比,所有经鱼藤酮处理后的细胞活性均有所下降(P<0.01),姜黄素为0.5 μmol/L时开始发挥对鱼藤酮致PC12细胞损伤的保护作用,细胞活力较鱼藤酮组增加15.0%;1.0 μmol/L时保护作用最强,PC12细胞活力较鱼藤酮组增加36.0%,差异有显著统计学意义(P<0.01),而姜黄素5.0 μmol/L 、10 μmol/L细胞活力分别较鱼藤酮组增加4.6%、2.6%,但差异无统计学意义(P>0.05)(见图1)。
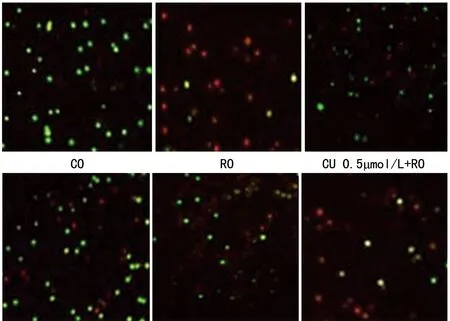
2.2 AO/EB荧光染色法观察细胞凋亡 在显微镜下观察细胞形态,空白对照组(CO)细胞形态正常,几乎都是发出绿色荧光;鱼藤酮组(RO)处理过的细胞,可观察到细胞发生了边缘化、核凝集发绿色荧光等早期凋亡现象同时出现伴染色体破坏橘黄色荧光的晚期凋亡;加入姜黄素(Cur)0.5 μmol/L、 1.0 μmol/L、 5.0 μmol/L 、10 μmol/L预处理30 min后,姜黄素在0.5 μmol/L 时发橘黄色荧光的晚期凋亡细有所减少,1.0 μmol/L时晚期凋亡细胞减少最为显著,5.0 μmol/L 、10 μmol/L虽然也有所减少但不明显(见图2)。
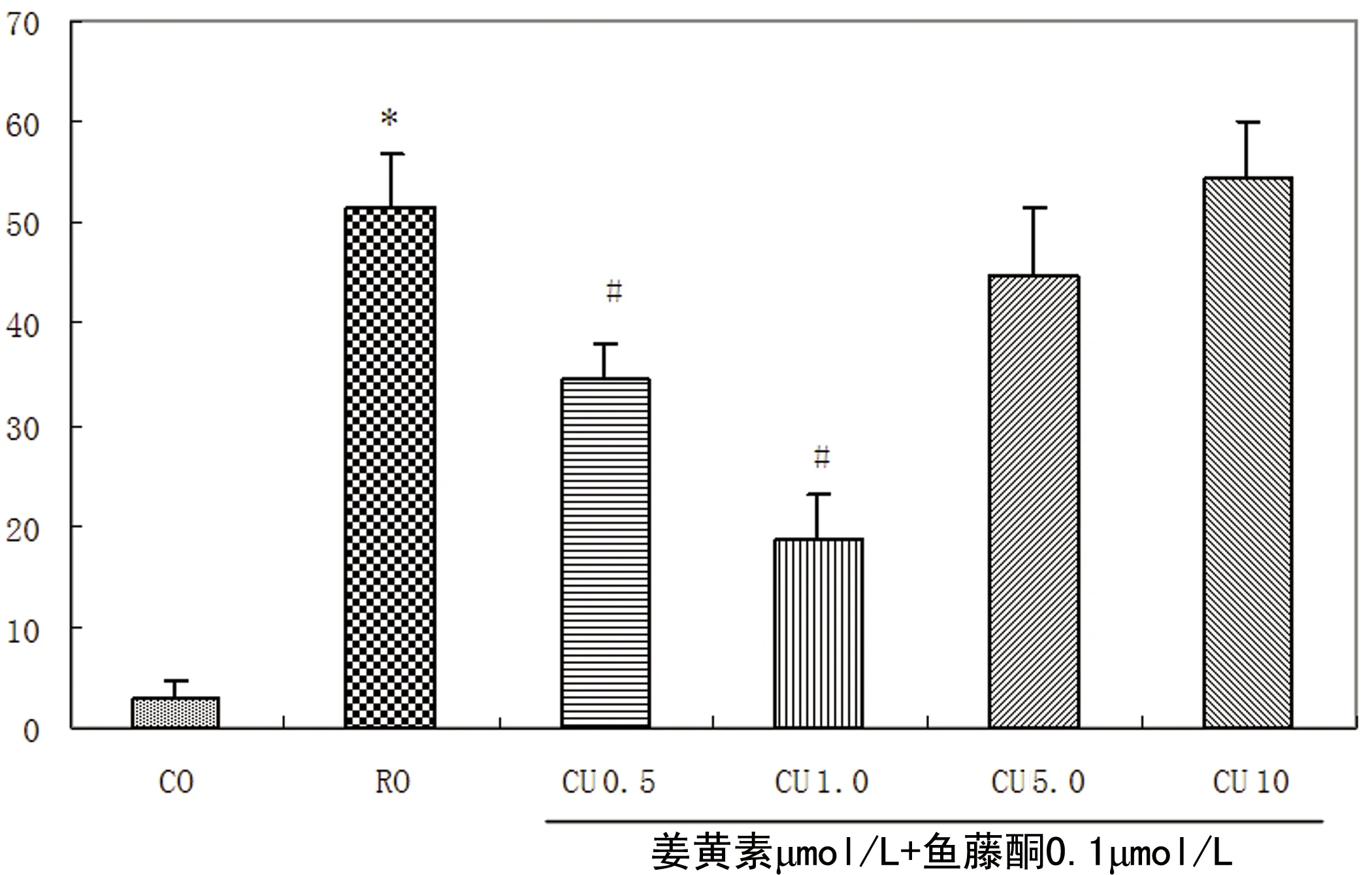
2.3 AnnexinⅤ-FITC/PI双染检测细胞凋亡 空白对照组的细胞凋亡率为2.9%,鱼藤酮处理后的细胞凋亡率上升至51.6%,与空白对照组相比有明显的差异性(P<0.01),0.5 μmol/L和1.0 μmol/L的姜黄素组细胞凋亡率分别为34.5%、18.7%明显减轻了鱼藤酮诱导的PC12细胞的凋亡(P<0.01),而5.0 μmol/L和1 μmol/L的姜黄素组细胞凋亡率分别为44.8%、54.5%与鱼藤酮组比较无显著性差异(见图3)。
2.4 Western-blot法检测细胞内IGF-1、Akt、FoxO3a的表达 见表1、图4。

CO:空白对照组;RO:鱼藤酮组;CU 0.5:0.5 μmol/L姜黄素干预组;CU 1.0:1.0 μmol/L姜黄素干预组;CU 5.0:5.0 μmol/L姜黄素干预组;CU 10:10 μmol/L姜黄素干预组。与空白对照组比较*P<0.01;与鱼藤酮组比较#P<0.01
图1 MTT法检测细胞活力
CU 1.0 μmol/L+RO CU 5.0 μmol/L+RO CU 10 μmol/L+RO
图2 AO/EB荧光染色法观察细胞凋亡
CO:空白对照组;RO:鱼藤酮组;CU 0.5:0.5 μmol/L姜黄素干预组;CU 1.0:1.0 μmol/L姜黄素干预组;CU 5.0:5.0 μmol/L姜黄素干预组;CU 10:10 μmol/L姜黄素干预组。与空白对照组比较*P<0.01;与鱼藤酮组比较#P<0.01
图3 AnnexinⅤ-FITC/PI双染检测细胞凋亡
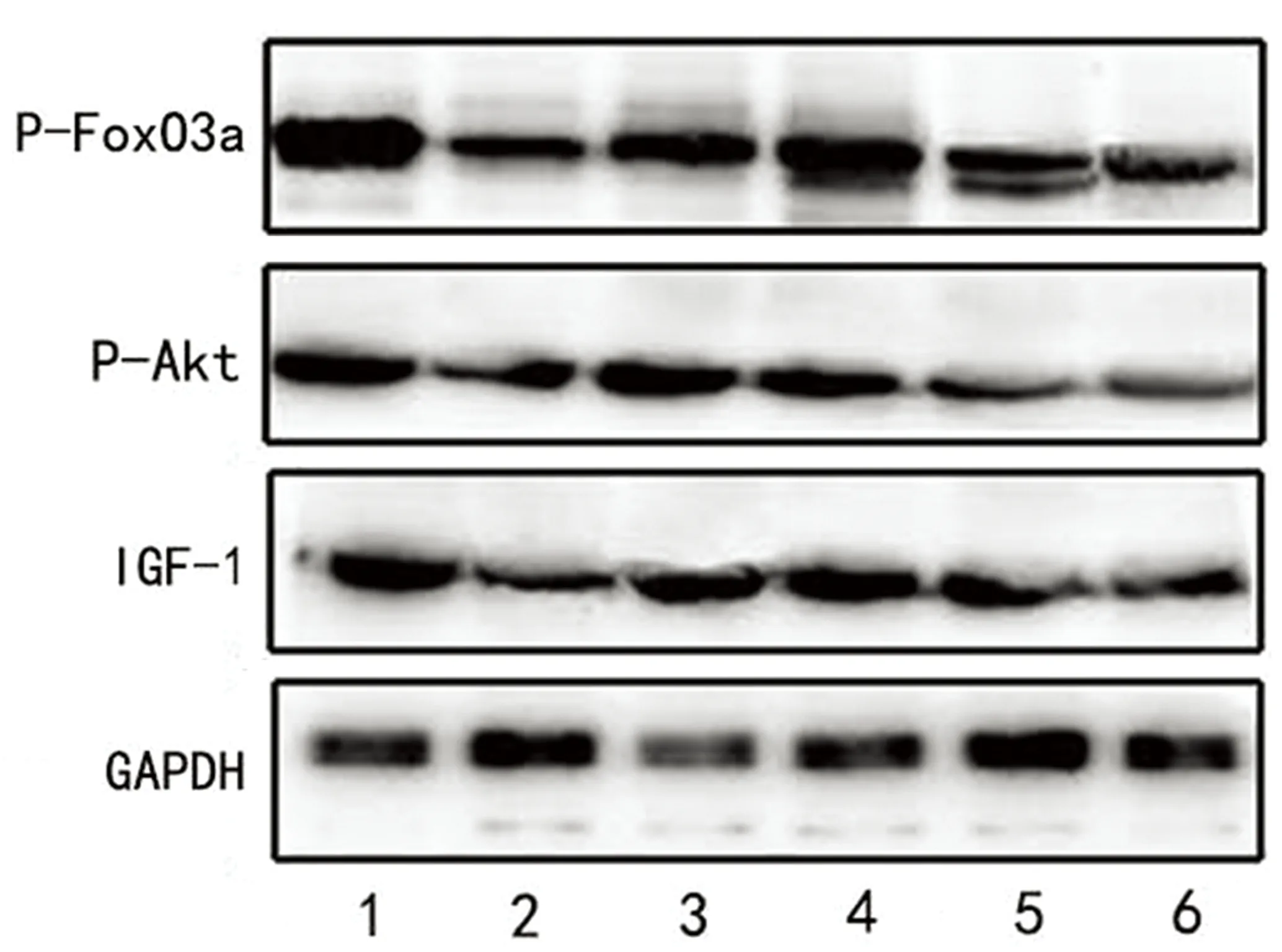
图4 细胞内IGF-1、Akt、FoxO3a的表达

组别IGF-1p-Aktp-FoxO3a空白对照组鱼藤酮组0.5μmol/L姜黄素组1.0μmol/L姜黄素组5.0μmol/L姜黄素组10μmol/L姜黄素组8.424±0.4301.620±0.215*5.846±0.301#7.615±0.208#2.002±0.3041.862±0.4139.602±0.2231.564±0.147*6.290±0.218#8.042±0.210#1.846±0.3571.628±0.4067.526±0.2060.928±0.213*5.021±0.197#6.885±0.189#1.439±0.3661.188±0.402
与空白对照组相比*P<0.01;与鱼藤酮组相比#P<0.01
3 讨 论
近十年来研究表明,许多因素参与PD的发生和发展过程,例如:氧化应激、线粒体功能障碍、炎症、细胞毒性、细胞凋亡等,不同因素引起的PD最终表现为中脑黑质多巴胺神经元(DA)的凋亡,也就是说PD发病的最终结果归因于细胞凋亡这一共同通路[6]。
PI3K/Akt通路是介导神经细胞存活的一条经典通路[7,8],PI3K/Akt/FoxO3a通路是调控细胞凋亡的重要通路之一[9]。IGF-1对神经元的保护作用多通过激动PI3K/Akt通路发挥作用[10]。IGF-1激动PI3K/Akt后,活化的PI3K通过3-磷酰化磷酸肌醇酯和磷酸肌醇依赖性激酶(PDK)共同作用而激活Akt,活化的Akt进一步激动促存活因子的转录实现抑制细胞凋亡。FoxO3a是Forkhead转录因子家族成员,是PI3K/Akt信号转导途径下游重要的靶基因,活化的Akt可以使促凋亡转录因子FoxO3a磷酸化失活,磷酸化的FoxO3a与DNA亲和力下降,从细胞核转移至细胞质,降低Bim蛋白表达,抑制细胞的凋亡[11]。姜黄素是从姜黄中提取的天然色素,具有抗氧化、抗肿瘤、抗炎、清除自由基等广泛的药理作用[12],姜黄素可通过信号转导通路等多种机制发挥对神经元细胞的保护作用,已有实验证实它对ActD/TNF-a协同诱导的PC12细胞的保护机制[13],但姜黄素能否通过激活IGF-1/Akt/FoxO3a通路发挥对神经细胞的保护作用,报道极少。
本实验结果显示鱼藤酮组细胞活力明显降低、凋亡率明显升高,0.5 μmol/L、 1.0 μmol/L明显发挥了对鱼藤酮诱导PC12细胞损伤的保护作用,随着姜黄素浓度的增加(5.0 μmol/L、 10 μmol/L)细胞活力和凋亡率较鱼藤酮组比较没有显著变化。崔群力[14]研究发现姜黄素在一定浓度范围内发挥保护作用,浓度过高时保护作用较低,甚至起促氧化损伤作用,损伤可能与应激因素激活热休克蛋白、促进a-突触蛋白有关[14]。以上实验研究表明姜黄素在0.5~1.0 μmol/L范围内可以拮抗鱼藤酮诱导的细胞损伤发挥保护作用。鱼藤酮组IGF-1、p-Akt、p-FoxO3a的表达明显减弱,细胞活力明显降低、凋亡率明显升高;同时姜黄素浓度(0.5 μmol/L、 1.0 μmol/L)时IGF-1、p-Akt、p-FoxO3a的表达较鱼藤酮组显著增强且细胞活力较鱼藤酮组明显升高、凋亡率明显降低,提示IGF-1/Akt/FoxO3a信号通路是姜黄素发挥对鱼藤酮诱导的PC12细胞的保护机制,姜黄素能增强PI3K/Akt通路中IGF-1的表达从而促进p-Akt、p-FoxO3a表达增强,磷酸化的FoxO3a与DNA亲和力下降,从细胞核转移至细胞质,Bim蛋白表达下降,发挥抑制细胞凋亡的作用。而高浓度(5.0 μmol/L、 10 μmol/L)的姜黄素组细胞IGF-1、p-Akt、p-FoxO3a的表达较鱼藤酮没有显著增强,细胞活力和凋亡率较鱼藤酮组比较没有显著变化。说明姜黄素在一定浓度范围内激活IGF-1/Akt/FoxO3a信号通路发挥对鱼藤酮诱导的PC12细胞的保护机制。
总之,姜黄素对鱼藤酮诱导的PC12细胞的保护作用呈浓度依赖性,作用机制可能与促进细胞IGF-1、p-Akt、p-FoxO3a的表达,通过该信号通路调控神经细胞的凋亡有关。但姜黄素能否通过其他信号转导通路发挥神经细胞的保护作用仍需要进一步探索研究。
[1]Dias V,Junn E,Mouradian M. The role of oxidative stress in Parkinson’s disease[J]. J Parkinsons Dis,2013,3(4):461-491.
[2]Jung TW,Lee JY,Shim WS,et al. Rosiglitazone Proteets human neuroblastoma SH 2SY5 Ycells against MPP+ induccd cytotoxieity via inhibition of mitoehondrial dysfunction and ROS production[J]. J Neurol Sci,2007,253(122):53260.
[3]Shafer TJ,Atchison WD. Transmitter,ion channel and receptor properties of pheochromocytoma (PC12) cells:a model for neurotoxicological studies[J]. Neurotoxicology,1991,12(3):473-492.
[4]Peng K,Li Y,Long L,et al. Knockdown of FoxO3a induces increased neuronal apoptosis during embryonic development in zebrafis[J]. Neurosci Lett,2010,484(2):98-103.
[5]Jover T. Acute estradiol protects CA1 neurons from ischemia-induced apoptotic cell death via the PI3K/Akt pathway[J]. Brain Research,2010,1321(12):1-12.
[6]Liu P,Wang JY,Wang ZY,et al. Effects of baicalin on hippocampus neuronal apoptosis in focal cerebral ischemia reperfusion injury rats [J]. Chi J Pharmacol Toxicol,2005,19(6):412-418.
[7]Yuan JY,Yankner BA. Apoptosis in the nervous system[J]. Nature,2000,407:802-809.
[8]Dudek HSR,Datta TF,Franke MJ,et al. Regulation of neuronal survival by the serine-threonine protein kinase Akt[J]. Science,1997,275:661-665.
[9]Huang H,Tindall DJ. FOXO factors:a matter of life and death [J]. Future Oncol,2006,2(1):83-89.
[10]Kenchappa P,YadavA,Singh G,et al. Rescue of TNFalpha-inhibited neuronal cells by IGF-1 involves Akt and c-JunN-terminal kinases[J]. J Neurosci Res,2004,76(4):466-474.
[11]Sedding DG,Fox O. Transcription factors in oxidative stress response and ageing--a new fork on the way to longevity [J]. Biol Chem,2008,389(3):279-83.
[12]许东晖,王 胜,金 晶,等. 姜黄素的药理作用研究进展[J]. 中草药,2005,36(11):1737-1740.
[13]谢 赛. 姜黄素对ActD/TNF-α协同诱导PC12细胞凋亡的保护作用及机制研究[D]. 暨南大学,2011.
[14]崔群力,孙圣刚. 姜黄素通过抗氧化作用拮抗鱼藤酮致PC12细胞损伤的研究[J]. 华中科技大学学报(医学版),2010,1:37-44
Curcumin prevents the PD model of rote-none-induced PD12 cells through IGF-1 /Akt/FoxO3a signaling pathway
LIMengnan,MAZhenkai,BAIHongying.
(DepartmentofNeurology,TheSecondAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450014,China)
Objective To investigate the cytoprotection of curcumin(Cur) against rote-none(Ro)-induced injury and the molecular mechanisms underlying in PC12 cells. Methods The Parkinson model of PC12 cells was established with Ro,use Cur to intervene. The experiment group was blank control(Co) group,Ro model group(final contentration:0.1 μmol/L),Cur intervention group(final contentration:0.5 μmol/L、1.0 μmol/L、5.0 μmol/L、10 μmol/L). Cell viability was determined using MTT reduction assay,cell apoptosis was observed by the method of AO/BE fluo-rescence staining,flow cytometry to detect the apoptosis rate. the expressions of IGF-1,Akt and FoxO3a proteins were measured by Western blotting. Results MTT results showed:Ro group cell viability significantly decreased as compared with the Co group,the difference was statistically significant(P<0.01);0.5 and 1.0 μmol/L Cur intervention groups significantly decreased the inhibitory rate of 0.1 μmol/L Ro on the growth of PC12 cells for 24 h,significantly inhibited the apoptosis of PC12 cells induced by Ro for 24 h as compared with the Ro group (P<0.01);Western blot results showed:Ro group cell significantly decreased as compared with the Co group,the difference was statistically significant(P<0.01);The expression of IGF-1,p-Akt and p-FoxO3a between 0.5 μmol/L and 1.0 μmol/L Cur intervention group and the Ro group all had statistics significance(allP<0.01 ). The results above all showed:5.0 and 10 μmol/L Cur intervention groups had no significant difference as compared with the Ro group(P>0.05). Conclusion Appropriate concentration of Cur had protective effect on the PD model by the mechanism of activating the IGF-1/Akt/FoxO3a pathway,and the protective effect was concentration dependent.
PC12 cells; Curcumin; Rotenone; Apoptosis
1003-2754(2017)07-0588-05
2017-03-28;
2017-06-17
河南省基础与前沿技术研究计划项目(No. 142300410461)
(郑州大学第二附属医院,河南 郑州 450014) 通讯作者:白宏英,E-mail:hybai@126.com
R742.5;Q26
A
