自制爬片装置用于细胞爬片及细胞染色
2017-08-12苏获毛林锋BensonKaluba段智曦刘擎黄鹏
苏获,毛林锋,Benson Kaluba,段智曦,刘擎,黄鹏
(1.中南大学护理学院,湖南 长沙 410013;2.中南大学湘雅医院,湖南 长沙 410008;3.中南大学湘雅二医院,湖南 长沙 410011)
自制爬片装置用于细胞爬片及细胞染色
苏获1,毛林锋2,Benson Kaluba2,段智曦3,刘擎2,黄鹏2
(1.中南大学护理学院,湖南 长沙 410013;2.中南大学湘雅医院,湖南 长沙 410008;3.中南大学湘雅二医院,湖南 长沙 410011)
目的利用自制爬片装置改进细胞爬片的制备方法。方法通过自制装置和传统方法制备细胞爬片,苏木精-伊红染色法(HE染色)观察细胞生长状态,比较两种细胞爬片制备方法的差异;利用自制装置制备同时给予3种不同干预处理的细胞爬片,验证其应用于制备多干预条件细胞爬片;制备同时含有3种不同细胞的集成爬片,验证其用于制作细胞集成爬片的应用。结果自制装置可简化细胞爬片流程,细胞直接贴于载玻片上生长,未出现污染和增殖受限,制作多干预或多种细胞集成爬片效果明确,无相互干扰现象。结论自制装置能更简便地制备以满足普通染色及特殊染色实验要求的细胞爬片,是一种更好的制备细胞爬片的方法。
细胞爬片;细胞培养;染色
Abstract:ObjectiveTo provide an improved method to prepare cell-attached slides.MethodsCellattached slides were prepared by routine method and self-made device,and the difference between the two methods were compared by observing the cell growth after HE staining.Three kinds of interventions were given to the same cell-attached slide to test the application in making different interventions cell-attached slide of the device.Three kinds of cells were planted in the same slide to test the application in making integrated cell-attached slides of the device.ResultsOur device simplified the preparation of cell-attached slides.Cells grown on the glass and never showed pollution or growth restriction,given different interventions or planted different cells at the same time without interaction.ConclusionsThe new method simplifies the processes of preparation cell-attached slides,and the slides made by our device satisfies the experiment demands of all kinds of cells staining,makes it as a more effective method than before.
Keywords:cell-attached slide;cells culture;cells staining
细胞爬片是观察细胞形态结构最常用的一种实验手段,利用细胞爬片进行体外实验可排除体内诸多干扰因素的影响,并方便对细胞进行各种干预处理[1]。传统的方法是在装有盖玻片的孔板中种入细胞,待细胞在盖玻片上贴壁生长后再取出盖玻片进行后续的染色实验,整个过程操作起来比较繁琐,且存在许多缺陷。随着研究的深入,细胞检测指标日渐丰富,对细胞爬片的需求逐渐增大,传统的方法需要逐一对每张爬片进行染色,不但操作繁琐,效率低,制作成本高,且每张细胞爬片处理过程难免会有差异,导致相互之间可比性差,实验结果分析困难。本研究中制备一种新型的细胞爬片装置,对传统爬片方法进行改良,简化操作流程,提高细胞爬片的制作效率,并且能够在一张载玻片上制作含有多种不同细胞的集成爬片,并同时进行多种干预处理,节约大量试剂及相关材料,减小实验误差,提高实验效率,现介绍如下。
1 材料与方法
1.1 材料与试剂
普通载玻片、直径9mm圆形小盖玻片、1.5ml EP管、12孔细胞培养板及用于染色用的HE染色[苏木精 - 伊红染色法(hematoxylin-eosin staining)]试剂盒、茜素红染色试剂盒、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色液、鬼笔环肽(红色)染色液(购自上海生工生物工程股份有限公司),DMEM(dulbecco's modified eagle medium)培养基、胎牛血清及胰蛋白酶(购自美国Gibco公司),用于干预处理的纳米颗粒(KaolinMeOH及KI@KaolinMeOH)(为本课题组前期制备),甲状腺癌细胞株TPC-1细胞、骨肉瘤细胞株人骨肉瘤(HOS)细胞、P1代大鼠正常软骨细胞及大鼠膝骨关节炎(osteoarthritis,OA)模型P1代软骨细胞(均为湘雅医院医学科学研究中心保存)。
1.2 方法
1.2.1 细胞爬片的制备 盖玻片及载玻片置于浓硫酸中浸泡过夜,自来水及双蒸水冲洗3遍,再在无水乙醇中浸泡6 h,双蒸水冲洗后烘干,并同爬片支架一起高温高压消毒,然后烤干。使用前,盖玻片及载玻片用多聚赖氨酸处理备用。在无菌超净工作台内剪下无菌EP管的盖子,并在距离EP管底部10 mm处剪断。将载玻片插入爬片装置,并将剪断的EP管放入爬片装置内并卡紧,置入染色湿盒上并用内紫外线照1~2 h。见图1。
传统细胞爬片制作前,在12孔细胞培养板的各孔内滴加1滴磷酸盐缓冲液(phosphate buffer saline,PBS),再放入盖玻片,使盖玻片贴住孔板的底部,确保孔板与盖玻片之间无气泡。复苏甲状腺癌TPC-1细胞,培养至对数生长期时,用0.25%胰酶消化并计数,调整细胞密度约为6×103,新型爬片装置每孔加入400μl细胞悬液,传统细胞爬片组每孔加入1 ml细胞悬液,放入37℃、5%二氧化碳CO2和>90%湿度的培养箱中培养24 h,细胞均匀生长在载玻片或盖玻片上后,取出载玻片或盖玻片,分别浸入PBS(pH 7.4)中洗3×5 min,然后再浸入4%多聚甲醛固定20 min,PBS洗3×5 min,再进行后续的HE染色观察细胞形态。
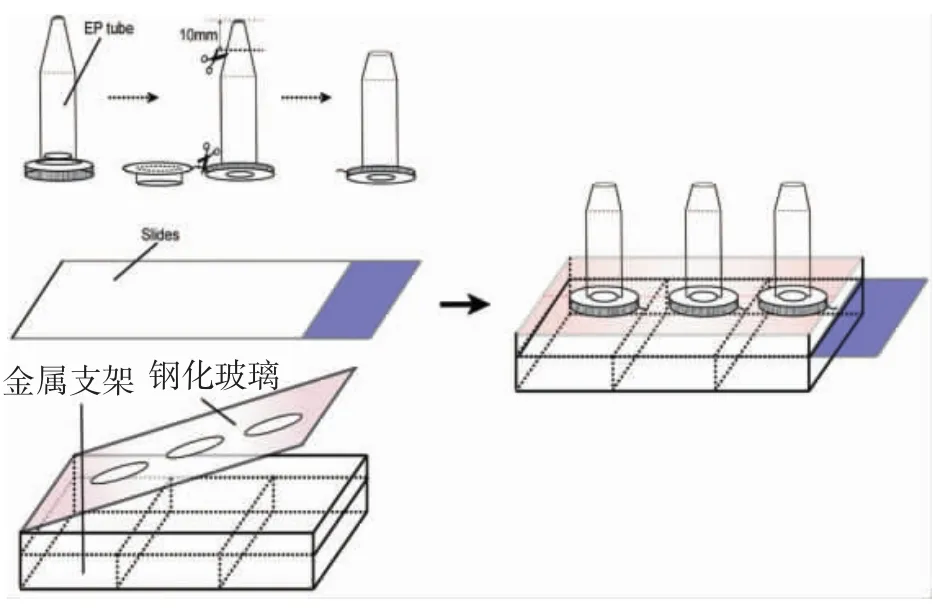
图1 爬片装置示意图及操作流程图
1.2.2 多种细胞集成爬片的制备 爬片装置及载玻片等物品准备方法同上述,为验证爬片装置可同时制作多种不同细胞的集成爬片,本研究中分别在3个EP管内种入骨肉瘤细胞株HOS细胞、P1代大鼠正常膝关节软骨细胞(Normal)及大鼠膝骨关节炎(OA)模型P1代软骨细胞,由于3种细胞钙盐含量不同,后续通过茜素红染色进行3种细胞的鉴定。复苏3种细胞,培养至对数生长期时,用0.25%胰酶消化并计数,调整细胞密度约为6×103,在3个EP管中分别加入3种细胞悬液400 μl,细胞培养箱中培养至细胞均匀生长在载玻片上后,取出载玻片进行后续实验。
1.2.3 多种干预条件细胞爬片的复制 本课题组之前的研究报道过甲状腺癌吞噬甲基化高岭土纳米颗粒(KaolinMeOH)及负载碘化钾的甲基化高岭土纳米颗粒(KI@KaolinMeOH)的能力不同[2],本研究中为验证爬片装置可以同时进行多种干预处理,分别在3个EP管内加入PBS及FITC处理的KaolinMeOH、KI@Kaolin-MeOH进行干预,通过鬼笔环肽及DAPI染色并在激光共聚焦显微镜下观察甲状腺癌细胞吞噬纳米材料的情况。按上述方法培养甲状腺癌TPC-1细胞,利用自制爬片装置制作细胞爬片,并加入20 μl浓度为50 μg/ml的纳米颗粒混悬液,培养细胞过夜,再进行后续的染色实验。
1.2.4 细胞染色 HE染色:上述制作的爬片经4%多聚甲醛固定后,PBS洗3×5min,苏木素染核8min,自来水冲洗,1%盐酸酒精分色数秒,自来水冲洗,伊红染液染2 min,自来水冲洗,自然晾干后中性树胶封片。两种方法分别制备6张细胞爬片,HE染色,莱卡倒置显微镜(×100)下观察细胞形态,并计数单张爬片细胞数进行统计分析。茜素红染色:细胞爬片固定后,用茜素红染液覆盖样本,37℃避光孵育60 min,双蒸水缓慢冲洗3 min,常规封片后,倒置显微镜下观察细胞内钙盐堆积情况,钙沉积细胞呈现橘红色,计数橘红色细胞数目并进行统计学分析。鬼笔环肽染色:细胞固定后,0.5%Triton X-100室温孵育10 min,用3%脱脂牛奶于4℃结合非特异性蛋白1 h,用鬼笔环肽工作液室温染色20 min,PBS洗2×5 min,最后用DAPI复染细胞核10min后,激光共聚焦显微镜下观察细胞骨架及纳米颗粒吞噬情况,通过Image J软件分析图片中细胞吞噬材料的OD值,并进行统计学分析。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,各组间的数据用单因素方差分析进行比较,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 自制爬片装置与传统方法制备细胞爬片比较
分别利用传统方法及自制爬片装置成功获得细胞爬片。普通载玻片的空白区域面积约为58 mm×25 mm,而1.5 ml EP管管口直径约为14 mm,利用自制爬片装置可以在1张载玻片上面同时获得3个细胞爬片区域。HE染色发现2种细胞爬片制备方法均可得到形态清晰的细胞爬片,但是传统方法制备的细胞爬片易出现严重的边缘效应及细胞脱落现象。应用传统方法单张爬片细胞数约为(2532±32.76)个,另外,从孔板中取出盖玻片的过程容易折断盖玻片;自制爬片装置让细胞直接生长并贴壁在载玻片上,制备的细胞爬片贴壁更均匀,贴壁更牢靠,无边缘现象及细胞脱落现象,单张爬片细胞数约为(4 145±83.10)个,传统爬片与新型爬片上单张爬片细胞数间差异有统计学意义(P=0.000)。见图2A、2B。
2.2 自制爬片装置用于制备集成细胞爬片
在自制爬片装置中同时培养的HOS细胞、P1代正常大鼠软骨细胞(Normal)、P1代大鼠骨关节炎模型软骨细胞(OA)分别贴壁在同一载玻片上的不同位置,相互独立,茜素红染色后,细胞内沉积的钙盐被染成橘红色。3种细胞在相同的条件下得到不同程度的染色效果,钙盐沉积细胞比率分别为:HOS组为0.81%、Normal组为15.45%、OA组为97.33%,3种细胞钙盐沉积比率间差异有统计学意义(P=0.000)。由于3种细胞分布在载玻片的不同位置,在同步染色的过程中无相互影响,提示自制爬片装置可用于集成多种细胞爬片的制备。见图3。
2.3 自制爬片装置用于制备多干预条件的细胞爬片
鬼笔环肽将细胞膜骨架蛋白染成红色,DAPI将细胞核染成蓝色,甲状腺癌细胞吞噬的纳米颗粒呈绿色荧光,用Image J软件测得3种干预条件下单张图片内的绿色荧光OD值分别为:PBS组为0;KaolinMeOH组为 (259.6±3.28);KI@KaolinMeOH组为(616.1±20.26)。3组图片的绿色荧光OD值差异有统计学意义(P=0.000)。KI@KaolinMeOH干预的甲状腺癌细胞内绿色荧光颗粒多于KaolinMeOH干预处理的细胞。见图4。
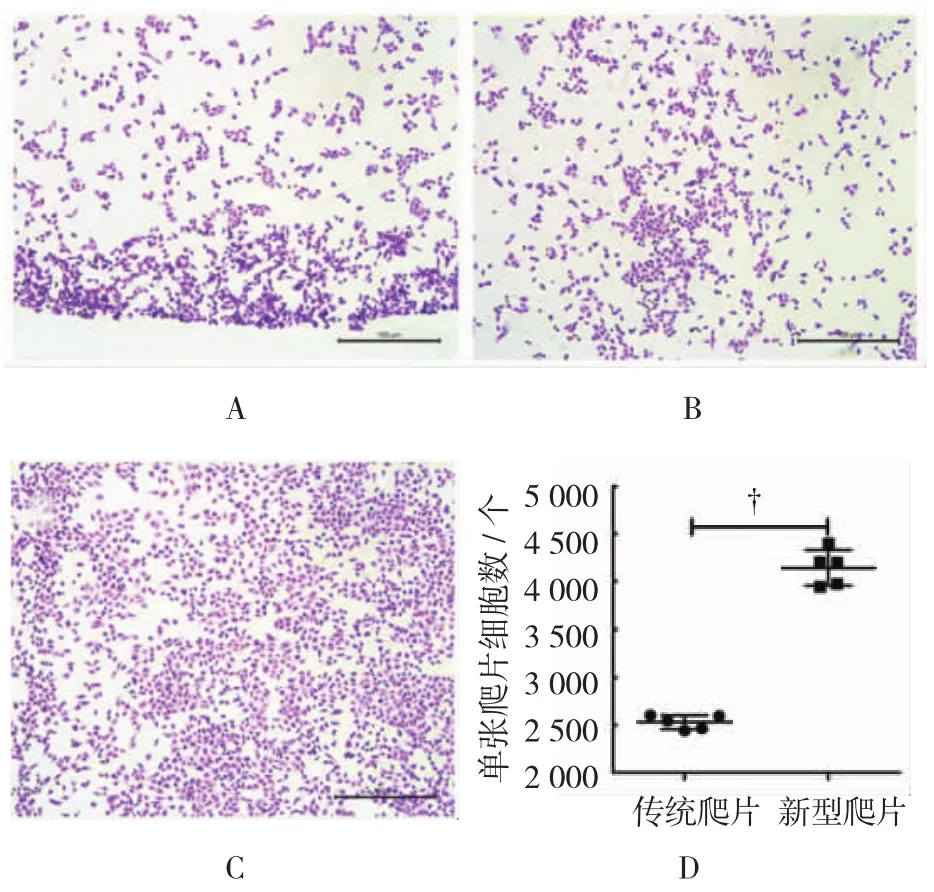
图2 自制爬片装置与传统方法制备细胞爬片比较
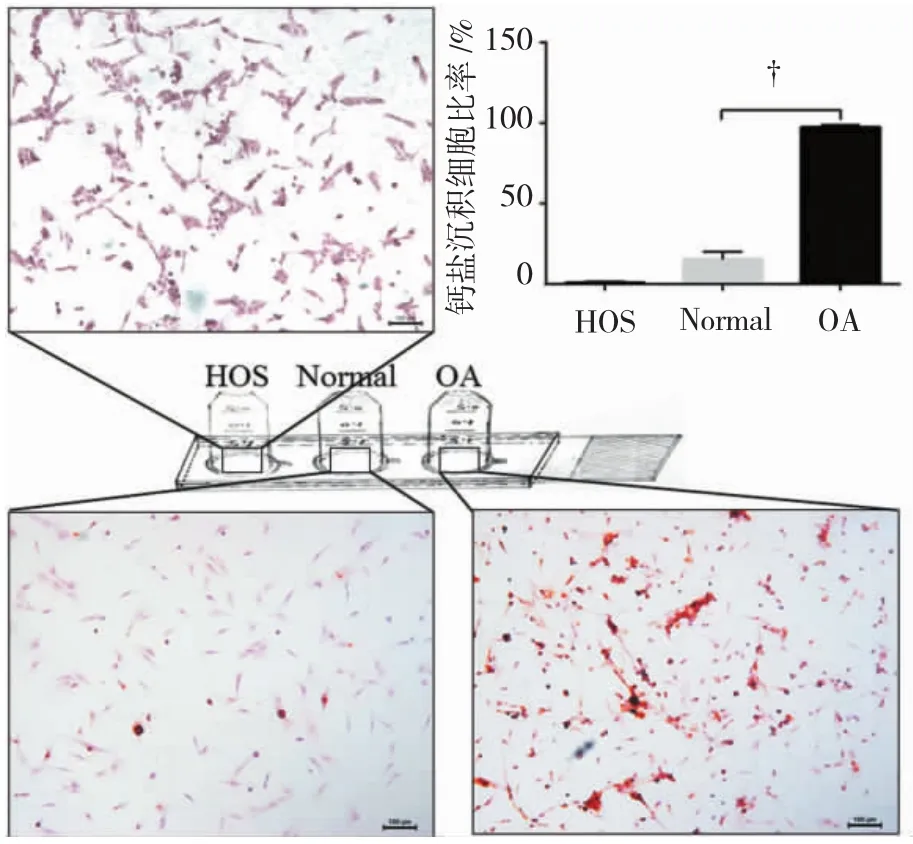
图3 自制爬片装置制备多种细胞的集成细胞爬片(茜素红染色×100)

图4 自制爬片装置制备多种干预条件细胞爬片(鬼笔环肽染色×400)
3 讨论
细胞爬片是体外培养细胞常用的一种实验手段,广泛应用普通染色下观察细胞形态结构[2-3]或特殊染色下观察细胞内蛋白分布情况[4-5]。传统爬片方法通过在置入盖玻片的细胞培养板中种植细胞实现,传统的细胞爬片制作方法存在以下不足:①每张爬片均需单独制备,进行大量细胞爬片制备的时候操作繁琐,且相互之间差异较大,对干预结果造成影响;②置入细胞培养板内的盖玻片由于贴合不紧易发生滑动,导致盖玻片的两面均可能有细胞贴壁生长,观察细胞形态结构时出现重影,影响结果;③虹吸作用导致细胞爬片与底部严密结合而很难分开,取出盖玻片的过程容易折断、夹碎和颠倒正反面等,对后续实验造成干扰;④细胞大量聚集生长在盖玻片的边缘,造成边缘效应;⑤染色过程中,反复冲洗夹取盖玻片易导致细胞脱片。
有研究在传统方法上进行改进,通过中性树胶将1ml tips粘在载玻片上,从而实现集成爬片的制作[6-7]。但是这些改进方法均存在一些不足,首先,中性树胶中普遍存在二甲苯等细胞毒性物质,对细胞增殖有一定的影响[8];其次,爬片制备好之后载玻片上面残留的中性树胶不利于后续的染色和封片;最后,中性树胶粘合不是很牢靠,爬片过程中可能因为漏液而导致细胞死亡[9]。
通过反复试验验证,本研究中自制的爬片装置可以高效地制作细胞爬片,相对于传统方法及现有报道的爬片方法,本研究方法具有以下的优势:①简化试验流程,操作简单,提高细胞爬片制备的成功率;②爬片装置可以反复消毒重复使用,试验用材价格低廉,载玻片、EP管都是实验室常用的耗材,不需要购买相应的细胞培养孔板,同时也不需要购买专用的细胞爬片;③细胞直接在载玻片上生长,分布更均匀,可以避免传统方法两面都贴上细胞的情况;④不使用中性树胶等粘合剂,不会对细胞生长造成影响;⑤单张载玻片上可同时制备3个细胞爬片,方便大批量的细胞爬片制备;⑥能确保干预条件一致性,提高研究结果的准确性;⑦EP管之间相互独立,单张载玻片上可以同时制备多种细胞的集成爬片和同时进行多种干预处理。
综上所述,本研究中自制的细胞爬片装置能极大地节约试剂盒耗材,细胞爬片效果好、操作方便,满足大批量细胞爬片染色的需求,有效地提高实验效率及准确率,满足普通染色及特殊染色实验要求,是一种更好的制备细胞爬片的方法,非常适合推广使用。
[1]李红军,崔文胜,王永霞,等.贴壁细胞不同制片方法对膜蛋白光镜免疫组化显示性的影响[J].中国普通外科杂志,2008,17(9):892-896.
[2]丛波,张加廷,韩龙,等.兔软骨细胞的分离及其与Ⅰ/Ⅱ型复合胶原膜共培养实验研究[J].中国现代医学杂志,2016,26(7):4-8.
[3]张立岩,孙新,田丹,等.改良分次酶消化法分离培养兔肌腱干细胞及诱导分化鉴定[J].中国现代医学杂志,2016,26(18):1-5.
[4]赵晓,黄飞麒,姚乃婕,等.S100A11-RAGE通过P38MAPK信号转导通路调控小鼠骨关节炎软骨细胞肥大和细胞外基质代谢[J].中国现代医学杂志,2016,26(16):6-11.
[5]于建超,王江平,李应龙,等.人干细胞白血病基因重组慢病毒载体的构建及其在Cajal样间质细胞中的表达[J].中国现代医学杂志,2017,27(6):10-16.
[6]徐洪,宋旭东,李莹,等.贴壁细胞在载玻片爬片的新方法[J].中国应用生理学杂志,2009,25(2):283-285.
[7]罗波,毛樱逾,郑小莉,等.细胞爬片集成染色法及应用[J].郑州大学学报(医学版),2011,46(4):615-617.
[8]罗波,毛樱逾,郑小莉,等.利用爬片支架来制备细胞爬片的一种新方法[J].现代预防医学,2010,37(19):3721-3722.
[9]项晓人,姜海英,赵喜新,等.大批量培养细胞爬片染色的简易装置[J].解剖学研究,2002,24(4):312.
New method of preparation cell-attached slides for staining with self-made device
Huo Su1,Lin-feng Mao2,Benson Kaluba2,Zhi-xi Duan3,Qing Liu2,Peng Huang2
(1.School of Nursing,Central South University,Changsha,Hunan 410013,China;2.Xiangya Hospital,Central South University,Changsha,Hunan 410008,China;3.The Second Xiangya Hospital of Central South University,Changsha,Hunan 410011,China)
Q2-33
A
10.3969/j.issn.1005-8982.2017.15.008
1005-8982(2017)15-0038-04
2017-04-19
黄鹏,E-mail:xiangyahp@csu.edu.cn;Tel:15273124136
