DTI检测阿尔茨海默病脑白质的改变
2017-08-11任津瑶龙淼淼祁吉倪红艳
任津瑶 龙淼淼 祁吉 倪红艳
DTI检测阿尔茨海默病脑白质的改变
任津瑶1龙淼淼2祁吉2倪红艳2
目的:应用磁共振弥散张量成像(DTI)技术评价阿尔茨海默病(AD)患者脑白质的改变,分析部分各向异性(FA)和局域各向异性(GA)参数对AD患者脑白质损伤的诊断效率。方法:选取2014年8月—2015年8月确诊的AD患者12例(AD组),16例认知正常的健康老年志愿者为对照组,进行MRI常规扫描和DTI检查,测量上纵束、扣带束、胼胝体、内囊、额叶、顶叶、颞叶、枕叶脑白质的FA、GA值。应用ROC曲线评价FA、GA参数检出AD患者脑白质损伤的诊断效率。结果:与对照组比较,AD组的扣带束后部FA、GA值降低;上纵束FA、GA值降低;顶叶白质FA、GA降低;额叶白质GA值降低;颞叶白质GA值降低;胼胝体压部GA降低,差异均有统计学意义。ROC曲线评价AD患者扣带束后部、上纵束、顶叶GA值曲线下面积较FA大, 顶叶GA值对于AD患者脑白质损伤具有较高的诊断效率。结论:AD患者表现为选择性脑白质域性损害,扣带束后部、上纵束、胼胝体压部、额叶、颞叶、顶叶皮层下脑白质损伤,GA诊断AD病患者脑白质异常的效率比FA更佳。
磁共振成像; 扩散张量成像; 阿尔茨海默病; 脑白质
阿尔茨海默病(alzheimer disease,AD)是一种神经退行性疾病,是老年痴呆中最常见的一种类型,严重影响着老年人的健康和生活质量。AD的病理生理机制尚未完全清楚。以往大部分研究工作集中在皮层萎缩、淀粉样蛋白和神经元在皮层和皮层下灰质的改变[1-3]。有研究显示AD患者随着病情的进展有明显广泛的脑白质损害[4]。且AD患者存在脱髓鞘改变、小胶质细胞的激活以及白质中的少突胶质细胞和星形胶质细胞反应性增生[5],这些白质损伤对AD的临床表现可能起着重要的作用,能够更好地理解这些变化可能引起AD的病理机制。在以往的白质损伤研究中多应用部分各向异性(fractional anisotropy,FA)参数,FA是张量本征值简单的比较,FA的敏感性会受到AD患者病理改变进程的影响,局域各向异性(geodesic anisotropy,GA)参数在AD白质损伤中的应用研究尚属于空白领域。本研究应用磁共振弥散张量成像(diffusion tensor imaging,DTI)评价AD患者脑白质的变化,应用ROC曲线分析FA和GA参数对AD患者脑白质损的诊断效率。
对象与方法
一、研究对象
选择2014年8月—2015年8月在天津市第一中心医院被确诊的AD患者12例(AD组),其中男7例,女5例,平均年龄(70.0±10.5)岁;均符合美国精神障碍诊断和统计工作第四册标准(DSM-IV-R)[6],并符合美国神经病、语言沟通和卒中研究所、阿尔兹海默及相关疾病学会诊断标准(NINCDS-ADRDA)[7]。令选取认知正常的健康老年志愿者16例为对照组(NC组),其中男8例,女8例,平均年龄(66.5±6.7)岁。所有的参与者都接受了一系列神经测试和神经心理学评估,包括简易精神状态检查表(MMSE)、蒙特利尔认知评估(MOCA)和日常生活能力量表(ADL)。
二、磁共振检查方法
采用3.0T MRI扫描仪(Siemens,Magnetom Trio Tim),使用标准头线圈进行头颅扫描。对研究者进行头颅常规T1WI、T2WI、FLAIR扫描,FOV 230 mm×230 mm,矩阵320×320,层厚5.5 mm、层间距1.1 mm,1次采集,所用参数如下:T1WI参数为TR 350 ms、TE 2.5 ms;T2WI扫描参数为TR 6 000 ms、TE 93 ms;FLAIR扫描参数为TR 8 500 ms、TE 120 ms。常规MRI检查颅脑内未见明显异常后,进行DTI扫描。采用单次激发自旋回波平面回波成像(single shot spin echo echo-planar imaging,single shot SE EPI)序列,实施横断面颅脑扫描,b值分别为0、1 000、2 000 s/mm,TR 10 500 ms、TE 103 ms,FOV 230 mm×230 mm,矩阵128×128,层厚1.8 mm、层间距0 mm,扩散敏感梯度方向数为30。
三、DTI参数的测量
感兴趣区域(regions of interest, ROI)的选择:胼胝体、双侧扣带束、双侧上纵束、内囊、额叶、顶叶、颞叶、枕叶的皮层下白质。在DTI彩色图上分别在不同层面测量FA和GA的数值。手动勾画轮廓及圆形ROI,大小15~46 mm2,每个部位测量3次并取平均值,左右对称部位取平均值,见图1~8。

图1 胼胝体膝部、双侧扣带束前部FA、GA图及ROI

图2 胼胝体体部、双侧上纵束FA、GA图及ROI

图3 胼胝体压部、双侧扣带束后部FA、GA图及ROI

图4 双侧内囊前、后肢FA、GA图及ROI
图5 双侧额叶白质FA、GA图及ROI

图6 双侧颞叶白质FA、GA图及ROI
图7 双侧顶叶白质FA、GA图及ROI

图8 双侧枕叶白质FA、GA图及ROI
四、统计学分析
应用SPSS16.0统计软件进行分析:两组12个脑白质兴趣区的FA、GA参数比较采用两独立样本t检验,采用MedCalc统计软件中的ROC曲线分析DTI的FA、GA参数对脑白质损伤的诊断效率,P<0.05为差异有统计学意义。
结 果
一、AD组与NC组不同脑白质部位的FA、GA值比较
与NC组相比,AD组的扣带束后部FA、GA值下降;上纵束FA、GA值下降;顶叶白质FA、GA下降;额叶白质GA值下降;颞叶白质GA值下降;胼胝体压部GA下降,差异均有统计学意义。而2组的扣带束前部、胼胝体膝部、胼胝体体部、内囊前后肢、枕叶的FA、GA值差异无统计学意义,见表1、2。
表1 AD组与NC组的FA值比较()

表1 AD组与NC组的FA值比较()
组别 例数 胼胝体膝部 胼胝体体部 胼胝体压部 扣带束前部AD组 12 0.874±0.066 0.923±0.029 0.929±0.037 0.692±0.084 NC组 16 0.886±0.065 0.922±0.025 0.945±0.346 0.732±0.034 t值 -0.448 0.099. -1.107 -1.728 P值 0.658 0.922 0.280 0.096组别 例数 扣带束后部 上纵束 内囊前肢 内囊后肢AD组 12 0.593±0.096 0.653±0.039 0.683±0.141 0.797±0.077 NC组 16 0.675±0.106 0.694±0.064 0.688±0.068 0.806±0.066 t值 -2.112 -2.119 0.126 -0.292 P值 0.045 0.044 0.901 0.773组别 例数 额叶白质 颞叶白质 顶叶白质 枕叶白质AD组 12 0.442±0.082 0.610±0.040 0.542±0.137 0.529±0.079 NC组 16 0.472±0.073 0.645±0.067 0.671±0.099 0.522±0.078 t值 -1.012 -1.671 -2.770 -0.256 P值 0.323 0.132 0.012 0.800
表2 AD组与NC组的GA值比较()

表2 AD组与NC组的GA值比较()
组别 例数 胼胝体膝部 胼胝体体部 胼胝体压部 扣带束前部AD组 12 2.322±0.482 2.677±0.350 2.739±0.329 1.344±0.362 NC组 16 2.463±0.613 2.694±0.321 3.078±0.464 1.555±0.258 t值 -0.681 -0.126 -2.257 -1.718 P值 0.502 0.901 0.033 0.102组别 例数 扣带束后部 上纵束 内囊前肢 内囊后肢AD组 12 1.155±0.258 1.289±0.171 1.583±0.655 1.814±0.355 NC组 16 1.502±0.379 1.543±0.283 1.419±0.289 1.904±0.336 t值 -2.881 -2.942 0.892 -0.685 P值 0.008 0.007 0.381 0.500组别 例数 额叶白质 颞叶白质 顶叶白质 枕叶白质AD组 12 0.664±0.153 1.098±0.128 0.872±0.202 0.922±0.185 NC组 16 0.826±0.199 1.306±0.225 1.178±0.209 0.893±0.187 t值 -2.430 -2.858 -3.906 0.420 P值 0.022 0.008 0.001 0.678
二、ROC曲线评价FA、GA对AD患者脑白质损伤的诊断效率
对AD患者扣带束后部、上纵束、顶叶FA、GA进行ROC曲线分析,曲线下面积多数大于0.700,表明该指标对AD患者脑白质损伤的诊断有一定准确性,各部位GA值的曲线下面积比FA值大,说明GA的诊断效率大于FA,其中顶叶GA值对于AD患者脑白质损伤具有最高的诊断效率,见表3。
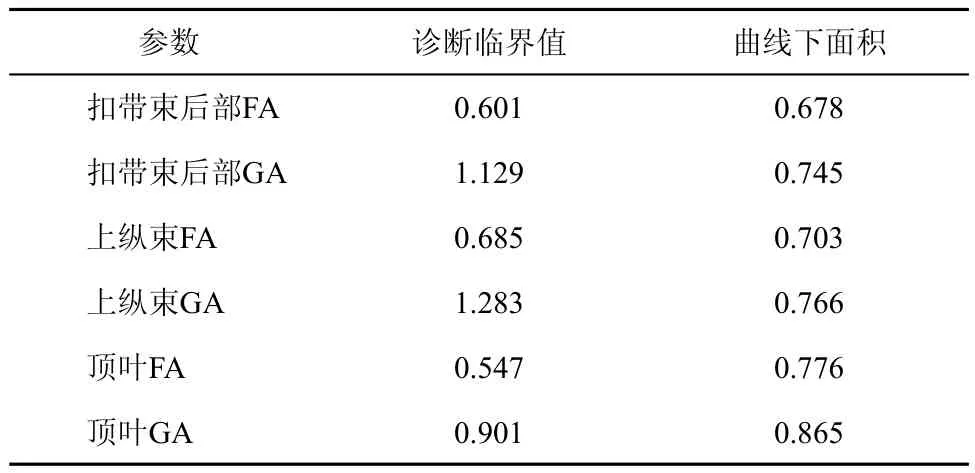
表3 各部位FA、GA值对AD患者脑白质变化的诊断效率
讨 论
有关AD早期的研究通常认为AD为皮质性痴呆,灰质有明显的病理改变[8-9]。早期微观研究阐述了AD边缘系统和新皮层大脑区域的细胞内和细胞外的特征,以及MR成像研究中AD患者的大脑灰质区域相应的体积变化[10-11]。近期的研究已经证实AD患者的脑白质存在明显的病理改变,在大脑皮层的细胞变性可能继发脑白质产生轴突丧失,因为皮质内外的投射纤维发生了退变会产生轴突损失[12],其他AD脑白质改变还包括原发性和继发性髓鞘脱失和胶质细胞增生[13]。最近一项研究同时在各种神经退行性疾病中应用体素形态学(Voxelbased morphometry,VBM)评估灰质和DTI评估白质,结果显示DTI比VBM的敏感性更好[14]。
DTI是一种很有发展的技术,尤其在评估脑白质结构的完整性方面非常有优势,其最初提出于1994年[15],分子扩散是指由这些分子所携带的热能所产生的布朗随机运动[16],扩散张量是一个三维椭球体,描述了单个体素中扩散的大小和方向。各向异性的程度可以用FA表示。FA是一个相对值,范围从在0和1之间,越接近1,说明各向异性程度越强。GA显示短程各向异性,相当于微观的各向异性,测量张量和最近同向张量之间的距离。
一些研究表明AD患者白质损伤在后部较深的部位,如上纵束和扣带束后部,不只是ROI的研究,在全脑的DTI与纤维示踪技术也发现有相同的发现[17-19]。本研究也发现AD患者扣带束后部和上纵束的FA、GA值低于正常对照组,提示此部位受损,在AD病变发展过程中,较早发生变化的部位在扣带束后部,此部位与周围环境的空间定向或记忆有关。上纵束是联络纤维中最长的纤维束,连接额叶、顶叶、枕叶、颞叶结构,将感觉、视觉、听觉、体感信息从大脑的后部传递到大脑的前部,本研究也发现上纵束FA、GA明显低于对照组,也同样发现顶叶、额叶、颞叶脑白质的完整性下降,上纵束的损伤可能是颞叶、额叶、顶叶信息传递障碍的原因,这也与AD患者记忆力、注意力、执行能力下降有关。
以往研究中应用最多的参数是FA,FA是张量本征值简单的比较,是几个方位敏感扩散测量差异的平均水平,FA的敏感性会受到AD患者病理改变进程的影响[20]。有研究发现FA的损失只发生在一个方向上排列的神经纤维束,且神经纤维交叉区域中的扩散各向异性基本没有变化[21]。本研究对AD患者扣带束后部、上纵束、顶叶的FA、GA值进行ROC曲线分析,曲线下面积多数大于0.700,说明对AD患者脑白质损伤的诊断有一定准确性,GA值曲线下面积大于FA值,表明GA比FA更能敏感地反映AD患者脑白质损伤的情况。GA是一个新的扩散张量的测量参数,2004年Fletcher首次定义了GA[22]。GA是3×3对称矩阵空间的局域距离,是测量张量到最近各向同性张量的距离。FA和GA表示本征值不同的计算方式绘制的参数图,GA是本征值指数反函数的标准偏差,能够提供白质纤维更具体的损伤程度[23]。本研究结果显示顶叶白质GA值曲线下面积最大为0.865,说明DTI检测AD患者脑白质变化,顶叶GA具有较高的诊断效率,顶叶白质损伤是AD患者病理改变比较早和比较严重的部位,顶叶白质功能是相关的感知与其他的感觉进行整合,并与言语辨认及文字记忆有密切联系,顶叶白质的损伤与AD患者认知功能下降密切相关,对于AD患者的影像学诊断具有非常重要的临床意义。
1 Bennett DA, Schneider JA, Arvanitakis Z, et al. Neuropathology of older persons without cognitive impairment from two communitybased studies[J]. Neurology, 2006,66(12):1837-1844.
2 Jack CR, Petersen RC, Xu YC, et al. Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment[J]. Neurology, 1999,52(7):1397-1403.
3 Sjöbeck M, Englund E. Glial levels determine severity of white matterdisease in Alzheimer's disease: a neuropathological study of glial changes[J]. Neuropathol Appl Neurobiol, 2003,29(2):159-169.
4 Sjöbeck M, Haglund M, Englund E. Decreasing myelin density reflected increasing white matter pathology in azheimer’s disease—a neuropathological study[J]. Int J Geriatr Psychiatry 2005 20(10):919-926.
5 Bartzokis G, Cummings JL, Sultzer D, et al. White matter structural integrity in healthy aging adults and patients with Alzheimer disease: a magnetic resonance imaging study[J]. Archives of Neurology 2003 60(3):393-398.
6 Thompson PM, Hayashi KM, Dutton RA, et al. Tracking Alzheimer's disease[J].Ann NY Acad Sci, 2007, 1097:183-214.
7 Fellgiebel A, Müller MJ, Wille P, et al. Color-coded diffusiontensor-Imaging of posterior cingulate fiber tracts in mild cognitive impairment[J].Neurobiol Aging, 2005, 26(8):1193-1198.
8 Braak E, Griffing K, Arai K, et al. Neuropathology of Alzheimer’s disease: what is new since A[J]. Eur Arch Psychiatry Clin Neurosci, 1999, 249(suppl 3):14-22.
9 Mirra SS, Heyman A, McKeel D, et al. The Consortium to Establish a Registry for Alzheimer’s Disease (CERAD). Part II. Standardization of the neuropathologic assessment of Alzheimer’s disease[J]. Neurology, 1991, 41:479-486.
10 Hauw JJ, Duyckaerts C, Delaere P, et al. Alzheimer’s disease: neuropathological and etiological data[J]. Biomed Pharmacother, 1989, 43:468-482.
11 Pearson RC, Esiri MM, Hiorns RW, et al. Anatomical correlates of the distribution of the pathological changes in the neocortex in Alzheimer’s disease[J]. Proc Natl Acad Sci USA, 1985, 82:4531-4534.
12 Lee PH, Oh SH, Bang OY, et al. Pathogenesis of deep white matter medullary infarcts: a diffusion weighted magnetic resonance imaging study[J]. J Neurol Neurosurg Psychiatry, 2005, 76:1659-1663.
13 Bucur B, Madden DJ, Spaniol J, et al. Age-related slowing of memory retrieval: contributions of perceptual speed and cerebral white matter integrity[J]. Neurobiol Aging, 2008, 29(7):1070-1079.
14 Jeurissen B, Leemans A, Tournier JD, et al. Investigating the prevalence of complex fiber configurations in white matter tissue with diffusion magnetic resonance imaging[J]. Hum Brain Mapp, 2013,34(11):2747-2766. doi: 10.1002/hbm.22099.
15 Petersen RC, Doody R, Kurz A, et al. Currentconcepts in mild cognitive impairment[J].Arch Neurol, 2001, 58(12):1985-1992.
16 Rose SE, McMahon KL, Janke AL, et al. MRI diffusion indices and neuropsychological performance in amnestic mild cognitive impairment[J]. J Neurol Neurosurg Psychiatry, 2006, 77(10):1122-1128.
17 Stěpán-Buksakowska I , Keller J , Laczó J , et al. Diffusion tensor imaging in Alzheimer disease and mild cognitive impairment[J]. Neurol Neurochir Pol, 2012, 46(5):464-471.
18 Wegrzyn M , Teipel SJ , Oltmann I , et al. Structural and functional cortical disconnection in Alzheimer's disease: a combined study using diffusion tensor imaging and transcranial magnetic stimulation[J]. Psychiatry Res, 2013, 212(3):192-200. doi: 10.1016/ j.pscychresns.2012.04.008.
19 孟京志, 皇丽丽, 郭李炜, 等.阿尔茨海默病患者联络纤维的DTI诊断价值[J].临床放射学杂志, 2012, (2):158-162.
20 Henley SM , Downey LE , Nicholas JM , et al. Degradation of cognitive timing mechanisms in behavioural variant frontotemporal dementia[J]. Neuropsychologia 2014, 65:88-101. doi: 10.1016/ j.neuropsychologia.2014.10.009.
21 Lim JS, Park YH, Jang JW, et al. Differential white matter connectivity in early mild cognitive impairment according to CSF biomarkers[J]. PloS one, 2014, 9(3):e91400. doi: 10.1371/journal.pone.0091400.
22 Fletcher PT, Joshi S. Principal geodesic analysis on symmetric spaces: statistics of diffusion tensors[J].Proceedings of ECCV 200 Workshop on Computer Vision Approaches to Medical Image Analysis (CVAMIA)LNCS, 2004, 3117:87-98.
23 Corouge I, Fletcher PT, Joshi S, et al. Fiber tract-oriented statistics for quantitative diffusion tensor MRI analysis[J].Med Image Anal, 2006, 10(5):786-798.
24 Nir TM, Jahanshad N, Villalon-Reina JE, et al. Thompson PM. Effectiveness of regional DTI measures in distinguishing Alzheimer’s disease, MCI, and normal aging[J]. Neuroimage Clin, 2013, 3:180-195. doi: 10.1016/j.nicl.2013.07.006.
Diffusion tensor imaging detection of white matter changes in Alzheimer's disease
Ren Jinyao1, Long Miaomiao1, Qi Ji2, Ni Hongyan2.1Tianjin Medical College,Tianjin 300222,China; Department of Radiology, Tianjin First Central Hospital, Tianjin 300192, China.
Email:nihyan@sina.com
Objective:To evaluate the changes of white matter in Alzheimer's disease(AD) patients by Magnetic resonance diffusion tensor imaging (DTI) and to analyze the diagnostic value of Fractional anisotropy (FA) and Geodesic anisotropy (GA) in detecting white matter abnormalities in AD patients.Methods:MRI routine scan and DTI were performed in 12 AD patients who were diagnosed from August 2014 to August 2015. 16 cognitively normal (NC) healthy elderly volunteers were enrolled, as control group, to this study. The FA and GA of superior longitudinal fasciculus, Cingulate, corpus callosum, internal capsule, frontal lobe, parietal lobe, temporal lobe and occipital lobe white matter were measured. The ROC curve was applied to analyze Fractional anisotropy (FA) and Geodesic anisotropy (GA) parameters to determine the diagnostic value in detecting white matter abnormalities in patients with AD.Results:Compared to the control group, the FA and GA values in the posterior cingulate were decreased, the FA and GA values of the superior longitudinal fasciculus were decreased, the FA and GA of the white matter in the parietal lobe were decreased, the GA value of the white matter in the frontal lobe was decreased, the GA value of the white matter in temporal lobe was decreased and the GA value of the splenium of corpus callosum was decreased. The differences were statistically significant. The area under the ROC curve was more than 0.700, which was larger than that of FA.Conclusion:AD patients usuaug show selective and regional damage in the posterior cingulated and the damage in superior longitudinal fasciculus, splenium of corpus callosum,frontal lobe, temporal lobe, parietal cortex and subcortical white matter lesions. The diagnostic value of GA in detection of white matter abnormalities in patients with AD was superior to FA.
Magnetic resonance Imaging; Diffusion tensor imaging; Alzheimer’s disease; White matter
2017-06-01)
(本文编辑:闫娟)
10.3877/cma.j.issn.2095-5782.2017.03.016
300222 天津医学高等专科学校1; 300192 天津市第一中心医院放射科2
倪红艳,Email:nihyan@sina.com
任津瑶,龙淼淼,祁吉,等. DTI检测阿尔茨海默病脑白质的改变[J/CD].中华介入放射学电子杂志,2017,5(3):189-193.
