纳米TiO2-SiO2复合材料作为锂离子负极材料的方法研究*
2017-08-09陈佳慧刘力宁
陈佳慧,刘力宁,王 珅,于 杰,韩 松
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
试验与研究Test and Research
纳米TiO2-SiO2复合材料作为锂离子负极材料的方法研究*
陈佳慧1,刘力宁,王 珅,于 杰,韩 松**
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
分别利用水解法及醇解法制备不同添加比例的TiO2-SiO2纳米复合材料,并对制得的复合材料进行金属掺杂,得到一种高效纳米复合材料的制备方法。通过X射线衍射(XRD)、比表面积(BET)及孔径分布分析对制得的纳米TiO2-SiO2复合材料的微观结构进行了表征。结果表明,所制备的复合材料为锐钛矿二氧化钛结构,并可能生成二氧化硅嵌在二氧化钛的晶格中,材料比表面积高达387.9634m2/g,孔隙分布适度。该纳米TiO2-SiO2复合材料具有良好的比容量,水解法表现出更优的充放电性能,其中水解法制备的硅钛物质的量比为1∶1的样品首次放电比容量达987.4mAh/g,100次循环后容量保持在76.1mAh/g。
锂电池;纳米TiO2-SiO2复合材料;水解法;醇解法;金属Ni掺杂
引言
可持续发展是中国人提出的发展目标,人类社会要实现可持续发展就必须解决能源问题和保护自然环境,人们不断地寻找和发展新材料和新能源,带动了整个电池界的发展,也就是利用各类金属来制作好的电池[1]。电池中最热门的金属就应该是锂金属,锂金属最轻,而且非常活泼,保存需要在石蜡中,并且具有最负的标准电极电位(-3.0853Vvs.SHE)。首个锂离子电池诞生于20世纪70年代,M.S.Whittingham利用金属锂作为负极材料,硫化钛作为正极材料,成功研制出了锂离子电池[2]。1982年,Illinois Institute of Technology的R.R.Agarwal和J.R.Selman通过实验,发现在锂电池充放电过程中,锂离子可以快速并且可逆地镶嵌入石墨层中,大大提高锂离子电池的安全性。从此,人们利用这个特性,开始了充电电池的研发[3]。锂电池具有高能量、高电压、自放电量少、可以长期储存、也可以进行充电等特点[4]。但其也有一些问题,就是它的能够循环的能力不是很好尤其是在充电和放电过程中,容易形成锂枝晶,如果通过了隔膜纸,枝晶就会接触到阴极材料从而导致电池的短路[5]。
锂离子电池又称为摇椅电池,它主要由负极壳、负极材料、电解液、隔膜、正极材料和垫片等填充物组成。正极通常为可容纳和镶嵌锂离子的具有层状结构的过渡金属氧化物组成,如LiFePO4、LiCoO2等,并且工作电压在3.5V左右,负极则为石墨等电位在1.5V左右的碳材料。电解液通常为有机电解液,其中LiPF6、碳酸丙烯酯(PC)、二甲醚(DEM)、碳酸乙烯酯(EC)比较常用。隔膜的主要作用是防止电池内部短路,并且可以让电解质自由穿过,来保证锂离子可以传输顺畅。它通常是由聚丙烯(PP)和聚乙烯(PE)组成,特别是PP/PE/PP三层隔膜结构最为常用[6]。
在锂离子电池负极材料中,石墨仍旧是最常用的材料。但是由于石墨的安全性、倍率放电等方面依然存在问题,随着现在锂离子电池市场的扩大,石墨负极已经不能很好地满足人们的需求[7]。人们将研究和开发的重点转向了具有高容量、高安全性能和高稳定性的过渡金属氧化物,来弥补石墨负极的缺陷与不足。
二氧化钛由于无毒无害、成本低廉等特点,未来有望取代石墨作为锂离子电池的负极材料。二氧化钛在充放电过程中,由于其开放的晶体结构,可以为锂离子提供空位[8,9]。与一般的负极材料相比,TiO2作为负极材料在固体与电解质界面形成SEI[10~12],且纳米二氧化钛具有高的比表面积,可嵌入锂的量大大增加。同时工作电压为1.75V,高于石墨,可避免锂离子电池在充放电过程中产生枝晶,解决了锂离子电池使用过程中的安全隐患。二氧化钛结构稳定,很难在循环过程中产生结构崩塌、体积膨胀等现象,延长了电池的使用寿命。因此,二氧化钛是碳基负极材料理想的替代品[13~15]。
本文采用水解法及醇解法合成了一系列纳米二氧化钛前驱体,并对其进行金属镍的掺杂,来了解不同形貌、结构的纳米二氧化钛的电化学性能。
1 材料与方法
1.1 水解法制备TiO2-SiO2纳米复合材料
室温下,向烧杯A、B中加入0.16mol醋酸,各放入一洁净的转子,将烧杯置于磁力搅拌器上,打开磁力搅拌器,适当提高转速。然后向各烧杯中逐滴加入0.04mol钛酸四丁酯,溶液变为淡黄色液体。继续在搅拌的条件下,向各烧杯中逐滴加入准确称量的正硅酸乙酯,使各个烧杯中正硅酸乙酯与钛酸四丁酯的物质的量比分别为 0.5、1。继续搅拌30min。向各个烧杯中逐滴加入去离子水,滴加速度控制在大约12滴/min。直到溶液变得稍许黏稠,停止滴加去离子水,继续搅拌30min。然后将溶液转移到高压反应釜中,在140℃下反应12h。12h后,将样品从高压反应釜转移到离心管中,加入约2/3的无水乙醇,在离心机中洗涤5min,共洗涤3次。然后将离心管内无水乙醇小心倒掉,将离心管开口放置于烘箱中,60℃烘干,研磨成粉末,即得所需的TiO2-SiO2复合催化剂。
1.2 醇解法制备TiO2-SiO2纳米复合材料
实验步骤与条件和水解组总体相同。只是将水解组的去离子水,换成无水乙醇。
1.3 纳米TiO2-SiO2复合材料与金属的掺杂
室温下,向烧杯中加入0.16mol醋酸,放入一洁净的转子,将烧杯置于磁力搅拌器上,打开磁力搅拌器,适当提高转速。然后向烧杯中逐滴加入0.04mol钛酸四丁酯,溶液变为淡黄色液体。然后继续在搅拌的条件下,向烧杯中逐滴加入准确称量的正硅酸乙酯。使各个烧杯中,正硅酸乙酯和钛酸四丁酯的物质的量之比为1∶1。
向含100mL无水乙醇的烧杯中加入适量硝酸镍,使得镍元素的质量为1g。将该无水乙醇混合溶液逐滴加入到正硅酸乙酯和钛酸四丁酯的混合溶液中。控制滴加速度约为30滴/min。滴加完毕后继续搅拌30min。然后将溶液转移到高压反应釜中,在140℃下反应12h。12h后,将样品从高压反应釜转移到离心管中,加入约2/3的无水乙醇,在离心机中洗涤5min,共洗涤3次。然后小心倒掉离心管内无水乙醇,将离心管口打开并放置于烘箱中,在60℃条件下烘干。研磨成粉末,即得金属镍掺杂的TiO2-SiO2纳米复合材料。
1.4 TiO2-SiO2纳米复合材料作为锂电池负极材料的表征
1.4.1 X射线衍射
本实验采用日本理学D/Max-r B型X-射线衍射仪对所制备的TiO2纳米粒子进行了结构分析。测试条件为∶Cu靶Kα射线,λ为0.15406nm,加速电压和应用电流分别为45kV和40mA。
1.4.2 比表面积测试
本实验采用Micromeritics公司的ASAP2020型比表面积分析仪,对合成样品的比表面积、孔径大小和分布等情况进行了测试分析[16]。采用氮气吸附脱附法[17],升温速率为10℃/min,脱气时温度保持在150℃,样品取样量为150mg。
1.5 材料电化学性能测试
1.5.1 电极制备及电池组装
将产物、石墨、PVDF按80∶10∶10的质量比混合均匀,在研钵中进行充分研磨,直至研磨均匀并且无颗粒,之后均匀涂覆在铜箔上。将涂覆好的铜箔放入恒温干燥箱中并在80℃真空条件下烘干8h后取出,用厚度为10mm的电动对辊机进行对辊。将对辊好的铜箔用切片机切成电极片待用。
将纯锂片、电解液、隔膜纸、负极片、垫片按顺序组装好,用电池压片机进行封口。其中电解液为EC/EMC/DEC电解液,比例为4∶3∶3。隔膜为PE膜。锂电池的组装均在氩气气氛的手套箱中进行,水氧值均低于0.1ppm。
1.5.2 充放电循环测试
充放电循环测试是测量锂离子电池电化学性能的重要手段。本实验先采用预先设定好的恒定的电流放电,直至放电截止电压后,再进行横流充电,达到截止电压后一个循环结束。在多次循环后,系统根据输入的活性物质质量,可以计算出电池的比容量、比能量、充放电平台电压、充放电效率等数据,用以分析材料的电化学行为。通过充放电测试还可以分析出电池内部在循环过程中发生的反应和变化。本实验采用武汉蓝电有限责任公司自主研发的电池充放电循环系统,设定的恒流充放电电流大小为1C,充放电截止电压分别为0V和3V。
2 结果与讨论
2.1 纳米TiO2-SiO2复合材料的微观结构
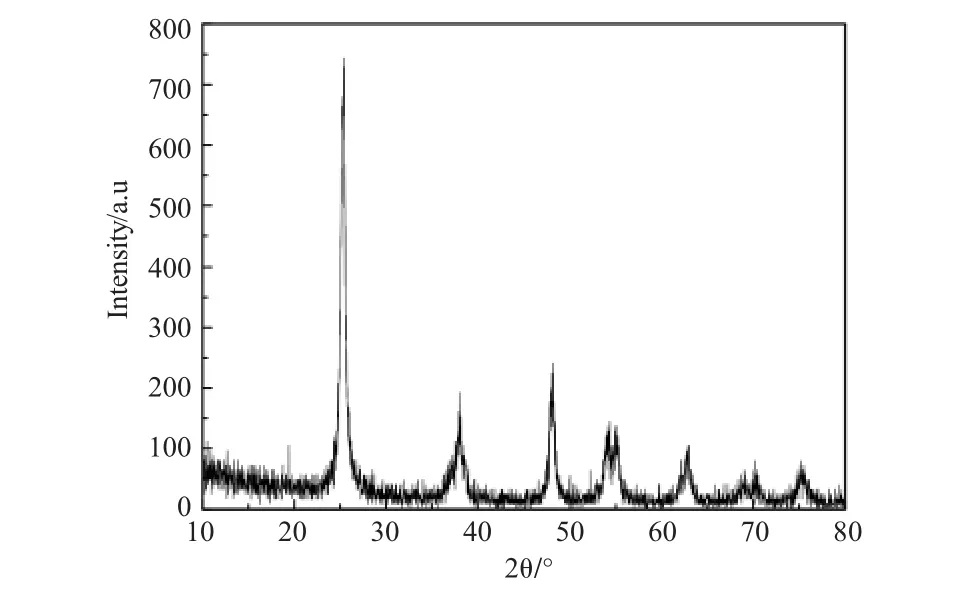
图1 醇解法制备硅钛物质的量比为0.5∶1的纳米复合材料的XRD图谱Fig.1 The XRD pattern of nanocomposites produced by alcoholysis method with a molar ratio of silicon to titanium of 0.5∶1
图1为TiO2-SiO2醇解0.5∶1制得的复合纳米材料的XRD图形拟合谱。从图可以看出,在2θ值为25.38°(d=3.5173)、38.041°(d=2.3631)、48.13°(d= 1.8901)、54.329°(d=1.6876)、62.84°(d=1.4776)时有衍射峰出现,对应于锐钛矿二氧化钛(空间群:I41amd(141),α=3.785Å,c=9.514Å,JCPDS No.65-5714),对应的晶面分别为(101)、(004)、(200)、(105)、(204)。但锐钛矿二氧化钛(JCPDSNo.65-5714)的标准衍射角为25.30°(d=3.5169)、37.79°(d=3.5169)、48.04°(d=3.5169)、53.88°(d=3.5169)、62.683°(d= 3.54809),从标准锐钛矿二氧化钛和样品的数据对比可看出,衍射角及层间距均有微小偏差,分析原因可能由于有少量二氧化硅生成掺杂嵌在二氧化钛晶格之中导致。

图2 醇解法制备硅钛物质的量比为1∶1的纳米复合材料的XRD图谱Fig.2 The XRD pattern of nanocomposites produced by alcoholysis method with a molar ratio of silicon to titanium of 1∶1
图2为TiO2-SiO2醇解1∶1制得的复合纳米材料的XRD图形拟合谱。从图可以看出,在2θ值为25.36°(d=3.5092),38.04°(d=2.3648),48.12°(d=1.8893),54.06°(1.6940)、62.98°(d=1.4747)时有衍射峰出现,对应于锐钛矿二氧化钛(空间群:I41amd(141), α=3.785Å,c=9.514Å,JCPDS No.65-5714),对应的晶面分别为(101)、(004)、(200)、(105)、(204)。但锐钛矿二氧化钛(JCPDS No.65-5714)的标准衍射角为 25.30°(d=3.5169)、37.79°(d=2.3785)、48.04°(d=1.8925)、53.884°(d=1.7001)、62.683°(d=1.4809),从标准锐钛矿二氧化钛和样品的衍射角及层间距对比可看出,样品的层间距比标准锐钛矿二氧化钛的层间距略小,原因可能由于有少量二氧化硅生成,并掺杂嵌在二氧化钛的晶格之中导致。

图3 水解法制备硅钛物质的量比为1∶1的纳米复合材料的XRD图谱Fig.3 The XRD pattern of nanocomposites produced by hydrolysis method with a molar ratio of silicon to titanium of 1∶1
图3为TiO2-SiO2水解1∶1制得的复合纳米材料的XRD图形拟合谱。从图可以看出,在2θ值为25.22°(d=3.5282),37.9°(d=2.3717),48.06°(d=1.8916),54.16°(d=1.6891)、62.72°(d=1.4793)时有衍射峰出现,对应于锐钛矿二氧化钛(空间群:I41amd(141),α=3.785Å,c=9.514Å,JCPDS No.65-5714),对应的晶面分别为(101)、(004)、(200)、(105)、(204)。但锐钛矿二氧化钛(JCPDS No.65-5714)的标准衍射角为25.30°(d=3.5169)、37.79°(d=2.3785)、48.04°(d=1.8925)、53.884°(d=1.7001)、62.683°(d=1.4809),从标准锐钛矿二氧化钛和样品的数据对比可看出,两者的衍射角及层间距存在微小偏差,可能是由于有少量二氧化硅生成嵌在二氧化钛晶格之中从而使层间距增大导致。

图4 水解条件下纳米TiO2-SiO2复合材料比表面积与孔隙分布Fig.4 The specific surface area and pore distribution of TiO2-SiO2nanocomposites produced by hydrolysis method
图4为TiO2-SiO2水解制得的复合纳米材料的氮吸附曲线及孔径分布曲线。通过多点BET法利用相对压力为0.05~0.20所对应的氮吸附数据可以计算出其比表面积为240.9349m2/g。据以往报道,纯TiO2的比表面积为71.824m2/g。由孔径分布曲线可以看出水解制得的复合纳米材料的孔径主要集中在10~20nm。所以,水解制备的TiO2-SiO2复合纳米材料是一种比表面积较大的多孔材料。

图5 醇解条件下纳米TiO2-SiO2复合纳米材料比表面积与孔隙分布Fig.5 The specific surface area and pore distribution of TiO2-SiO2nanocomposites produced by alcoholysis method
图5为TiO2-SiO2醇解制得的复合纳米材料的氮吸附曲线及孔径分布曲线。通过多点BET法利用相对压力为0.05~0.20所对应的氮吸附数据可以计算出其比表面积为387.9634m2/g,远远大于水解制备的TiO2-SiO2复合纳米材料的比表面积,根据目前的报道,本次醇解制备的TiO2-SiO2复合纳米材料的比表面积前所未有。由孔径分布曲线可以看出醇解制得的复合纳米材料的孔径主要集中在4.5~5.5nm。故醇解制备的TiO2-SiO2复合纳米材料是一种比表面积极大的多孔材料,这在电极材料方面也是一个突破。
2.2 纳米TiO2-SiO2复合材料作为锂电池负极材料的电化学性能
Li+离子嵌入二氧化钛的电化学反应过程可以表示为:

当x=1时,计算出的相应的嵌锂比容量为335mAh/g,这就是二氧化钛的理论嵌锂容量,x则称为嵌锂系数[15]。

图6 醇解条件制备比例为0.5∶1的纳米复合材料充放电曲线及循环性能曲线Fig.6 The charging and discharging curve and cycle performance curve of nanocomposites produced by alcoholysis method with a molar ratio of silicon to titanium of 0.5:1
图6为醇解法制备硅钛物质的量比例为0.5∶1的纳米复合材料在常温下0~3.0V电压区间的前4次充放电曲线和循环性能曲线。由放电曲线观察到,在恒流充放电流为100μA的条件下,样品的首次放电容量达到626.9mAh/g,相当于嵌锂系数1.87,首次充电容量达到122.3mAh/g,显示了较高的储锂容量,但是电极材料还是有大部分的不可逆容量。从1.5V左右到0.5V之间电压缓慢下降,首次放电时放电平台在0.54V附近,这个是形成不可逆的LixTiO2的过程。
随着充放电次数增加,如图6所示,第10次放电容量达到 55.4mAh/g,第 50次放电容量在37.7mAh/g,100次循环后容量仍保持在35.5mAh/g,样品电化学性能曲线充放电平台斜度略大,但曲线分散比较集中,所以样品的循环稳定性能较好。
图7为醇解法制备硅钛物质的量比例为1∶1的纳米复合材料在常温下0~3.0V电压区间的前4次充放电曲线和循环性能曲线。由图可知样品在恒流充放电流为100μA的条件下,首次放电比容量为558.2mAh/g,相当于嵌锂系数1.67,首次充电比容量为125.9mAh/g,充放电效率为23%,首次充放电的不可逆损失比较大,高达432.3mAh/g。首次放电过程中在0.75V附近有一段很短的放电平台,而在1.5V附近有较为明显的倾斜平台出现,而首次充电曲线中没有出现明显的充电电压平台,仅在1.9V左右有一倾斜平台。分析有可能是因为二氧化钛的导电性能较差,导致部分嵌入的Li+离子不能可逆脱出[18~20]。
从材料的循环性能曲线可以看出,经过10次循环后放电比容量为72.8mAh/g,50次循环后放电比容量为49.9mAh/g,100次循环以后放电比容量仍保持在49.6mAh/g。

图7 醇解条件制备比例为1∶1的纳米复合材料充放电曲线及循环性能曲线Fig.7 The charging and discharging curve and cycle performance curve of nanocomposites produced by alcoholysis method with a molar ratio of silicon to titanium of 1∶1
图8是水解条件制备比例为1∶1的纳米复合材料的前4个充放电循环曲线及循环性能曲线。恒流充放电流为100μA,由图可知样品具有非常高的首次放电比容量(987.4mAh/g),首次充电比容量为288.9mAh/g,是二氧化钛的理论容量335mAh/g(LiTiO2)的2.95倍。首次库伦效率为30%,也说明首次不可逆容量损失较大。这是由于锂离子嵌入TiO2晶体后形成不可逆的LixTiO2。在首次放电过程中可以看到在电压0.7V附近有一个非常明显的充放电平台,在1.5V左右也出现了一个倾斜平台。随着充放电次数的增加,第10次放电容量达到120.7mAh/g,第50次放电容量为82.1mAh/g,100次循环后容量仍保持在76.1mAh/g,样品电化学性能曲线充放电平台斜度略大,但容量保持率很低。

图8 水解条件制备比例为1∶1的纳米复合材料充放电曲线及循环性能曲线Fig.8 The charging and discharging curve and cycle performance curve of nanocomposites produced by hydrolysis method with a molar ratio of silicon to titanium of 1∶1
图9为醇解条件制备比例为1∶1且掺杂金属Ni的纳米复合材料的前四次充放电循环曲线及循环性能曲线。由图可以看出样品在恒流充放电流为100μA的条件下,首次放电比容量为808.7mAh/g,相当于嵌锂系数2.41,首次充电比容量为93.5mAh/g,首次充放电的不可逆损失非常大,但跟未掺金属Ni的醇解法制备的硅钛比为1∶1的样品相比,首次放电的比容量增加了45%,有效提高了电子的导电能力。首次放电过程中在0.75V附近有很短一段放电平台,而首次充电曲线中没有明显的充电电压平台出现。而从材料的循环性能曲线可以看出,经过10次循环后放电比容量为86.7mAh/g,50次循环后放电比容量为82.6mAh/g,100次循环以后放电比容量仍保持在68.6mAh/g。


图9 醇解条件制备比例为1∶1且掺杂金属Ni的纳米复合材料充放电曲线及循环性能曲线Fig.9 The charging and discharging curve and cycle performance curve of Ni-doped nanocomposites produced by alcoholysis method with a molar ratio of silicon to titanium of 1∶1
3 结论
分别利用水解法和醇解法合成了不同比例的纳米TiO2-SiO2复合材料,并对其进行金属Ni的掺杂,将其作为锂离子负极材料合成锂电池进行电化学性能测试。通过X射线衍射全谱拟合技术研究了该材料的微结构,XRD结果显示样品为锐钛矿二氧化钛结构,但将样品与标准锐钛矿二氧化钛的XRD数据作对比显示层间距及衍射角均有微小偏差,分析原因有可能是由于在二氧化钛的晶格间掺杂嵌入了少量生成的二氧化硅而导致的。在进行BET比表面积及孔径分布的分析中可以看出,醇解法制得的样品孔隙要比水解法制得的小,孔隙直径多分布在4.5~5.5nm,比表面积更是高达387.9634m2/g。可以推断醇解法制得的样品晶体排布更加致密,纳米级数更小。这与醇解制备过程中,反应过程温和、反应速率较慢的现象相吻合。同时,水解法制得的产品孔隙直径多分布在10~20nm,比表面积虽然不及醇解制得的样品大,但是仍然达到了240.9349m2/g。电化学性能测试表明该纳米TiO2-SiO2复合材料具有良好的比容量,在0~3V电压范围内,恒流充放电流为100μA的条件下,醇解法制备的正硅酸乙酯与钛酸四丁酯的物质的量比为0.5∶1的样品初始放电比容量达626.9mAh/g,相当于嵌锂系数1.87,100次循环后容量保持在35.5mAh/g。醇解法制备的正硅酸乙酯与钛酸四丁酯的物质的量比为1∶1的样品初始放电比容量达558.2mAh/g,相当于嵌锂系数1.67,100次循环后容量保持在49.6mAh/g。醇解法制备的掺杂了金属Ni且正硅酸乙酯与钛酸四丁酯的物质的量比为1∶1的样品初始放电比容量达808.7mAh/g,相当于嵌锂系数2.41,100次循环后容量保持在68.6mAh/g,证明掺杂了金属Ni能有效提高材料的电子的导电能力。水解法制备的正硅酸乙酯与钛酸四丁酯的物质的量比为1∶1的样品初始放电比容量达 987.4mAh/g,相当于嵌锂系数2.95,100次循环后容量保持在76.1mAh/g。分析不可逆容量可能是由于形成不可逆的LixTiO2的过程,而不可逆容量的损失一部分应该来自于锂离子进入到材料中的一些非活性位点,使插入的锂不能脱出,变成了所谓的“死锂”。
[1] 徐永刚.LiFePO_4/C纳米复合正极材料的制备与结构及电化学行为[D].上海:华东理工大学,2011.
[2] WHITTINGHAM M S.Intercalation chemistry and energy storage[J].Science,1976,192(4244):1126~1127.
[3] THACKERAY M M.Lithium insertion into manganese spinels[J].Materials Research Bulletin,1983,18(4):461~472.
[4] 窦清山.几种锂电池正极材料的发展与比较[J].新疆有色金属, 2010,33(S1):111~112.
[5] JEONG G.Prospective materials and applications for Li secondary batteries[J].Energy&Environmental Science,2011,4(6):1986~2002.
[6] WHITTINGHAM M S.Lithium batteries and cathode materials[J].ChemInform,2004,35(50):4271~4301.
[7] POP N.In Situ Investigation of the Electrochemical Reduction of Carbonate Electrolyte Solutions at Graphite Electrodes[J].Journal of the Electrochemical Society,1998,145(4):1081~1087.
[8] MASAHIRO MIYAUCHI.Photoinduced Surface Reactions on TiO2and SrTiO3Films:Photocatalytic Oxidation and Photoinduced Hydrophilicity[J].Chemistry of Materials,2000,12(1):3~5.
[9] GAO Y,A YOSHITAKE MASUDA,K KOUMOTO.Light-Excited Superhydrophilicity of Amorphous TiO2Thin Films Deposited in an Aqueous Peroxotitanate Solution[J].Langmuir,2004,20(8): 3188~3194.
[10] YANG Z.Nanostructures and lithium electrochemical reactivity of lithium titanites and titanium oxides:A review[J].Journal of Power Sources,2009,192(2):588~598.
[11] SHEN L.In situ synthesis of high-loading Li4Ti5O12-graphene hybrid nanostructures for high rate lithium ion batteries[J]. Nanoscale,2011,3(2):572~574.
[12] MORIGUCHI I.A Mesoporous Nanocomposite of TiO2and Carbon Nanotubes as a High-Rate Li-Intercalation Electrode Material[J].Advanced Materials,2006,18(1):69~73.
[13] REDDY M A.Room temperature synthesis and Li insertion into nanocrystalline rutile TiO2.Electrochemistry Communications, 2006,8(8):1299~1303.
[14] BAUDRIN E.Structural evolution during the reaction of Li with nano-sized rutile type TiO2at room temperature[J].Electrochemistry Communications,2007,9(2):337~342.
[15] JIANG C.Nanocrystalline rutile TiO2electrode for high-capacity and high-rate lithium storage[J].Electrochemical and Solid-State Letters,2007,10(5):A127~A129.
[16] WON R.Methods and compositions for topical delivery of retinoic acid:US,08079220[P].1999-09-21.
[17] 林萍.纳米二氧化钛制备方法研究、性能研究及其应用[D].上海:东华大学,2011,.
[18] 李翔.纳米结构TiO2的制备及其在锂电池上的应用[D].武汉:武汉工程大学,2013.
[19] ARMSTRONGAR.TiO2B nanowires as negative electrodes for rechargeable lithium batteries[J].Journal of Power Sources,2005, 146(1):501~506.
[20] PERAMUNAGE D.Preparation of Micron-Sized Li4Ti5O12and Its Electrochemistry in Polyacrylonitrile Electrolyte-Based Lithium Cells[J].Journal of the Electrochemical Society,1998,145(8): 2609~2615.
The Research on the Methods of TiO2-SiO2Nanocomposites as Lithium Ion Anode Materials
CHEN Jia-hui,LIU Li-ning,WANG Shen,YU Jie and HAN Song
(College of Forestry,Northeast Forestry University,Harbin 150040,China)
The method of hydrolysis and alcoholysis is applied to make TiO2-SiO2nanocomposites with different adding proportion,and then the obtained nanocomposites are doped with metal;at last a preparation method for preparing high-effective nanocomposites is got.The microstructure of TiO2-SiO2nanocomposites are characterized by X-ray diffraction(XRD),specific surface area(BET)and bore diameter analysis.The results show that the nanocomposites have the structure same as anatase titanium dioxide,and have the possibility to produce silicon dioxide embeds in titanium dioxide’s crystal lattice.The specific surface area of the nanocomposite is 387.9634m2/g,the pore distribution is uniform.This TiO2-SiO2nanocomposite has a good specific capacity,and shows a better charge-discharge property when it is produced by hydrolysis method.The specific discharge capacity of the sample made by hydrolysis method with a molar ratio of titanium to silicon of 1:1 will reach 987.4mAh/g,and after 100 times of cycle it is 76.1mAh/g.
Lithium-ion batteries;TiO2-SiO2nanocomposites;hydrolysis;alcoholysis;Ni doping
TB332;TM919
A
1001-0017(2017)03-0157-07
2017-02-10 *基金项目:国家自然科学基金面上项目(编号:21176047)
陈佳慧(1991-),女,黑龙江哈尔滨人,在读硕士研究生,主要从事新能源材料方面的研究。
**通讯联系人:韩松,教授,博士,研究方向:光催化纳米材料,E-mail:songh77@126.com
