新疆棉花品种次生代谢酶活性与诱导抗蚜性的关系
2017-08-09王惠卿陈刘生王佩玲
芦 屹, 王惠卿, 陈刘生, 王佩玲*, 李 晶*
(1. 石河子大学农学院植物保护系, 石河子 832003; 2. 新疆维吾尔自治区植物保护站, 乌鲁木齐 830006)
新疆棉花品种次生代谢酶活性与诱导抗蚜性的关系
芦 屹1,2, 王惠卿2, 陈刘生1, 王佩玲1*, 李 晶2*
(1. 石河子大学农学院植物保护系, 石河子 832003; 2. 新疆维吾尔自治区植物保护站, 乌鲁木齐 830006)
为了明确不同棉花品种次生代谢酶活性与诱导抗蚜性的关系,研究了不同类型棉花品种在棉蚜为害胁迫下,苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)活性的变化及其对抗蚜性的影响。结果表明,未受蚜害时不同品种同一酶活性存在显著差异;受蚜害诱导后,抗蚜品种和感蚜品种3种酶活性均有不同程度的上升,抗蚜品种酶活性显著高于感蚜品种,诱导抗蚜性的强弱在不同品种间差异显著。
棉花; 苯丙氨酸解氨酶; 过氧化物酶; 多酚氧化酶; 棉蚜; 诱导抗蚜性
棉蚜AphisgossypiiGlover属半翅目蚜科,是世界性棉花害虫,也是我国长江、黄河流域和西北内陆棉区的重大害虫之一。20世纪80年代中期以来,棉蚜已成为新疆棉区的主要防治对象。1985年棉蚜在吐鲁番地区暴发成灾,继而在全疆各棉区普遍发生,危害严重[1-2]。由于新疆生长季节干旱,又无明显的雨季,对害虫的发生极为有利,棉蚜发生的范围之广,数量之多,危害期之长和损失之重都占全国首位[3]。长期以来,新疆棉蚜防治主要依赖化学药剂,包括药剂拌种、涂茎、毒土熏蒸、化学挑治等技术措施,但棉蚜危害并未得到有效遏制[4]。培育和利用抗蚜品种是棉蚜综合治理的重要措施之一,研究棉花抗蚜性机制,对今后在生理生化或分子水平抗性品种选育、揭示品种抗虫性的本质方面具有重要意义。
次生代谢(secondary metabolism)是指生物合成生命非必需物质并储存次生代谢产物(又称为“天然产物”)的过程[5-9]。植物在长期进化过程中,依靠次生代谢合成抗虫活性物质,从而具备了对害虫不同程度的抗性,达到控制害虫种群数量、交配行为和地理分布的效果,减轻了虫害[6]。当植物受到侵害时,植物细胞中控制物质代谢的酶首先做出反应[10-12],尤其是一些次生代谢物质形成过程中的关键酶类会很快执行保护性反应。许多研究认为,植物体内保护酶系统(PAL、POD、PPO)在植物抗病虫中有重要意义,与植物的抗病虫能力有着密切关系[11,13]。对昆虫取食引起植物保护酶变化的研究表明,植物对害虫的应激反应还表现在保护酶活力的增强。从棉花对害虫的诱导防御反应过程来分析,次生抗虫物质形成积累前后,必然会发生次生物质合成基因表达及与次生代谢相关酶活性的变化。新疆气候条件、栽培措施特殊,关于本地棉花品种次生代谢酶活性变化与抗蚜性关系的研究尚不多见。本研究选取新疆棉区主栽的9个不同抗(感)蚜棉花品种,通过对棉蚜为害引起的3种次生代谢相关酶活性变化进行测定分析,以期为新疆棉花诱导抗蚜机制研究提供试验数据和依据,为抗蚜育种工作和实现棉蚜的持续控制提供参考。
1 材料与方法
1.1 供试棉花品种及虫源
供试棉花品种9个:其中感虫品种‘中棉所35’、高抗品种‘新海21号’由塔里木大学植物保护教研室提供,中抗品种‘新陆早12号’、‘新陆早24号’、‘标杂A1’、‘新炮台1号’、‘新陆早13号’、抗蚜品种‘新杂棉2号’、感蚜品种‘81-3’由石河子大学作物育种教研室提供[14-15]。棉花品种的抗蚜性鉴定来自笔者前期试验结果,棉蚜采自农学院实验站春季田间自然虫源。
1.2 方法
1.2.1 田间试验设计
试验于2007年在石河子大学农学院实验站9号网室中进行。试验网室用80目筛网笼罩,设置处理和对照各1个小区,处理与对照之间用80目筛网隔开。品种随机排列,每品种分别种植于处理及对照小区内,每小区2行。每4行为一组覆膜,膜宽140 cm,实行宽窄行种植,行距为30-50-30 cm、株距10 cm,处理及对照各品种3次重复,网室总面积48 m2。4月23日铺膜点播,播种时棉种不作任何药剂处理,整个生育期内不喷施任何杀虫剂,滴灌方式,管理措施与一般大田相同。处理:6月20日棉花现蕾期模拟大田棉蚜发生量在各棉花品种上接入棉蚜(每株3~4头),接种方式为搭叶接混合蚜[16];对照:各棉花品种整个生育期未受蚜害。试验过程中及时观测各处理蚜虫发生情况,在未接蚜虫前,如发现蚜虫及时清除。
1.2.2 样品采集
在棉花现蕾期(7月3日),分别采集处理和对照中各品种棉株倒3叶叶片,以液氮浸泡后,放入-70℃超低温冰箱中保存备用。
1.2.3 棉花次生代谢酶活性测定方法
苯丙氨酸解氨酶(PAL)活性测定参照薛应龙的方法[17]。取处理叶片0.3 g,加入0.05 g PVP,再加5 mL预冷的0.1 mol/L硼酸缓冲液(pH=8.8,内含5 mmol/L巯基乙醇),冰浴中研磨匀浆,在4℃下10 000 r/min离心15 min,上清液用作酶活性测定。取1 mL 0.02 mol/L苯丙氨酸(用0.1 mol/L pH=8.8的硼酸缓冲液制备),加2 mL 0.05 mol/L硼酸盐缓冲液(pH=8.8)和0.1 mL酶液,对照用0.1 mL 0.1 mol/L硼酸盐缓冲液(pH=8.8)代替酶提取液。于30℃水浴保温30 min,用紫外分光光度计测定290 nm处的吸光度,酶活性单位定义为每克鲜重每小时吸光度的变化ΔA290/(h·g)。
过氧化物酶(POD)活性测定参照李合生的方法[18]。取处理叶片0.5 g放入研钵中,加入5 mL 0.05 mol/L的磷酸缓冲液(pH=7.8),冰浴研磨,匀浆倒入离心管中,在4℃下10 000 r/min低温离心20 min,上清液用作酶活性测定。反应液包括2.9 mL 0.05 mol/L磷酸缓冲液(pH=7.8),1.0 mL 2% H2O2,1.0 mL 0.05 mol/L愈创木酚,0.1 mL酶液。用加热5 min的酶液为对照,从加入H2O2开始计时。在470 nm下每隔1 min读数一次,共读3次,以每克鲜重叶片1 min内吸光度变化值ΔA470/(min·g)表示酶活力的大小。
多酚氧化酶(PPO)活性测定参照汤章城的方法[19]。取处理叶片0.5 g,加入0.05 mol/L磷酸缓冲液(pH=6.8)5 mL,0.1 g PVP,在4℃下研磨匀浆后,于4℃低温离心(15 000 r/min,20 min),上清液为酶提取液。在比色皿中加入1.5 mL 0.02 mol/L邻苯二酚溶液和0.05 mol/L pH 6.8的磷酸缓冲液1.5 mL,酶液0.2 mL,对照用0.2 mL 0.05 mol/L磷酸缓冲液(pH=6.8)代替酶液,立即于398 nm处测定吸光值,每隔1 min读数,以每克鲜重叶片1 min内吸光度的变化ΔA398/(min·g)表示PPO活性。
1.2.4 数据统计分析
数据采用Excel与SPSS软件处理,用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 不同棉花品种在棉蚜为害后PAL活性的变化
对9个供试棉花品种(系)苯丙氨酸解氨酶活力测定结果表明(表1),不同棉花品种(系)正常棉株的PAL活性存在一定差异,抗蚜品种活性高于感蚜品种,差异达极显著(F=148.41,F0.01(8,18)=3.71)。受棉蚜为害后,各品种的PAL活性均有不同程度的升高,抗蚜品种PAL活性提高率明显高于感蚜品种,经方差分析品种间PAL活性差异达极显著(F=358.55,F0.01(8,18)=3.71)。‘新海21号’、‘新杂棉2号’和‘新陆早13号’的PAL活性分别为13.89、13.61和13.61 ΔA290/(h·g),而感蚜品种‘中棉所35’、‘81-3’的PAL活性仅为7.94和7.89ΔA290/(h·g),感蚜品种PAL活性增加值不如抗蚜品种‘新海21号’、‘新杂棉2号’和‘新陆早13号’明显,但所有品种蚜害诱导与正常棉株的PAL活性差异均表现为极显著(9组F测验值见表1,F0.01(1,4)=21.20)。
表1 不同棉花品种(系)苯丙氨酸解氨酶活力1)
Table 1 The activity of phenylalanine ammonia lyase in different cotton varieties (lines)

棉花品种(系)Cottonvariety(line)苯丙氨酸解氨酶活力/ΔA290·h-1·g-1 ActivityofPAL蚜害棉株 Injuredcotton正常棉株 NormalcottonF新海21号Xinhai21(13.89±0.147)aA(8.56±0.111)bA836.30新杂棉2号Xinzacotton2(13.61±0.147)aA(8.28±0.147)bA658.19新陆早13号Xinluzao13(13.61±0.200)aA(8.22±0.222)bA324.13标杂A1BiaozaA1(11.89±0.147)aC(7.28±0.147)bB492.05新陆早12号Xinluzao12(12.56±0.056)aB(7.00±0.096)bB2490.14新陆早24号Xinluzao24(8.11±0.147)aE(4.89±0.200)bC168.06新炮台1号Xinpaotai1(9.11±0.147)aD(4.44±0.147)bCD503.86中棉所35CCRI35(7.94±0.147)aE(4.11±0.056)bDE594.9881-3(7.89±0.056)aE(3.50±0.255)bE283.68
1) 表中数据为平均值±标准误,同列中不同大写字母表示不同棉花品种间差异显著(P<0.01),同行中不同小写字母表示同一品种正常与蚜害之间差异显著(P<0.01)。下同。 Data in the table are mean±SE; the different uppercase letters in the same column and the lowercase letters in the same row indicate significant difference at 1% level. The same below.
2.2 不同棉花品种在棉蚜为害后POD活性的变化
对9个供试棉花品种过氧化物酶活力测定结果(表2)表明,不同棉花品种(系)正常棉株的POD活性存在一定差异,抗蚜品种活性高于感蚜品种,差异达极显著(F=295.64,F0.01(8,18)=3.71)。对于蚜害棉株而言,不同品种之间POD活性较正常棉株有明显的增加,增长的幅度较大,蚜害后品种间POD活性差异达极显著(F=179.39,F0.01(8,18)=3.71)。抗蚜品种‘新杂棉2号’、‘新海21号’蕾期正常棉株POD活性分别为135.83和135.33 ΔA470/(min·g),蚜害后则上升为222.33、209.33 ΔA470/(min·g),感蚜品种‘81-3’和‘中棉所35’正常棉株POD活性分别为102.33和78.33 ΔA470/(min·g),蚜害后上升为152.83、110.67 ΔA470/(min·g),感蚜品种棉株的POD活性尽管也在上升,活性增加值远不如抗蚜品种如‘新杂棉2号’和‘新海21号’明显,但所有品种蚜害诱导与正常棉株的POD活性差异均表现为极显著(9组F测验值见表2,F0.01(1,4)=21.20)。由此可见,棉蚜刺吸为害引起棉株组织中抗氧化酶活性升高,POD在棉花品种诱导抗蚜性中有明显作用。
2.3 不同棉花品种在棉蚜为害后PPO活性的变化
对9个供试棉花品种多酚氧化酶活力测定结果(表3)表明,不同棉花品种(系)正常棉株的PPO活性存在一定差异,抗蚜品种活性高于感蚜品种,差异达极显著(F=23.824,F0.01(8,18)=3.71)。对于蚜害棉株而言,不同品种之间PPO活性较正常棉株有明显的增加,增长的幅度较大,抗蚜品种‘新海21号’和‘新杂棉2号’较正常棉株几乎增长了一倍,蚜害后品种间PPO活性差异达极显著(F=94.288,F0.01(8,18)=3.71)。抗蚜品种‘新海21号’和‘新杂棉2号’蕾期正常棉株PPO活性分别为1.18、0.98 ΔA398/(min·g),蚜害后则上升为2.22、2.00 ΔA398/(min·g),感蚜品种‘中棉所35’和‘81-3’正常棉株PPO活性分别为0.58和0.57 ΔA398/(min·g),蚜害后上升为1.12、0.98 ΔA398/(min·g)。蚜虫为害后,高抗棉花品种的多酚氧化酶活性快速增加,而中抗和感蚜品种的多酚氧化酶活性增加值较小,但所有品种蚜害诱导与正常棉株的PPO活性差异均表现为极显著(9组F测验值见表3,F0.01(1,4)=21.20)。
表2 不同棉花品种(系)过氧化物酶活力测定
Table 2 The activity of peroxidase in different cotton varieties (lines)

棉花品种(系)Cottonvariety(line)过氧化物酶活力/ΔA470·min-1·g-1 ActivityofPOD蚜害棉株 Injuredcotton正常棉株 NormalcottonF新杂棉2号Xinzacotton2(222.33±3.444)aA(135.83±1.642)bA514.05新海21号Xinhai21(209.33±1.764)aB(135.33±1.424)bA1065.60新陆早13号Xinluzao13(203.50±4.368)aB(126.00±0.764)bB305.40标杂A1BiaozaA1(191.83±2.351)aC(117.00±0.577)bC955.46新陆早12号Xinluzao12(161.33±2.522)aD(108.50±1.607)bD312.08新炮台1号Xinpaotai1(151.67±2.489)aD(102.50±0.577)bE370.3281-3(132.00±4.359)aE(102.33±1.167)bE43.23新陆早24号Xinluzao24(152.83±0.882)aD(97.83±0.882)bEF1944.64中棉所35CCRI35(110.67±0.727)aF(78.33±0.441)bG1447.54
表3 不同棉花品种(系)多酚氧化酶活力测定
Table 3 The activity of polyphenol oxidase in different cotton varieties (lines)
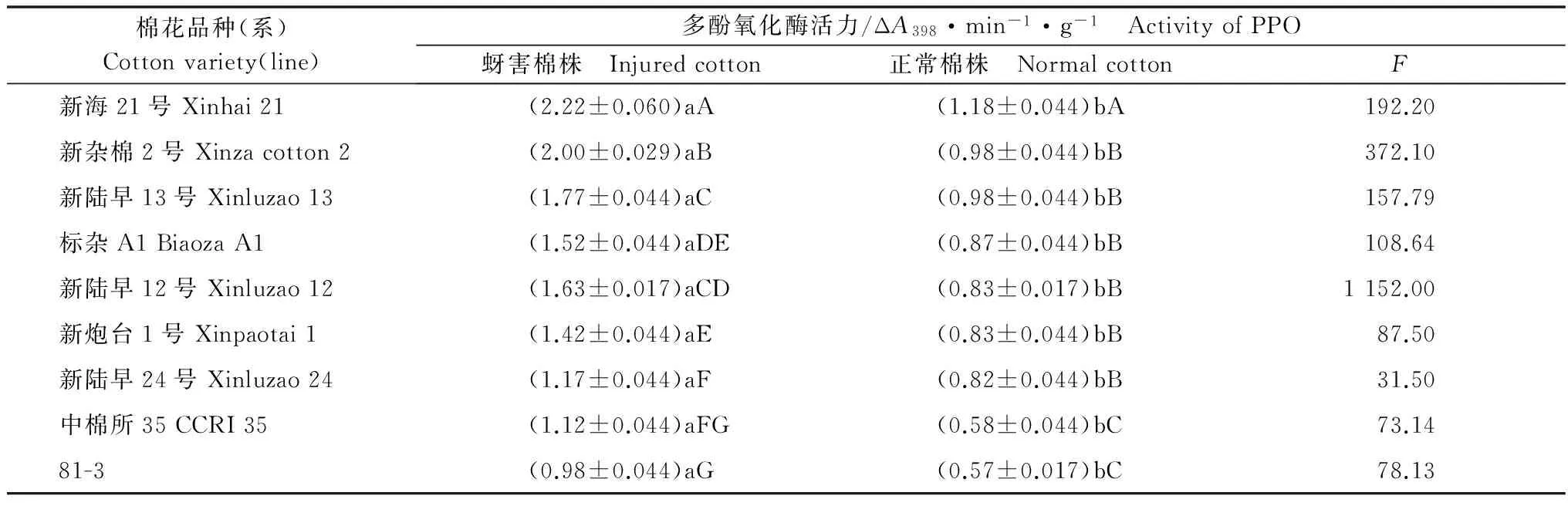
棉花品种(系)Cottonvariety(line)多酚氧化酶活力/ΔA398·min-1·g-1 ActivityofPPO蚜害棉株 Injuredcotton正常棉株 NormalcottonF新海21号Xinhai21(2.22±0.060)aA(1.18±0.044)bA192.20新杂棉2号Xinzacotton2(2.00±0.029)aB(0.98±0.044)bB372.10新陆早13号Xinluzao13(1.77±0.044)aC(0.98±0.044)bB157.79标杂A1BiaozaA1(1.52±0.044)aDE(0.87±0.044)bB108.64新陆早12号Xinluzao12(1.63±0.017)aCD(0.83±0.017)bB1152.00新炮台1号Xinpaotai1(1.42±0.044)aE(0.83±0.044)bB87.50新陆早24号Xinluzao24(1.17±0.044)aF(0.82±0.044)bB31.50中棉所35CCRI35(1.12±0.044)aFG(0.58±0.044)bC73.1481-3(0.98±0.044)aG(0.57±0.017)bC78.13
3 讨论
植物在病虫危害或条件胁迫等不良外界环境时,通过诱导或抑制次生代谢酶的产生来适应环境而使其得以生存,笔者通过对抗蚜程度不同的棉花品种(系)受棉蚜侵害胁迫前后3种酶活性变化的分析证实了PAL、POD、PPO等酶是植物次生代谢过程中的3个关键酶,当植物处于病虫危害胁迫时,被害组织的活性氧突增,而保护酶系统具有清除活性氧,防止植物受害的作用,3种酶会很快执行防御反应,表现为酶活性的增加。3种酶活性在受蚜害后有明显的升高,充分证实3种酶在棉株组织和细胞遭受侵害时,会产生诱导机制来抵御棉蚜的取食。从测试结果看,受蚜虫刺吸诱导后,抗蚜品种表现为3项指标迅速升高,且峰值高;感蚜品种各项指标上升缓慢,且峰值远比抗蚜品种低。
苯丙氨酸解氨酶(PAL)是苯丙烷类代谢的关键酶和限速酶,其活性的高低与植物抗虫性有很大关系[20-22]。本研究中棉蚜的为害显著增加了抗、感品种棉株体内苯丙氨酸解氨酶的活性,受蚜害诱导后,棉株体内调节这一代谢速度的关键酶PAL活性迅速上升,显示着这一代谢途径能够被蚜害诱导活化速度加快,合成较多的次生抗生物质,有效地调动了相关防御体系,在一定程度上抑制了蚜害的扩展,受害轻。而感蚜品种诱导抗性反应慢,且强度低,未能及时有效抵御蚜害的加剧,受害重。棉株PAL活性变化能够反映这种诱导抗性强弱及在不同品种间的差异。
过氧化物酶(POD)是植物抗逆反应过程中的一种氧化还原酶[23-24],在诱导抗性防御机制中起重要作用[25-26]。本研究中棉蚜刺吸为害及其对生理生化过程的影响,可能引起棉叶组织中O2-和H2O2等超氧物的过量生成,抗氧化酶系活性随即增高,可迅速清除活性氧对棉花的危害,从而强化了棉花的自我防御能力。高抗品种在受到棉蚜刺吸为害时,棉叶组织中POD活性迅速提高,对蚜虫的危害胁迫反应迅速,从而增强了其抗蚜性。棉花品种间酶活性的差异显示了诱导抗性的强弱。
多酚氧化酶(PPO)亦属于抗氧化酶系[27],多酚类物质在量上增加了植株的总酚含量,进而在次生代谢有关酶的作用下合成抗生性更强的木质素和氧化成醌[28-29]。本研究中棉株受蚜害后,体内PPO活性随多酚物质增加而上升,说明酚类氧化反应在加强,酚类物质氧化产物的毒性可增强寄主的抗虫反应,从而提高了棉株的抗蚜性。棉花在棉蚜为害的条件下,多酚氧化酶活性的变化可反映棉花抗蚜性的强弱,棉花抗蚜品种反应快、酶活性变化较大,蚜害较轻,而感蚜品种的反应慢、酶活性变化较小,不能及时地防止蚜害进一步蔓延发生,造成蚜害严重。
笔者前期分别对棉花品种叶片形态特性、生化物质含量以及诱导抗逆性物质等进行了研究,发现棉花抗蚜性与品种叶片的蜡质、棉酚、单宁、游离脯氨酸含量密切相关[14-15]。与单宁含量呈正相关,即单宁含量越高,感蚜性越强;与蜡质、棉酚、可溶性糖含量呈负相关,其中棉酚含量对抗蚜性的影响最大,含量越高,抗蚜性强;游离脯氨酸在棉花的固有和诱导抗蚜性中作用明显。本研究发现抗蚜品种次生代谢酶活性显著高于感蚜品种,棉花诱导抗蚜性的强弱在不同品种间存在显著差异。综合上述研究结论,棉花抗蚜性是由多种因素综合作用的结果,无论是形态特性、生化物质含量等组成抗性,还是次生代谢物质的诱导抗性,在抵御棉蚜侵害的过程中都具有积极的主动保护作用。组成抗性属于植物固有特性,虽然会因环境条件的不同而影响其抗性程度,却总是存在并始终起作用;诱导抗性则属于动态特征,对植食性昆虫除具有负面影响还存在正效应,在受到昆虫为害时不能立即发挥作用[30]。因此,组成抗性在抗蚜机制中最为重要,发挥的作用也大于诱导抗性。但尽管如此,诱导抗蚜性作为一种新的棉花抗性类型,在防御棉蚜的危害方面具有很大的潜力,今后在选用和利用抗性品种,减少化学农药的使用,以及延缓棉蚜抗药性快速形成等方面必将有广阔的研究和应用前景。
[1] 王登元, 于江南. 新疆棉花生产可持续发展与害虫综合管理[J]. 新疆农业科学, 1999(6):257-260.
[2] 吕昭智, 陈健, 吴志勇, 等. 新疆棉区主要有害生物与可持续发展[J]. 干旱区研究, 1999, 16(3):28-32.
[3] 棉花重大病虫害综合防治技术研究与示范专题组.新疆棉区主要病虫害综合防治技术体系[J].新疆农业大学学报, 1999, 22(4):270-275.
[4] 张润志, 任立, 张广学. 新疆棉区棉蚜控制策略探讨[J]. 中国生物防治, 2000, 16(4):183-185.
[5] 杜丽娜, 张存莉, 朱玮, 等. 植物次生代谢合成途径及生物学意义[J]. 西北林学院学报, 2005, 20(3):150-155.
[6] 王琦, 董合忠. 棉花次生代谢物质及其抗虫活性研究进展[J]. 棉花学报, 2013, 25(6):557-563.
[7] Theis N, Lerdau M. The evolution of function in plant secondary metabolites[J]. International Journal of Plant Science, 2003(164):93-102.
[8] 阎秀峰. 植物次生代谢生态学[J]. 植物生态学报, 2001, 25(5):639-640.
[9] Kutchan T M. Ecological arsenal and developmental dispatcher: The paradigm of secondary metabolism [J]. Plant Physiology, 2001, 125: 58-60.
[10]钦俊德. 昆虫与植物的关系——论昆虫与植物的相互作用及其演化[M]. 北京:科学出版社, 1987:39.
[11]朱俊洪, 程立生. 植物次生性物质与植物抗虫性的关系及其在害虫防治中的应用前景[J]. 华南热带农业大学学报, 2001, 7(1):26-32.
[12]Ryan C A.Oligosaccharide as recognition signals for the expression of defensive genes in plants [J]. Biochemistry, 1988, 27:8879-8883.
[13]Vela G, Dinora M, Hugo S.Polyphenoloxidase activity during ripening and chilling stress in ‘Manila’ mangoes [J].Journal of Horticultural Science and Biotechnology,2003,78(1):104-107.
[14]芦屹, 王惠卿, 王佩玲, 等. 新疆不同棉花品种游离脯氨酸与抗蚜性的关系[J]. 植物保护, 2013, 39(3):22-25.
[15]芦屹, 王佩玲, 刘冰, 等. 新疆棉花主栽品种的抗蚜性及其机制研究[J]. 棉花学报, 2009, 21(1):57-63.
[16]肖松华, 李胜, 黄骏麒, 等. 棉花温室内单株抗蚜性鉴定方法研究[J].江苏农业科学, 1998, 26(3):36-39.
[17]薛应龙. 植物生理学实验手册[M]. 上海:上海科学技术出版社, 1985:191-192.
[18]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2001:164-165.
[19]汤章城, 王国强, 史益敏, 等. 现代植物生理学实验指南[M]. 北京:科学出版社, 1999:322.
[20]王敬文, 薛应龙. 植物苯丙氨酸解氨酶的研究——Ⅱ苯丙氨酸解氨酶在抗马铃薯晚疫病中的作用[J]. 植物生理学报, 1982, 8(1):35-42.
[21]马俊彦, 杨汝德, 敖利刚. 植物苯丙氨酸解氨酶的生物学研究进展[J]. 现代食品科技, 2007, 23(7):71-75.
[22]Mauch-Mani B, Slusarenko A J.Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance of arabidopsis to peronospora parasitica [J]. Plant Cell, 1996, 8(2):203-212.
[23]季春梅, 曹辰兴, 雷关红, 等. 黄瓜诱导抗蚜性与次生代谢相关酶活性的关系[J]. 山东农业科学, 2011(10):32-35.
[24]Kawano T.Roles of the reactive oxygen species-generating peroxidase reactions in plant defense and growth induction[J]. Plant Cell Reports, 2003, 21(9):829-837.
[25]陈明顺, 仵均祥, 张国辉. 植物诱导性直接防御[J]. 昆虫知识, 2009, 46(2):175-186.
[26]Ralph J, Bunzel M, Marita J M, et al. Peroxidase-dependent cross-linking reactions ofp-hydroxycinnamates in plant cell walls [J]. Phytochemistry Reviews, 2004, 3(1):79-96.
[27]代丽,宫长荣,史霖,等.植物多酚氧化酶研究综述[J].中国农学通报,2007,23(6):312-316.
[28]Bi J L, Murphy J B, Felton G W.Antinutritive and oxidative components as mechanisms of induced resistance in cotton toHelicoverpazea[J]. Journal of Chemical Ecology, 1997, 23(1):97-117.
[29]程璐,贺春贵,胡桂馨,等.苜蓿斑蚜为害对5种苜蓿品种(系)PAL、POD、PPO酶活性的影响[J].植物保护,2009,35(6):87-90.
[30]朱麟, 杨振德, 赵博光, 等. 植食性昆虫诱导的植物抗性最新研究进展[J]. 林业科学, 2005, 41(1):165-173.
(责任编辑:田 喆)
Correlation between induced resistance to aphids and secondary metabolism enzyme activities of cotton varieties in Xinjiang
Lu Yi1,2, Wang Huiqing2, Chen Liusheng1, Wang Peiling1, Li Jing2
(1.DepartmentofPlantProtection,CollegeofAgriculture,ShiheziUniversity,Shihezi832003,China; 2.PlantProtectionStationofXinjiangUygurAutonomousRegion,Urumqi830006,China)
In order to define the correlation between induced resistance to aphids and secondary metabolism enzyme activities of different cotton varieties, experiments were carried out to study the change in the activities of phenylalanine ammonia-lyase (PAL), peroxidase (POD) and polyphenol oxidase (PPO) and their resistance to aphids on different cotton varieties. The results indicated that there were significant differences in the activity of the same enzyme in different varieties without aphid infestation. Under aphid infestation, the activities of three enzymes in resistant and susceptible varieties were increased distinctly, and the activity in resistant varieties was significantly higher than that in the susceptible ones. The contents of phenolic compounds were changed in the same way. The further tests showed that PAL, POD and PPO were participated in the defense system of cotton, and the strength of the induced resistance to aphids had significant differences between different varieties.
cotton; phenylalanine ammonia-lyase; peroxidase; polyphenol oxidase;Aphisgossypii; induced resistance to aphids
2016-08-28
2016-09-21
“十一五”国家科技支撑计划(2006BAD21B02-3);新疆兵团农八师科委重点项目(2005-01);新疆兵团博士基金(05JJ01)
S 435.622, S 433.1
A
10.3969/j.issn.0529-1542.2017.04.009
* 通信作者 E-mail:wangpl69@126.com;ljjl626@sina.com
