菠菜叶蛋白泡沫法分离工艺的优化
2017-08-08陈元涛刘海彬高中超
刘 龙 张 炜 陈元涛 刘海彬 高中超 雷 蕾
(青海师范大学化学系,青海 西宁 810008)
菠菜叶蛋白泡沫法分离工艺的优化
刘 龙 张 炜 陈元涛 刘海彬 高中超 雷 蕾
(青海师范大学化学系,青海 西宁 810008)
为有效开发利用菠菜叶蛋白资源,以菠菜叶为原料,在单因素试验基础上,以回收率和富集比为指标,选取稀释倍数、气速、温度和pH值为考察因素,根据Box-Behnken试验设计原理进行响应面试验设计优化得出泡沫法分离菠菜叶蛋白的最佳工艺条件为:稀释倍数16倍、气速260 mL/min、温度40 ℃、pH 7.5,在该条件下,回收率和富集比分别达81.56%、14.94。研究结果表明泡沫分离技术是实现菠菜叶蛋白粗分离的一种有效方法。
菠菜叶;蛋白;泡沫分离;回收率;富集比
叶蛋白是植物叶体内各种氨基酸组成的具有特定空间结构的高分子聚合物[1],是世界上最大的可再生蛋白质资源之一,营养均衡、不含胆固醇,是优质蛋白的重要来源[2]。
菠菜(SpinaciaoleraceaL.)原产于伊朗,又称波斯菜、菠棱菜、赤根菜等,富含多种蛋白质、氨基酸、维生素及铁、钙、镁等多种矿物质,有“菜中之王”“维生素宝库”之美称[3-4]。目前,有关菠菜的研究大多都集中于维生素及微量元素,并已研制出菠菜蛋糕、菠菜冰淇淋、菠菜饮料等[5],而有关菠菜叶蛋白的理论研究却很少,舒友琴等[6]对菠菜叶蛋白进行了碱液提取,梁丽琴等[7]对菠菜叶蛋白进行了酶解多肽的制备,但未见对其分离纯化的报道。据测定,每500 g 菠菜中含蛋白12.5 g,相当于2个鸡蛋的含量,比白菜高2倍[8];与大豆饼蛋白相比较,必需氨基酸的数量和所占比例均优于大豆饼蛋白[9];由于菠菜中的许多蛋白质与酚类和黄酮类化合物以复合体的形式存在,因此具有较强的抗氧化能力,也是良好的天然抗氧化剂来源[10-11]。另外菠菜种植面积广、生长周期短、是人类的常食蔬菜之一,因此开发利用菠菜叶蛋白,不仅能缓解蛋白质资源的紧缺,还能减少人们摄入过多动物蛋白造成的危害,对提高人类膳食水平具有重要的现实意义[12-13]。
目前,叶蛋白的主要提取分离方法有直接加热法、酸(碱)加热法、盐析法、有机溶剂法、酸碱沉淀法、发酵酸法和酶法等[14-15]。但在通常的工业规模条件下,一系列的层析、超滤、沉淀等步骤用于蛋白质的分离和浓缩,能耗高、耗时长[16],且这些方法大多只考虑了蛋白分离的单个因素,削弱了蛋白的分离效果,因此寻找一个综合有效的菠菜叶蛋白提取分离方法势在必行[17]。
泡沫分离技术是基于表面活性物质在泡沫上的选择性物理吸附,从而达到表面活性物质与多组分体系分离、浓缩的技术[16]。它具有能耗低、条件温和、有机溶剂用量少、易于工业放大、可连续操作等优点,是一种具有广泛发展前景的分离技术[18-19]。目前,泡沫分离技术不仅被广泛用于矿物浮选、石油污染废水处理[20],还用于生化、蛋白[21-22]、多糖[23]等领域的分离浓缩。将泡沫分离法用于菠菜叶蛋白的分离提取可将几种常用叶蛋白提取方法的关键因素结合在一起,实现分离效果的最大化。
本研究以菠菜为原料,采用泡沫分离技术,通过响应面优化分析稀释倍数、气速、温度和pH值等因素对泡沫分离菠菜叶蛋白的影响,以确定菠菜叶蛋白的最佳提取工艺参数,旨在为今后菠菜叶蛋白的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
菠菜:选购于青海湟源县草原村韩国大叶菠菜种植基地;
牛血清蛋白标准品(批号:20120202):上海源叶生物科技有限公司;
考马斯亮蓝G-250(批号:W20J7E9268):高纯,上海源叶生物科技有限公司;
磷酸、无水乙醇:AR级,天津市开通化学试剂有限公司。
1.2 主要仪器设备
双光束紫外-可见分光光度计:TU-1901型,北京普析通用仪器有限责任公司;
玻璃转子流量计:LZB型,南京顺来达测控设备有限公司;
空压机:FB45/7型,上海捷豹压缩机制造有限公司;
pH计:PB-10型,梅特勒-托利多(上海)仪器有限公司;
分析天平:BSA224S-CW型,赛多利斯科学仪器(北京)有限公司;
恒温水浴锅:IKA IC型,广州仪科实验室技术有限公司;
旋转蒸发仪:IKARV-10型,广州仪科实验室技术有限公司;
循环水恒温泡沫分离柱(见图1):内径35 mm、外径 40 mm、柱高800 mm,本实验室自制。

1. 空压机 2. 压力表 3. 阀门 4. 缓冲瓶 5. 转子流量计 6. 泡沫分离柱 7. 循环水入口 8. 循环水出口 9. 泡沫接收器
图1 泡沫分离装置图
Figure 1 Experimental apparatus for foam fractionation
1.3 方法
1.3.1 菠菜预处理 将采购的新鲜菠菜洗净后,55 ℃烘干,粉碎过80目筛,备用。
1.3.2 菠菜叶蛋白的提取 按m菠菜∶m水=1∶10的比例,准确称取过筛后的菠菜叶粉末,在55 ℃条件下,用pH=9.5的氢氧化钠水溶液磁力搅拌提取0.5 h,重提1次,合并提取液,滤纸抽滤,备用[6]。
1.3.3 菠菜叶蛋白含量的测定 采用考马斯亮蓝比色法[24]。
1.3.4 菠菜叶蛋白泡沫分离的评价指标 分别按式(1)、(2)计算菠菜叶蛋白的回收率和富集比。

(1)

(2)
式中:
R——菠菜叶蛋白回收率,%;
E——菠菜叶蛋白富集比;
C0——菠菜叶蛋白初始液质量浓度,μg/mL;
Cf——菠菜叶蛋白泡沫层质量浓度,μg/mL;
V0——菠菜叶蛋白初始液体积,mL;
Vf——菠菜叶蛋白泡沫层体积,mL。
1.3.5 泡沫分离菠菜叶蛋白单因素试验
(1) 稀释倍数对泡沫分离菠菜叶蛋白的影响:控制装液量600 mL,气速300 mL/min,温度45 ℃,pH 7.0,选取稀释倍数为30,25,20,15,10,7倍进行泡沫分离,以回收率和富集比为评价指标来确定最佳稀释倍数。
(2) 温度对泡沫分离菠菜叶蛋白的影响:在控制装液量600 mL,稀释倍数15,气速300 mL/min,pH 7.0的条件下,选取温度为25,30,35,40,45,50 ℃,以回收率和富集比为评价指标来确定最佳温度。
(3) 气速对泡沫分离菠菜叶蛋白的影响:在控制装液量600 mL,稀释倍数15,温度45 ℃,pH 7.0的条件下,选取气速为200,250,300,350,400,450 mL/min进行泡沫分离,以回收率和富集比为评价指标来确定最佳气速。
(4) pH对泡沫分离菠菜叶蛋白的影响:在控制装液量600 mL,稀释倍数15倍,气速300 mL/min,温度45 ℃,pH 7.0的条件下,选取pH 5.5,6.0,6.5,7.0,7.5,9.0进行泡沫分离,以回收率和富集比为评价指标来确定最佳pH。
1.3.6 泡沫分离菠菜叶蛋白响应面优化试验设计 利用软件Design-Expert 8.0.6,根据Box-Behnken试验设计原理,在单因素试验基础上,选择 4因素3水平进行响应面试验设计,即稀释倍数、温度、气速、pH 4个因素为自变量,回收率和富集比为响应值,探究菠菜叶蛋白泡沫分离的最佳工艺条件组合。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 稀释倍数对泡沫分离菠菜叶蛋白的影响 由图2可知,在稀释倍数为7~30时,随着稀释倍数的增大,菠菜叶蛋白回收率从88.3%降低到84.3%,富集比从6.6上升到26.9。因为稀释倍数减小,吸附在泡沫上的蛋白质双分子层逐渐趋于饱和[25],且浓度越高,泡沫上蛋白质分子排列越紧密,起泡性越强,液膜越厚,排液速率越慢,持水量越多。考虑到泡沫分离工艺过程应尽量保证较低的稀释倍数,选取稀释15倍作为下一步的研究条件。

图2 稀释倍数对泡沫分离菠菜叶蛋白的影响
2.1.2 气速对泡沫分离菠菜叶蛋白的影响 由图3可知,在气速为200~450 mL/min时,随着气速的增大,泡沫分离菠菜叶蛋白回收率从77.4%增大到86.0%,而富集比从13.8降低到5.8。这是因为气速增大,单位时间产生的泡沫增多,滞留时间较短,持液量增加[26]。综合考虑气速对泡沫分离菠菜叶蛋白回收率和富集比的影响,选取气速为300 mL/min作为下一步的研究条件。

图3 气速对泡沫分离菠菜叶蛋白的影响
2.1.3 温度对泡沫分离菠菜叶蛋白的影响 由图4可知,在温度为25~50 ℃时,随着温度的升高,菠菜叶蛋白回收率从78.9%降低到71.0%,富集比从8.6上升到14.2。这是因为温度升高,泡沫黏度降低,稳定性变差,聚并加剧,排液速率加快[27]。此外,研究还发现升高温度能显著提高泡沫分离菠菜叶蛋白的时间效率(35 ℃约为30 min,45 ℃仅需15 min)。综合考虑,选取45 ℃作为下一步的研究条件。
2.1.4 pH对泡沫分离菠菜叶蛋白的影响 由图5可知,在pH为5.5~9.0时,随着pH的增大,菠菜叶蛋白的回收率先升高后降低,pH=7.0时最高(74.7%),富集比先降低后升高,pH=6.5时最低(9.1)。这是因为pH较低时(<7.0),随pH升高,菠菜叶蛋白的溶解度增加,起泡性变好[28],回收率升高,持液量增加,富集比降低;pH较高时(>7.0),溶解度的增加对菠菜叶蛋白起泡性的影响不再显著,而是随着pH值的增大,分子间静电荷增加,分子间排斥力增大,泡沫聚并现象加重,总体泡沫吸附量降低,单位泡沫吸附量增加。考虑到泡沫分离应在保证一定回收率的前提下来提高富集比,且中性对工业设备损害较小,选取pH 7.0 作为下一步的研究条件。

图4 温度对泡沫分离菠菜叶蛋白的影响

图5 pH对泡沫分离菠菜叶蛋白的影响
2.2 响应曲面法优化泡沫分离菠菜叶蛋白工艺试验结果及分析
2.2.1 菠菜叶蛋白响应面因素水平设计表 根据单因素试验结果确定的因素水平表见表1。

表1 菠菜叶蛋白响应面因素水平设计表
2.2.2 响应面试验结果 响应面试验设计及试验结果见表2。对表2试验数据进行多元回归拟合,得到泡沫分离菠菜叶蛋白回收率(R)和富集比(E)的拟合方程:
R=80.90-4.37A+1.59B-4.93C+0.16D-0.45AB-0.58AC+0.41AD+0.17BC-2.41BD-2.36CD-3.45A2-2.83B2+0.17C2-3.19D2,
(3)
E=7.39+3.31A-2.05B+0.61C+0.89D-1.28AB+0.16AC+0.82AD-0.69BC-0.21BD-0.28CD-0.019A2+0.96B2-0.22C2+2.04D2。
(4)



表2 响应面试验设计及结果

表3 回收率线性回归分析表†
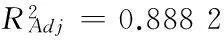

表4 富集比线性回归分析表†

2.2.4 3D响应面分析 由图6可知,回收率随着气速的增加而增大(a,d,e),随着稀释倍数、温度的升高而减小(a,b,c,d,f),随着pH的升高先升高后降低(或趋于平缓)(c,e,f)。两因素交互作用由大到小为:BD>CD>AC>AB>AD>BC,和方差分析的结论一致。
由图7可知,富集比随着稀释倍数的降低、气速的增大而减小(a,b,c,d,e),随着温度的升高而增大(b,d,f),随着pH的升高先减小后增大(c,e,f)。两因素交互作用由大到小为:AB>AD>CD>BD>AC>BC,和方差分析的结论一致。
2.3 最佳工艺条件的确定及验证
2.3.1 最佳工艺条件的确定 模型(3)得出的最佳组合为:稀释倍数13.50,气速325.00 mL/min、温度40.39 ℃、pH 7.02,最佳回收率为86.54%(富集比为5.17);模型(4)得出的最佳组合为:稀释倍数19.91、气速264.82 mL/min、温度47.14 ℃、pH 7.41,最佳富集比为16.50(回收率为67.56%),可以看出2个指标是相反的过程(与单因素试验结果一致)。基于回收率和富集比是泡沫分离的2个重要指标,缺一不可,且一般应在保证一定回收率的条件下来提高富集比。因此,调整确定最佳优化工艺条件为:稀释倍数15.99,气速259.48 mL/min,温度40.00 ℃,pH 7.50,理论回收率83.55%,理论富集比13.17,可信度达0.926,模型拟合度较高。

图6 回收率响应面3D图

图7 富集比响应面3D图
2.3.2 验证实验 为了验证建立模型的可靠性,利用响应面软件所给的最优工艺条件并结合实际操作,选取稀释倍数16、气速260 mL/min、温度40 ℃、pH 7.5进行实验验证,重复3次。在此条件下,验证结果为:回收率81.56%,富集比14.94,均与预测值接近。说明采用响应面法得到的拟合模型能很好地预测回收率和富集比与各试验因素之间的关系,工艺参数可靠,具有一定的实际应用价值。
3 结论
(1) 本研究在单因素试验基础上,以回收率和富集比为指标,根据Box-Behnken试验设计原理,对泡沫法分离菠菜叶蛋白进行响应面工艺优化验证,得出最佳工艺条件为:稀释倍数16,气速260 mL/min,温度40 ℃,pH 7.5,在此条件下,回收率81.56%,富集比14.94。试验结果表明,泡沫分离技术是一种实现菠菜叶蛋白粗分离的有效,低成本方法,为菠菜叶蛋白的开发利用提供了理论依据和试验参考。
(2) 本研究证实了泡沫法分离菠菜叶蛋白的可行性,拓展了泡沫分离技术在分离提取叶蛋白领域的应用。
(3) 然而,目前泡沫分离技术大多适用于低浓度,具有表面活性物质的分离提取,有关菠菜叶蛋白功能性质的改善及高浓度下的泡沫分离提取有待进一步研究。
[1] 郑集, 陈钧辉. 普通生物化学[M]. 北京: 高等教育出版社, 2007: 67.
[2] 王震, 乔天磊, 霍乃蕊, 等. 植物叶蛋白提取及应用前景[J]. 山西农业科学, 2015, 43(12): 1 727-1 731.
[3] 郭玉花, 黄震, 滕立军, 等. 新鲜菠菜的纳米活性气调包装研究[J]. 食品与机械, 2009, 25(4): 167-170.
[4] 朱军伟, 谢晶, 林永艳, 等. 贮藏温度对薄膜包装菠菜品质的影响[J]. 食品与机械, 2011, 27(6): 219-221.
[5] 袁道强, 梁丽琴, 王振锋, 等. 菠菜叶蛋白功能特性的研究[J]. 现代食品科技, 2005, 21(1): 13-16.
[6] 舒友琴, 梁丽琴, 扶庆权, 等. 菠菜叶蛋白的提取研究[J]. 食品科学, 2005, 26(10): 124-127.
[7] 梁丽琴, 催林栋, 段江燕. 胰蛋白酶水解制备菠菜叶蛋白多肽的工艺研究[J]. 山西师范大学学报: 自然科学版, 2016(2): 72-75.
[8] 刘娇. 菜中之王——菠菜[J]. 解放军健康, 2003(5): 29-29.
[9] 曹雪玲, 李鑫, 刘发现. 蔬菜中蛋白质的提取及含量分析[J]. 广州化工, 2015(18): 39-40.
[10] 赖冬花, 傅红, 杨琳, 等. 菠菜色素蛋白复合物的抗氧化性研究[J]. 食品研究与开发, 2013, 34(3): 116-120.
[11] 闫岩, 傅红, 杨琳, 等. 菠菜与螺旋藻中水溶性蛋白抗氧化性的比较研究[J]. 中国食品学报, 2012, 12(11): 37-41.
[12] 张鑫, 曲文娟, 马海乐, 等. 脱水菠菜的催化式红外辐射灭菌研究[J]. 食品科学, 2013, 34(23): 133-137.
[13] 叶晶晶, 曹宁宁, 殷浩, 等. 植物蛋白的研究进展[J]. 安徽农业科学, 2011, 39(31): 19 046-19 047.
[14] 王震, 乔天磊, 霍乃蕊, 等. 植物叶蛋白提取方法及研究进展[J]. 山西农业科学, 2016, 44(1): 126-130.
[15] 郭珍, 陈复生, 李彦磊, 等. 反胶束萃取技术及其在植物蛋白质提取中的应用研究进展[J]. 食品与机械, 2013, 29(1): 240-242.
[16] NAKABAYASHI T, TAKAKUSAGI Y, IWABATA K, et al. Foam fractionation of protein: Correlation of protein adsorption onto bubbles with a pH-induced conformational transition[J]. Analytical Biochemistry, 2011, 419(2): 173-179.
[17] 刘海彬, 张炜, 陈元涛, 等. 响应面法优化泡沫分离桑叶蛋白工艺[J]. 食品科学, 2015, 36(8): 97-102.
[18] 潘丽, 张守文, 谷克仁, 等. 泡沫分离技术在食品工业中的应用现状[J]. 河南工业大学学报: 自然科学版, 2015, 36(4): 120-124.
[19] KAMALANATHAN I D, MARTIN P J. Competitive adsorption of surfactant-protein mixtures in a continuous stripping mode foam fractionation column[J]. Chemical Engineering Science, 2016, 146: 291-301.
[20] BURGHOFF B. Foam fractionation applications[J]. Journal of Biotechnology, 2012, 161(2): 126-137.
[21] KHALESI M, VENKEN T, DECKERS S, et al. A novel method for hydrophobin extraction using CO2, foam fractionation system[J]. Industrial Crops & Products, 2013, 43(43): 372-377.
[22] MU Tai-hua, LIU Ying, ZHANG Miao, et al. Protein Recovery from Sweet Potato Starch Wastewater by Foam Separation[J]. Separation Science & Technology, 2014, 49(14): 2 255-2 260.
[23] 李志洲. 泡沫分离法优化美味牛肝菌多糖分离工艺[J]. 食品与机械, 2012, 28(3): 130-134.
[24] ZHAO Zhuo, SUN Wen-bin, JI Ya-ru, et al. Effects of temperature on determination of protein concentration with coomassie brilliant blue method[J]. Agricultural Science & Technology, 2015, 16(2): 209-213.
[25] LIU Hai-bin, ZHANG Wei, CHEN Yuan-tao, et al. Techno-logy optimization of Medicago sativa leaf protein separation with foam fractionation[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(9): 271-276.
[26] 杨博, 王永华, 姚汝华. 蛋白质的泡沫分离[J]. 食品与发酵工业, 2001, 27(2): 76-79.
[27] 刘宗民. 泡沫分离回收马铃薯淀粉废水中蛋白质的工艺[D]. 天津: 河北工业大学, 2013: 41-46.
[28] 王芳, 刘华, 董梅红. 桑叶蛋白的功能特性研究[J]. 食品科学, 2010, 31(11): 81-86.
Optimization on foam separation process for spinach leaf protein
LIU Long ZHANG Wei CHEN Yuan-tao LIU Hai-bin GAO Zhong-chao LEI Lei
(Department of Chemistry, Qinghai Normal University, Xining, Qinghai 810008, China)
In order to develop and utilize spinach leaf protein resources effectively, the spinach leaves were used as raw material in this work. Based on the single factor experiments, Box-Behnken design was adopted to investigate the influence of four factors: the dilution ratio, gas velocity, temperature and pH on recovery rate and enrichment ratio of leaf protein from spinach leaves. The optimum conditions for the foam separation of spinach leaf protein were found: diluting time of 16 times, gas velocity of 260 mL/min, temperature of 40 ℃, pH value of 7.5. Under these conditions, the recovery and enrichment ratio reached to 81.56% and 14.94, respectively. The results show that foam separation technique is an effective method to separate leaf protein from spinach.
spinach leaf; protein; foam separation; recovery; enrichment ratio
青海省基础研究计划项目(编号:2017-ZJ-712)
刘龙,男,青海师范大学在读硕士研究生。
张炜(1972—),女,青海师范大学教授,硕士。 E-mail:zhangwei@qhnu.edu.cn
2017—03—23
10.13652/j.issn.1003-5788.2017.06.034
