QuEChERS—高效液相色谱法检测柑桔中毒死蜱、吡虫啉和残杀威农残
2017-08-08孙志高郝静梅于奉生
孙志高 盛 冉 郝静梅 龙 勇 于奉生 方 明
(1. 西南大学柑桔研究所,重庆 400712;2. 西南大学食品科学学院,重庆 400715)
QuEChERS—高效液相色谱法检测柑桔中毒死蜱、吡虫啉和残杀威农残
孙志高1,2盛 冉1郝静梅1龙 勇1于奉生1方 明1
(1. 西南大学柑桔研究所,重庆 400712;2. 西南大学食品科学学院,重庆 400715)
将改进的QuEChERS方法与GB/T 24691—2009中农药提取方法进行比较,通过高效液相色谱法检测2种方法对柑桔农残的分离效果。结果显示:改进的QuEChERS方法检测毒死蜱、吡虫啉和残杀威时出峰时间分别约为5.1,3.8,11.5 min;当空白加标水平分别为0.8~80.0,0.5~40.0,0.8~80.0 μg/mL时,检出限分别为0.89,0.55,0.39 μg/mL;当空白加标水平分别为1~20,1~20,5~30 μg/mL时,回收率分别为68%~109%,94%~108%,109%~125%,相对标准偏差分别为2.48%~5.03%,7.79%~10.92%,2.32%~6.77%。采用GB/T 24691—2009提取毒死蜱、吡虫啉和残杀威时,出峰时间与改进的QuEChERS方法基本相同;当与改进的QuEChERS方法采用相同的空白加标水平,检出限分别为0.80,0.78,0.54 μg/mL,回收率分别为107%~195%,25%~87%,53%~93%,相对标准偏差分别为5.61%~7.73%,6.89%~9.42%,5.44%~10.45%。因此,QuEChERS—高效液相色谱法检测毒死蜱、吡虫啉和残杀威农残时优于GB/T 24691—2009方法。
QuEChERS;高效液相色谱;毒死蜱;吡虫啉;残杀威
柑桔作为世界第一大类水果,种植面积和产量都逐年稳步增长,且种植面积和产量中国都稳居第一,2014年中国柑桔种植面积为240.40×104hm2、产量为3 546.93×104t[1]。同时,柑桔也是世界第三大贸易农产品,鲜果出口为其主要方式,但中国柑桔的质量安全、贸易出口形势却不容乐观,突出表现为农药残留率偏高[2]。因此,开发快速、高效、简便、灵敏的农残检测方法刻不容缓,对柑桔产业发展有着重要的意义。
果蔬农药残留检测方法较多,其中分子印迹[3]、光谱无损检测[4]、QuEChERS联用液相或气相[5-7]等方法发展迅速。但在众多方法之中,QuEChERS联用液相或气相对农药检测更具有广泛性、稳定性和准确性。该方法以乙腈作为提取剂,利用氯化钠盐析以促进农药提取,采用无水硫酸镁对水、PSA(乙二胺基-N-丙基)等基质杂物进行吸取净化处理,进而实现农药的简单高效提取[7-10]。QuEChERS技术经过10多年的发展,国外已经将其作为标准方法应用,如英国BS EN 15662:2008标准已将QuEChERS法作为植物来源食物中农药残留的检测方法,并在原方法的基础上改进和发展了多种相似的方法,根据检测样品、农药种类不同,采用具有缓冲或酸性物质的乙腈溶液,取代了原始单一乙腈提取剂[8,11-13];将具盐析功能的氯化钠、吸水功能的无水硫酸镁、纯化吸附各种基质杂质功能的PSA等也替换成了其它物质[14-17]。
虽然中国GB/T 24691—2009已实施,但该标准方法在提取农残时存在有机溶剂消耗量大、耗时长、准确度不高等缺陷。本试验拟对改良QuEChERS法与GB/T 24691—2009中农药提取试验方法进行对比研究,旨在探讨改良QuEChERS法在果蔬洗涤剂国标中应用的可行性。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
柑桔样品:北碚447,采于重庆市北碚区歇马镇卫星村;
毒死蜱农药:有效成分14.8%,中国农业科学院植保所廊坊农药中试厂;
吡虫啉农药:有效成份10%,江苏克胜集团股份有限公司;
残杀威农药:有效成份12%,江苏扬农化工股份有限公司;
吡虫啉[Imidacloprid,1-(6-氯吡啶-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,cas:138261-41-3]标准品(纯度98.4%)、毒死蜱[Chorpyrifos,O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸,cas:2921-88-2]标准品(纯度99.4%)、残杀威[Propoxur,2-(1-甲基乙氧基)苯基氨基甲酸甲酯,cas:114-26-1]标准品(纯度98.1%)、PSA(乙二胺基-N-丙基):上海哈灵生物科技有限公司;
乙腈:色谱纯,美国Sigma公司;
其它试剂未作特殊说明均为分析纯。
1.1.2 仪器与设备
高效液相色谱(HPLC):UltiMateTM 3000型,美国DIONEX公司;
台式低速大容量离心机:L-550型,长沙湘仪离心仪器有限公司;
台式高速冷冻离心机:UnicenMR型,德国Germany Herolab公司;
漩涡振荡器:XW-80A型,上海青浦沪西仪器厂;
组织捣碎机:JJ-2B型,江苏省金坛市荣华仪器制造有限公司;
电子天平:YP10K-1型,上海舜宇恒平科学仪器有限公司;
电子天平:FA2004B型,赛多利斯科学仪器;
水浴锅:LKTC-B1-T型,上海双舜实业发展有限公司。
1.2 方法
1.2.1 色谱条件 色谱柱:博纳艾杰尔C18(4.6 mm × 250 mm,5 μm);柱温:35 ℃;流速:1.0 mL/min;检测波长:230(毒死蜱),269(吡虫啉),210(残杀威) nm;进样量:20 μL;流动相为乙腈/水(毒死蜱、吡虫啉、残杀威对应的乙腈与水体积比分别为95∶5,55∶45,80∶20)。
1.2.2 标准溶液制备 分别准确称取毒死蜱标准品、吡虫啉标准品、残杀威标准品0.04,0.02,0.04 g,乙腈溶解,制成质量浓度分别为200,100,200 μg/mL的标准品原溶液。准备适量原溶液,将3种标品分别配置成0.8,1.0,2.0,3.0,4.0,20.0,80.0 μg/mL(毒死蜱);0.5,1.0,2.0,3.0,10.0,40.0 μg/mL(吡虫啉);0.8,1.0,2.0,3.0,4.0,20.0,80.0 μg/mL(残杀威)系列浓度的标准溶液,备用。
1.2.3 试样处理
(1) 标准硬水:称取MgSO4·7H2O 24.7 g和CaCl216.7 g,配制成10 L,即浓度为2 500 mg/kg。在使用时,将1 L再稀释成10 L,即浓度为250 mg/kg。
(2) 农药乳液制备:称取适量毒死蜱、吡虫啉和残杀威等农药分别溶于500 g无水乙醇溶液中搅拌均匀,再用标准硬水定量至5 000 g,搅拌均匀备用。3种农药乳液浓度分别为>1 000(毒死蜱),>500(吡虫啉),>1 000(残杀威) mg/kg。
(3) 含农药柑桔样本制备:选取无损伤、腐烂且大小均匀的柑桔作为试验样本。将样品浸于农药乳液中,30 min后取出放置于通风橱晾干24 h。将制备好的柑桔样品分成若干组,每组2份平行样品,每份重量为(400±40) g。
1.2.4 样品检测
(1) 改良QuEChERS方法:称取样品10 g加乙腈15 mL、无水MgSO44 g、NaCl 1 g漩涡振荡3 min,并在4 200 r/min离心5 min,取2 mL离心上清液于加有150 mg/mL无水MgSO4、20 mg/mL PSA的10 mL离心管中漩涡振荡,再在10 000 r/min离心5 min,并用0.22 μm有机膜过滤备用。
(2) 国标法(GB/T 24691—2009):取60 g捣碎均匀的柑桔样品、加入100 mL 0.1%冰乙酸乙腈溶液、6 g 无水乙酸钠和18 g无水MgSO4,搅匀并置于50 Hz的超声器中处理3 min后,取上清萃取液于烧杯中,且按此方法重复2次。将重复萃取3次后的样品残渣放入50 mL离心管,于4 000 r/min离心4 min,将离心之后的上清液与前面得到的萃取液混合,并置于(80±2) ℃水浴中浓缩至5~8 mL(浓缩耗时约3~4 h),最后浓缩液定容至50 mL备用。
2 结果与分析
2.1 色谱条件选择
在190~400 nm波长范围,分别对毒死蜱、吡虫啉、残杀威标准溶液进行全波段扫描,分别在230,269,210 nm处能够获得较好吸收值。为了避免因出峰时间太早受到溶剂峰干扰、出峰时间太晚耗时太长,以及受样品基质等因素的影响,本研究通过优化检测条件,确定的最佳流动相为乙腈(A)和水(B),且3种农药(毒死蜱、吡虫啉、残杀威)检测流动相A与B的体积比分别为95∶5,55∶45,80∶20;所检测的标品色谱图见图1。
2.2 样品测定
由表1可知,在提取柑桔样品农药残留过程中,标准法与改良QuEChERS法相比,不论是提取时间还是溶剂消耗量,改良QuEChERS法都远远少于国标法,因此改良QuEChERS法极具实际应用意义。
由图2和图3可知,毒死蜱和残杀威在2种提取方法下其保留时间(毒死蜱约5.1 min、残杀威约11.5 min)、峰形与标品一致、峰形对称且受其它基质影响较小。但吡虫啉由QuEChERS法处理后其色谱图中基质对目标峰影响较小,与标品对比保留时间均在3.8 min附近,色谱图更优于国标提取法,且改良QuEChERS法峰形更加对称、保留时间附近无杂质干扰,能够更好地实现农残检出,因此改良QuEChERS法对样品中基质清除效果优于标准法。

图1 毒死蜱、吡虫啉、残杀威标品HPLC图
2.3 线性方程和检出限
以空白基质加标的方式确定2种方法对毒死蜱、吡虫啉、残杀威3种农药的线性方程和检出限。根据选择的HPLC条件对标准溶液检测,以峰值为y、标准溶液浓度为x绘制标准曲线,得出毒死蜱、吡虫啉和残杀威3种农药的线性方程分别为y=0.690 5x-0.137 1、y=1.802 4x+0.093、y=0.805 5x-0.219 9,相关系数R2分别达0.999 9,1.000 0,0.999 8。由表2可知,毒死蜱、吡虫啉和残杀威3种农药空白加标水平分别为0.8~80.0,0.5~40.0,0.8~80.0 μg/mL时,改良后的QuEChERS法对吡虫啉和残杀威的检出限分别为0.55,0.39 μg/mL均低于国标法的0.78,0.54 μg/mL,虽改良后的QuEChERS法对毒死蜱的检出限为0.89 μg/mL稍高于国标法的0.80 μg/mL,但相差不大。整体而言,改良后的QuEChERS法优于国标法。

图2 国标法提取柑桔样品中毒死蜱、吡虫啉、残杀威残留HPLC图
Figure 2 The national standard method extraction of Citrus samples of chlorpyrifos, imidacloprid and propox-ur residues HPLC

表1 改良QuEChERS法与国标法比较

图3 改良QuEChERS法提取柑桔样品中毒死蜱、吡虫啉、残杀威残留HPLC图
Figure 3 The modified QuEChERS method (right) extra-ction of Citrus samples of chlorpyrifos, imidacloprid and propoxur residues HPLC
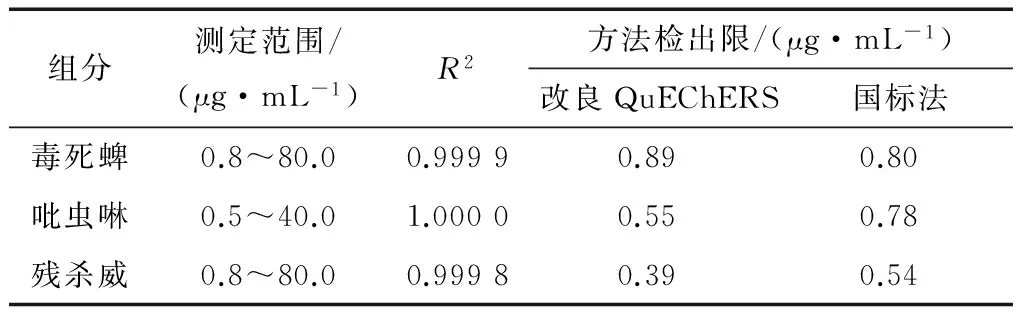
表2 HPLC测定范围及检出限
2.4 精密度与加标回收率试验
采用空白柑桔样品加标,其中1~20 μg/mg毒死蜱、1~20 μg/mg吡虫啉和5~30 μg/mg残杀威,采用改良的QuEChERS法,回收率可分别控制在68%~109%,94%~108%,109%~125%,相对标准偏差分别为2.48%~5.03%,7.79%~10.92%,2.32%~6.77%。而国标法回收率仅能分别控制在107%~195%,25%~87%,53%~93%,相对标准偏差分别在5.44%~10.45%,6.89%~9.42%,5.61%~7.73%。由表3~5可知,采用改良的QuEChERS法,3种农药的回收率都远远高于国标法,且加标回收率及相对标准偏差能够满足NY/T 788—2004《农药残留试验准则》要求,仅部分指标与《农药残留试验准则》推荐标准稍有偏差,因此改良的QuEChERS法优于标准法。
3 结论
对柑桔样品中1~20 μg/mg毒死蜱、1~20 μg/mg吡虫啉和5~30 μg/mg残杀威采用改良的QuEChERS提取,HPLC图谱目标峰较对称、检出限较低分别为0.89,0.55,0.39 μg/mL,回收率分别达到94%~108%,68%~109%,109%~125%,相对标准偏差分别为7.79%~10.92%,2.48%~5.03%,2.32%~6.77%,基本可满足《农药残留试验准则》中所要的范围;采用GB/T 24691—2009的方法目标峰也较为对称,检出限分别为0.8,0.78,0.54 μg/mL,回收率低分别为25%~87%,107%~195%,53%~93%,相对标准偏差高分别为6.89%~9.42%,5.61%~7.73%,5.44%~10.45%;2种方法出峰时间都分别在5.1,3.8,11.5 min左右。表明改良的QuEChERS法在检测柑桔农残毒死蜱、吡虫啉和残杀威时,优于GB/T 24691—2009的方法。

表3 HPLC加标回收率及变异系数
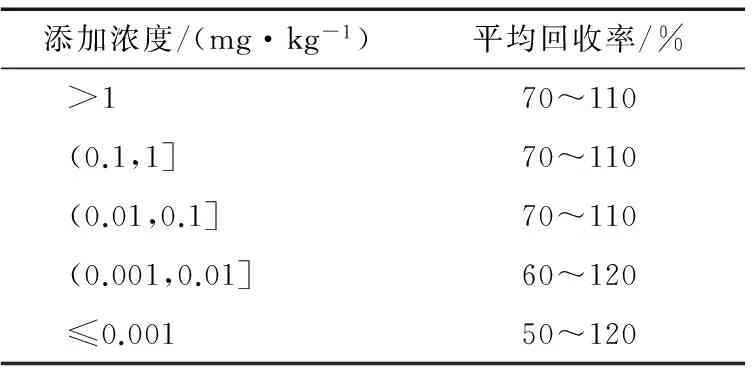
表4 《农药残留试验准则》中不同添加浓度要求的回收率

表5 《农药残留试验准则》中不同添加浓度回收率试验要求的相对标准偏差
本试验采用简单、快捷、高效的改良-QuEChERS法,将其运用到农残检测领域,具有替代GB/T 24691—2009中检测毒死蜱、吡虫啉和残杀威3种农残的潜质。同时,本试验对仪器和试验条件要求不高,适合大多数实验室开展农残分析。但基质效应是农残检测定量分析中影响准确性的重要因素[18-20],本试验中基质效应虽低于国标,但还需从中寻找更优的方法,以降低基质效应或建立有效的基质效应补偿措施。
[1] 齐乐, 祁春节. 世界柑桔产业现状及发展趋势[J]. 农业展望, 2016, 12(12): 46-52.
[2] 张耀海, 焦必宁, 赵其阳, 等. 我国主产地柑桔的农药残留现状研究[J]. 食品与发酵工业, 2011, 37(4): 189-193.
[3] SELLERGREN B. Direct Drug Determination by Selective Sam-ple Enri-chment on an Imprinted Polymer [J]. Analytical Chemistry, 1994, 66(9): 1 578-1 582.
[4] 李文秀, 徐可欣. 蔬菜农药残留检测的红外光谱法研究[J]. 光谱学与光谱析, 2004, 24(10): 1 202-1 204.
[5] 张秀尧, 蔡欣欣, 陈洛略, 等. 缓冲QuEchERs法提取气相色谱火焰光度检测法快速测定水果蔬菜中39种有机磷农药残留[J]. 中国卫生检验杂志, 2007, 17(12): 2 133-2 135.
[6] ANASTASSIADES M, LEHOTAY S, STAJNBAHER D. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
[7] PAREJA L, CESIO V, HEINZEN H, et a1. Evaluation of various QuEChERS based methods for the analysis of herbicides and other commonly used pesticides in polished rice by LC-MS/MS[J]. Talanta, 2011, 83(5): 1 611-1 622.
[8] Technical Committee CEN/TC 275. BS EN 15662:2008 Foods of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrileextraction/partitioning and clean-up by dispersive SPE-QuEChERS-method[S]. [S. l.]: Standards Policy and Strategy Committee, 2008.
[9] 何进林, 张志华. 高效液相色谱法测定水果中吡虫啉农药残留量[J]. 食品科学, 2011, 32(6): 230-232.
[10] 鲁红, 吴国杰, 梁世强, 等. QuEChERS/超高效液相色谱—高分辨飞行时问质谱联用法测定蔬菜中4种有机磷农药残留[J]. 广东农业科学, 2012, 39(11): 181-184.
[11] LEHOTAY S J, MASTOVSKA K, LIGHFIELD A R. Use of buffering to improve results of problematic pesticides in a fast and easy method for residue analysis of fruits and vegetables[J]. Journal of AOAC International, 2005, 88(2): 615-629.
[12] AYSAL P, AMBRUS A, LEHOTAY S J, et al. Validation of an efficient method for the determination of Pestieide residues in fruits and vegetables using ethyl acetate for extraction[J]. Journal of Environmental Science and Health, 2007, 42(5): 481-490.
[13] LESUEUR C, KNITTL P, GARTNER M. Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuEChERS method[J]. Food Control, 2008, 19(9): 906-914.
[14] LEHOTAY S J, SON K A, KWON H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2010, 1 217(16): 2 548-2 560.
[15] PAYA P, ANASTASSIADES M, MACK D, et al. Analysis of pesticide residues using the Quick Easy Cheap Effective Rugged and Safe (QuEChERS) pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection[J]. Analytical and Bioanalytical Chemistry, 2007, 389(6): 1 697-1 714.
[16] 刘洪林, 童华荣, 曾艺涛, 等. 农药残留分析前处理方法研究进展[J]. 食品与机械, 2014, 30(5): 299-304.
[17] 张帆, 李忠海, 黄媛媛, 等. 改良QuEChERS—气相色谱法测定茶油中有机磷类农药残留[J]. 食品与机械, 2013, 29(5): 87-90.
[18] FRENICH A G, VIDAL E L M, MONTORO P, et al. High-throughput determination of pesticide residues in food commodities by use of ultraperformance liquid chromatography-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2008, 390(3): 947-959.
[19] 王连珠, 周昱, 陈泳, 等. QuEChERS样品前处理—液相色谱—串联质谱法测定蔬菜中66种有机磷农药残留量方法评估[J]. 色谱, 2012, 30(2): 146-153.
[20] 潘媛, 牛华, 马雪涛, 等. 阿维菌素类农残检测方法的优化[J]. 食品与机械, 2012, 28(3): 90-92.
Detected chlorpyrifos, imidacloprid, and propoxur residues in citrus by QuEChERS-high performance liquid chromatography method
SUN Zhi-gao1,2SHENG Ran1HAO Jing-mei1LONG Yong1YU Feng-sheng1FANG Ming1
(1. College of Food Science Southwest University, Chongqing 400715, China;2. Southwest University, Citrus Research Institute, Chongqing 400712, China)
QuEChERS is a simple and efficient extraction method, widely used in the pesticide of residue detection. The purpose of this paper was to compare the extraction methods of pesticides between the improved QuEChERS method and the GB/T 24691—2009 (fruit and vegetable detergent). The extraction of pesticide residue from citrus samples were detected by HPLC. The results showed that when the chlorpyrifos, imidacloprid and propoxur were detected by the improved QuEChERS method, the peak time was about 5.1, 3.8, 11.5 min, respectively. When the spiked blank levels were 0.8~80, 0.5~40, 0.8~80 μg/mL, the detection limits were 0.89, 0.55, and 0.39 μg/mL. While the spiked blank levels respectively were in 1~20, 1~20, 5~30 μg/mL, the recovery rate was 68%~109%, 94%~108%, 109%~125% and the relative standard deviation was 2.48%~5.03%, 7.79%~10.92%, 2.32%~6.77% respectively. When the fruit and vegetable detergent extracted from GB/T 24691—2009, the peak time of chlorpyrifos, imidacloprid and propoxur was basically the same as the modified QuEChERS method. Moreover, when the same spiked blank level was applied to the improved QuEChERS method, the detection limits were 0.80, 0.78, and 0.54 μg/mL, respectively, The recoveries were 107%~195%, 25%~87% and 53%~93%, and the relative standard deviations were 5.61%~7.73%, 6.89%~9.42% and 5.44%~10.45%, respectively. Thus, it indicated that the improved QuEChERS-HPLC was better than GB/T 24691—2009 (fruit and vegetable detergent).
QuEChERS; high performance liquid chromatography; chlorpyrifos;imidacloprid; propoxur
四川省科技计划项目(编号:2014NZ0062)
孙志高(1964—),男,西南大学副研究员,硕士生导师。 E-mail: cpro@cric.cn
2017—03—20
10.13652/j.issn.1003-5788.2017.06.014
