白藜芦醇调节微小RNA-29b表达抑制高糖诱导的大鼠视网膜muller细胞凋亡
2017-08-08曾凯宏余雪梅黄璐娇
曾凯宏,王 元,邓 波,余雪梅,宋 怡,周 雪,黄璐娇
(1.四川省医学科学院.四川省人民医院临床营养科,四川 成都610072;2.电子科技大学医学院,四川 成都610054)
白藜芦醇调节微小RNA-29b表达抑制高糖诱导的大鼠视网膜muller细胞凋亡
曾凯宏1,2,王 元2,邓 波1,余雪梅1,宋 怡1,周 雪1,黄璐娇1
(1.四川省医学科学院.四川省人民医院临床营养科,四川 成都610072;2.电子科技大学医学院,四川 成都610054)
目的 研究白藜芦醇(RSV)防护糖尿病早期视损伤的分子机制。方法通过建立视网膜muller细胞(RMCs)体外高糖模型,采用免疫荧光双标、qRT-PCR、western blot、Annexin V/PI流式细胞技术检测高糖和RSV对微小RNA-29b(miR-29b)、特异蛋白1(SP1)表达及RMCs凋亡的影响。结果高糖培养后,miR-29b和SP1表达明显改变,RMCs凋亡率明显增加,RSV干预可明显抑制高糖诱导的miR-29b和SP1异常表达和RMCs凋亡;通过预先在RMCs中转染miR-29b类似物和miR-29b抑制剂研究发现,RSV抑制凋亡作用受明显影响(P<0.05)。结论RSV通过调节miR-29b表达发挥抗糖尿病早期视损伤作用。
白藜芦醇;微小RNA-29b;特异蛋白1;糖尿病视网膜病变;凋亡,
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最为常见的并发症之一,是世界范围内致盲的主要眼病,国内外目前尚无有效治疗措施[1,2]。大量研究表明,在DR早期视网膜微血管病变之前即可检测到视网膜muller细胞(retinal muller cells,RMCs)凋亡[3~5]。Silva 等[6]研究 DR 早期神经细胞微小RNA(MicroRNA,miRNA)表达时发现,miR-29b在DR早期RMCs凋亡中起重要作用。miR-29b通过调节转录因子特异蛋白1(Specificity protein 1,SP1)表达参与 DR早期 RMCs凋亡。白藜芦醇(resveratrol,RSV)是葡萄、花生、决明子和虎杖等天然植物中的一种有效成分,具有广泛的生物学和药理学作用[7]。近年研究发现,RSV不仅能降低 DR大鼠血糖水平,抑制胰岛β细胞凋亡,还能增加DR大鼠肌细胞、肝细胞及脂肪细胞对葡萄糖的摄取能力,增加肝细胞的糖原合成能力等[8,9]。RSV对DR早期RMCs凋亡有无作用,尚不清楚。
本研究通过建立体外培养的 RMCs高糖模型,观察高糖和RSV对miR-29b、SP1表达和RMCs凋亡的影响。本研究旨在揭示RSV防护DR早期病变的分子机制,为指导人们通过膳食途径防治DR提供科学依据。
1 材料与方法
1.1 材料2013年1月至2015年12月,出生后3~5 d的Sprague Dawley(SD)大鼠10只,由四川省医学科学院·四川省人民医院实验动物研究所提供;白藜芦醇、各种抗体、荧光定量PCR试剂、Western blot试剂及各种试剂盒购于美国Sigma公司。
1.2 方法
1.2.1 细胞培养 出生后3~5 d的新生SD大鼠,用750 ml/L酒精浸泡消毒同时麻醉,无菌条件下取眼球,双抗PBS漂洗数遍,小心剥离视网膜,加入5 g/L胰蛋白酶,37℃消化20~30 min,充分吹打,加入含200 ml/L血清的培养基终止消化,不锈钢网过滤,1000 r/min离心3~5 min,培养基重悬,离心,反复2次。去上清后加入含200 ml/L血清的培养基制细胞悬液,调细胞密度为3×108个/L,接种于25cm2培养瓶中。3d换培养基,9 d后,将培养瓶密封,放入恒温摇床,200 r/min摇24 h进行RMCs纯化。细胞形态一致后,1:2传代分瓶,第2/3代细胞用于实验。细胞传代后接种于预置盖玻片的24孔培养板中,24 h完全伸展后进行鉴定。用RMCs标志物谷氨酰胺合成酶GS、谷氨酸转运蛋白GLAST和波形蛋白 vimentin联合,免疫细胞荧光双标鉴定RMCs。
1.2.2 细胞鉴定 细胞爬片以40 g/L多聚甲醛固定30 min,PBS 漂洗5 min×3次,用含10 g/L BSA、5 ml/L TritonX-100的PBS缓冲液孵育30 min,同前漂洗后,用含50~100 ml/L正常羊血清的PBS缓冲液孵育10 min,加1:2000稀释的 Anti-GS和Anti-GLAST,4℃过夜(同时设PBS替代一抗的空白对照和正常羊血清替代一抗的替代对照),PBS漂洗后与罗丹明标记的荧光二抗37℃孵育30 min,PBS漂洗后加1 ∶200稀释的 Anti-vimentin,37℃,2 h,PBS漂洗后与FITC标记的荧光二抗37℃孵育30 min,PBS漂洗后加Hoechst于37℃孵育5 min,PBS缓冲液漂洗后,900 ml/L甘油封片,激光共聚焦显微镜观察照相。第3代的RMCs用于试验。
1.2.3 高糖模型建立及实验分组 高糖模型建立参照我们以往方法[3-5],待细胞达80%融合时,弃掉含血清的培养液,换无血清的培养液培养24 h后,再换成含不同浓度葡萄糖的培养液,分别为:5、10、15、20、25、30、35、40 mM,通过 12、24、36、48、72 h 观察后,确立RMCs高糖模型的最适葡萄糖浓度为25 mM。实验分10组,分别是:正常对照组(CON)(普通培养基培养的细胞,不含葡萄糖和RSV);10、20、30 mM RSV干预正常对照组(CON+10 mM RSV,CON+20 mM RSV,CON+30 mM RSV);高糖组(HG)(25 mM葡萄糖的培养基培养的细胞);10、20、30 mM RSV 干预高糖组(HG+10 mM RSV,HG+20 mM RSV,HG+30 mM RSV)以及甘露醇高渗对照组(CON+mannitol,HG+mannitol)。
1.2.4 MiR-29b类似物和miR-29b抑制剂转染细胞 根据miR-29b序列合成miR-29b抑制剂和miR-29b类似物,然后转染入细胞。取对数期细胞,待细胞融合至80%后进行转染,将0.4 μg质粒DNA加入50 μl无血清培养基中(动作轻柔)。再把2 μl lipofectamine TM 2000 脂质体稀释至 50 μl,室温放置5 min,二者轻轻混合,室温放置20 min。吸出培养板中原液,轻柔加入配制好的含质粒DNA和脂质体复合物的转染培养基,总体积500 μl。放置于饱和湿度,37℃,5%CO2孵箱孵育4~6 h,再换新鲜培养基培养24 h。
1.2.5 QRT-PCR检测miR-29b和SP1 mRNA表达采用实时荧光定量PCR法(qRT-PCR)检测微小RNA-29b(miR-29b)和特异蛋白1(SP1)基因表达,分别设计微小RNA-29b(miR-29b)和特异蛋白1(SP1)基因引物以及TaqMan荧光探针(由大连宝生物公司合成)。引物序列为:微小RNA-29b(miR-29b):5'-CGTAGCACCATTTGAAATCAGTGTT-3',5'-GTGCAGGGTCCGAGGT-3';特异蛋白 1(SP1):5'-AGG TGC ACC AGC TTC CAG GCC TG-3',5'-CCA GGT CCA TGA AGG CCA AGT TG-3';核糖体蛋白L13 A(RPL13 A):5'-AAGCCTACAAGAAAGTTTGCCTATC-3',5'-TGTTTCCGTAGCCTCATGAGC-3'。 用常规酚/氯仿法提取大鼠 RMCs的 mRNA,进行qPCR 反应,反应体系 25 μl:2×TaqMan University PCR 混合液 12.5 μl,10 μmol/L 正反向引物各 0.5 μl,10 μmol/L TaqMan 探 针 0.3 μl,100 ng/ μl DNA0.2 μl,同时设立内对照核糖体蛋白 L13 A(RPL13 A)基因,反应在ABI Prism 7000荧光定量PCR仪上进行。反应条件为:93°C 2 min,93°C 1 min,55°C 1 min,共40个循环。采用低循环数(Ct)比较法计算目的基因的相对拷贝数与表达量。
1.2.6 Western blot检测特异蛋白1(SP1)蛋白表达 常规提取细胞总蛋白,Lowry法利用核酸蛋白检测仪测定蛋白浓度,各取蛋白样品30 μg上样,12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,转移至PVDF膜,1%BSA的TBST封闭,加相应各抗体4℃孵育过夜;加1∶20稀释SP-9002试剂盒中的二抗及三抗孵育,37℃振摇1 h;DAB避光显色3~5 min,至理想条带出现,对PVDF膜扫描存盘。
1.2.7 Annexin V/PI双标记法凋亡检测细胞凋亡以Annexin V/PI凋亡试剂盒检测细胞凋亡,细胞处理后,用4℃预冷的 PBS洗细胞2次,再用250 μl稀释的binding缓冲液重新悬浮细胞,并使其浓度为1×106/ml,取 100 μl的细胞悬液于 5 ml流式管中,加 5 μl Annexin V/FITC 溶液和 10 μl 20 μg/ml的 PI溶液,混匀后于室温避光放置15 min,在反应管中加400 μl PBS,流式细胞仪上机检测。
1.3 统计学方法统计分析采用SPSS 19.0软件。计量资料采用均数±标准差表示,两组数据间的比较采用独立样本t检验,多组数据间的比较采用单因素方差分析,相关性用双变量分析,计数资料采用χ2检验,Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 SD大鼠RMCs体外原代培养及鉴定取出生3~5天的新生SD大鼠视网膜进行原代视网膜细胞培养,培养9天后后,细胞达80%以上融合,胞体呈长纤维形,胞浆丰富,胞膜清晰,单核或多核,核呈椭圆形,位于细胞中央,整个视野可见典型的神经细胞、RMCs和神经节细胞,此时可进行RMCs纯化培养。纯化24 h后,细胞分布均匀,形态基本一致,生长情况良好,可见清晰的长梭形RMCs。以RMCs特征性标志物GS、Vimentin和GLAST对细胞进行鉴定,Hoechst 33342复染核,观察发现98%以上的细胞三种抗体染色呈阳性(图1)。
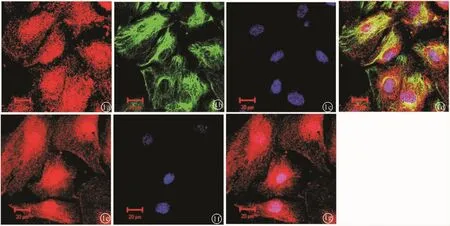
图1 谷氨酰胺合成酶、谷氨酸转运蛋白及波形蛋白联合鉴定大鼠视网膜muller细胞 a:谷氨酰胺合成酶鉴定大鼠视网膜 muller细胞;b:波形蛋白鉴定大鼠视网膜muller细胞;c:Hoechst 33342复染核;d:谷氨酰胺合成酶、波形蛋白及Hoechst 33342联合鉴定大鼠视网膜muller细胞;e:谷氨酸转运蛋白鉴定大鼠视网膜muller细胞;f:Hoechst 33342复染核;g:谷氨酸转运蛋白联合Hoechst 33342鉴定大鼠视网膜 muller细胞
2.2 RSV对高糖培养的大鼠RMCs miR-29b表达的影响qRT-PCR结果显示,与正常对照组(CON)相比,25 mM高糖培养组(HG)RMCs中miR-29b mRNA表达量明显降低(P<0.05),10、20和30 mM RSV(HG+10 mM RSV,HG+20 mM RSV,HG+30 mM RSV)干预明显增加高糖组(HG)miR-29b mRNA表达量,呈剂量依赖关系,10、20和30 mM RSV(HG+10 mM RSV,HG+20 mM RSV,HG+30 mM RSV)干预高糖组miR-29b mRNA表达量分别比未干预组增加了2.4倍、3.3倍和3.4倍(P<0.05)。10、20和30 mM RSV干预对正常组(CON+10 mM RSV,CON+20 mM RSV,CON+30 mM RSV)对miR-29b mRNA表达量无明显影响(P>0.05)。甘露醇高渗对照对miR-29b mRNA表达量无明显影响(P> 0.05),见图2。
2.3 RSV对高糖培养的大鼠RMCs SP1表达的影响高糖培养RMCs 72小时后,SP1 mRNA表达量明显增加,10、20和30 mM RSV干预明显降低高糖组SP1 mRNA表达量(P<0.05)。同样,高糖培养组(HG)SP1蛋白表达量也明显高于正常对照组(CON)(P < 0.05)。10、20和 30 mM RSV(HG+10 mM RSV,HG+20 mM RSV,HG+30 mM RSV)干预明显降低高糖组(HG)SP1蛋白表达量(P<0.05)。正常对照组(CON)SP1 mRNA和蛋白表达量与10、20和30 mM RSV干预正常对照组(CON+10 mM RSV,CON+20 mM RSV,CON+30 mM RSV)无明显差异(P>0.05)。甘露醇高渗对照对SP1 mRNA和蛋白表达量无明显影响(P>0.05),见图3。

图2 白藜芦醇对大鼠视网膜muller细胞(RMCs)miR-29b mRNA表达的影响 与CON比较,***P<0.001;与HG比较,##P<0.01,###P <0.001
2.4 RSV经调节miR-29b表达抑制高糖诱导的RMCs凋亡通过Annexin V/PI染色流式细胞分析发现,HG培养后,大鼠视网膜RMCs凋亡率明显高于正常对照组(CON),20 mM RSV(HG+20 mMRSV)干预可明显降低HG组RMCs凋亡率。为了研究miR-29b在RSV抗凋亡中的作用,我们预先在细胞中转染了miR-29b类似物和miR-29b抑制剂,如图4所示,当细胞中转染了miR-29b抑制剂时,RSV抗高糖诱导的RMCs凋亡作用被逆转;当细胞中转染了miR-29b类似物后,RSV抗凋亡作用增加,表明RSV可能通过miR-29b发挥抗高糖诱导的RMCs凋亡。
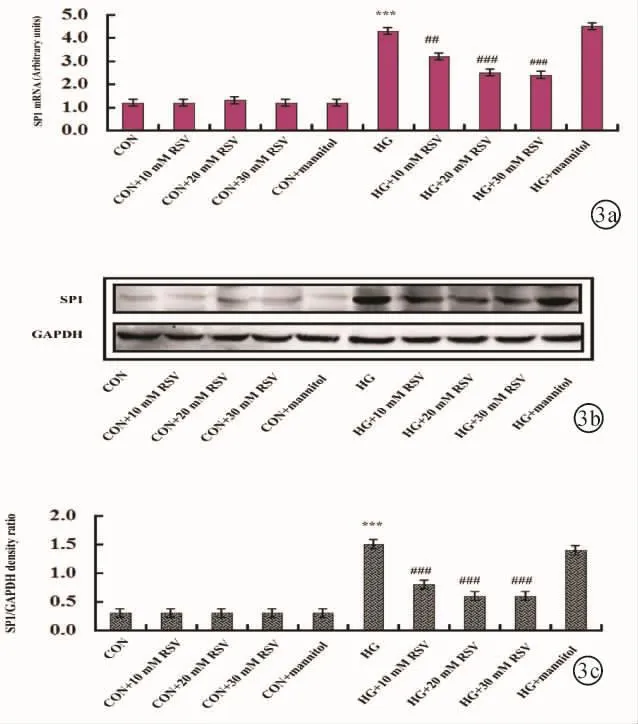
图3 白藜芦醇对大鼠视网膜muller细胞(RMCs)SP1 mRNA和蛋白表达的影响 a:QRT-PCR检测大鼠视网膜 muller细胞(RMCs)SP1 mRNA表达量;b:Western blot检测大鼠视网膜muller细胞(RMCs)SP1蛋白表达量(代表图像);c:SP1与GAPDH蛋白表达量相对密度比值,与CON比较,***P<0.001;与HG比较,##P <0.01,###P <0.001

图4 白藜芦醇通过调节miR-29b表达抑制高糖诱导的大鼠视网膜muller细胞凋亡 a:Annexin V/PI双标流式细胞技术检测细胞凋亡(代表图像);b:大鼠视网膜 muller细胞凋亡比率 与CON比较,***P<0.001,###P<0.001&P<0.05,与HG+20mM RSV比较,&&&P<0.001 versus
3 讨论
糖尿病发展成DR是一个缓慢的过程,一般需要5~6年的时间。糖尿病明确诊断、眼底出现改变之前的阶段被称作DR的临床前期。研究发现,DR的临床前期是先有视网膜神经的损害,然后才是组织学或是检眼镜下可见的血管异常[1,3-5]。我们前期研究也证实,DR早期RMCs结构和功能均发生异常改变,主要表现为胶质反应性增生、谷氨酸代谢异常、血管内皮细胞生长因子(VEGF)上调表达及RMCs凋亡。通过抑制DR早期RMCs损伤,将能阻止 DR 微血管病变,从而避免致盲[3~5]。
目前,国内外关于DR防护的研究不胜枚举,多数研究证明,高级糖基化终产物抑制剂、蛋白激酶C抑制剂、肾素-血管紧张素系统抑制剂及一些抗氧化剂等对DR有防护效应,但对DR早期视损伤防护效果不明显[7~9]。我们采用抗氧剂牛磺酸对DR早期RMCs损伤干预后发现,低浓度的牛磺酸干预对RMCs损伤基本没有防护效应,高浓度牛磺酸干预对RMCs损伤虽有一定防护效应,但牛磺酸干预后DR早期患者视功能改善情况并不理想[4]。可能存在以下两个原因:①作用效力不够;②作用时间滞后。因而寻找更有效、更早期的抗RMCs损伤的DR早期防治措施十分必要。
本研究我们通过体外建立RMCs高糖模型,通过不同剂量RSV干预发现,高糖培养后,miR-29b和SP1表达明显改变,RMCs凋亡率明显增加,RSV干预可明显抑制高糖诱导的miR-29b和SP1异常表达和RMCs凋亡。通过预先在细胞中转染了miR-29b类似物和miR-29b抑制剂发现,RSV抑制凋亡作用受明显影响,初步提示RSV通过miR-29b发挥抗糖尿病早期视损伤作用。
[1]Zhou T,Che D,Lan Y,et al.Mesenchymal marker expression is elevated in Müller cells exposed to high glucose and in animal models of diabetic retinopathy[J].Oncotarget,2017,8(3):4582-4594.
[2]赵帅,尹妮.激光光凝治疗糖尿病视网膜病变后的药物干预[J].实用医院临床杂志,2016,13(2):117-118.
[3]Zeng K,Yang N,Wang D,et al.Resveratrol prevents retinal dysfunction by regulating glutamate transporters,glutamine synthetase expression and activity in diabetic retina[J].Neurochem Res,2016,41(5):1050-1064.
[4]Zeng K,Ming J,Yang N,et al.Taurine prevents high glucose-induced angiopoietin-2/tie-2 system alterations and apoptosis in retinal microvascular pericytes[J].Mol Cell Biochem,2014,396(1-2):239-248.
[5]Zeng K,Xu H,Chen K,et al.Effects of taurine on glutamate uptake and degradation in Müller cells under diabetic conditions via antioxidant mechanism[J].Mol Cell Neurosci,2010,45(2):192-199.
[6]Silva VA,Polesskaya A,Sousa TA,et al.Expression and cellular localization of microRNA-29b and RAX,an activator of the RNA-dependent protein kinase(PKR),in the retina of streptozotocin-induced diabetic rats[J].Mol Vis,2011,17:2228-2240.
[7]Goutham G,Manikandan R,Beulaja M,et al.A focus on resveratrol and ocular problems,especially cataract:From chemistry to medical uses and clinical relevance[J].Biomed Pharmacother,2017,86:232-241.
[8]Ghadiri Soufi F,Arbabi-Aval E,Rezaei Kanavi M,et al.Anti-inflammatory properties of resveratrol in the retinas of type 2 diabetic rats[J].Clin Exp Pharmacol Physiol,2015,42(1):63-68.
[9]Bola C,Bartlett H,Eperjesi F.Resveratrol and the eye:activity and molecular mechanisms[J].Graefes Arch Clin Exp Ophthalmol,2014,252(5):699-713.
Resveratrol inhibits the apoptosis of rats retinal muller cells induced by high glucose via regulating miRNA-29b expression
ZENG Kai-hong1,2,WANG Yuan2,DENG Bo1,YU Xue-mei1,SONG Yi1,ZHOU Xue1,HUANG Lu-jiao1(1.Department of Clinical Nutrition,Sichuan Academy of Medical Sciences &Sichuan Provincial People's Hospital,Chengdu 610072,China.2.School of Medicine,Chengdu University of E-lectronic Science and Technology,Chengdu 610054,China)
Objective To investigate the molecular mechanisms of protecting early diabetic retinopathy by resvertrol(RSV).MethodsThe effects of RSV on expressions of miRNA-29b(miR-29b)and specificity protein 1(SP1)as well as apoptosis of retinal muller cells(RMCs)were investigated through development of rat RMCs hyperglucose model in vito,and mothods of immunofluorescence,qRT-PCR,western blot and Annexin V/PI flow-cytometry.ResultsHigh glucose induced down-regulation of miR-29b and upregulation of SP1 and increased the apoptosis of RMCs.The effects could be reversed by RSV in vitro.Moreover,the anti-apoptosis effect of RSV could be reversed by transfection of miR-29b analogues to RMCs and miR-29b inhibitor(P < 0.05).ConclusionResveratrol can inhibit diabetic retinopathy in early stage by regulation of miR-29b expression.
Resveratrol;miRNA-29b;Specificity protein 1;Diabetic retinopathy;Apoptosis
Q5
A
1672-6170(2017)04-0022-05
2017-03-12;
2017-05-31)
国家自然科学基金项目资助(编号:81202206);四川省卫生计生委项目资助(编号:150216)
