过氧化氢诱导视网膜色素上皮细胞氧化损伤模型的建立
2017-08-08杨影,曲超
杨 影,曲 超
(四川省医学科学院·四川省人民医院眼科,四川 成都 610072)
过氧化氢诱导视网膜色素上皮细胞氧化损伤模型的建立
杨 影,曲 超
(四川省医学科学院·四川省人民医院眼科,四川 成都 610072)
目的 探讨视网膜色素上皮细胞氧化损伤模型的构建方法。方法将培养的人视网膜色素上皮细胞分为对照组和实验组,实验组加入50、100、200、300、400 μmol/LH2O2,对照组不加入H2O2,采用MTT法检测细胞活力,在培养箱内分别培养2、8、24 h,采用CCK-8检测细胞抑制率,用比色法观察每组中超氧化物歧化酶(SOD)及丙二醛(MDA)含量的变化,流式细胞术检测细胞凋亡。结果人RPE细胞经200 μmol/LH2O2处理2、8、24 h后,与对照组比较细胞的活力、抗氧化物酶SOD活性均出现显著降低(P<0.05),MDA含量均有显著升高(P<0.01),细胞凋亡率较对照组显著升高,差异有统计学意义(P<0.01)。结论200 μmol/LH2O2作用处理人视网膜色素上皮细胞是体外模拟视网膜色素上皮细胞氧化损伤的良好模型。
过氧化氢;视网膜色素上皮细胞;氧化损伤
【Key words】Hydrogen peroxide;Retinal pigment epithelial cells;Oxidative damage
年龄相关性黄斑变性(age-related macular degeneration,AMD)又称为老年性黄斑变性(senile macular degeneration,SMD),在临床上既是常见病又是难治性疾病,常常引起患者视力下降甚至失明,且发病有逐年增加的趋势。关于AMD的病因尚未完全明了,有研究表明人视网膜色素上皮细胞(RPE)的氧化损伤在年龄相关性黄斑变性的发病和病程发展中起重要的作用,RPE抗氧化损伤的研究将对AMD等视网膜疾病的治疗开阔新的前景。
氧化应激是指细胞暴露于活性氧而引起的细胞损伤,过氧化氢(H2O2)是一类活性氧,其极易透过细胞膜与细胞内的铁离子(Fe2+)通过Fenton反应产生很高活性的羟自由基(·OH),攻击细胞结构从而引起细胞损伤[1],但这种损伤不会造成细胞死亡,而且在适宜的保护剂作用下,这些损伤还有可能被修复[2]。由于H2O2易于获得,性质相对稳定,所以其已成为研究细胞氧化损伤的重要工具。因此,本研究2015年1月至2016年5月以RPE细胞为研究对象,以H2O2为氧化损伤诱导剂,建立一种可靠的体外模拟氧自由基诱导细胞氧化损伤模型,旨在为后续研究氧化损伤的机制以及抗氧化应激药物的筛选提供试验基础。
1 材料与方法
1.1 材料与仪器人视网膜色素上皮细胞D407细胞系由四川省人民医院分子遗传中心实验室提供,H2O2溶液(购自美国 Sigma Aldrich公司),RPMI-1640培养基、胎牛血清(购自美国 GIBCO公司),MTT试剂盒、CCK-8试剂盒(购自美国 Sigma公司),总超氧化物歧化酶(SOD)检测试剂盒(购自中国LEAGENE公司,)丙二醛(MDA)测试盒(购自南京建成生物技术有限公司),流式细胞检测仪(美国Becton Dicknson),Annexin V-FITC流式凋亡试剂盒(美国BD公司),超净工作台 (购自苏州净化设备有限公司),细胞培养箱(购自美国Shellab公司)。
1.2 试验方法
1.2.1 细胞复苏与培养 遵守快融的原则,先将水浴锅调至37~37.5℃,从-80℃冰箱或者液氮罐里拿出人视网膜色素上皮细胞冻存管迅速投入37℃温水中,并轻轻摇动使其内容物迅速融化(最好在1min以内),取出冻存管,微微上下晃动冻存管,用75%酒精消毒后开启,用吸管吸出溶解后的细胞悬液,注入离心管并加入5 ml的含10%胎牛血清(FBS)的细胞培养液。以800~1000 rpm离心5 min,除去上清液,加入1 ml培养液吹打,使其形成悬浮液。用含20%FBS的细胞培养液适当稀释后,调整细胞浓度为50×106/ml接种到25 cm2培养瓶,置于37℃、饱和湿度、5%CO2孵箱中培养,每2d换液1次,细胞近铺满(80%~90%)时,用2.5 g/L胰蛋白酶消化传代。取对数生长期的人RPE传代细胞接种于6孔板及96孔板中。
1.2.2 H2O2浓度的筛选 将细胞按浓度1×106/ml接种于96孔板中,37℃培养24 h后分别加入0、50、100、200、300、400 μmol/L(n=6)H2O2,于培养箱内孵育24 h,每孔加入 20 μL 5 mg/ml MTT,将培养板在培养箱内孵育4~6小时,吸去培养液,每孔加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪OD490 nm处测量各孔的吸光值(A490)。细胞抑制率(%)=[A(对照组)-A(实验组)]/A(对照组)×100%,筛选出合适的H2O2浓度。
1.2.3 CCK-8检测细胞抑制率 收集生长良好的人RPE细胞,调整细胞浓度至1×106/ml,分别接种于96孔板中培养24 h,同步化后分成正常对照组和氧化损伤组,将200 μmol/L的H2O2加入细胞培养液中,将细胞置于5%CO2培养箱内分别培养2、8、24 h,向每孔加入10 μl CCK-8溶液,将培养板在培养箱内孵育1~4小时。用酶标仪测定在450 nm处的吸光度。
1.2.4 抗氧化物酶SOD活性检测 细胞处理及分组如1.2.3,收集细胞培养液,加入300 μl试剂A冰浴匀浆,4℃,10000 g离心10 min,收集上清,按照每个反应1.6 ml的体积,均匀混合1 mlSOD检测缓冲液、0.3 mlNBT显色液、0.3 ml酶溶液,加入反应启动工作液后充分混匀。取空白对照管置于暗处,其他各管置于4000Lx日光下反应20 min。,以不照光的空白对照管调零,用紫外分光光度计,比色杯光径为1 cm,检测560 nm处吸光度值。
1.2.5 MDA含量测定 细胞处理及分组同1.2.3,细胞处理结束后消化、离心收集细胞,按南京建成生物工程研究所提供的相应试剂盒说明书,用酶标仪测定530 nm处的吸光值(A530)。
1.2.6 流式细胞术检测细胞凋亡 细胞处理及分组同1.2.3,细胞处理结束后消化、离心收集细胞,加入Annexin V-FITC结合液,采用Annexin V-FITC流式凋亡试剂盒检测,计算细胞凋亡率。
1.3 统计学方法采用SPSS 16.0统计软件进行数据分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析和Turkey's多因素t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度H2O2处理对人RPE细胞活力的影响由表1可见,H2O2处理后细胞活力降低,细胞数量减少,并且呈现剂量依赖关系,H2O2的浓度越高,细胞存活率越低,细胞抑制率越高,当H2O2浓度为 50、100 μmol/L,细胞存活率高于 70%,当 H2O2浓度为 300、400 μmol/L,细胞存活率低于 30%,细胞形态破坏严重,存活细胞过少,不宜造模;当H2O2浓度为200 μmol/L,抑制率在53.20%时,损伤相对适中,差异有统计学意义(P<0.01),故后续试验选择200 μmol/LH2O2作为细胞氧化损伤的最佳浓度。
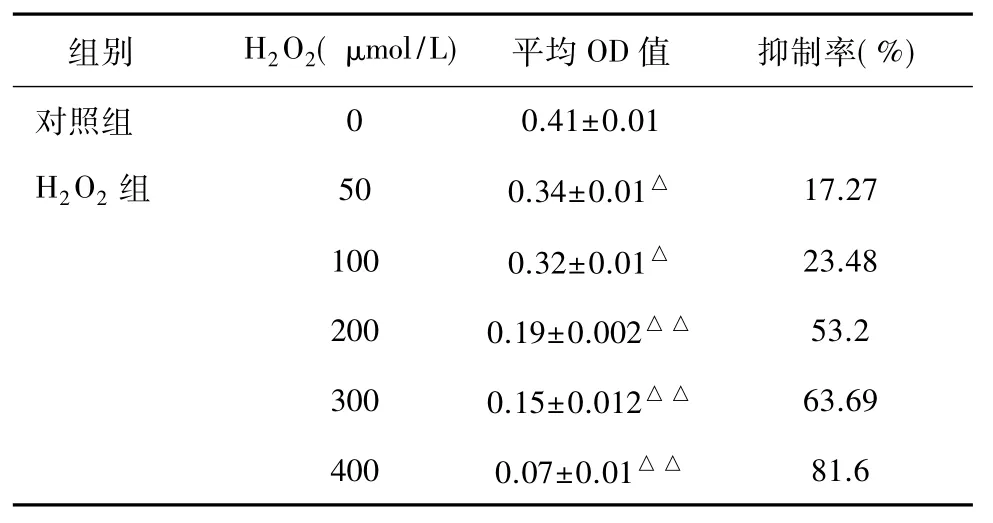
表1 不同浓度H2O2处理对人RPE细胞活力的影响
2.2 CCK-8检测不同作用时间H2O2对人RPE细胞活力的影响人RPE细胞经200 μmol/LH2O2处理2、8、24 h后,与对照组比较细胞的活力均出现极显著降低(P<0.01),而且与时间成依赖性,时间越长,活力越低,见表2。

表2 200 μmol/L H2O2处理对人RPE细胞活力的影响
2.3 200 μmol/L H2O2处理对人RPE细胞抗氧化物酶SOD活性的影响人RPE细胞经200 μmol/L H2O2处理2、8、24 h后,与对照组比较细胞抗氧化物酶SOD活性均出现显著降低(P<0.05),见表3。
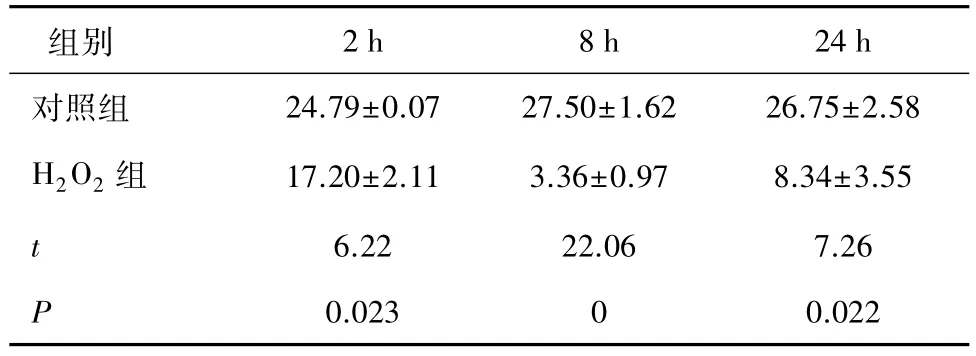
表3 200 μmol/L H2O2处理对人RPE细胞抗氧化物酶SOD活性的影响
2.4 200 μmol/L H2O2处理对人 RPE细胞 MDA含量的影响人RPE细胞经200 μmol/L H2O2处理2、8、24 h后,与对照组比较细胞MDA含量均有显著升高(P<0.01),见表4。

表4 200 μmol/L H2O2处理对人RPE细胞MDA含量的影响
2.5 200 μmol/L H2O2处理对人RPE细胞凋亡率的影响人RPE细胞经200 μmol/L H2O2处理2、8、24 h后,与对照组比较,细胞凋亡率显著升高,差异有统计学意义(P<0.01),与时间成依赖性,见表5。

表5 200 μmol/L H2O2处理对人RPE细胞凋亡率的影响 (%)
3 讨论
RPE细胞的损伤、衰老及死亡在AMD发病和病程发展中起到重要作用[3]。氧化应激被认为是许多疾病的一个重要组成部分,已经被在许多种疾病的细胞模型中进行研究。视网膜因为其对于氧气的大量消耗及不饱和脂肪酸的高构成比和暴露于可见光中,使视网膜对于氧化应激极为敏感[4]。视网膜色素上皮细胞构成了光感受器与脉络膜之间的血-视网膜屏障的外层。视网膜色素上皮细胞清除光感受器副产物等生理功能,导致它们整个生命过程持续暴露于一定数量的活性氧(ROS)中,包括过氧化氢和超氧化物[5,6]。尽管有多种生理性防御机制存在,来保护视网膜-视网膜色素上皮免于氧化损伤,有证据显示累积的氧化暴露破坏视网膜色素上皮细胞连接和屏障的完整性,诱导视网膜色素上皮细胞起泡[7,8]。这些改变使视网膜易于发生黄斑变性。
本研究采用MTT法检测不同浓度H2O2处理对人RPE细胞活力的影响,发现H2O2处理后细胞活力降低,细胞数量减少,并且呈现剂量依赖关系,H2O2的浓度越高,细胞存活率越低,细胞抑制率越高,当 H2O2浓度为200 μmol/L,抑制率在53.20%时,损伤相对适中,和对照组比较有显著统计学意义,故后续试验选择200 μmol/LH2O2作为细胞氧化损伤的最佳浓度。同时采用CCK-8检测人RPE细胞经200 μmol/LH2O2处理 2、8、24 h 后细胞活力的变化,与对照组比较细胞的活力均出现显著降低,而且与时间成依赖性,说明细胞氧化损伤模型构建成功。
针对细胞氧化损伤相关的其他指标,如MDA、SOD等指标的检测,有助于更准确地描述氧化损伤模型细胞的功能,特别是细胞抗氧化系统功能的变化,进一步确认模型的构建是否合理;同时观察这些指标在对照组和损伤组中的变化趋势,也有助于推测和理解下一步研究中的目标药物发挥保护(或损伤)作用的机制[9~12]。
SOD是体内最重要的氧自由基清除剂,其基础水平代表了细胞对抗氧自由基的能力,而损伤过程中SOD下降反映了细胞遭受氧化损伤攻击的严重程度。本研究中人RPE细胞经200 μmol/L H2O2处理2、8、24 h后,与对照组比较细胞抗氧化物酶SOD活性均出现显著降低,间接反映了细胞的结构和功能损伤程度。
细胞受到H2O2损伤后,细胞内生成大量活性自由基,引发细胞膜上脂质过氧化反应,生成终产物MDA;并且大量损耗细胞内源性抗氧化剂如 GSH等,破坏细胞内氧化与抗氧化平衡,使细胞处于氧化应激状态[13~16],MDA 作为脂质过氧化的天然产物,可以一定程度上反映ROS造成损伤的程度,本研究发现人 RPE 细胞经 200 μmol/L H2O2处理 2、8、24 h后,与对照组比较细胞MDA含量均有显著升高,说明H2O2处理引起了细胞内脂质强烈的过氧化反应。
本研究采用流式细胞术检测细胞凋亡率,发现经 200 μmol/L H2O2处理 2、8、24 h 后,与对照组比较细胞凋亡率有极显著差异,说明200 μmol/LH2O2作用处理人RPE细胞后,诱导了明显的细胞凋亡或坏死。
综合上述,200 μmol/LH2O2作用处理人RPE细胞,不仅影响了细胞的活性、诱导了明显的凋亡或坏死,而且伴随着细胞内ROS升高、脂质过氧化升高、SOD耗竭等一系列变化,符合RPE细胞氧化应激过程中应有的反应,且这些指标的变化具有良好的稳定性和可重复性,损伤组和对照组间变化的幅度也均达到了统计学的要求,有利于体外研究和筛选抗氧化药物,是体外模拟RPE细胞氧化损伤的良好模型。
[1]Farombi E O,Moller P,Dragsted L O.Ex-vivo and in vitro protective effects of kolaviron against oxygen-dervied radical-induced DNA damage and oxidative stress in human lymphocyles and rat liver cells[J].Cell Biology and Toxicology,2004,20:71-82.
[2]金明,王玉娇,金梅花,等.两种细胞建立肝细胞氧化损伤模型比较[J].中国公共卫生,2015,31(3):324-326.
[3]Curcio CA,Johnson M,Huang JD,Rudo lf M.Apolipo protein B-containing lipo proteins in retinal aging and age-related m aculardegeneratio n[J].J Lipid Res,2010,51(3):451-467.
[4]Beatty S,Koh H,Phil M,et al.The role of oxidative stress in the pathogenesis ofage-related macular degeneration[J].Surv Oph-thalmol,2000,45(2):115-134.
[5]Wang ZY,Shen LJ,Tu L,et al.Erythropoietin protects retinal pigment epithelial cells from oxidative damage[J].Free Radic Bi-ol Med,2009,46(8):1032-1041.
[6]Miceli MV,Liles MR,Newsome DA.Evaluation of oxidative processes in human pigment epithelial cells associated with retinal outer segment phagocytosis[J].Exp Cell Res,1994,214(1):242-249.
[7]Bailey TA,Kanuga,Romero IA,et al.Oxidative stress affectsthe junctional integrity of retinal pigment epithelial cells[J].Invest Ophthalmol Vis Sci,2004,45(2):675-684.
[8]Strunnikova N,Zhang C,Teichberg D,et al.Survival of retinalpigment epithelium after exposure to prolonged oxidative injury:adetailed gene expression and cellular analysis[J].Invest Ophthal-mol Vis Sci,2004,45(10):3767-3777.
[9]Zamudio-Cuevas Y,Díaz-SobacR,Vázquez-Luna A,etal.The antioxidant activity of soursop decreases the expression of a member of the NADPH oxidase family[J].Food Funct,2014,5(2):303-309.
[10]Kyrylkova K,Kyryachenko S,Leid M,et al.Detection of apoptosis by TUNEL assa[J].Methods MolBiol,2012,887:41-47.
[11]Loo DT.In situ detection of apoptosis by the TUNEL assay:an overview of techniques[J].Methods MolBiol,2011,682:3-13.
[12]Skindersoe ME,Kjaerulff S.Comparison of three thiolprobes for determination of apoptosis-related changes in cellular redox status[J].Cytometry A,2014,85(2):179-187.
[13]张欣,赵新淮.几种多酚化合物对 H2O2和 CCl4诱导人肝细胞损伤的保护[J].食品科学,2009,30(3):262-266.
[14]王东,姜丽萍,刘晓芳,等.鞣花酸对HEK-293细胞DNA损伤作用[J].中国公共卫生,2013,29(11):1630-1632.
[15]李炯,王忠彦,于敏.δ阿片受体激活对过氧化氢损伤的心肌细胞的保护作用[J].中国药理学与毒理学杂志,2009,23(6):431-435.
[16]孙婧陶,李兆华,张宝修,等.过氧化氢诱导延边奶山羊乳腺上皮细胞氧化损伤模型的建立[J].江苏农业科学,2013,41(10):149-152.
Development of a model of oxidative damage of human retinal pigment epithelial cells induced by hydrogen peroxide
YANG Ying,QU Chao (Department of Ophthalmology,Sichuan Academy of Medical Sciences & Sichuan Provincial People's Hospital,Chengdu,610072,China)
QU Chao
Objective To develop a model of oxidative damage of retinal pigment epithelial(RPE)cells.MethodsCultured human RPE cells were divided into normal group and experimental group.The experimental group was treated with 50,100,200,300 and 400 μmol/L H2O2while the control group was not treated with H2O2.The cell growth inhibition rate was detected with MTT assay,The incubator was cultured for 2,8,and 24 h and the cell inhibition rate was detected by using CCK-8.The changes in superoxide dismutase(SOD)and malondialdehyde(MDA)were measured with colorimetry method.Flow cytometry was used to detect the cell apoptosis rate.ResultsCompared to the control group,the vitality of humna RPE cells and the activity of antioxidant enzyme SOD were significantly reduced after 2,8 and 24 hours of treatment(P < 0.05),but MDA content was significantly increased(P < 0.01).Apoptosis rate were significantly higher in the control group when compared to the experimental group(P < 0.01).ConclusionHuman RPE cells treated with 200 μmol/L H2O2is an appropriate model of oxidative damage of RPE cell in vitro.
R774.1
A
1672-6170(2017)04-0018-04
2016-12-12;
2017-04-24)
四川省科技厅应用基础研究项目(编号:30504010256)
曲 超
