基于点扫描的超分辨显微成像进展∗
2017-08-08赵光远郑程方月匡翠方刘旭
赵光远 郑程 方月 匡翠方刘旭
(浙江大学光电科学与工程学院,现代光学仪器国家重点实验室,杭州 310027)
基于点扫描的超分辨显微成像进展∗
赵光远 郑程 方月 匡翠方†刘旭
(浙江大学光电科学与工程学院,现代光学仪器国家重点实验室,杭州 310027)
(2017年3月30日收到;2017年5月2日收到修改稿)
光学显微镜一直推动着现代科学技术的发展.随着科学的进步,对显微成像分辨率的要求在生物、材料等领域日渐凸显,而常规宽场显微成像一直面临着成像分辨率衍射受限的问题.1968年出现的共聚焦显微镜作为点扫描显微镜的开端第一次实现了远场下成像分辨率的突破,它具有层切性好、信噪比高等优点.在1994年出现的受激辐射荧光损耗显微镜将显微成像能力突破到2.8 nm左右,并成为目前效果最佳、应用较广泛的超分辨显微技术.荧光差分显微和饱和荧光吸收竞争等点扫描技术具有无荧光染剂限制、饱和光强低、光路简单等优势,并且能取得1/6波长的分辨能力,进而在超分辨显微领域仍有着发挥空间.Airyscan技术作为以上方法的补充可以弥补点扫描系统中由于探测小孔半径减小而带来的信号丢失,从而提高成像信噪比和分辨率,但阵列探测器成本较高.上述点扫描显微镜通过改变照明或者探测的方式实现了分辨率突破.本文详细讨论了点扫描超分辨方法的原理、成像效果及面临的瓶颈,并分析了点扫描超分辨显微镜在应用和技术上的趋势.
超分辨,共聚焦,受激辐射荧光损耗显微术,点扫描
1 引 言
远场光学显微镜一直被认为是推动科学发展的最重要技术之一.自从16世纪发明光学显微镜以来,因其使裸眼不可见物体或结构得到展现,在诸如生物、医药以及材料科学中被广泛应用.这种技术能够描绘微结构的边界、测量表面形态以及定位活体生物中特殊分子的分布.如果没有光学显微镜,科学家对于“微观世界”的探索将会受到很大限制.
作为成像质量的重要评判标准,分辨率是显微镜至关重要的参量.直到显微镜被发明300年后,光波传输的衍射本质以及它对分辨率的影响才得到深入研究.Airy在1835年将光通过圆形孔径汇聚而成的图案描述为Airy光斑.之后Abbe成为公式化描述衍射极限的先驱.虽然在其1873年里程碑式的那篇文章中甚至没有包含任何一个简明的公式,但Abbe至关重要地点明:常规显微镜的分辨率是由其工作波长和成像物镜的数值孔径(numerical aperture,NA)决定[1].受到Abbe的启发,在1877年,Helmholtz和随后的Stephenson[2]分别独自从理论上得到衍射极限(横向)的公式:

式中λ是工作波长,n是光传播介质的折射率,θ是物镜可收集光线角的一半.在轴向方面分辨率将更加弱,da(轴向分辨能力)可改写成[3]:

在Abbe定理提出后,又产生了大量的关于如何通过系统的点扩散函数(point spread function,PSF)来定量描述系统分辨能力的工作,其中1874年Rayleigh(瑞利)判据[4]以及1927年Huston提出的半高全宽(full-width half-magnitude, FWHM)[5]方法逐渐成为研究者的首选准则.
Abbe的工作的深远影响在于他不仅发现并从数学角度定义了衍射极限,同时也给出了提高分辨率的准则.从(1)式中可以看出,通过减少工作波长或者提高系统的数值孔径,显微镜的分辨率可以提高到一定的程度.基于这个原理,Kohler在1904年搭建了第一台紫外光显微镜,在这之后X射线被引入到显微成像系统中[6].但超低波长的光具有很大的损伤性,很难被应用到生物成像中.与此同时,虽然浸油物镜能使系统的NA得到很大提升,但这样的提高依旧是有限的,而且高折射率对于成像质量会带来色差等负面影响.因此,这些困难激励着科学家们去探索着真正意义上的超分辨显微技术,去绕过或者突破Abbe衍射极限.
Abbe定理在显微成像领域有着毋庸置疑的贡献,但另一方面,Abbe定理的广泛影响力也限制着后续科学家的创造能力.在这之后的一个世纪内, Abbe定理所提到的衍射极限被认为等同于分辨率极限.事实上,在常规显微中Abbe定理的作用更大程度上体现在光束收集方面.对于一个成像系统,理想的点扩散函数应该为一个冲击函数,那么对应得到的成像结果就能保持被成像样品的原始分辨率,如图1(a)所示.但实际上的成像系统都是衍射受限系统,其点扩散函数一般被扩张至一定宽度,因此对应的成像结果的分辨率下降,图像变得模糊,如图1(b)所示.若系统点扩散函数突破衍射极限,对应成像结果就会在原先衍射受限结果的基础上更加靠近理想成像的结果,分辨率有所提升,如图1(c)所示.
在既定探测性质不可改变的条件下,我们通过改变进入探测系统前光传播和载波的方式来调节分辨率,从而缩小系统的有效PSF,达到超分辨显微.在1968年以共聚焦显微技术为开端[7],这些突破性进展中有在2014年获得诺贝尔奖的Hell提出的受激辐射荧光损耗显微术(stimulated emission depletion microscopy,STED)[8],Betzig等[9]和Hess等[10]提出的光敏定位显微术(photonactivated localization microscopy,PALM)、文献[11—13]提出的随机光学重建显微术(stochastic optical reconstruction microscopy,STORM)、以及结构光照明(structured illumination microscopy,SIM)显微术[14,15],和 blind-SIM显微方法[16].上述方法无不利用这两种性质:1)不同于宽场显微镜平面波照明,Abbe定理在光照明时仍有作用;2)荧光颗粒和部分具有光开关(photoswitchable)性质的荧光颗粒使得光与样品之间可以存在频率移动或者其他非线性作用[17].
点扫描超分辨系统以共聚焦系统为开端,发展了许多改进型的点扫描显微技术,其中包含STED、多点照明共聚焦以及蔡司公司的Airyscan等.因为点扫描系统的三维成像能力、高聚焦光强、高信噪比等能力,在生物、材料方面有着很重要的应用.本文重点介绍点扫描超分辨系统的方法和最新进展.

图1 成像结果 (a)对应于理想冲击点扩散函数得到的成像结果;(b)对应于衍射受限系统的成像结果;(c)对应于系统点扩散函数突破衍射极限的成像结果Fig.1.Optical imaging results:(a)The imaging results corresponding to the ideal impulse PSF;(b)the imaging results analogous to the di ff raction limited system PSF;(c)the imaging results of the system that point spread function surpass the di ff raction limit.
2 共聚焦原理
共聚焦显微镜(confocal)如图2所示,不同于宽场显微的平面光波照明样品,Confocal将聚焦高斯光斑照明在样品上,并且在探测光路中引入物理小孔进行滤波.共聚焦的定义也在于探测和照明的面为共轭关系且都为聚焦模式.共聚焦系统的成像过程可以表示为[18,19]
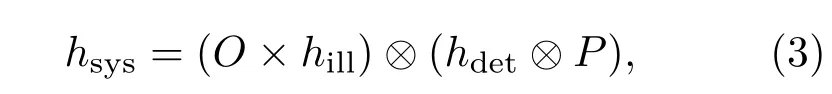
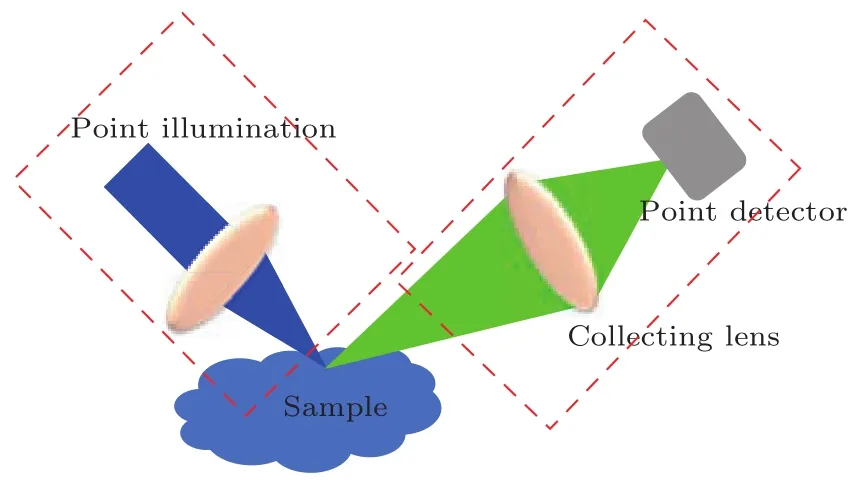
图2 共聚焦荧光显微系统原理示意图 左边为照明光路将聚焦光斑汇聚在样品上,右边为收集光路利用点探测器收集激发荧光Fig.2.The sketch of confocal imaging process.As can be seen in the fi gure,the light illuminated onto the sample from the left side with a focused beam spot. After illumination,the emitted fl uorescence from the sample is collected as seen on the right side.
这里hill,hdet分别是照明和探测PSF;P是小孔的孔径函数;hsys则是最终的系统PSF.通过扫描振镜改变照明角度或者平台平移可以实现照明光对样品的扫描.因为点照明的特殊性,小孔在探测的同时具有强大的滤波和层切作用[20],在被扫描范围以外的发出信号,即离焦信号能被有效抑制,因此共聚焦显微镜可以得到高于宽场显微镜的信噪比的成像结果.共聚焦显微系统与Heimstad发明的荧光显微系统结合起来[21],具有强大的三维成像[22]和描绘荧光染色结构功能,目前已成为高分辨率显微镜的主流.
如果共聚焦系统小孔的孔径无限小,它的孔径函数可以表示为冲击函数,相应地(3)式可以简化为

此时共聚焦系统的PSF可在轴向和横向上都提高至宽场的1.4倍[23].但实际应用中,小孔的孔径越小代表能被探测到的信号越弱,信噪比会变差,影响分辨率的提高.实验证明在0.6—0.8 AU时可以达到信噪比和分辨率平衡的最佳效果[24].
由共聚焦系统的公式,我们可以发现对于点扫描系统的进一步突破也在于继续改变照明或者探测成像系统,从此衍生出了STED[8]、荧光辐射差分显微术( fl uorescence emission di ff erence microscopy,FED)[25]和Airyscan等超分辨显微系统.
3 STED超分辨系统
STED超分辨系统的理论在1994年由Stefan Hell提出.简而言之,相比于共聚焦显微技术, STED产生了一个更小的聚焦光斑,也就是改变激发PSF来达到超分辨.
STED的原理如图3(a),荧光光子被激发到S1能级,扫描显微镜的激发PSF被叠加上一个λSTED>λexc的STED空心光斑,产生受激辐射使得在激发态S1上的光子被STED光损耗到基态S0.S1能级上的激发光子概率将受到STED光光强调制[26]:

式中kexc=σ01Iexcλ/(hc1)对应激发光激发速率; kSTED=σSTEDISTEDλ/(hc1),k0对应STED光损耗速率以及荧光速率;σ01,σSTED分别是激发吸收截面、STED光吸收截面;h对应普朗克常量;c1对应光在介质中的传播速率;Iexc和ISTED分别为激发光和STED光光强.
如图3(b),因为被叠加上的是空心STED光斑,在强STED光损耗下,激发光可有效激发的区域被限制在空心STED光的中心区域.当STED光斑增强,荧光可激发出光的区域便越来越小,利用缩小的光斑扫描样品便能得到亚衍射极限级分辨率.图3(c)为STED系统的装置图.STED系统分辨率随着光强的变化可表示为[27]

其中P为照明光强,Ps为STED的等效饱和光强[28].目前,最常见的获取空心光斑的方法是基于高倍数值孔径下的相位调制[29].因为STED对于光束的高要求,发展出了基于径向矢量光调制的STED光斑[29,30].矢量光调制的STED光斑空心区域更小,但是荧光分子本身具有的荧光极性会带来测量误差.对于STED光斑操纵的研究也同时促进了光刻[31]、光镊[32]以及焦点调制[33]的研究.

图3 STED超分辨显微镜过程 (a)STED双能级系统;(b)STED系统的激发聚焦光斑、STED聚焦光斑、最终有效激发光;(c)STED系统简图:1,光子计数器;2,激发光;3,STED光;4,涡旋位相板;5,聚焦物镜;6,激发光斑;7,STED光斑叠加在激发光斑上;8,自发辐射的荧光光斑Fig.3.The imaging process of STED super-resolution system:(a)The double energy level system of STED; (b)the excitation spot,STED depletion spot,the spontaneous emitted spot;(c)the sketch of STED system.
图4为STED超分辨显微镜效果图,其中提到的time-gated STED(g-STED)技术利用了荧光光子激发的不同寿命原理[34].外圈激发的荧光光子寿命比内圈的短,换言之,外圈的荧光发光时间比内圈的短,在收集荧光时利用时间相关单光子计数(time correlated single photon counting,TCSPC)寿命探测系统,将外圈短寿命的荧光光子舍弃,从而缩小探测PSF获得更高分辨率的超分辨成像结果.从图4(d)的对比可以发现,同样光强下g-STED可以达到38 nm分辨率,相较于STED的80 nm有大幅提升.其他的类STED点扫描超分辨方法有基态损耗成像(ground-state depletion imaging,GSD)[35],可逆饱和光线性荧光跃迁(reversible saturable optical linear fl uorescence transitions,RESOLFT)等[36].STED显微方法不仅可用于生物样品观测,也可以观测量子通信中常见的NV色心等.NV色心的分子稳定性可以使它承受3.7 GW/cm2量级的照明光强,从而达到2.4 nm的图像分辨率[37].
STED显微方法存在的不足是深层成像时两束光路难以保持对准并且空心光斑畸变较严重,导致成像深度较低[38].一种可行的方法是引入贝塞尔光束生成STED光斑从而增加其穿透深度[39],实验中GB-STED在155µm深度下可达112 nm的分辨率[40].另外,STED系统搭建较之于共聚焦系统难度较大,利用自适应光学等改善搭建效果和像差自动校正是STED亟需解决的问题[41].
近年来,在STED成像系统提高方面,Hell研究组做了大量前瞻性的工作.基于超连续光源的STED,通过声光可调滤光器(AOTF)选模可以实现四色STED[43],近期发表的文章中已经实现用同波长STED光实现四色成像[44].利用easy-STED模块可以实现双色STED光共路照明,目前已经开发出相应产品[45].基于并行扫描的STED可以大幅度提高成像速度[46,47],而消色差以及图像后处理方法在并行扫描中的应用可以进一步提高其成像质量[48,49].

图4 几种方法的成像图 (a)共聚焦显微镜;(b)STED显微镜;(c)g-STED;(d)图(a)—(c)中虚线部分每种方法对应的强度图;可以验证g-STED相比STED可达到更高分辨率[42]Fig.4.The imaging results of several systems:(a)Imaging results of confocal;(b)imaging results of STED;(c)imaging results of g-STED[42];(d)intensity of the dashed line part in fi g.(a)– fi g.(c),which verify the higher resolution of g-STED than STED.
因为depletion光激发或者受激辐射光无法被完全滤除的缘由,提高STED成像技术的信噪比是一个研究得较多的方向.其中相减方法也被广泛应用,在量子点STED研究中,文献[50]提出了将得到的STED成像结果再减去单独STED光照射产生的图像从而提高信噪比.在近期发表的四色STED中将逐行扫描的STED成像结果减去STED照射结果来提高信噪比[44].不同的是,Gao等[51]提出了double-depletion STED方法中将同一脉冲周期内的STED效果只和STED光背景噪声相减.就STED相减去噪角度来看,这三种方法在减小被相减扫描图像漂白、漂移方面为递进关系,doubledepletion有着最佳的效果但是在控制脉冲时延上最为复杂[51].
减小荧光照明光强和荧光漂白影响是STED近两年的重要进展.通过适当减小STED波长来增大STED光吸收截面,是有效减少STED光强度需求的方向之一,但STED光和激发光波长接近产生的自发辐射会带来图像信噪比下降等风险[52].Liu等[53]利用“镧系掺杂上转换纳米颗粒”的荧光上转换效应进行STED成像,从而减小STED光所需要的光强,为材料特性的研究提供了思路.Yang等[54]利用反射光增强STED光光强来达到STED光强度需求减少.Hell组先后提出了Protected-STED[55]和MINFIELD-STED[56]方法,根据STED激发的空心特点以及样品的稀疏特性来保护荧光样品的过度漂白.通过对纳米抗体标记的核孔复合物进行成像,MINFIELD-STED证明了可以实现一般STED因为信号不足无法达到的小于25 nm分辨率的成像效果.
STED技术是目前点扫描超分辨显微领域较为成熟的技术,并且有着几十纳米量级的分辨率,在商业领域以Abberior Instruments的Rescue-STED,3D-STED、双色-STED产品为代表,已经得到广泛应用.
4 饱和竞争超分辨显微方法
作为一种刚出现的点扫描超分辨显微方法,饱和竞争超分辨显微方法(saturated competition microscopy,SAC)是一种同色光竞争方法[57].不同于STED技术中受激辐射和自发辐射在S1能级荧光辐射中的后竞争,SAC在荧光吸收的S0能级中额外引入一束饱和空心光斑作为竞争光去竞争实心光斑的吸收过程.这类似于GSD的基态损耗方法[35],但SAC利用的是同色激光在基态的饱和吸收竞争.SAC系统中将共聚焦显微镜分成两路,一路进行实心频率调制(kexc),一路进行相位调制成空心光斑当两种光斑共同激发到样品面上,便形成了饱和吸收的过程(图5(a)).低光强的实心光斑荧光激发区域被高光强的空心光斑减小,利用锁相放大器解调被频率调制的实心激发光可获得超分辨图像.类似于STED,实心光斑的激发概率可以表示为

相比于STED,SAC有饱和光强需求低、对样品损伤小的优势(图5(b)).从(5)和(7)式的比较中可以发现,这是因为同波长的SAC相比STED有着更大的吸收截面以及竞争分别发生在饱和吸收和辐射两种不同能级.文献[57]将SAC与SIM以及Confocal(一种宽场情况下利用结构光照明的超分辨方法)对比,验证了其超分辨显微效果(图5(d)—(g)).SAC取得了远高于Confocal的成像效果,即使和SIM成像结果比,SAC的分辨能力也更加优秀(可见白色框标重点区域).
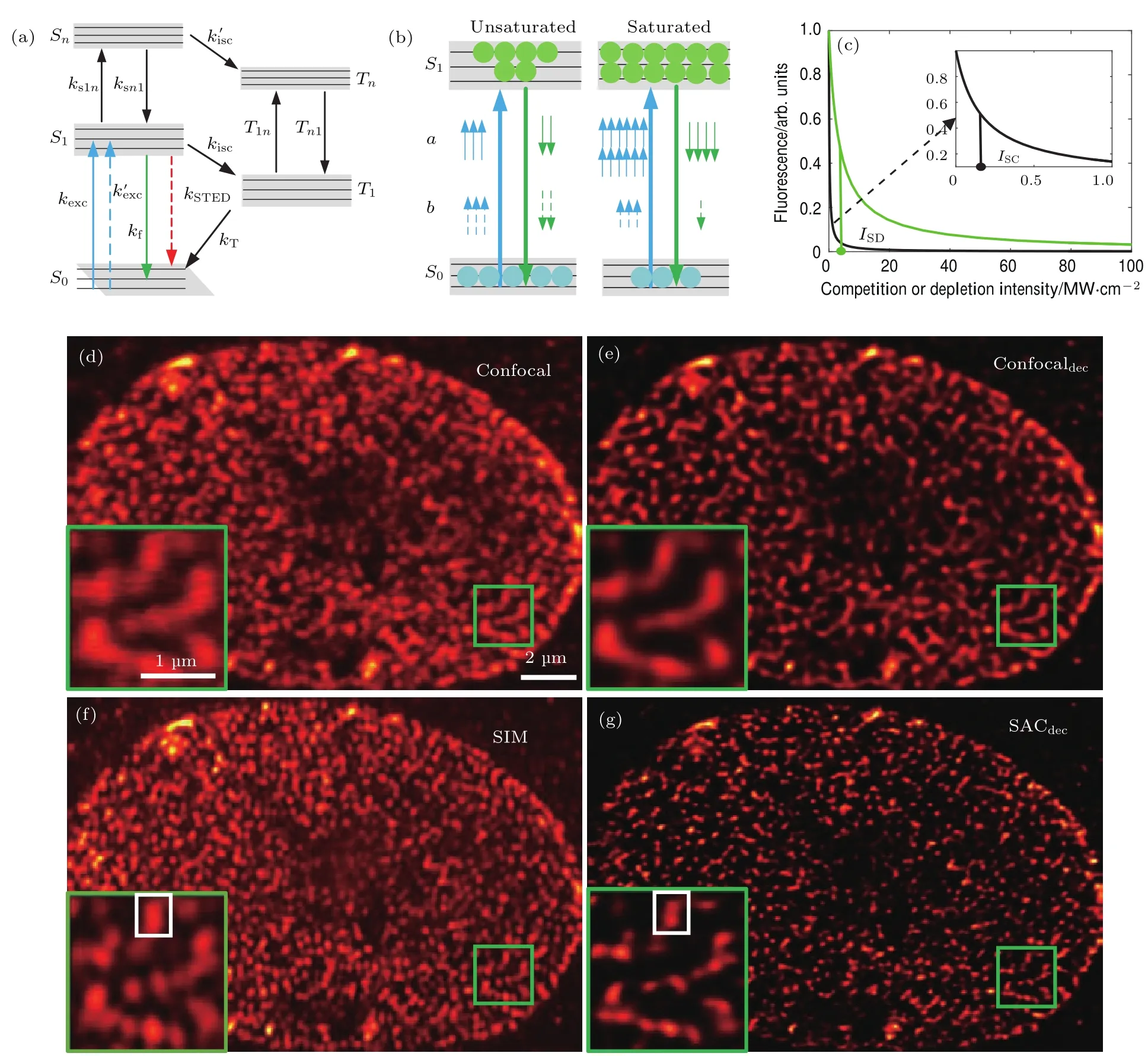
图5 SAC机理和成像结果 (a)SAC超分辨显微方法中用来照明激发强度的五能级系统;(b)SAC在低光强和饱和光强激发下的荧光激发比率,‘a’表示高光强的竞争光束,‘b’表示低光强的主激发光束;(c)SAC的实心光斑荧光激发损失比率随着空心竞争光束光强增加时的变化曲线,可以看到空心光强增加时SAC的荧光激发损失比例相对STED更加大;(d)—(g)不同成像方法对于细胞核孔进行成像的结果,(e),(g)分别代表对于Confocal和SAC进行5次Richardson Lucy反卷积后的结果[57]Fig.5.The imaging principle and results of SAC:(a)Five-level molecular electronic state model used to calculate the relationship between the excitation emission intensities;(b)illustration of the saturation of S1state and the process of competition during the excitation,‘a’denotes the high-intensity competition beam(solid lines)while‘b’denotes the low-intensity primary excitation beam(dashed lines);(c)the remaining fl uorescence in S1state analogous to the competition or depletion intensity from SAC or STED;(d)–(g)comparison between SIM and SAC veri fi es SAC’s enhanced resolution,(e)and(g)represent the results that deconvolved from the raw confocal and SAC results after 5 Richardson Lucy iterations,respectively[57].
经验证SAC成像方法可以达到1/6波长的成像效果,同时具有比STED装置简单、低光强、无荧光染剂限制、低成本等优势.但该方法也有着一些待解决的不足:两路竞争的激发光来源于同一激光器,空心光激发和实心光激发的荧光需要先到达探测器再通过锁相放大器将信号分离,这会面临探测器饱和以及锁相对噪声抑制比不足带来的信噪比等问题,导致分辨率难以进一步提高.
5 基于分时差分的自发辐射荧光显微方法(FED)
差分成像可提供更高的分辨率和信噪比,因此被广泛应用[58-60].在较早的研究中,Heintzmann等[61]做过基于不同小孔大小下的成像,得到的图像相减从而实现超分辨成像,但图像的信噪比很低,边缘还有着大量信号残余.近几年,文献[25,62, 63]提出了以FED为代表的将空心光斑和实心光斑分时扫描得到图像相减提高分辨率的方法.其核心原理可以表示为

图6 FED示意图 (a),(b)分别代表实心斑和空心斑激发PSF;(c),(d)代表两种激发PSF分别经过探测之后的PSF;(e)为最后得到的FED的PSF[25]Fig.6.Working process of FED:(a),(b)Represent the solid and doughnut excitation spot respectively;(c),(d)are the detected PSF after the detecting process;(e)is the fi nal system PSF of FED after undergoing the subtraction process[25].
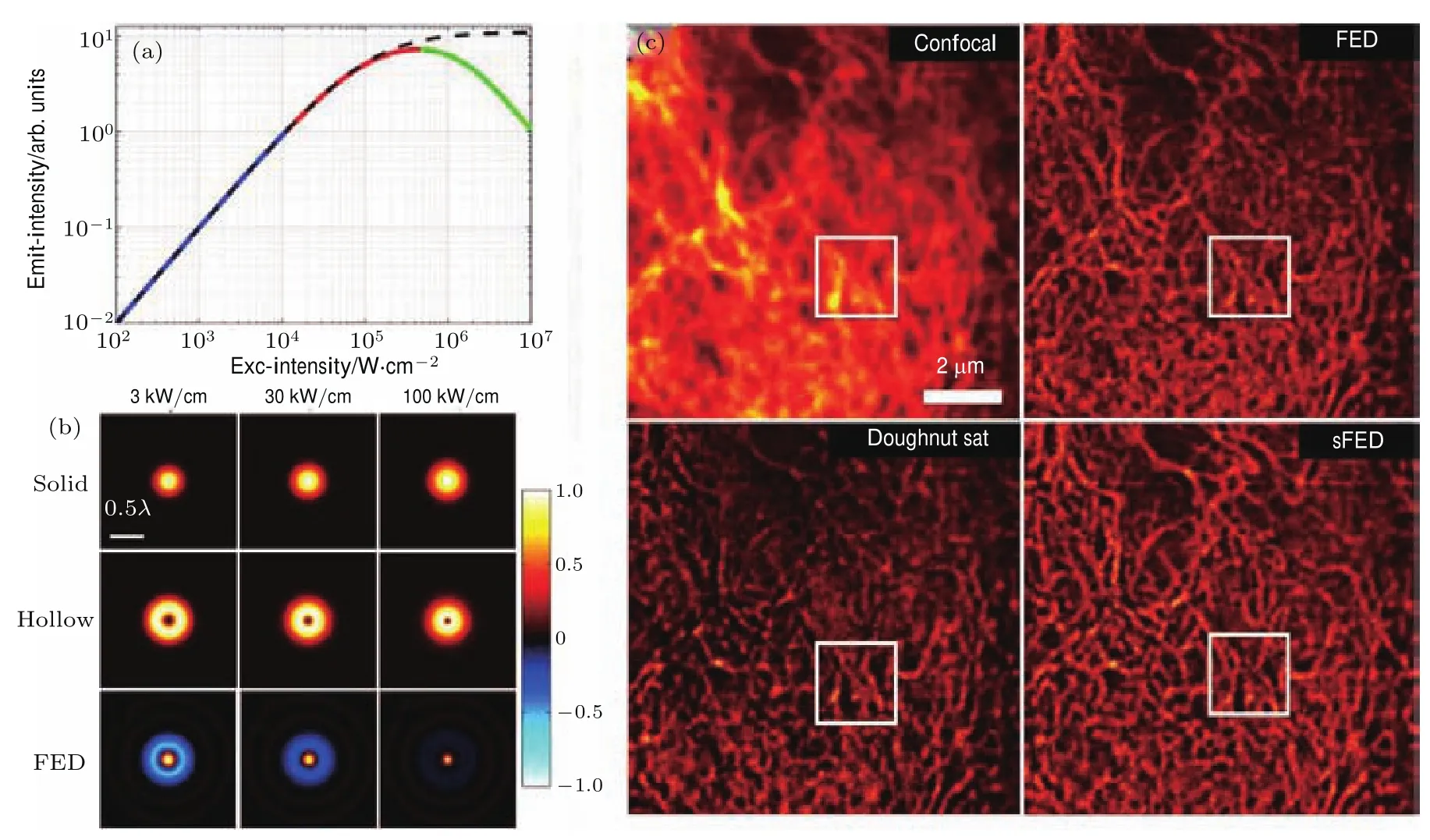
图7 饱和FED超分辨图 (a)仿真所得的荧光分子激发强度随着照明光强的变化;(b)不同照明光强下实心光斑、空心光斑以及饱和FED的仿真效果图,可见随着饱和程度的增强不仅负值畸变减小,分辨率也有所提高;(c)Confocal,FED,空心斑饱和的FED以及空心实心都饱和的sFED对微管成像结果图,可见sFED在空心和实心激发光斑都饱和时,分辨率和信息留存方面都表现更好[70]Fig.7.Imaging results of saturated FED(sFED):(a)The simulated results of saturated excitation curve of FED corresponding to the increase of illumination intensity;(b)simulated PSFs of solid illumination spot,hollow illumination spot,and sFED result corresponding to di ff erent illumination intensities;(c)imaging results of microtubules corresponding to Confocal,FED, doughnut beam sFED,both doughnut and solid saturated FED,as can be seen in the fi gures,when the doughnut and solid excitation spot are both saturated,sFED achieves the best imaging performance[70].
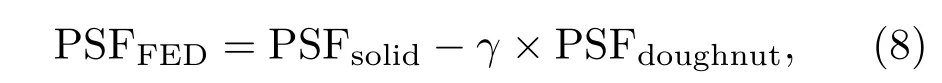
其中PSFFED,PSFsolid,PSFdoughnut分别对应着FED、实心光斑、空心光斑的PSF;γ为相减系数.因为FED相减中会出现负值带来的畸变,在相减系数取值以及光斑调制上需做大量的工作[64-66].
经过矢量光调制的FED方法可以减少畸变和提高分辨率[67-69].用于照明的共聚焦实心光斑和空心光斑分别用偏振转换器产生的径向偏振光和切向偏振光调制而得,调制所得的实心光斑和空心光斑的外轮廓可以更加接近,减少负值畸变.同时因为切向偏振光调制出来的光斑比传统涡旋光斑的空心区域要小,可以得到更高的分辨率.矢量光调制FED在488 nm波长照明下可达到110 nm的分辨率[67].
与SAC和STED的机理类似,FED采用激发实心光斑和空心光斑同时饱和,得到的饱和FED(sFED)的光斑分辨能力将会更高[70].利用荧光饱和效应,我们获得外轮廓拓展的实心斑和中心缩小的空心斑成像结果.因为非线性效应的存在,两种匹配的饱和图像一定程度上消除了负值畸变,并且相比普通FED提高了成像分辨率和信噪比.如图7所示,利用sFED在633 nm波长光照明下可得到100 nm左右的分辨率.
FED超分辨方法具有无荧光染料限制、后处理方便的优势,在相减系数研究方面目前最先进的是强度权重相减(intensity weight subtraction, IWS)方法[71].FED今后的发展方向可以是利用脉冲激光器来减少漂白,也可以是三维的sFED动态生物细胞观测[72].
6 基于阵列探测器的超分辨方法
在引言中提到,普通共聚焦系统的分辨率和信噪比受限于pinhole大小.Pinhole越大收集荧光强度会越强,但另一方面图像的分辨能力会较弱,小pinhole则反之.因此pinhole大小多取在平衡点0.6 AU附近[24].尽管如此,0.6 AU的pinhole大小依然意味着光子信号的大量损失.1988年,Sheppard[73]提出了类似于SIM的方法,有将共聚焦显微镜分辨能力提高2倍的可能.虽然理想带宽最终能达到2倍,但是Sheppard等[74]也发现在不考虑斯托克斯红移的情况下,半高全宽的值最高可达到普通显微镜的1.53倍,超过该倍率带宽的信号将迅速衰减(图8(c)).在Sheppard所提出的方法中,装置依旧为共聚焦显微镜的聚焦照明,但是点探测器部分被替换成了阵列探测器((图8(a))[75].通过对于每个探测器所获得的图像运用相应算法进行像素重组,可以得到的成像结果分辨率提高.此类方法被统称为Airyscan[75],而ISM[76]和OPRA[77]都可以作为这种方法的别名或变种.Airyscan方法在2010年由Müller和Enderlein等[76]利用EMCCD作为阵列探测器得以实现.在2012年,York等[78]用多点激发实现了生物细胞的快速成像.de Luca等[79]在2013年证明不同探测器的像素重组不仅可在后处理中完成,也可以通过光学形式的Rescan形式完成.Sheppard等[74]发现在不考虑斯托克斯红移的情况下,对于一个物体的点进行成像,其焦点的峰值强度是普通显微镜的1.84倍,这种相比于共聚焦的优势也被称为Superconcentration现象.需要注意的是Airyscan虽然总的信号强度增大了,但是每个光电倍增管(photomultiplier tube,PMT)通道的探测都伴随泊松噪声的产生,因此整体的噪声是增加的.在蔡司的Airyscan显微镜产品的图像后处理中有相减步骤,减去均匀化的噪声值,从而提高图像信噪比.图8(b)比较了Airyscan(OPRA)和共聚焦、宽场显微等的PSF,可见Airyscan在半高全宽上的提升[77].图8(c)和图8(d)为归一化和未归一化不同pinhole大小的Confocal与Airyscan(ISM)的光学传递函数(optical transmission function,OTF)分布的对比,可见利用Airyscan成像方法不仅在整体信号强度上有所提高(图8(d)),并且在高频区域的分量比例也更高(图8(c))[80].不同于传统的Airyscan处理方法, Kuang等[81]引入Vikmom方法去后处理Airyscan点探测器所得到的信号图像,Vikmom将阵列探测器得到的信号用虚拟结构光照明的方法进行调制,然后引入傅里叶域层叠术(Fourier ptychography microscopy)方法到图象恢复中.如图8(d)所示, Vikmom在提高分辨率的基础上,可以增强层切效应,修正光路畸变等.
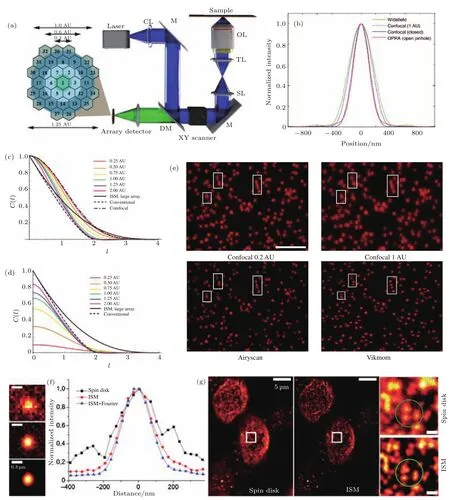
图8 A˙iryscan显微方法和效果图 (a)Airyscan系统简图[82];CL,收集透镜;M,反射镜;L,透镜;SL,扫描镜;TL,场镜;OL,物镜;DM,二色镜;(b)宽场、1 AU pinhole大小的Confocal、理想无pinhole Confocal,Airyscan方法对应的PSFs;(c)归一化不同小孔大小对应的Confocal OTFs[80];(d)未归一化的不同小孔大小对应的Confocal OTFs;(e)0.2 AU小孔的Confocal,1 AU的confocal,0.2 AU的Airyscan,Vikmom对应的成像结果;(f)spinning-disk Airyscan对应的成像结果,左边从上往下分别是spinning-disk共聚焦、Airyscan、经过Fourier reweighting后的Airyscan结果,右边为plot对左边结果的plot;(g)spinning-disk Confocal和spinning-disk Airyscan对于生物细胞的成像结果[83]Fig.8.The principle and imaging results of Airyscan:(a)Imaging system of Airyscan[82],CL,collecting lens;M,re fl ecting mirror;L,lens;SL,scanning lens;TL, field lens;OL,objective lens;DM,dichroic mirror;(b)the normalized PSFs of wide field,Confocal with 1 AU,Confocal with non-pinhole,and Airyscan microscopies;(c)the normalized OTF for confocal microscopes with di ff erent pinhole sizes and ISM with a large array[80];(d)the unnormalized OTF for a confocal microscope with di ff erent pinhole sizes in Airy units,the OTF for ISM with a large array is also shown;(e)imaging results of Confocal with 0.2 AU pinhole,Confocal with 1 AU pinhole,Airyscan,and Vikmom with 0.2 AU pinhole;(f)imaging results of a single particle using spinning-disk Airyscan,on the left,upper,spinning-disk confocal result,middle,the Airyscan result, lower,the Airyscan result after the Fourier reweighting,on the right is the plot of three methods;(g)the imaging results of biological samples upon spinning-disk confocal method and Airyscan method[83].
在Airyscan探索中,在扫描过程中引入spinning-disk可以大幅提高成像速度.图8(f)和图8(g)展示了采用Airyscan方法的spinning-disk系统取得了分辨率的提高,但从图中也可以发现Airyscan对于分辨率提高的局限性.相比于普通spinning-disk扫描的结果,无论是从半高全宽还是从最小分辨距离来看,Airyscan都达不到两倍提高.就仿真效果来看,Airyscan相比于0.6 AU的共聚焦分辨率提升1.2倍左右[74].
7 其他的点扫描超分辨显微系统
以上的点扫描超分辨显微方法多应用于荧光成像,但是在如非荧光成像等的材料科学领域,分辨率的提升依然重要.不仅是荧光颗粒存在饱和吸收过程,部分材料也存在光强吸收饱和效应.Wang等[84]在2013年将饱和吸收引入到pump-probe系统中观察石墨烯,得到了石墨烯的超分辨成像效果.另外,Rogers等[85]证明在不存在饱和吸收的材料观测中,用加工super-oscillation透镜调制照明光可以使共聚焦系统取得更小的聚焦光斑,从而达到λ/6超分辨显微效果[86].
近年来,散射介质对于超分辨成像的增益效果更加瞩目.在传统的认知中,光经过深层组织或者强散射颗粒应尽量降低散射程度.有诸多研究尝试用干涉等方法建立传输矩阵对透过散射介质的光束进行再整形.然而2011年Putten等[87]做了相反的工作,他们利用光经过强散射系统,得到了半高全宽在100 nm的汇聚光斑,称作高折射率散射分辨率增强(high-index resolution enhancement by scattering,HIRES)方法.HIRES的前提在于光波前相位的精确标定.当然HIRES也没有打破衍射极限,文中解释分辨率的提高在于光经过散射介质后OTF的最大锥角增大.2013年Park等[88]将这种现象解释为散射介质的多重散射增强了对倏逝波的探测,如图9.散射介质和倏逝波的研究为深层组织的超分辨方法提供了可能.
另外,近场光学基于等离子激元的超分辨显微技术为超分辨显微提供了另外一些可能,利用表面等离子体激元以及局域等离子体激元耦合产生大k矢照明光从而超分辨成像是其中的主要方法[89,90],这些对于远场点扫描显微成像有着一些借鉴意义.通过片上波导增大超分辨显微的视场目前已经被应用到STORM技术上,对于点扫描也有借鉴意义[91].

图9 基于散射控制亚波长成像原理[88](a)常规光学系统仅能控制或者观测到在截止频率内的远场光波,图中超过k0的部分是自由空间中的倏逝波矢量并且不可以被常规光学系统探测;(b)常规透镜只能在截止频率内的频率分量;(c)当平面波入射到一个随机介质中,多重散射的发生将入射波调制成既包含传导波又包含倏逝波分量;(d)当撞击打散的波前被控制汇聚到一个目标位置,产生波矢量被相位匹配从而在目标位置重建出一个亚波长焦点Fig.9.Principle of subwavelength manipulation using scattering control[88]:(a)Conventional optics can only control or observe propagating far- field wave vectors that fall within the cuto ffspatial frequency,For|k|·|k0|,where k0is the wave vector in free space,the wave vectors are evanescent and are consequently inaccessible in the far field using conventional optics;(b)a conventional lens can therefore only control the far field within the cuto fffrequency,when the phase of each wave vector within the cuto fffrequency is matched at a target point,a di ff raction-limited focus with a width of l/2 can be obtained;(c)when a plane wave is incident on random media,the wave is multiply scattered and converted into a manifold of di ff erent wave vectors that contain both propagating and evanescent terms,the scrambled random phase of each wave vector results in a speckle containing subwavelength spatial modes;(d)when the impinging wavefront is controlled at a target position,the resulting wave vectors can be phase-matched to construct a subwavelength focus at a target position.
8 总 结
本文介绍了点扫描超分辨显微镜的发展方法类别和最新进展.点扫描超分辨显微镜以Confocal为开端,经过几十年的发展,出现了STED,FED, Airyscan,SAC和散射超分辨成像等方法.相比于SIM为代表的宽场结构光超分辨显微成像,STED, SAC等成像方法具有成像分辨率的优势.对比STORM等利用随机定位的超分辨显微成像,点扫描显微成像具有成像速度快,三维成像效果佳和层析能力好的优点.随着现代科学技术的发展,可以预见点扫描超分辨显微术将发挥重大的作用.
STED作为其中的代表取得了最大的分辨率提升效果,可达生物细胞20 nm,NV色心2.4 nm的分辨能力.但目前,点扫描或者是现有的超分辨显微方法从技术角度已经出现了一个新的瓶颈,进一步地增强超分辨显微的效果将十分困难.除STED之外,其他超分辨显微的成像分辨多在2—3倍以内.但是STED等点扫描显微镜因为光散射面临着不同程度的穿透深度限制问题,如何解决这些问题将是点扫描超分辨显微镜研究的重点.另外散射介质调控的亚衍射光斑汇聚值得探究.
Airyscan作为一种改变探测的成像改进,可以与其他方法结合,但是高性能阵列探测器价格昂贵是一大难题,目前这方面已做出7探测器的相对于宽场成像提高30%分辨率的拉曼超分辨显微镜[92].但Airyscan的广泛应用依然面临着探测器昂贵、系统复杂的问题.SAC成像系统作为新出现的成像方法,取得了λ/6的分辨率突破.相比STED,SAC有着潜在的优点,其图像分辨能力和信噪比提高的潜力有待进一步挖掘.
[1]Abbe E 1873 Archiv für Mikroskopische Anatomie 9 413
[2]Stephenson J W 1877 Monthly Microsc.J.17 82
[3]Sil fi esJS,SchwartzSA,DavidsonM W 2013 http://www.microscopyu.com/articles/superresolution/di ff ractionbarrier.html[2017-3-1]
[4]Rayleigh L 1874 Philos.Mag.Ser.47 81
[5]Houston W V 1927 Phys.Rev.29 478
[6]Kirz J,Jacobsen C,Howells M 1995 Q.Rev.Biophys. 28 33
[7]Petráň M,Hadravský M,Egger M D,Galambos R 1968 J.Opt.Soc.Am.A 58 661
[8]Hell S W,Wichmann J 1994 Opt.Lett.19 780
[9]Betzig E,Patterson G H,Sougrat R,Lindwasser O W, Olenych S,Bonifacino J S,Davidson M W,Lippincott-Schwartz J,Hess H F 2006 Science 313 1642
[10]Lindwasser O W,Olenych S,Bonifacino J S,Davidson M W,Lippincott-Schwartz J,Hess H F 2006 Science 313 1642
[11]Rust M J,Bates M,Zhuang X 2006 Nat.Methods 3 793
[12]Douglass K M,Sieben C,Archetti A,Lambert A,Manley S 2016 Nat.Photon.10 705
[13]Shechtman Y,Weiss L E A,Backer S,Lee M Y,Moerner W E 2016 Nat.Photon.10 590
[14]Gustafsson M G 2000 J.Microsc.198 82
[15]Heintzmann R,Cremer C G 1999 Proceedings of SPIEThe International Society for Optical Engineering 3568 1399
[16]Mudry E,Belkebir K,Girard J,Savatier J,Moal E L, Nicoletti C,Allain M,Sentenac A 2012 Nat.Photon.6 312
[17]Heintzmann R,Gustafsson M G L 2009 Nat.Photon.3 362
[18]Webb R H 1996 Rep.Prog.Phys.59 427
[19]Sheppard C J,Wilson T 1981 J.Microsc.124 107
[20]Wilson T 2011 J.Microsc.154 143
[21]Ellinger P 2008 Biol.Rev.15 323
[22]Brakenho ffG J,Ht V D V,Spronsen E A,Nanninga N 1989 J.Microsc.153 151
[23]Brakenho ffG J,Blom P,Barends P 1979 J.Microsc. 117 219
[24]Borlinghaus R T,Kappel C 2016 Nat.Methods 13
[25]Kuang C,Li S,Liu W,Hao X,Gu Z,Wang Y,Ge J,Li H,Liu X 2013 Sci.Rep.3 1441
[26]Willig K I,Harke B,Medda R,Hell S W 2007 Nat. Methods 4 915
[27]Westphal V,Hell S W 2005 Phys.Rev.Lett.94 143903
[28]Rittweger E,Han K Y,Irvine S E,Eggeling C,Hell S W 2009 Nat.Photon.3 144
[29]Xie H,Liu Y,Jin D,Santangelo P J,Xi P 2013 J.Opt. Soc.Am.A 30 1640
[30]Hao X,Kuang C,Wang T,X Liu 2010 J.Opt.12 115707
[31]Hao X,Kuang C,Li Y,Liu X 2012 J.Optics 14 045702
[32]Zhang C,Li H,Wang S,Zhao W,Feng X,Wang K, Wang G,Bai J 2016 J.Laser Micro Nanoen.11 290
[33]Zhu B,Shen S,Zheng Y,Gong W,Si K 2016 Opt.Express 24 19138
[34]Hao X,Kuang C,Gu Z,Li S 2012 Commun.Photon. Conference 1 3
[35]Hell S W,Kroug M 1995 Appl.Phys.B 60 495
[36]Keller J 2006 Ph.D.Dissertation(Heidelberg:Heidelberg University)
[37]Wildanger D,Patton B R,Schill H,Marseglia L,Hadden J P,Knauer S,Schönle A,Rarity J G,O’Brien J L,Hell S W 2011 Adv.Mater.24 OP309
[38]Gigan S 2017 Nat.Photon.11 14
[39]Zhang P,Goodwin P M,Werner J H 2014 Opt.Express 22 12398
[40]Yu W,Ji Z,Dong D,Yang X,Xiao Y,Gong Q,Xi P, Shi K 2015 Laser Photon.Rev.10 147
[41]Patton B R,Burke D,Owald D T J,Bewersdorf Gould J,Booth M J 2016 Opt.Express 24 8862
[42]Wang Y,Hao X,Liu X 2013 Opt.Engineer.52 093107
[43]Wildanger D,Rittweger E,Kastrup L,Hell S W 2008 Opt.Express 16 9614
[44]Winter F R,Loidolt M,Westphal V,Butkevich A N, Gregor C,Sahl S J,Hell S W 2017 Sci.Rep.7 46492
[45]Reuss M,Engelhardt J,Hell S W 2010 Opt.Express 18 1049
[46]Bingen P,Reuss M,Engelhardt J,Hell S W 2011 Opt. Express 19 23716
[47]Yang B,Przybilla F,Mestre M,Trebbia J B,Lounis B 2014 Opt.Express 22 5581
[48]Chmyrov A,Leutenegger M,Grotjohann T,Schönle A, Keller fi ndeisen J,Kastrup L,Jakobs S,Donnert G,Sahl S J,Hell S W 2017 Sci.Rep.7 44619
[49]Bergermann F,Alber L,Sahl S J,Engelhardt J,Hell S W 2015 Opt.Express 23 211
[50]Hanne J,Falk H J,Görlitz F,Hoyer P,Engelhardt J, Sahl S J,Hell S W 2015 Nat.Commun.6 7127
[51]Gao P,Prunsche B,Zhou L,Nienhaus K,Nienhaus G U 2017 Nat.Photon.11 163
[52]Bordenave M D,Balzarottt F,Stefani F D,Hell S W 2016 J.Phys.D:Appl.Phys.49 365102
[53]Liu Y,Lu Y,Yang X,Zheng X,Wen S,Fan W,Vidal X,Zhao J,Liu D,Zhou Z 2017 Nature 543 229
[54]Yang X,Xie H,Alonas E,Liu Y,Chen X,Santangelo P J,Ren Q,Xi P,Jin D 2016 Light-Sci.Appl.5 e16134
[55]Danzl J G,Sidenstein S C,Gregor C,Urban N T,Ilgen P,Jakobs S,Hell S W 2016 Nat.Photon.10 122
[56]Göttfert F,Pleiner T,Heine J,Westphal V,Görlich D, Sahl S J,Hell S W 2017 Proc.Natl.Acad.Sci.USA 114 2125
[57]Zhao G,Kabir M M,Toussaint K C,Kuang C,Zheng C,Yu Z,Liu X 2017 Optica 4 633
[58]Veselý P,Lücers H,Riehle M,Bereiterhahn J 1994 Cell Motility&the Cytoskeleton 29 231
[59]Denk W,Strickler J H,Webb W W 1990 Science 248 73
[60]Wilson T,Hamilton D K 1984 J.Mod.Opt.31 453
[61]Heintzmann R,Sara fi s V,Munroe P,Nailon J,Hanley Q S,Jovin T M 2013 Micron 34 293
[62]Dehez H,Piché M,De K Y 2013 Opt.Express 21 15912
[63]Wang D,Liu S,Chen Y,Song J,Liu W,Xiong M,Wang G,Peng X,Qu J 2016 Opt.Express 25 10276
[64]You S,Kuang C,Rong Z,Liu X 2014 Opt.Express 22 26375
[65]Wang N,Kobayashi T 2014 Opt.Express 22 28819
[66]Wang N,Kobayashi T 2015 Opt.Express 23 13704
[67]Rong Z,Kuang C,Fang Y,Zhao G,Xu Y,Liu X 2015 Opt.Commun.354 71
[68]Segawa S,Kozawa Y,Sato S 2014 Opt.Lett.39 3118
[69]Segawa S,Kozawa Y,Sato S 2014 Opt.Lett.39 4529
[70]Zhao G,Kuang C,Ding Z,Liu X 2016 Opt Express 24 23596
[71]Korobchevskaya K,Peres C,Li Z,Antipov A,Sheppard C J,Diaspro A,Bianchini P 2016 Sci.Rep.6 25816
[72]Zhao G,Rong Z,Zheng C,Liu X,Kuang C 2016 J. Innov.Opt.Heal.Sci.9 1793
[73]Sheppard C J 1988 Optik 80 53
[74]Sheppard C J,Mehta S B,Heintzmann R 2013 Opt.Lett. 38 2889
[75]Hu ffJ 2015 Nat.Methods 12
[76]Müller C B,Enderlein J 2010 Phys.Rev.Lett.104 198101
[77]Roth S,Sheppard C J,Kai W,Heintzmann R 2013 Opt. Nanoscopy 2 1
[78]York A G,Parekh S H,Nogare D D,Fischer R S,Temprine K,Mione M,Chitnis A B,Combs C A,Shro ffH 2012 Nat.Methods 9 749
[79]de Luca G M,Breedijk R M,Brandt R A,Zeelenberg C H,de Jong B E,Timmermans W,Azar L N,Hoebe R A, Stallinga S,Manders E M 2013 Biomed.Opt.Express 4 2644
[80]Sheppard C J,Roth S,Heintzmann R,Castello M,Vicidomini G,Chen R,Chen X,Diaspro A 2016 Opt.Express 24 27280
[81]Kuang C,Ma Y,Zhou R,Zheng G,Fang Y,Xu Y,Liu X,So P T 2016 Phys.Rev.Lett.117 028102
[82]Ge B,Wang Y,Huang Y,Kuang C,Fang Y,Xiu P, Rong Z,Liu X 2016 Opt.Lett.41 2013
[83]Schulz O,Pieper C,Clever M,Pfa ffJ,Ruhlandt A, Kehlenbach R H,Wouters F S,Großhans J,Bunt G, Enderlein J 2013 Proc.Natl.Acad.Sci.USA 110 21000
[84]Wang P,Slipchenko M N,Mitchell J,Yang C,Potma E O,Xu X,Cheng J X 2013 Nat.Photon.7 449
[85]Jin N,Rahmat-Samii Y 2007 IEEE Trans.Antenn. Propag.55 556
[86]Rogers E T,Lindberg J,Roy T,Savo S,Chad J E,Dennis M R,Zheludev N I 2012 Nat.Mater.11 432
[87]van Putten E G,Akbulut D,Bertolotti J,Vos W L,Lagendijk A,Mosk A P 2011 Phys.Rev.Lett.106 193905
[88]Park J H,Park C,Yu H S,Park J,Han S,Shin J,Ko S H,Nam K T,Cho Y H,Park Y K 2013 Nat.Photon.7 454
[89]Fang Z,Zhu X 2013 Adv.Mater.25 253840
[90]Zhang W,Fang Z,Zhu X 2016 Chem.Rev.117 5095
[91]Diekmann R,Helle Ø I,Øie C I,McCourt P,Huser T R,Schüttpelz M,Ahluwalia B S 2017 Nat.Photon.11 322
[92]Roider C,Ritsch-Marte M,Jesacher A 2016 Opt.Lett. 41 3825
PACS:87.64.mk,87.64.M—,87.64.kv,87.63.lm DOI:10.7498/aps.66.148702
Progress of point-wise scanning superresolution methods∗
Zhao Guang-Yuan Zheng Cheng Fang YueKuang Cui-Fang†Liu Xu
(State Key Laboratory of Modern Optical Instrumentation,College of Optical Science and Engineering,Zhejiang University,
Hangzhou 310027,China)
30 March 2017;revised manuscript
2 May 2017)
Optical microscope has been giving impetus to the development of modern technology.As the advancement of these techniques,high resolution microscopy becomes crucial in biological and material researches.However,the di ff raction limit restricts the resolution of conventional microscopy.In 1968,confocal microscopy,the fi rst pointwise scanning superresolution method,appeared.It improves the imaging resolution,enhances the contrast,and thus breaks through the di ff raction limit.Since then many superresolution methods have come into being,among which the pointwise scanning superresolution method earns reputation for its high imaging resolution and contrast.The stimulated emission depletion microscopy becomes the most prominent method with an achievable resolution of about 2.4 nm and then widely used.Besides,the newly developed fl uorescence emission di ff erence microscopy(FED)and the saturated absorption competition microscopy(SAC)have their advantages of non-constraint on fl uorescent dyes,low saturated beam power, simpli fi ed optical setups,while they achieve a resolution of lower than λ/6.Further explorations of FED will be keen on vivo biological observations by using it,while that of SAC can concentrate on enhancing the resolution on a nanoscale and reducing the signal-to-noise ratio.In addition,the Airy scan technique in which a detector array is used for image acquisition,can serve as a complementary tool to further enhance the imaging quality of pointwise scanning superresolution method.The detector-array enables both the narrowed size of pinhole and the increasing of the acquired signal intensity by 1.84 folds.The other methods,e.g.superoscillation lens and high-index resolution enhancement by scattering,have the potentialities to obtain superresolved image in material science or deep tissues.After being developed in the past three decades,the superresolution methods now encounter a new bottleneck.Further improvement of the current methods is aimed at imaging depth,and being used more practically and diversely.In this review,we detailedly describe the above pointwise scanning superresolution methods,and explain their principles and techniques. In addition,the de fi ciencies and potentialities of these methods are presented in this review.Finally,we compare the existing methods and envision the next generation of the pointwise scanning superresolution methods.
superresolution,confocal,stimulated emission depletion microscopy,pointwise scanning
:87.64.mk,87.64.M—,87.64.kv,87.63.lm
10.7498/aps.66.148702
∗国家重点基础研究发展计划(批准号:2015CB352003)、国家重点研发计划(批准号:2016YFF0101400)、国家自然科学基金(批准号:61335003,61377013,61378051,61427818)、浙江省自然科学基金(批准号:LR16F050001)和中央高校基本科研业务费资助的课题.
†通信作者.E-mail:cfkuang@zju.edu.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
*Project supported by the National Basic Research Program of China(Grant No.2015CB352003),the National Key Research and Development Program of China(Grant No.2016YFF0101400),the National Natural Science Foundation of China(Grant Nos.61335003,61377013,61378051,61427818),the Natural Science Foundation of Zhejiang Province,China (Grant No.LR16F050001),and the Fundamental Research Funds for the Central Universities,China.
†Corresponding author.E-mail:cfkuang@zju.edu.cn
