咸水滴灌下塔里木沙漠公路防护林土壤生化作用强度及微生物生态特征
2017-08-07靳正忠雷加强李生宇徐新文
靳正忠,雷加强,李生宇,徐新文
中国科学院新疆生态与地理研究所, 乌鲁木齐 830011
咸水滴灌下塔里木沙漠公路防护林土壤生化作用强度及微生物生态特征
靳正忠*,雷加强,李生宇,徐新文
中国科学院新疆生态与地理研究所, 乌鲁木齐 830011
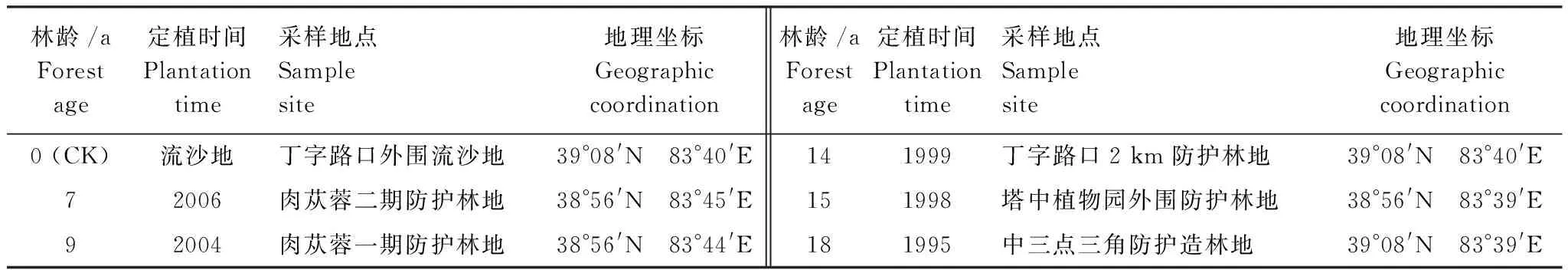
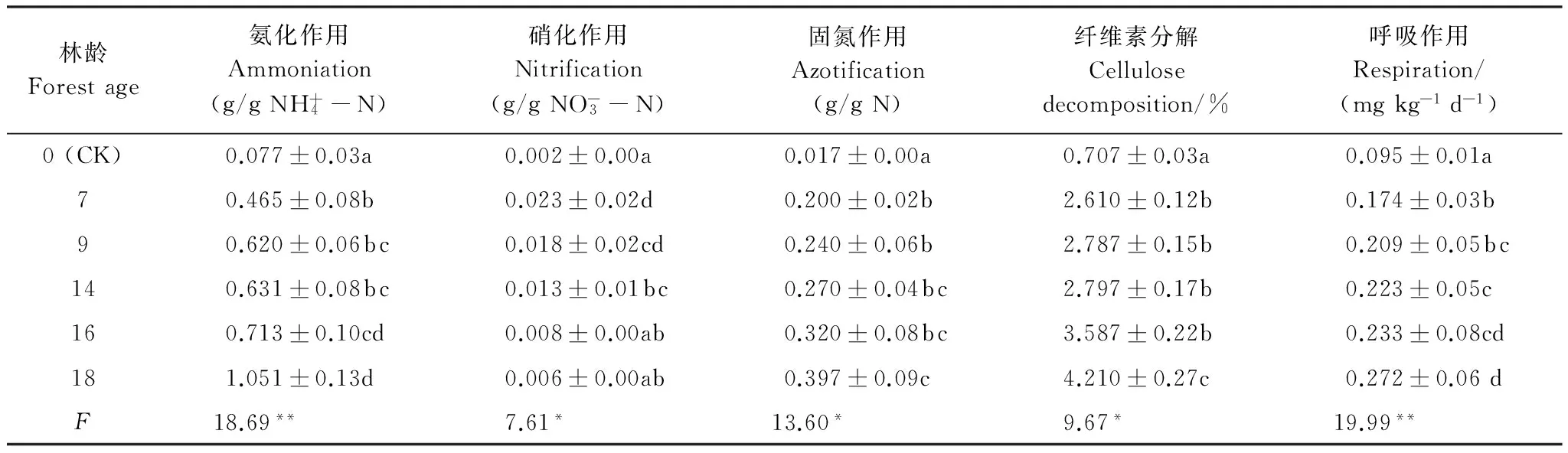
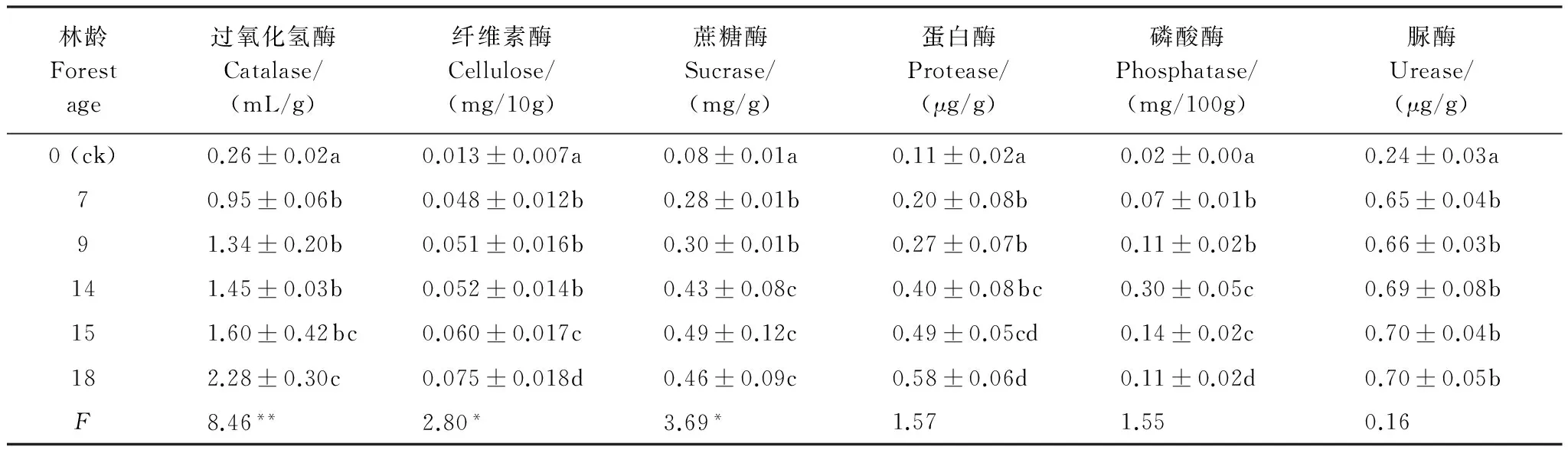
土壤生化作用强度是表征土壤生物学活性的重要指标。选择传统研究方法,从氨化作用、硝化作用、固氮作用、纤维素分解、呼吸作用以及酶活性6个方面,揭示了咸水滴灌下塔里木沙漠公路防护林地土壤生化作用强度的分异规律。结果表明,(1)随防护林定植年限的增大,土壤氨化作用、固氮作用、纤维素分解和呼吸作用的强度均明显增强,其中氨化作用和呼吸作用变化尤为明显;而硝化作用强度有所减弱。(2)0—50 cm土体内,随土壤深度增大,生化作用强度提高,氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用强度的垂直差异均达极显著水平(F>F0.01)。(3)随防护林定植年限的增大,不同土壤酶活性的变化各异,其中,过氧化氢酶活性显著增大(F>F0.01),纤维素酶和蔗糖酶的活性明显提高(F>F0.05),而蛋白酶、磷酸酶和脲酶的活性变化不大(F 流动沙漠;防护林地;咸水滴灌;定植年限;土壤生化强度 作为土壤有机体的基本生理功能,生化作用主要由微生物活动引起,而微生物是森林生态系统的主要分解者,因此土壤生化作用强度能够反映森林系统物质循环规律。土壤生化作用主要由氨化作用、硝化作用、呼吸作用、固氮作用和纤维素分解强度来体现[1]。微生物在土壤残体和有机质分解和生化循环中起重要调节作用[2]。土壤氨化、硝化、固氮及纤维素分解作用强度是在相关微生物类群直接参与下进行的,对维持生态系统C、N平衡起重要作用[3]。土壤生化作用强度常作为土壤微生物活性的综合指标[4]。 有关人工生物群落演变中土壤生化作用强度,前人已围绕盐碱地[5]、火烧迹地[6]和沙地[7]等开展过大量研究,但这些研究集中于非极端干旱区沙地免灌林地或淡水灌溉林地。有关处在极端干旱区的塔里木沙漠公路土壤生化作用强度的相关研究未见公开报道。塔里木沙漠公路位于塔克拉玛干沙漠这样的流动沙漠区域,其环境条件具有鲜明的特殊性(高温、高盐碱和多风沙),研究这种独特环境条件下咸水滴灌流沙地生物群落土壤生化作用演变的特殊性,对于认识人工植被干预下流沙地的成土发育规律具有重要意义。 塔里木沙漠公路地处塔克拉玛干沙漠,在塔里木盆地油气资源开发、南疆社会经济发展中发挥着重要作用,为确保其安全运行,沿线建立了“塔里木沙漠公路防护林生态工程”。在高温、干旱、高盐碱、多风沙等恶劣自然条件对防护林构成巨大威胁的背景下,揭示咸水滴灌条件下,随着定植年限和土壤深度的增加,防护林内风沙土的生化作用强度的变化规律,对理解防护林土壤发育趋势有重要意义。 因此,本研究以塔里木沙漠公路防护林土壤为研究对象,通过分析林地土壤氨化作用、固氮作用、呼吸作用和纤维素分解特征及其与土壤理化性质和微生物之间的关系,旨在揭示林地土壤物质循环特征及影响机制,为塔里木沙漠公路防护林的科学管理提供生物学方面理论依据。 1.1 研究区概况 塔克拉玛干沙漠腹地的自然环境极为严酷,气候极端干燥、地表水资源匮乏、地下水矿化度高、风沙活动强烈、土壤贫瘠。据前期研究及监测资料,沙漠公路沿线降水量不足50 mm,潜在蒸散量达3800 mm,极端最高气温43.2℃,极端最低气温-19.3℃,最大风速24 m/s,≥6.0 m/s的起沙风总时数550—800 h/a;沙漠公路沿线沙丘形态复杂多样,既有高度达50 m以上的纵向复合沙垄,也有高度不足1 m的新月形沙丘,次级沙丘覆盖率达60%以上,分布于高大复合沙垄垄间的小沙丘年移动量在15 m以上;沙漠公路沿线土壤以形成过程极为微弱的风沙土为主,自然植被贫乏,盖度极低[8-9]。 1.2 防护林简介 塔里木沙漠公路防护林生态工程北起塔里木沙漠公路K118 km+900 m处,南止塔里木沙漠公路K561 km+400 m处,全长442.5 km,包括公路全部沙漠路段,除去民丰隆起区6.5 km不宜造林路段,防护林带全长436 km。防护林设计总体宽72—78 m,林带总面积3128 hm2,栽植苗木总量1800余万株。 防护林工程选用适应性强、耐旱、耐沙埋的3种荒漠植物,即柽柳(Tamarix)、梭梭(Haloxylon)和沙拐枣(Calligomum),作为建设树种。采用带状混交和行间混交相组合的方式,株行距1 m × 2 m或1 m × 1 m。防护林灌溉采用地下水,滴灌方式。灌水矿化度2.6—29.7 g/L,灌水周期约为10 d。 1.3 试验设计 在塔里木沙漠公路防护林区,控制防护林其它条件(雅丹地貌、株行距1 m × 2 m、滴灌水质3 g/L左右、灌水周期10 d、根系发育)基本一致的前提下,选择5种定植时间不同的防护林以及流沙地(表1),于2013年8月中旬,依据防护林梭梭主要根系分布于地下50 cm土层内[10],分0—10、10—20、20—30、30—50 cm 4个深度,采集林地土壤。所选林地均有梭梭定植,且所用滴灌水矿化度基本相同,约为3 g/L。当定植年限大于5年时,梭梭根系发育趋于稳定,不同林龄下土壤发育差异不大[10]。 采样时紧贴防护林木梭梭根部[11]。同一样地随机设置5个平行采样点(重复5次),不同样点的同层土样弃去植物残体,过2 mm筛后混和均匀,装入对应编号的无菌样品袋,放入-4℃车载冰箱并运回实验室。用于理化性质、生物量和酶活性测定的样品实验室风干;用于分析生化强度的样品低温保存。 表1 不同防护林地简况 2.4 测试方法 土壤氨化作用和固氮作用采用土壤培养法;硝化作用采用溶液培养法;纤维素分解采用埋片法[12]。 土壤基础呼吸采用室内密闭培养法,利用一定浓度的KOH(或NaOH)溶液吸收土壤呼吸作用释放出的CO2,根据KOH溶液的消耗计算出CO2的含量[12]。 土壤酶活性测定用常规化学分析方法,其中蛋白酶、纤维素酶、蔗糖酶、磷酸酶、脲酶和过氧化氢酶比色法,过氧化氢酶采用滴定法[13]。 土壤微生物量碳、氮、磷分别采用熏蒸提取-容量分析法、茚三酮比色法和熏蒸提取-全磷测定法分析[14]。 磷脂脂肪酸分析(PLFA)法:微生物 PLFA分析包括脂肪酸提取、甲酯化和鉴定等步骤[15]。 聚合链式反应-变性梯度凝胶电泳(PCR-DGGE)法:土壤DNA提取、PCR扩增、变性梯度凝胶电泳、割胶回收、DGGE图谱分析和DNA克隆及序列分析[16]。 土壤理化性质采用常规分析方法[17],其中有机质用重铬酸钾容量法-外加热法,全氮用高氯酸-硫酸消化法,有效氮用碱解蒸馏法,全磷用酸溶-钼锑抗比色法,有效磷用0.5 mol/L NaHCO3浸提钼锑抗比色法,全钾用酸溶-火焰光度法,速效钾用NH4OAc浸提-火焰光度法,水溶性盐含量用残渣烘干法,土壤含水量用烘干法,容重用环刀法。 1.5 数据处理 PLFA图谱 利用GC-MS确定脂肪酸种类,借助STATISTICA6.0软件,对脂肪酸图谱进行方差分析。 DGGE指纹图谱 利用Bio-Rad公司的凝胶成像系统(Quantity One 4.4.1,Bio-Rad,USA),进行条带判读、迁移率、强度和面积计算。 土壤微生物的差异性:通过DPS 9.5统计软件中的方差分析及其多重比较(LSD法)以及相关分析揭示不同林地土壤生化强度的差异显著性及与土壤理化因子和微生物间的关系。 2.1 土壤生化作用强度 由表2看出,随着定植年限的增大,塔里木沙漠公路防护林地土壤的氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用的强度均有所增强。方差分析及其多重比较后发现,流沙地生化作用的强度明显小于定植7、9、14、15a和18b的防护林地土壤。F检验可知,各样地间氨化作用和呼吸作用的强度的差异极显著(F>F0.01),而硝化作用、固氮作用和纤维素分解的强度差异显著(F>F0.05)。定植5年的防护林地土壤氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用的强度分别为0.465、0.023、0.200、2.610%、0.174 mg kg-1d-1,而定植18年的防护林地土壤氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用的强度则分别提高到1.051 mg/g、0.006 mg/g、0.397 mg/g、4.210%和0.272 mg kg-1d-1,增幅均大于1.5倍。对于定植7、9、14a和15a的防护林地,土壤固氮作用和纤维素分解的强度差异不明显;而硝化作用强度差异不大。 表2 不同林地土壤生化作用强度的差异性(Mean ± SD, n=5) (1)显著性检验采用最小差异法 (LSD),F检验,重复5次;(2)F值后**和*表示在0.01和0.05显著水平上差异明显,数值后相同字母表示在0.01显著水平上差异不明显 表3 林地土壤生化强度的垂直差异性(Mean ± SD, n=5) 由表3可知,土壤氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用的强度在土层间的垂直差异极显著(F>F0.01)。随土壤深度的增加,生化作用强度呈现增强趋势,即0—10 cm > 10—20 cm > 20—30 cm > 30—50 cm。不同生化作用因子在0—50 cm土体内的垂直分异有所不同,氨化作用、硝化作用、固氮作用、纤维素分解和呼吸作用的强度的变化范围分别为1.13—2.82、0.007—0.026、0.14—0.44、2.10—4.23%、0.18—0.29 mg kg-1d-1,可见,氨化作用和固氮作用的强度垂直分异较为明显。 2.2 土壤酶活性 由表4可知,不同林地间土壤酶活性存在一定差异,这种差异的显著性依酶种而不同。经方差分析和F检验后发现,过氧化氢酶活性的差异极显著(F=8.46 >F0.01),纤维素酶和蔗糖酶的活性差异显著(F=2.80 >F0.05、F=3.69 >F0.05),而蛋白酶、磷酸酶和脲酶活性的差异不显著(F=1.57、1.55、0.16 表4 不同林地土壤酶活性的差异性(Mean ± SD, n=5) 2.3 土壤生化作用强度与土壤环境因子的关系 为揭示影响塔里木沙漠公路防护林地土壤生化作用强度的关键土壤环境因子,筛选对各生化强度因子影响较为显著的土壤因子,以土壤生化强度因子即氨化作用(Y1)、硝化作用(Y2)、固氮作用(Y3)、呼吸作用(Y4)和纤维素分解强度(Y5)为依变量,以土壤物理、化学和生物因子即容重(X1)、含水量(X2)、全盐(X3)、有机质(X4)、全氮(X5)、全磷(X6)、全钾(X7)、速效氮(X8)、速效磷(X9)、速效钾(X10)、微生物量碳(X11)、微生物量氮(X12)、微生物量磷(X13)、微生物脂肪酸多样性(X14)和微生物遗传多样性(X15)为因变量,采用逐步回归分析法,逐个淘汰不显著自变量,同时引入显著自变量,获得了最优回归方程[18](表5)。 表5 土壤环境因子与土壤微生物量的最优化回归模型(逐步回归分析法) 由表5可知,进入氨化作用最优回归方程的因子有全盐(X3)、全氮(X5)、全钾(X7)、速效氮(X8)、速效钾(X10)、微生物量氮(X12)、微生物量磷(X13)和微生物遗传多样性(X15),方程决定系数为0.95。其中,全氮、全钾、速效氮、微生物量氮和微生物遗传多样性与氨化作用强度正相关,全氮含量的正相关系数最大;而全盐含量、速效钾含量和微生物量磷含量与氨化作用强度负相关。 进入硝化作用最优回归方程的因子有含水量(X2)、全盐(X3)、全氮(X5)、全钾(X7)、速效氮(X8)、速效磷(X9)、微生物量磷(X13)、微生物脂肪酸多样性(X14)和微生物遗传多样性(X15),方程决定系数为0.97。各因子中,含水量、全氮、速效氮、微生物量氮、微生物脂肪酸多样性和微生物遗传多样性与土壤硝化作用强度呈正相关关系,但相关系数均不大;而全盐含量和全钾含量与硝化作用负相关。 进入固氮作用最优回归方程的因子有容重(X1)、含水量(X2)、全盐(X3)、有机质(X4)、全氮(X5)、全磷(X6)、速效氮(X8)、速效磷(X9)、速效钾(X10)、微生物量碳(X11)、微生物脂肪酸多样性(X14)和微生物遗传多样性(X15),方程决定系数为0.95。其中,含水量、有机质、全氮、速效氮、微生物量碳、微生物脂肪酸多样性和微生物遗传多样性与土壤固氮作用强度正相关,全氮含量的相关性最大;而全盐含量、全磷含量、速效磷含量和速效钾含量与固氮作用负相关,全磷的负相关系数最大。 进入纤维素分解最优回归方程的因子有容重(X1)、含水量(X2)、全盐(X3)、有机质(X4)、全氮(X5)、全钾(X7)、速效氮(X8)、速效磷(X9)、速效钾(X10)、微生物量碳(X11)、微生物量磷(X13)和微生物遗传多样性(X15),方程决定系数为0.96。其中,容重、含水量、有机质、全氮、全钾、速效氮、微生物量碳、微生物量磷和微生物遗传多样性与纤维素分解强度正相关,全氮的正相关系数最大为23.51,微生物量磷和含水量的正相关系数也较大;而容重、速效磷和速效钾与纤维素分解强度负相关。 进入呼吸作用最优回归方程的因子有容重(X1)、全盐(X3)、有机质(X4)、全氮(X5)、全磷(X6)、全钾(X7)、速效氮(X8)、速效磷(X9)、速效钾(X10)、微生物量氮(X12)、微生物量磷(X13)和微生物遗传多样性(X15),方程决定系数为0.99。其中,有机质、全氮、全磷、全钾、微生物量氮、微生物量磷和微生物遗传多样性与土壤呼吸作用正相关,但相关系数均较小;而容重、含盐量、速效氮磷钾与呼吸作用有弱的负相关。 综合分析发现,五个生化强度因子的最优回归方程的决定系数均在0.95以上,且P< 0.01。15个土壤因子中,只有全盐(X3)、全氮(X5)和速效氮(X8)进入了所有5个最优回归方程,即土壤盐分和氮元素成为影响塔里木沙漠公路防护林地土壤生化强度的关键土壤因子,同时影响不同土壤生化强度因子的土壤环境因子有一定差异。相比而言,纤维素分解强度对受土壤环境因子的影响程度最大。 土壤氨化、硝化、固氮、纤维素分解和呼吸作用的强度是在土壤微生物各主要生理类群直接参与下进行的,土壤在这些微生物群体的协调下,对维持其生态系统的C、N平衡有重要作用[19]。 在位于世界第二大流动沙漠—塔克拉玛干沙漠腹地,流沙地上定植防护林后,土壤氨化作用明显增强,由流沙地不足0.01 mg/g增加到定植18a的防护林地大于1 mg/g,且随林龄增大而极显著增强,这是由于塔里木沙漠公路防护林地土壤区系组成中以细菌为主[20],随防护林定植年限增大,参与氨化作用的细菌数量增加,可能促进了氨化作用强度。在0—50 cm土体内,氨化作用的垂直差异极显著,随土壤深度增加而有所增强,这与防护林土壤质量的垂直分异密切相关[21]。回归分析表明塔里木沙漠公路防护林地土壤氨化作用主要与土壤氮素和微生物遗传多样性的相关性较大。相同条件下,氨化作用的强弱与有机质的含量和组成有密切关系[12]。土壤微生物量氮被认为是自然生态系统中土壤氨化过程的主要氮素来源[22]。 影响硝化作用的主要因素包括温度、水分、pH值、有机质含量、含氮量和微生物生物量及其活性等[23]。塔里木沙漠公路防护林地土壤硝化作用随着防护林定植年限增大而明显减弱,流沙地为0.002 mg/g,定植5年的林地为0.023 mg/g,而15a的防护林地为0.006 mg/g,这是由于在流沙上定植防护林后,土壤微生物活性有所增强,微生物促进凋落物分解[24],改善土壤质量,进而有利于参与硝化作用的细菌生长。而晋西北黄土高原区小叶锦鸡儿人工灌丛不同定植年限(5、10、20、30、40a)土壤硝化速率的随生长年限延长而加快,30a时达高峰,40a开始衰退[25]。在0—50 cm土体内的垂直差异极显著,土层加深硝化作用强度有减弱趋势,这与土体条件的垂直分异对参与硝化作用的微生物的影响不同有关。回归分析表明,塔里木沙漠公路防护林地土壤硝化作用主要与土壤含水量、氮元素和土壤微生物多样性相关性较大。硝化作用为硝酸细菌和亚硝酸细菌将氨转化成亚硝酸和硝酸的两个连续过程,与氮素的有效利用有关[26-27]。风干土的硝化作用速率明显小于新鲜土,硝化作用起重要作用的硝化菌数量在经历风干过程后很难恢复到新鲜土水平[28]。 固氮作用形成的氮素化合物是土壤氮素的主要来源[29]。在塔里木沙漠公路防护林地,随林龄增大,土壤固氮作用明显增强,流沙地为0.017 mg/g,18年防护林地为0.397 mg/g;在0—50 cm土体内的垂直差异极显著,土层加深,固氮作用增强,这是因为塔里木沙漠公路防护林土壤全氮与水分含量等关键因子随林龄增大而增加以及在土层间的差异所致[30]。回归分析表明固氮作用与土壤含水量、有机质、氮素、微生物量碳、微生物多样性有较明显的正相关。不同栽培年限毛竹林地土壤固氮菌群落组成发生了明显变化,长期栽培毛竹林引起的土壤养分变化对土壤固氮菌多样性具有重要影响[31]。植被恢复下土壤固氮微生物区系组成的变化是不同理化因子之间相互关联、共同影响的结果[32]。 纤维素是组成森林凋落物的主要成分[33-34]。土壤纤维素的分解对于提高土壤肥力,改善植物营养有重要意义[35]。在塔里木沙漠公路防护林地,随林龄增大,土壤纤维素酶活性明显增强,流沙地不足1%,而18年的防护林地超过4%;同时,在0—50 cm土体内,纤维素分解强度垂直差异明显,随土层加深有增强趋势;回归分析表明,土壤容重、含水量、有机质、微生物量磷与纤维素分解强度正相关性较大。土壤纤维素分解酶活性与土壤有机质、有效氮、有效磷、蛋白酶、脲酶及蔗糖酶有显著的正相关,与土壤水分、全氮、全磷等土壤肥力因子也有一定的正相关[36]。土壤养分是决定土壤好氧性纤维素分解菌数量的主要因子,水热条件对其直接作用并不明显,但水热、施肥、土壤类型对纤维素分解菌数量有显著的交互作用[37]。人工植被恢复显著地改善了土壤生态环境,促进了土壤养分的提高[38]。 土壤呼吸作用是释放CO2的过程[39]。在塔里木沙漠公路防护林地,土壤呼吸作用强度在不同林龄的防护林地间的差异极显著,林龄增大,呼吸作用增强,定植7a林地为0.17 mg/kg,定植18a的林地增大到0.27 mg/kg,这与凋落物对土壤呼吸有显著作用有关[40]。在0—50 cm土体内,呼吸作用强度的垂直差异极显著,随土层加深而增强,这是因为,深层土壤根系生物量较多,水分条件较好,造成土壤呼吸速率较高[41]。回归分析表明,土壤有机质、全量氮磷钾、微生物量氮磷与呼吸作用正相关较明显,但相关系数较小。土壤酶主要来源于土壤微生物细胞,与土壤微生物密切相关[35]。 土壤酶活性是土壤肥力评价的重要指标[42]。塔里木沙漠公路防护林从7a生长到18a,过氧化氢酶活性提高最快,纤维素酶活性增强较明显,而脲酶活性的变化最小。这是因为不同酶种的影响因素不同,固沙植被的生长能够促进土壤有机质和氮素的积累,为微生物的存活提供能源物质,进而提高土壤酶活性[43]。 塔里木沙漠公路防护林位于塔克拉玛干沙漠腹地,以高温、干旱、高盐碱、多风沙为代表的环境因子造就了“死亡之海”的美誉。流动风沙土上定植有强抗逆性的梭梭、沙拐枣和柽柳后,在咸水灌溉和人工施入化肥磷酸二铵和尿素的影响下,土壤开始正向发育,容重降低、持水性增强、养分有效性增强,土壤微生物活性逐步增大,最后促使土壤氮素转化加速,氨化作用增强,硝化作用减弱;林木根系和微生物一起,促进了土壤固氮作用;枯枝落叶进入土壤,在具备一定水分和氮磷含量下,逐渐被微生物所分解,纤维素分解作用增强;随着林木的生长,根系活性增强,和微生物代谢活动一起,使土壤呼吸作用加强。然而,回归分析发现,土壤含盐量对土壤氨化、固氮、呼吸和纤维素分解有有抑制作用,这与王海涛等[44]的结论一致。氮元素作为植物生长的必需元素,在塔里木沙漠公路防护林地土壤中,对氨化、呼吸、固氮和纤维素分解强度有明显促进作用,可能是氨化、固氮作用需要以氮素为核心;微生物生长需要氮素作为营养,与微生物呼吸相关;纤维素分解在一定的碳氮比例下进行比较有利。 本研究认为,在现有的管理措施下,塔里木沙漠公路防护林地土壤生化强度仍在增大。范亚文[45]研究指出,在碱斑土壤上种植耐盐植物后,土壤氨化作用、固氮作用增强;而硝化作用减弱,且定植7a耐盐植物的生化强度与本研究中定植18a的防护林地较为接近,显然塔里木沙漠公路防护林地土壤生化强度的变化与干旱区其它林地相比明显缓慢[46],这反映不同土壤母质、气候条件和管理措施对土壤生化强度的影响较大。 因此,可以认为,在现有管理措施和环境条件下,随着林木的正常生长,塔里木沙漠公路防护林地土壤的生化作用强度还会增强,至于何时出现回落,需要进一步研究。 [1] 覃勇荣, 梁文忠, 陈贵常, 余美君, 覃兴家, 刘旭辉. 不同植被对桂西北石漠化地区土壤生化作用强度的影响. 西北农业学报, 2013, 22(12): 68- 74. [2] Jordan D, Kremer R J, Bergfield W A, Kim K Y, Cacnio V N. Evaluation of microbial methods as potential indicators of soil quality in historical agricultural fields. Biology and Fertility of Soils, 1995, 19(4): 297- 302. [3] Zabinski C A, Gannon J E. Effects of recreational impacts on soil microbial communities. Environmental Management, 1997, 21(2): 233- 238. [4] Kelly J J, Tate R L. Use of BIOLOG for the analysis of microbial communities from zinc-contaminated soils. Journal of Environmental Quality, 1998, 27(4): 600- 608. [5] 汤洁, 方天儒, 侯克怡, 赵仁竹, 梁爽. 盐碱区不同开发年限水田温室气体排放规律及影响因素. 环境科学, 2014, 35(12): 4727- 4734. [6] 孙毓鑫, 吴建平, 周丽霞, 林永标, 傅声雷. 广东鹤山火烧迹地植被恢复后土壤养分含量变化. 应用生态学报, 2009, 20(3): 513- 517. [7] 戴雅婷, 侯向阳, 闫志坚, 吴洪新, 解继红, 张晓庆, 高丽. 库布齐沙地两种植被恢复类型根际土壤微生物和土壤化学性质比较研究. 生态学报, 2016, 36(20): 6353- 6364. [8] 李生宇, 李红忠, 雷加强, 李丙文, 徐新文, 周宏伟. 塔克拉玛干沙漠不同立地条件下咸水滴溉苗木的生长差异. 水土保持学报, 2004, 18(3): 118- 122. [9] 周智彬, 李培军, 徐新文, 潘伯荣. 塔克拉玛干沙漠腹地人工绿地对沙地盐分时空分布的影响. 水土保持学报, 2002, 16(2): 16- 19. [10] 王晓静, 徐新文, 雷加强, 李生宇, 王永东, 李中全. 沙漠腹地咸水滴灌条件下沙漠公路防护林根系垂直分布特征. 科学通报, 2008, 53(Z2): 69- 73. [11] 刘久俊, 方升佐, 谢宝东, 郝娟娟. 生物覆盖对杨树人工林根际土壤微生物、酶活性及林木生长的影响. 应用生态学报, 2008, 19(6): 1204- 1210. [12] 许光辉, 郑洪元. 土壤微生物分析方法手册. 北京: 农业出版社, 1986. [13] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986. [14] 吴金水, 林启美, 黄巧云, 肖和艾. 土壤微生物生物量测定方法及其应用. 北京: 气象出版社, 2006: 55- 88. [15] Larkin R P, Honeycutt C W, Griffin T S. Effect of swine and dairy manure amendments on microbial communities in three soils as influenced by environmental conditions. Biology and Fertility of Soils, 2006, 43(1): 51- 61. [16] 段学军, 闵航. 镉胁迫下稻田土壤微生物基因多样性的DGGE分子指纹分析. 环境科学, 2004, 25(5): 122- 126. [17] 中国科学院南京土壤研究所. 土壤理化分析. 上海: 上海科学技术出版社, 1978. [18] 唐启义, 冯明光. 实用统计分析及其DPS数据处理系统. 北京: 科学出版社, 2002: 304- 311. [19] Prassd P. A comparative account of the microbiological characteristics of soils under natural forest, grassland and crop fieldfrom Eastern India. Plant and Soil, 1995, 175(1): 85- 91. [20] 靳正忠, 雷加强, 徐新文, 李生宇, 赵思峰. 流动沙漠腹地咸水滴灌林地土壤微生物的种群特征. 应用与环境生物学报, 2009, 15(2): 192- 196. [21] 靳正忠, 雷加强, 李生宇, 徐新文, 邱永志, 谷峰, 刘小路. 流动沙漠腹地防护林土壤肥力质量垂直演化与评价. 土壤学报, 2010, 47(6): 1075- 1085. [22] 赵彤, 蒋跃利, 闫浩, 黄懿梅. 土壤氨化过程中微生物作用研究进展. 应用与环境生物学报, 2014, 20(2): 315- 321. [23] 刘娟娟. 环境条件对土壤微生物多样性和硝化作用的影响[D]. 南京: 南京师范大学, 2011. [24] 邹飏阳, 靳正忠, 张栋栋, 李生宇, 徐新文. 塔克拉玛干沙漠公路防护林带不同林分的凋落物贮量及土壤性质研究. 土壤通报, 2015, 46(3): 656- 663. [25] 白日军, 杨治平, 张强, 张训忠. 晋西北不同年限小叶锦鸡儿灌丛土壤氮矿化和硝化作用. 生态学报, 2016, 36(24), doi: 10.5846/stxb201506101175. [26] Jensen K, Revsbech N P, Nielsen L P. Microscale distribution of nitrification activity in sediment determined with a shielded microsensor for nitrate. Applied and Environmental Microbiology, 1993, 59(10): 3287- 3296. [27] Katyal J C, Carter M F, Vlek P L G. Nitrification activity in submerged soils and its relation to denitrification loss. Biology and Fertility of Soils, 1988, 7(1): 16- 22. [28] 林江辉, 李辉信, 胡锋, 赵海燕. 干土效应对土壤生物组成及矿化与硝化作用的影响. 土壤学报, 2004, 41(6): 924- 930. [29] 张萍. 刀耕火种对土壤微生物和土壤肥力的影响. 生态学杂志, 1996, 15(3): 64- 67. [30] 靳正忠, 雷加强, 徐新文, 李生宇, 赵思峰, 邱永志, 许波, 谷峰. 沙漠腹地人工绿地土壤微生物变异与土壤环境因子关系的研究. 中国生态农业学报, 2008, 16(6): 1358- 1364. [31] 何冬华, 沈秋兰, 徐秋芳, 陈俊辉, 程敏, 毛新伟, 李永春. 不同年限毛竹林土壤固氮菌群落结构和丰度的演变. 土壤学报, 2015, 52(4): 934- 942. [32] 李刚, 王丽娟, 李玉洁, 乔江, 张海芳, 宋晓龙, 杨殿林. 呼伦贝尔沙地不同植被恢复模式对土壤固氮微生物多样性的影响. 应用生态学报, 2013, 24(6): 1639- 1646. [33] Marshall K C. Advances in Microbial Ecology. New York: Plenum Press, 1985: 237- 244. [34] 张萍, 郭辉军, 杨世雄, 刀志灵. 高黎贡山土壤微生物生态分布及其生化特性的研究. 应用生态学报, 1999, 10(1): 74- 78. [35] 李阜棣, 喻子牛, 何绍江. 农业微生物学实验技术. 北京: 中国农业出版社, 1996. [36] 刘旭辉, 覃珊, 覃勇荣, 叶美凤, 潘振兴. 不同植被对石漠化地区土壤纤维素分解酶活性的影响. 中国农学通报, 2010, 26(18): 335- 340. [37] 荣娟敏, 孙波. 水热条件和土壤类型对纤维素分解菌的影响. 土壤, 2012, 44(1): 84- 89. [38] 王翔. 安太堡露天矿复垦地植被恢复对土壤酶活性和微生物区系影响的研究[D]. 太原: 山西大学, 2012. [39] 陈锡时, 郭树凡, 汪景宽, 张键. 地膜覆盖栽培对土壤微生物种群和生物活性的影响. 应用生态学报, 1998, 9(4): 435- 439. [40] 时秀焕, 张晓平, 梁爱珍, 申艳, 范如芹, 杨学明. 土壤CO2排放主要影响因素的研究进展. 土壤通报, 2010, 41(3): 761- 768. [41] Wiseman P E, Seiler J R. Soil CO2efflux across four age classes of plantation loblolly pine (PinustaedaL.) on the Virginia Piedmont. Forest Ecology and Management, 2004, 192(2/3): 297- 311. [42] 李亮, 包耀贤, 廖超英, 赵志强, 唐海滨. 乌兰布和沙漠东北部沙区人工林土壤微生物及酶活性研究. 西北植物学报, 2010, 30(5): 987- 994. [43] 虎瑞, 王新平, 张亚峰, 潘颜霞, 石薇, 金艳霞. 沙坡头地区固沙植被对土壤酶活性的影响. 兰州大学学报: 自然科学版, 2015, 51(5): 676- 682. [44] 王海涛, 张银太, 何兴东, 高玉葆, 薛苹苹, 张宁. 干旱区油蒿生物量凋落分解与土壤呼吸. 中国沙漠, 2007, 27(3): 455- 459. [45] 范亚文. 种植耐盐植物改良盐碱土的研究[D]. 哈尔滨: 东北林业大学, 2001. [46] 张丽萍, 陈亚宁, 李学森, 张丽华, 黄湘. 准噶尔盆地西北缘梭梭、假木贼、盐穗木群落土壤呼吸特征比较. 干旱区地理, 2009, 32(2): 188- 195. Biochemical intensity and microbial eco-characterization of soils irrigated with saline water from the Tarim Desert Highway shelter-belt JIN Zhengzhong*, LEI Jiaqiang, LI Shengyu, XU Xinwen XinjiangInstituteofEcologyandGeography,ChineseAcademyofSciences,Urumqi830011,China Biochemical intensity of soil is an important index for characterizing biological activity. In this study, traditional research methods were employed to determine the soil biochemical characteristics of the Tarim Desert Highway shelter-belt from six aspects, including ammonification, nitrification, azotification, cellulose decomposition, respiration, and enzymatic activity. The main experimental results were as follows: (1) With increasing years since planting, ammonification and respiration showed the greatest improvements; azotification and cellulose decomposition also showed significant improvements, but nitrification was weakened. (2) Vertical differences in ammonification, nitrification, azotification, cellulose decomposition, and respiration in the 0—50 cm soil layer reached highly significant levels (F>F0.01), and biochemical activity of the soil increased with depth. (3) As years since planting increased, catalase activity showed the greatest increase (F>F0.01), cellulose and invertase activity also significantly increased (F>F0.05), and protease, phosphatase, and urease activity only minimally increased (F mobile desert; shelter-belt land; saline water irrigation; plantation time; soil biochemical intensity 国家自然科学基金项目 (41571498) 2016- 06- 13; 2017- 01- 16 10.5846/stxb201606131142 *通讯作者Corresponding author.E-mail: jinzz@ms.xjb.ac.cn 靳正忠,雷加强,李生宇,徐新文.咸水滴灌下塔里木沙漠公路防护林土壤生化作用强度及微生物生态特征.生态学报,2017,37(12):4091- 4099. Jin Z Z, Lei J Q, Li S Y, Xu X W.Biochemical intensity and microbial eco-characterization of soils irrigated with saline water from the Tarim Desert Highway shelter-belt.Acta Ecologica Sinica,2017,37(12):4091- 4099.1 研究方法
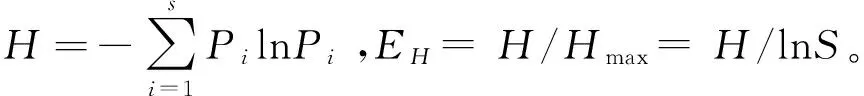
2 结果与分析


4 讨论与结论
