Exendin-4改善氧化应激减轻t-BHP诱导的HUVECs凋亡
2017-08-07王林曦刘小莺刘晓红刘礼斌
吴 莉, 王林曦,2, 刘小莺, 刘晓红, 陈 洲, 刘礼斌
Exendin-4改善氧化应激减轻t-BHP诱导的HUVECs凋亡
吴 莉1, 王林曦1,2, 刘小莺1, 刘晓红1, 陈 洲3, 刘礼斌1
目的 探讨Exendin-4对第三丁基过氧化氢(t-BHP)诱导人脐静脉内皮细胞(HUVECs)凋亡的影响。 方法 在原代培养的HUVECs中,采用t-BHP(100 μmol/L)干预4 h,加用或不加用Exendin-4(100 nmol/L)预处理细胞24 h,分为:对照组(A组)、t-BHP处理组(B组)、Exendin-4处理组(C组)及Exendin-4+t-BHP组(D组)。应用MTT比色法检测细胞存活率,DAPI染色荧光显微镜观察细胞凋亡率,活性氧(ROS)检测试剂盒检测ROS的产生。 结果 与A组比较,100 μmol/L t-BHP作用4 h,B组的HUVECs存活率下降40%(P<0.001);DAPI染色荧光显微镜观察证实,t-BHP可以诱导HUVECs凋亡;加用Exendin-4预处理细胞24 h,D组的HUVECs存活率较B组增高(P<0.01)。DAPI染色荧光显微镜观察细胞凋亡率提示,与B组比较,Exendin-4预处理可使D组的细胞凋亡率减少44%(P<0.05),并减少ROS的产生(P<0.05)。 结论 t-BHP能够诱导HUVECs凋亡,Exendin-4可减少t-BHP诱导的HUVECs凋亡。
过氧化氢; 内皮, 血管/细胞学; 脐静脉/细胞学; 肽类; 毒液类; 细胞凋亡; 氧化性应激
糖尿病大血管并发症的病理基础是动脉粥样硬化性改变。研究表明,糖尿病患者体内氧化应激水平增高,过强的氧化应激会诱导内皮细胞凋亡,是动脉粥样硬化起始和进展的重要因素[1-2]。抑制过强氧化应激所诱导的内皮细胞凋亡可作为糖尿病血管病变防治措施的新靶点。
第三丁基过氧化氢(tert-butyl hydroperoxide, t-BHP)是过氧化氢的类似物,化学性质稳定,是体外研究氧化应激的常用物质。本课题组前期研究阐明t-BHP可诱导人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)凋亡[3]。胰升糖素样肽-1(glucagon-like peptide-1, GLP-1)是一种肠促胰岛素,除有效降低血糖外,还有多种生理功能。Gaspari等研究发现,GLP-1受体激动剂可保护内皮功能,抑制ApoE(-/-)小鼠动脉粥样斑块的形成。Exendin-4是GLP-1受体激动剂[4]。本实验拟在原代培养的HUVECs中观察Exendin-4对t-BHP诱导内皮细胞凋亡的影响,为糖尿病大血管并发症的防护提供必要的实验依据。
1 材料与方法
1.1 材料 ECM培养基(批号:19602,美国ScienCell研究实验室);0.25%胰酶(批号:1782823,美国Gibco公司);t-BHP(批号:#BCBN5378V,美国Sigma公司);Exendin-4(批号:#065M4752V,美国Sigma公司);二甲基亚砜(DMSO,批号:M7423,美国MP Biomedicals);DAPI染色液(杭州碧云天生物技术研究所);活性氧(reactive oxygen species,ROS)检测试剂盒(杭州碧云天生物技术研究所);噻唑蓝(MTT,杭州碧云天生物技术研究所)。
1.2 方法
1.2.1 HUVECs原代培养 参照文献[5]的原代培养方法收集HUVECs,用ECM培养基(ECM+青霉素100 U/mL+链霉素100 μg/mL+10%胎牛血清)按2×105~3×105mL-1的细胞密度接种,在37 ℃、体积分数为0.05的CO2培养箱中培养,细胞生长约80%~90%融合时进行传代培养。选用3~5代的HUVECs,以5×105mL-1的细胞密度接种于相应的培养板中进行相应实验。
1.2.2 分组 参照本课题组前期研究结果[3,6]。本实验采用100 μmol/L t-BHP干预HUVECs 4 h,Exendin-4浓度采用100 nmol/L,预处理时间为24 h。实验分组:(1)对照组(A组):用无血清ECM培养基空白预处理细胞24 h后,空白处理4 h;(2)t-BHP处理组(B组):空白预处理细胞24 h后,t-BHP 100 μmol/L干预细胞4 h;(3)Exendin-4处理组(C组):Exendin-4 100 nmol/L处理细胞24 h后,空白处理4 h;(4)Exendin-4+t-BHP组(D组):Exendin-4 100 nmol/L预处理细胞24 h后,加入t-BHP 100 μmol/L作用4 h。
1.2.3 MTT检测方法检测细胞活力 按1.2.2实验分组处理细胞后,各组每孔加入5 g/L MTT试剂10 μL,37 ℃孵育4 h,弃上清,各孔加100 μL DMSO,振荡10 min,用酶标仪在490 nm波长下检测吸光度,计算细胞存活率。
1.2.4 DAPI染色用荧光显微镜观察细胞凋亡 按1.2.2实验分组处理细胞后,弃上清,PBS清洗1次,加入DAPI染色液覆盖细胞,室温放置3~5 min,吸弃DAPI染色液,用PBS洗涤3次,封片后荧光显微镜(激发波长355 nm)下检测细胞凋亡率。正常细胞表现为弱蓝色的荧光;凋亡细胞表现为强蓝色的荧光或表现为染色质固缩、边集。
1.2.5 ROS检测 按1.2.2实验分组处理细胞后,弃上清,PBS清洗1次,加入DCFH-DA(用无血清ECM培养基稀释使其终浓度为10 μmol/L),37 ℃孵育20 min,用无血清ECM培养基洗涤细胞3次,用荧光显微镜在激发波长488 nm下观察并拍照。用Image J软件分析平均荧光强度。

2 结 果
2.1 Exendin-4对t-BHP诱导的HUVECs存活率的影响 MTT检测结果显示,与A组比较,100 μmol/L t-BHP作用4 h,B组的HUVECs存活率下降40%(P<0.001,图1);加用Exendin-4预处理后,D组的HUVECs存活率(0.593±0.085)较B组(0.803±0.055)增高(P<0.01,图1)。

Con:对照组; Ex-4:Exendin-4; t-BHP:第三丁基过氧化氢. 与对照组比较,△:P<0.001;与t-BHP组比较,#:P<0.01.图1 Exendin-4对t-BHP诱导的HUVECs存活率的影响Fig 1 The effect of Exendin-4(100 nmol/L) on the cell viability of HUVECs induced by t-BHP
2.2 Exendin-4对t-BHP诱导HUVECs凋亡的影响 DAPI染色荧光显微镜观察结果显示,与A组比较,100 μmol/L t-BHP作用4 h,B组的HUVECs凋亡增加;Exendin-4预处理的D组的HUVECs凋亡率较B组减少44%(P<0.05,图2)。
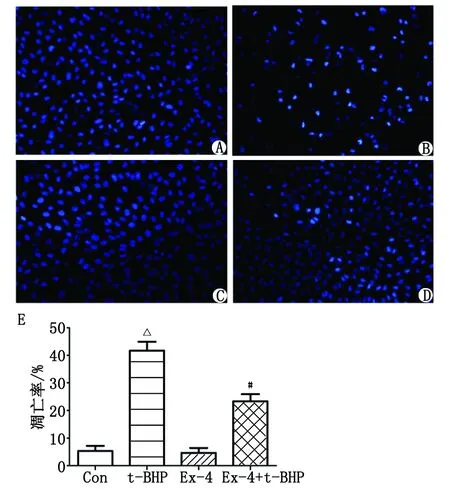
A:对照组;B:t-BHP干预组;C:Exendin-4处理组;D:Exendin-4+t-BHP处理组;E:凋亡率分析. 凋亡细胞为强蓝色荧光或染色质固缩、边集. Con:对照组; Ex-4:Exendin-4; t-BHP:第三丁基过氧化氢. 与对照组比较,△:P<0.001;与t-BHP组比较,#:P<0.05.图2 Exendin-4对t-BHP诱导的HUVECs凋亡的影响( ×200)Fig 2 The effect of Exendin-4 on the apotosis of HUVECs induced by t-BHP( ×200)
2.3 Exendin-4对活性氧产生的影响 与A组比较,B组的绿色荧光强度增强,平均荧光强度增高(P<0.05,图3);与B组比较,D组的绿色荧光强度减弱,平均荧光强度降低(P<0.05,图3)。
3 讨 论
氧化应激是老化和心血管障碍的起因,糖尿病患者体内氧化应激水平升高,ROS产生增多,内皮细胞对ROS介导的功能障碍尤为敏感。过强的氧化应激会诱导内皮细胞凋亡,此病理过程会促进动脉粥样硬化的起始及进展[2,7]。Cancel等也阐明内皮细胞凋亡的病理性增加会促进动脉粥样硬化的发生和进展[8]。若增强抗氧化防御能力,减少氧化应激诱导的内皮细胞凋亡,可预防和延缓糖尿病患者大血管并发症的发生发展。

A:对照组;B:t-BHP干预组;C:Exendin-4处理组;D:Exendin-4+t-BHP处理组;E:平均荧光强度分析. Con:对照组;Ex-4:Exendin-4; t-BHP:第三丁基过氧化氢. 与对照组比较,△:P<0.05;与t-BHP组比较,#:P<0.05.图3 Exendin-4对活性氧产生的影响( ×200)Fig 3 The effect of Exendin-4 on the generation of ROS( ×200)
t-BHP是过氧化氢的类似物,化学性质比较稳定,在应用于研究氧化损伤模型方面具有优势,已被广泛用于建立体外氧化应激的细胞模型。本研究结果显示,t-BHP(100 μmol/L)干预4 h,HUVECs存活率降低,DAPI染色荧光显微镜观察从细胞形态学方面也证实t-BHP可诱导HUVECs凋亡。
GLP-1是一种肠促胰岛素,其分泌的主要刺激物是肠道内营养物质的摄入。GLP-1能阻止胰岛β细胞凋亡,诱导胰岛β细胞再生,促进胰岛素分泌,改善外周组织对胰岛素的敏感性。GLP-1半衰期短,仅1~2 min,此半衰期短的特点限制了其临床应用。近年来,大量的GLP-1类似物和GLP-1受体激动剂发展起来并逐渐走向临床。Exendin-4是GLP-1受体激动剂,可以激活GLP-1受体,半衰期长,作为降糖新药已成为研究关注的热点。
随着GLP-1受体在心血管系统中表达的确立,目前研究集中于GLP-1对心脏和血管系统的影响。针对GLP-1的临床荟萃分析提示,GLP-1除了控制血糖、改善脂代谢、减轻体质量等作用外,还具有独立于上述作用之外的心血管保护作用:可以改善内皮功能、促进心肌葡萄糖摄取、提高心脏收缩功能等[9]。研究标明,GLP-1可改善高糖环境下人脐静脉内皮细胞的氧化应激[10],亦可诱导抗氧化防御基因HO-1和NQO1,减弱氧化应激诱导的基因损伤,对氧化应激诱导的内皮细胞老化有直接的保护作用[11]。从这些研究可以看出,GLP-1对氧化应激状态下的内皮细胞有保护作用。本研究中,ROS检测结果提示,与B组比较,Exendin-4预处理可减少细胞ROS的产生。MTT检测结果提示,加用Exendin-4预处理细胞24 h,HUVECs存活率较单独t-BHP干预组增高。DAPI染色荧光显微镜检测细胞凋亡率结果显示,Exendin-4预处理可使HUVECs凋亡率减少。本研究中可以观察到,Exendin-4可以减轻ROS的产生,减少t-BHP诱导的HUVECs凋亡。研究表明,Exendin-4激活GLP-1受体后,可通过刺激G蛋白而激活腺苷酸环化酶,形成环磷酸腺苷(cyclic adenosine monophosphate, cAMP),细胞内cAMP水平升高,进而激活蛋白激酶A(protein kinase A, PKA)。GLP-1在发挥细胞保护作用、减少病理状态下细胞凋亡的过程中,cAMP依赖的PKA信号通路是一关键途径[12]。Ge等阐明GLP-1通过cAMP/PKA依赖的方式减少高糖诱导的心脏微血管内皮细胞凋亡[13]。因此,笔者推测,Exendin-4可能通过cAMP/PKA通路减轻氧化应激,减少t-BHP诱导的HUVECs凋亡,此机制需要进一步研究证实。
[1] Saeidnia S,Abdollahi M. Toxicological and pharmacological concerns on oxidative stress and related diseases[J].ToxicolApplPharmacol,2013, 273(3):442-455.
[2] Kondo T, Hirose M, Kageyama K. Roles of oxidative stress and redox regulation in atherosclerosis[J].JAtherosclerThromb, 2009,16(5):532-538.
[3] 唐 莉,刘小莺,王林曦,等. 氧化应激诱导内皮细胞凋亡与PI3k/Akt-Bcl-2通路的关系[J]. 细胞与分子免疫学杂志,2011,27(8):859-861.
[4] Gaspari T,Welungoda I,Widdop R E,etal. The GLP-1 receptor agonist liraglutide inhibits progression of vascular disease via effects on atherogenesis, plaque stability and endothelial function in an ApoE(-/-) mouse model[J].DiabVascDisRes, 2013,10(4): 353-360.
[5] 付 伟,李慧敏,苏建华,等.人脐静脉内皮细胞的原代培养及鉴定[J]. 南京医科大学学报:自然科学版, 2009,29(1):89-91.
[6] 吴 莉,王燕萍,刘小莺,等. Exendin-4减轻衣霉素诱导的人脐静脉内皮细胞凋亡[J]. 福建医科大学学报,2012,46(2):85-89.
[7] Shaw A,Doherty M K,Mutch N J,etal. Endothelial cell oxidative stress in diabetes: a key driver of cardiovascular complications[J].BiochemSocTrans,2014,42(4):928-933.
[8] Cancel L M,Ebong E E,Mensah S,etal. Endothelial glycocalyx, apoptosis and inflammation in an atherosclerotic mouse model[J].Atherosclerosis,2016,252:136-146.
[9] Kang Y M,Jung C H. Cardiovascular effects of glucagon-like peptide-1 receptor agonists[J].EndocrinolMetab(Seoul),2016,31(2):258-274.
[10] 王丽静,陈丽云,刘晓红,等. 胰高血糖素样肽-1可改善高糖环境下人脐静脉内皮细胞的氧化应激[J]. 福建医科大学学报, 2014,48(4):222-226.
[11] Oeseburg H,de Boer R A,Buikema H,etal. Glucagon-like peptide 1 prevents reactive oxygen species-induced endothelial cell senescence through the activation of protein kinase A[J].ArteriosclerThrombVascBiol, 2010,30(7):1407-1414.
[12] Drucker D J. Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis[J].MolEndocrinol, 2003,17(2):161-171.
[13] Ge G H,Dou H J,Yang S S,etal. Glucagon-like peptide-1 protects against cardiac microvascular endothelial cells injured by high glucose[J].AsianPacJTropMed, 2015,8(1):73-78.
(编辑:张慧茹)
Exendin-4 Mitigated Oxidative Stress and Protected Human Umbilical Vein Endothelial Cells from t-BHP-induced Apoptosis
WU Li1, WANG Linxi1,2, LIU Xiaoying1, LIU Xiaohong1, CHEN Zhou3, LIU Libin1
1.Department of Endocrinology, Fujian Medical University Union Hospital;Fujian Institute of Endocrinology, Fuzhou 350001, China;2.Department of Geriatrics, Fujian Medical University Union Hospital, Fuzhou 350001, China;3.College of Pharmacy, Fujian Medical University, Fuzhou 350122, China
Objective To explore the effect of Exendin-4 on human umbilical vein endothelial cells(HUVECs)apoptosis induced by tert-butyl hydroperoxide(t-BHP). Methods Primary HUVECs were induced by t-BHP(100 μmol/L) for 4 h, with or without pretreatment of Exendin-4(100 nmol/L)for 24 h. The cells were divided into four groups: control group(A group), t-BHP group(B group), Exendin-4 group(C group) and Exendin-4+t-BHP(D group). MTT assay was used to measure the cell viability, and fluorescence microscopic analysis with DAPI staining was used to evaluate the apoptotic rate of HUVECs. Reactive oxygen species(ROS) detection kit was used to detect the generation of ROS. Results Following t-BHP administration, the HUVECs viability of B group decreased about 40%(P<0.001)compared to A group and fluorescence microscopy confirmed that t-BHP was inducing HUVECs apoptosis. The viability of HUVECs of D group was increased than that of B group(P<0.01). The fluorescence microscopic analysis with DAPI staining showed that the apoptosis rate of HUVECs of D group decreased about 44% (P<0.05)than that of B group. The Generation of ROS was attenuated by Exendin-4 pretreatment compared to B group(P<0.05). Conclusion t-BHP could induce apoptosis of primary HUVECs, and Exendin-4 could protect HUVECs from t-BHP-induced apoptosis.
hydrogen peroxide; endothelium, vascular/cytology; umbilical veins/cytology; peptides; venoms; apoptosis; oxidative stress
2016-10-11
福建省科技重点项目(2013Y0041);福建省卫生和计划生育委员会青年项目(2014-1-43);福建医科大学苗圃基金(2014MP031)
福建医科大学 1.附属协和医院 内分泌科,福建省内分泌研究所, 福州 350001;2.附属协和医院 老年病科,福州 350001;3.药学院,福州 350122
吴 莉,女,住院医师,医学硕士
刘礼斌. Email:libin.liu@fjmu.edu.cn
R322.123; R329.24; R329.25; R977.6; R996.3
A
1672-4194(2017)02-0088-04
