MiR-137在缺血性卒中后抑郁患者外周血中的表达及其临床意义
2017-08-07鲁豫田小军史莉瑾苏洲郭双喜王玉梅
鲁豫,田小军,史莉瑾,苏洲,郭双喜,王玉梅
·学术交流·
MiR-137在缺血性卒中后抑郁患者外周血中的表达及其临床意义
鲁豫,田小军,史莉瑾,苏洲,郭双喜,王玉梅
目的 探讨缺血性卒中后抑郁患者miR-137的变化及临床意义。方法 采用中国急性缺血性脑卒中诊治指南 2014急性脑梗死诊断标准、汉密尔顿抑郁量表(HAMD-24项)、精神障碍诊断及统计手册第五版(DSM-5)将研究对象分为正常对照组、抑郁症组各20例,并发抑郁组、未并发抑郁组各37例。运用实时荧光定量PCR方法(qRT-PCR)检测各组microRNA(miRNA)-137的表达水平,并对相关结果进行比较。结果四组样本的性别、年龄、合并高血压病、合并糖尿病、合并心脏病、NIHSS评分差异无统计学意义(均P>0.05)。与未并发抑郁组相比,并发抑郁组左侧脑梗死例数明显增高(P<0.05)。与正常对照组相比,未并发抑郁组、并发抑郁组miR-137水平明显降低(均P<0.05);与未并发抑郁组相比,并发抑郁组miR-137水平明显降低(P<0.05);并发抑郁组、抑郁症组miR-137水平差异无统计学意义(P>0.05)。结论 缺血性脑卒中会引起miR-137表达水平的下降,并且miR-137表达水平的下降参与缺血性卒中后抑郁的形成。miR-137可以作为缺血性卒中后抑郁的预测、诊断及治疗指标。
脑卒中;卒中后抑郁;miR-137
卒中后抑郁(PSD)是脑卒中后最常见的心理行为障碍并发症,主要表现为认知功能障碍、情绪低落或兴趣的缺失[1],对脑卒中患者神经功能的康复具有明显的负面影响。脑卒中后1个月内其发病率为17%~52%[2],而作为占全部脑卒中约60%~80%的缺血性脑卒中,其PSD的发病率更高。原发性抑郁症的治疗主要包括单胺氧化酶抑制剂、三环类抗抑郁药、选择性5-羟色胺再摄入抑制剂、选择性去甲肾上腺素再摄取抑制剂。而单胺氧化酶抑制剂、三环类抗抑郁药由于其毒副作用大、不良反应多,治疗剂量与中毒剂量相近,目前已较少使用。选择性5-羟色胺再摄入抑制剂、选择性去甲肾上腺素再摄取抑制剂的可选择性也较少。因此针对PSD发病机制的新型抗抑郁药的出现就显得尤为迫切。microRNA(miR)是一类长约19~22个核苷酸的单链小分子非编码RNA,通过在转录后水平调控基因的表达来参与细胞的生长、发育、分化。近年来大量研究[3-5]表明miRs在神经元的生成、突触可塑性及脑源性神经营养因子生成等方面均扮演者重要角色,并参与抑郁症的形成。PSD作为一种特殊类型的抑郁症,其发病是否也与miRs相关呢?查阅相关文献[6-12],发现BLC2、SLC6、CREB1、Grin2A基因参与PSD形成,进一步通过miRBASE、miRDB、TARGETSCAN-VERT等软件进行靶基因预测发现上述基因均是miR-137潜在靶基因,受miR-137的调控。因此本研究选择miR-137作为缺血性PSD的临床研究方向以探讨缺血性PSD患者miR-137的变化,为进一步研究miR-137在缺血性PSD中的作用提供基础理论,并发现新的缺血性PSD的预测、诊断及治疗指标。
1 对象与方法
1.1 对象 以2016年1月~2016年6月新乡医学院第一附属医院确诊的首次急性缺血性脑卒中住院患者为研究对象,于确诊14 d后根据汉密尔顿抑郁量表(HAMD-24项)评分标准将其分为并发抑郁组(≥ 20 分)和未并发抑郁组(<8分)。选取同期新乡医学院第二附属医院确诊的抑郁症住院患者(既往无脑梗死病史)20例为抑郁症组及新乡医学院第一附属医院健康体检者(既往无脑梗死、抑郁症病史)为正常对照组。各组具体情况:(1)并发抑郁组:37例,男24例,女13例;年龄35~75岁,平均60.58岁。(2)未并发抑郁组:37例,男24例,女13例;年龄45~76岁,平均60.44岁。(3)抑郁症组:20例,男13例,女7例;年龄41~75岁,平均60.50岁。(4)正常对照组:20名,男13名,女7名;年龄37~78岁,平均62.79岁。并发抑郁组及未并发抑郁组纳入标准:(1)首次急性缺血性脑卒中的诊断均符合中国急性缺血性脑卒中诊治指南 2014 诊断标准[13],并经头颅 MRI-DWI 检查证实,且NIHSS评分<16分;(2)抑郁症的诊断均符合精神障碍诊断及统计手册第五版(DSM-5)的规定[14],且HAMD 评分≥ 20 分。排除标准:(1)NIHSS评分>16分,即神经系统功能严重缺损导致意识障碍、听力障碍、失语等无法配合检查者;(2)合并对机体精神状态可能产生消极影响的癫痫、Alzheimer’s病、自身免疫性疾病、肿瘤、甲状腺功能减退等疾病者;(3)既往有脑卒中病史者;(4)伴有严重的心、肺、肝、肾功能不全者;(5)伴有原发性抑郁症的缺血性脑卒中患者;(6)既往有脑梗死病史的抑郁症患者;(7)不愿意配合调查者。本研究经医院伦理委员会批准通过,并获得研究对象及其家属的知情同意。
1.2 方法
1.2.1 筛选入组 (1)缺血性脑卒中患者影像学证据收集:所有首发急性缺血性脑卒中患者均行头颅MRI-DWI检查,并记录病变部位。(2)神经系统功能缺损及抑郁状态评估:采用NIHSS量表对所有缺血性脑卒中患者进行神经系统功能缺损评估,<16分者入组;采用中国精神疾病诊断标准第三版(CCMD-3)规定及HAMD-24项评分标准对抑郁状态进行评估,HAMD 评分≥20 分入组。上述评估均由2名或2名以上医师完成,结果取均数。(3)基本资料登记:入院 24 h 内记录所有入组患者基本情况,包括性别、年龄、脑卒中严重程度及高血压病、糖尿病等。
1.2.2 miR-137定量检测 (1)样本外周血采集:缺血性脑卒中患者于确诊14 d后采取清晨空腹8 h以上外周血2 ml,健康对照组采取清晨空腹外周血2 ml,抑郁症组于抗抑郁治疗之前抽取清晨空腹外周血2 ml, EDTA-K2抗凝管4℃保存。(2)总RNA提取:4℃保存的外周血于抽取后6 h内应用RNAiso Blood提取总RNA,并依次应用超微量分光光度计及琼脂糖凝胶电泳检测RNA纯度与完整性,提取的RNA纯度与完整性合格后,于离心管中-80℃保存以进行下一步实验。(3)逆转录成cDNA:采用Prime Script TMRT reagent Kit with gDNA Eraser进行基因组DNA消化及逆转录反应。(4)实时荧光定量PCR (qRT-PCR)反应:应用SYBR® Premix Ex TaqTM(Tli RNaseH Plus)和qRT-PCR仪进行miR-137的定量检测:以U6作为内参,最终配制成25 μg反应体系。反应条件:预变性:1个循环、95℃30 s;PCR反应:40个循环、95℃30 s、60℃34 s。反应结束后得到循环阈值Ct,计算表达量。每个样本做3个复孔实验,取平均值。ΔCt=CtmiR-137-CtU6,ΔΔCt=(实验组ΔCt)-(对照组ΔCt),2-ΔΔCt为miR-137的相对表达量。
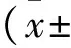
2 结 果
2.1 四组样本临床基本资料比较 见表1。四组样本的性别、年龄、合并高血压病、合并糖尿病、合并心脏病、NIHSS评分差异无统计学意义(均P>0.05);并发抑郁组与未并发抑郁组相比其左侧脑梗死例数明显增高(P<0.05)。
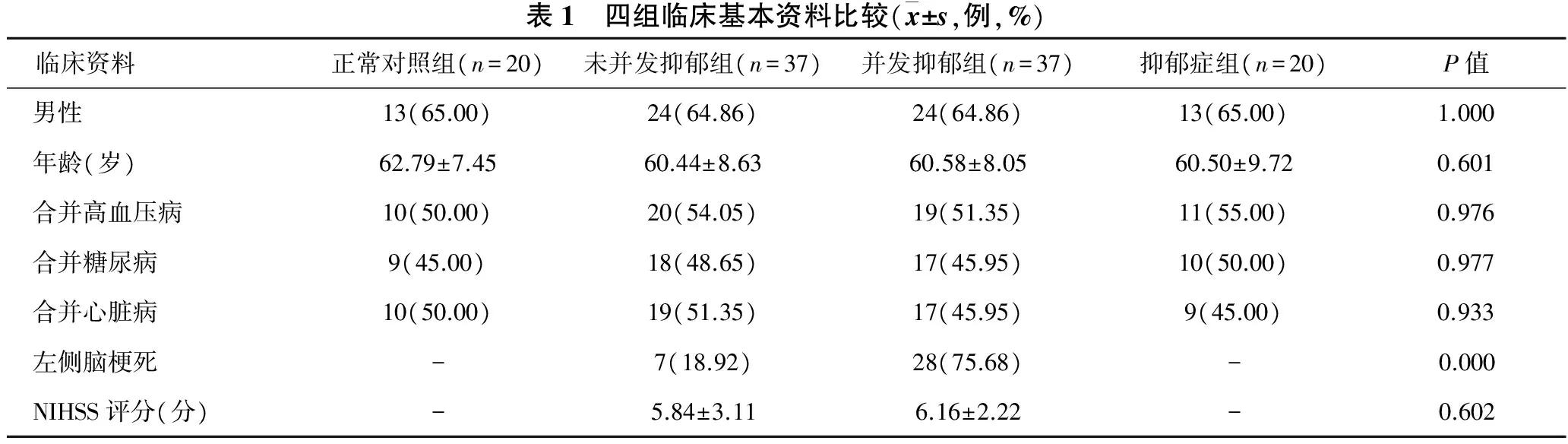
表1 四组临床基本资料比较(x±s,例,%)临床资料正常对照组(n=20)未并发抑郁组(n=37)并发抑郁组(n=37)抑郁症组(n=20)P值男性13(65.00)24(64.86)24(64.86)13(65.00)1.000年龄(岁)62.79±7.4560.44±8.6360.58±8.0560.50±9.720.601合并高血压病10(50.00)20(54.05)19(51.35)11(55.00)0.976合并糖尿病9(45.00)18(48.65)17(45.95)10(50.00)0.977合并心脏病10(50.00)19(51.35)17(45.95)9(45.00)0.933左侧脑梗死-7(18.92)28(75.68)-0.000NIHSS评分(分)-5.84±3.116.16±2.22-0.602
2.2 总RNA检测结果 见图1。应用超微量分光光度计检测各样本的总RNA纯度,OD 260/280在1.7~2.1之间,说明总RNA提取纯度好,无蛋白等其他成分污染,无降解。提取的总RNA进行琼脂糖凝胶电泳,凝胶扫描成像可见28S,18S及5.8S三条带完整清晰,无扩散现象,28S条带亮度约为18S条带2倍,样本总RNA提取合格,且5.8S条带清晰可见(根据miR bp值,miR电泳位置位于5.8S),故可继续下一步实验。
2.3 扩增曲线及熔解曲线的结果 扩增曲线Ct值均<35,说明实验数据均可靠。熔解曲线结果均为单峰曲线,说明该反应特异性良好,无引物二聚体等其它非目的性产物。
2.4 qRT-PCR相对定量检测miR-137结果 (1)miR-137的相对表达量即2-ΔΔCt值在并发抑郁组(0.003±0.000)、未并发抑郁组(0.025±0.015)较正常对照组明显降低(均P<0.05);(2)2-ΔΔCt值在并发抑郁组(0.016±0.014)较未并发抑郁组明显降低(P<0.05);(3)2-ΔΔCt值在并发抑郁组(1.272±0.517)较抑郁症组差异无统计学意义(P>0.05)。
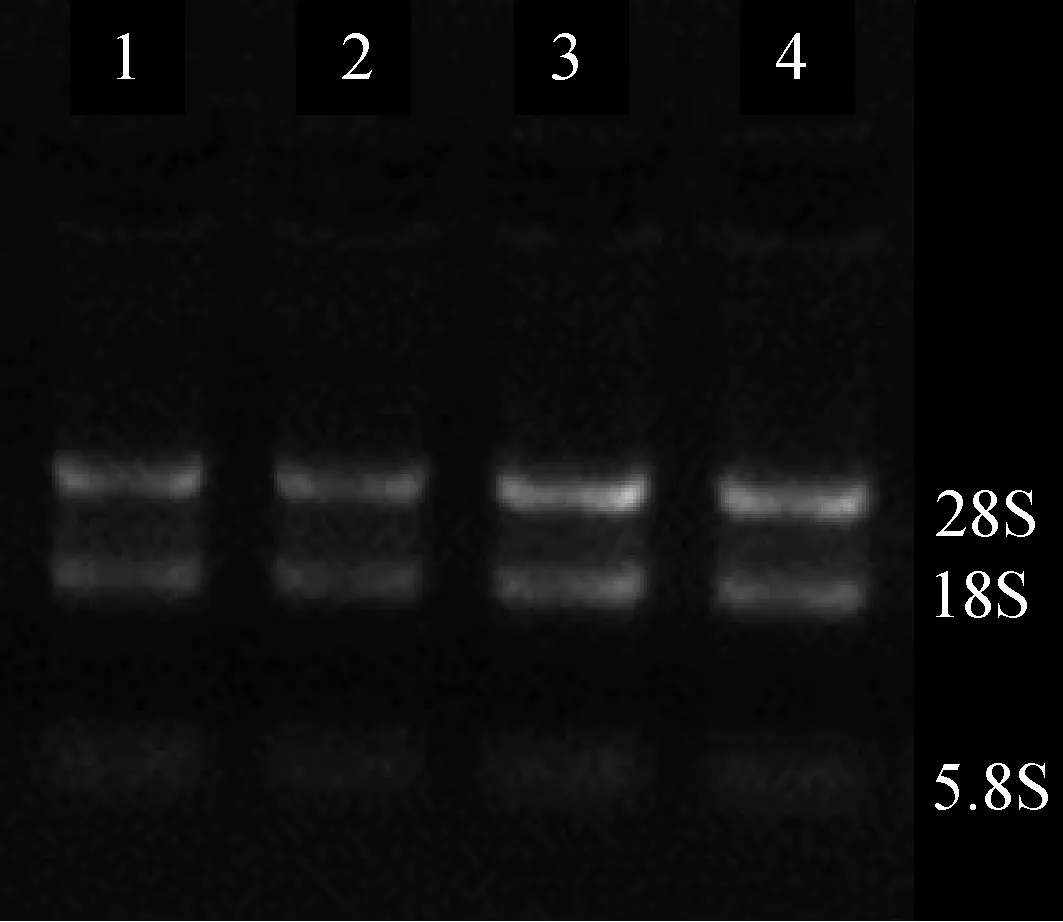
图1 四组外周血样本总RNA琼脂糖凝胶电泳图结果 注: 1、2、3、4 分别为正常对照组、抑郁症组、并发抑郁组、未并发抑郁组
3 讨 论
脑卒中是一种严重威胁人类健康的难以治愈疾病,它具有很高的发病率、致残率及死亡率。近几年的研究[15]表明脑卒中的发病率以每年9%的速率进行增长,并且已经成为中国人的主要死亡原因之一。PSD是脑卒中后最常见的一种精神行为并发症,与脑卒中患者的神经功能、社会功能的恢复密切相关。急性脑卒中患者至少有1/3最终会发展为抑郁,而抑郁会增加脑卒中的发病率、致残率、死亡率[16]。
有研究[17]表明抑郁的病理机制可能为神经再生减少及大脑突触可塑性失调,而脑卒中等急性应激可导致部分神经营养信号通路减弱,海马及前额叶皮质神经元再生、突触可塑性受损等,从而通过边缘系统导致抑郁的产生,说明脑卒与抑郁具有相关性。另外miRs在神经元的生成、突触可塑性及脑源性神经营养因子生成等方面均扮演者重要角色[5],由此推测脑卒中可能会通过影响miRs来调节抑郁的产生。检索大量文献后发现,关于miRs与PSD的研究较少,且研究内容仅局限在某一miR的一个方面。本实验通过靶基因预测发现,miR-137调控BLC2、SLC6、CREB1、Grin2A等多种PSD相关基因,能从上述多种机制参与PSD形成,且目前尚无相关临床研究。因此认为,miR-137可能在PSD形成中发挥重要作用,有望成为新的药物治疗靶点,具有重要研究价值。
本实验通过对各组临床基本资料如:年龄、性别、合并常见慢性疾病、神经功能缺损情况等进行统计学分析,发现上述各指标在各组间不具有统计学差异,即确保了混杂因素在各组间无差异性,保证了缺血性脑卒中为唯一变量,进而使miR-137的表达不受缺血性脑卒中以外的其他因素影响,使研究结果更加可信。另外,通过对比并发抑郁组及未并发抑郁组,本研究发现左侧大脑半球梗死(特别是基底节区及额叶梗死)更容易引起抑郁状态的产生,这可能与大脑半球不同部位的不同功能有关。对比各组间miR-137表达量发现,缺血性脑卒中会引起外周血miR-137水平下调,并发抑郁组miR-137水平下调更明显,甚至已经超过单纯抑郁症组。综上所述,缺血性脑卒中会引起miR-137表达水平的下降,并且miR-137表达水平的下降参与缺血性PSD的形成。miR-137可以作为缺血性PSD的预测、诊断及治疗指标。但本实验尚存在一定的不足之处:(1)由于脑卒中患者住院疗程的限制,本实验纳入样本量不够大;(2)miR-137调控基因的最终作用机制,即分子、蛋白水平的调控,尚需进一步的临床实验进行研究。
[1]Robinson RG,Jorge RE.Post-stroke depression:a review[J].Am J Psychiatry,2016, 173:221.
[2]Robinson RG,Spalletta G.Poststroke depression:a review[J].Can J Psychiatry,2010,55:341.
[3] Smalheiser NR , Lugli G, Rizavi HS, et al.MicroRNA expression is down-regulated and reorganized in prefrontal cortex of depressed suicide subjects[J].PLoS One,2012,7:e33201.
[4]Kos A,Aschrafi A,Nadif-Kasri N.The multifarious hippocampal functions of microRNA-137[J].Neuroscientist, 2016,22:440.
[5]Yan H,Fang M,Liu XY.Role of microRNAs in stroke and poststroke depression[J].Scientific World J,2013, 2013:459692.
[6]Mellios N,Huang HS,Grigorenko A,et al.A set of differentially expressed miRNAs,including miR-30a-5p,act as post-transcriptional inhibitors of BDNF in prefrontal cortex[J].Hum Mol Genet,2008,17:3030.
[7]Noonan K, Carey LM,Crewther SG. Meta-analyses indicate associations between neuroendocrine activation, deactivation in neurotrophic and neuroimaging markers in depression after stroke[J].J Stroke Cerebrovasc Dis,2013,22:e124.
[8]Wayman GA,Davare M,Ando H,et al.Anactivity-regulated microRNA controls dendritic plasticity bydown-regulating p250GAP[J].Proc Natl Acad Sci USA,2008,105:9093.
[9]Alboni S,Tascedda F,Corsini D,et al.Stress induces altered CRE/CREB pathwayactivity and BDNF expression in the hippocampus of glucocorticoid receptor-impaired mice[J].Neurophamacology,2011,60:1337.
[10]樊蔚虹,姚建平,赵文景.柴胡疏肝散对卒中后抑郁大鼠海马组织Bcl-2Bax蛋白表达的影响[J].中国实验方剂学杂志,2011,17:128.
[11]姚珊,沈霞,岳炫烨.SLC6A4基因rs2020939多态性与卒中后抑郁相关性的研究[J].徐州医学院学报,2014,34:689.
[12]Meng X,Yu Y,Kou C,et al.No genetic association between single-nucleotide polymorphisms in the coding region of the SLC6A4 gene and internalizing disorders in mainland Chinese university students[J].Psychiatr Genet,2013,23:36. .
[13]中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48:246.
[14]美国精神医学学会,张道龙(译).精神障碍诊断与统计手册[M].第5版.北京大学出版社,2015:79.
[15]Tsai CF, Thomas B, Sudlow CL. Epidemiology of stroke and its subtypes in Chinese vs white populations: a systematic review[J]. Neurology, 2013,81:264.
[16]Linden M, Baumann K, Rotter M,et al.Posttraumatic embitterment disorder in comparison to other mental disorders[J]. Psychother Psychosom,2008,77:50.
[17]Verhagen M,vander Meij A,van Deurzen PA.Meta-analysis of the BDNF Val66Met polymorphism in major depressive disorder:effects of gender and ethnicity[J].Mol Psychiatry,2010,15:260.
Expression and its clinical significance of miR-137 in peripheral blood of patients with depression after ischemic stroke
LUYu,TIANXiao-jun,SHILi-jin,etal.
DepartmentofNeurology,theFirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China
Objective To explore the changes of miR-137 of patients with depression after ischemic stroke and its clinical significance. Methods All the patients were separately divided into four groups according to the following rating scales: 2014 diagnostic criteria for acute cerebral infarction, Hamilton depression scale(HAMD-24), Diagnostic and statistical manual of mental disorders, the fifth edition (DSM-5)were applied to categorizing. According to the above grouping standards,all the patients were grouped as normal control group (n=20),the depression group (n=20), post-stroke depression group (n=37),no depression after stroke group (n=37). The expression level of microRNA(miR)-137 in each group was detected by quantitative real-time PCR(qRT-PCR),and the results were compared. Results The difference of gender,age,chronic dieases,the site of infarction,NIHSS score had no statistical significance in the four group (allP>0.05). Compared with no depression after stroke group, the number of patients with left cerebral infarction was significantly increased in post-stroke depression group(P<0.05). Compared with the normal control group,miR-137 in no depression after stroke group and in post-stroke depression group significantly decreased(allP<0.05); compared with no depression after stroke group, miR-137 in post-stroke depression group significantly decreased(P<0.05); the level of miR-137 between post-stroke depression group and depression group showed no statistical significance (P>0.05).Conclusions Ischemic stroke can induce the low expression of miR-137 which participates in the formation of post-stroke depression.miR-137 may act as a predictive,diagnostic,therapeutic index of poststroke depression.
stroke;post-stroke depression;miR-137
453100新乡医学院第一附属医院神经内科
王玉梅
R746.13
A
1004-1648(2017)03-0217-04
2016-07-26
2016-08-29)
