生物净化低温高铁锰氨氮地下水氨氮去除机制
2017-08-07曹瑞华王艳菊曾辉平北京工业大学水质科学与水环境恢复工程北京市重点实验室北京004哈尔滨工业大学城市水资源与水环境国家重点实验室黑龙江哈尔滨50090
李 冬,曹瑞华,杨 航,王艳菊,曾辉平,张 杰,(.北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 004;.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090)
生物净化低温高铁锰氨氮地下水氨氮去除机制
李 冬1*,曹瑞华1,杨 航2,王艳菊1,曾辉平1,张 杰1,2(1.北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
在某水厂,对“两级曝气+两级过滤”生物净化工艺净化低温高铁锰氨氮(5~7.8℃, Fe2+>8.0mg/L, Mn2+>3.0mg/L, NH4+-N>3.0mg/L)地下水过程中,氨氮去除机制进行了试验研究.试验表明:一级和二级滤柱分别存在45.22%和35.97%的氮素损失(TNloss),DO实际耗值分别比理论值少24.67%和22.27%.利用DO计量关系证明TNloss过程是耗氧过程,TNloss与TNloss的DO耗值线性相关性较好,R2>0.970.分析表明:TNloss产生于自养脱氮过程,与吸附、生物同化、异养反硝化和锰氧化耦合反硝化机制无关.利用氮素守恒和DO计量关系定量计算,一级和二级滤柱分别有51.40%、40.93%的氨氮由自养脱氮过程去除.生物硝化耦合自养脱氮是氨氮去除的主要途径,且进水氨氮浓度越高,自养脱氮比例越高.
低温;高铁锰;氨氮;地下水;厌氧氨氧化;自养脱氮
《2015年中国环境状况公报》[1]报告指出,全国地级以上城市集中式饮用水(地下水)水源地13.4%水质不达标,主要污染物为铁、锰和“三氮”(亚硝酸盐氮、硝酸盐氮和氨氮).近年来,除铁除锰地下水厂水源受氨氮污染日益严重,例如,本文试验所在的某水厂原水氨氮从 2009~2016年增加了近 0.7mg/L.铁锰氨生物净化滤池是铁锰氧化菌(MnOB)与硝化菌(AOB和 NOB)的共生系统,铁锰氨在生物滤池内可通过生物作用净化去除[2-3].但是,当原水中同时存在高浓度铁锰氨时,铁优先被去除,氨氮次之,锰最后才能被去除[4].目前研究认为,在中性环境条件下,饮用水中铁主要通过化学氧化去除,锰主要通过MnOB氧化去除[2-3,5-6],氨氮则主要通过硝化途径去除[7-9].最近有研究报道[10-12]采用生物滤池处理受氨氮污染的常温地表饮用水时,氮素存在亏损,氨氮去除存在自养脱氮过程.Cai在利用单级生物滤池净化铁锰氨污染的地下水时[13],及利用“两级曝气+两级过滤”工艺净化低温高铁锰氨氮地下水时均发现出水存在氮素亏损、DO消耗异常.如果受氨氮污染的低温高铁锰地下水净化过程中有一部分氨氮可以通过非硝化途径去除,不仅可以减少氨氮硝化的DO耗值,降低硝氮产生,还可为MnOB提供更多DO,提高Mn2+去除率.为此,本文对“两级曝气+两级过滤”除铁除锰生物净化工艺中的氨氮转化去除机制进行了分析,以期更好地为铁锰氨复合污染的低温地下水净化提供依据.
1 材料方法
1.1 试验装置
在某地下水厂净化间搭建“两级曝气+两级过滤”中试试验装置,开展两级生物净化工艺中氨氮转化去除机制分析.试验装置如图1所示.两根生物滤柱反应器均由有机玻璃制成,内径均为150mm,高 3000mm.滤料均采用水厂滤池的无烟煤滤料,级配1.0~1.2mm,滤层厚度一级1400mm,二级 1400mm.承托层均采用鹅卵石,级配1.2~20mm,厚度400mm.

图1 反应器装置Fig.1 Experimental equipment of the reactor
1.2 试验水质
试验采用某地下水厂曝气后原水,并通过蠕动泵人为配加硫酸锰(MnSO4⋅H2O)和硫酸铵[(NH4)2SO4],模拟高铁锰氨氮复合污染的低温地下水.水厂曝气后原水及试验配水主要水质指标如表1所示.

表1 试验水质情况Table 1 Characteristics of the water for experiment
1.3 检测方法
滤柱运行期间,反冲洗周期为 24h,反冲洗历时4min,反冲洗强度10L/(m2⋅s),反冲洗4h后,当滤柱对铁锰氨氮的净化能力恢复至反冲洗前水平,生物滤层达到稳定时取样检测,检测项目及方法如下:Fe2+(二氮杂菲分光光度法),Mn2+(过硫酸铵分光光度法),NH4+-N(纳氏试剂比色法),总Fe(二氮杂菲分光光度法),NO2--N(N-(1-萘基)-乙二胺光度法),(紫外分光光度法),化学需氧量(CODMn)(高锰酸盐指数(酸法)),DO、p H、T(便携式测定仪)(Qxi 315i-WTW).
1.4 分析及计算方法
试验在低浓度铁锰和氨氮、低滤速条件下连续进水启动,视出水情况改变进水锰和氨氮浓度.试验期间,根据滤柱成熟情况梯级提速.除铁除锰生物滤柱进入高浓度铁锰和氨氮(Fe2+>8.0mg/L,Mn2+>3.0mg/L, NH4+-N>3.0mg/L)培养期后,对进出水铁锰、“三氮”、DO进行检测,根据DO计量关系和氮素守恒对氨氮的转化去除机制进行分析.
1.4.1 氮素守恒计算式

式中: Δ(NO3--N)Th为硝氮理论生成量; Δ(NO3--N)Ac为硝氮实际生成量; Δ(NO3--N)dif为硝氮实际生成量与理论生成量的差值; Δ(NO2--N)C为亚氮减少量; Δ(NO2--N)Pr为亚氮生成量; Δ(NH4+-N)为氨氮减少量; TNloss为进出水氮素损失量; TNin为进水氮素总量; TNout为出水氮素总量,以上各参数单位均为mg/L; NLR为氮素损失率,%.
1.4.2 DO守恒计算式
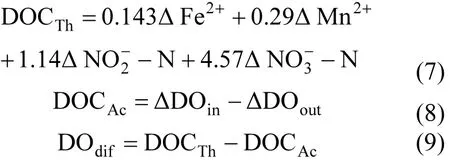
式中: DOCTh为理论需氧量; DOCAc为实际耗氧量; ΔDOin为进水溶解氧量; ΔDOout为出水溶解氧量,各参数的单位均为mg/L.
2 结果与讨论
2.1 高铁锰氨氮净化工艺中的TNloss和DOC分析高铁(Fe2+>8.0mg/L)高锰(Mn2+>3.0mg/L)、高氨氮(NH4+-N>3.0mg/L)地下水“两级曝气+两级过滤”生物净化工艺经过 75d(0~75d培养阶段,1d为1个周期)自然挂膜,启动成功,出水铁锰及氨氮被去除至痕量,出水满足国家饮用水卫生标准.此后,又经过58d(76~133d培养阶段)的滤速提升驯化培养,成功实现低温高铁锰氨氮地下水高速净化去除,如图2~4所示.

图2 生物滤柱运行过程中进出水亚铁浓度变化Fig.2 Variation of Fe2+concentration during the period of operation of the biological filter
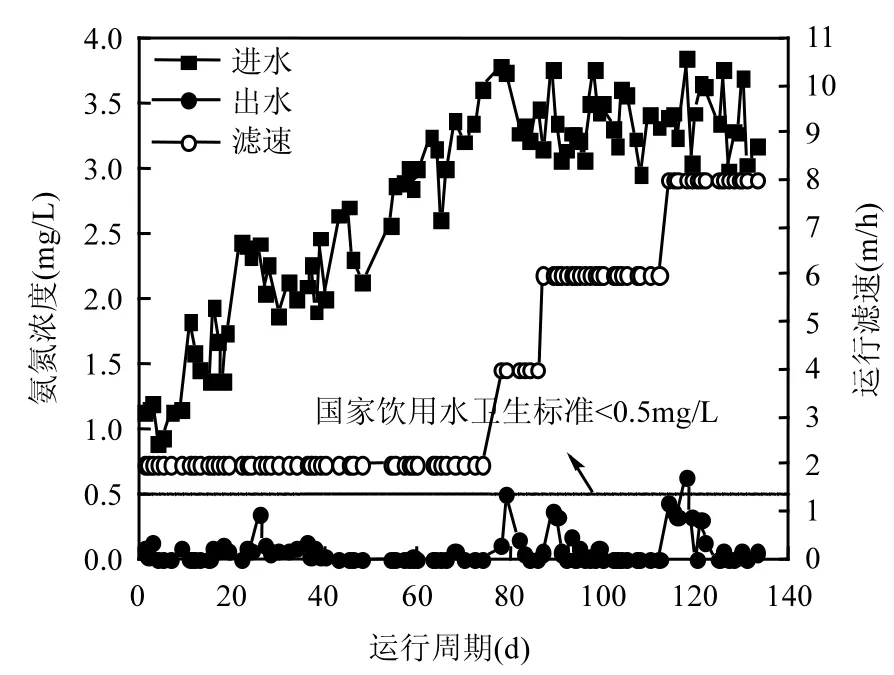
图3 生物滤柱运行过程中进出水氨氮浓度变化Fig.3 Variation of NH4+-N concentration during the period of operation of the biological filter

图4 生物滤柱运行过程中进出水锰浓度变化Fig.4 Variation of Mn2+concentration during the period of operation of the biological filter
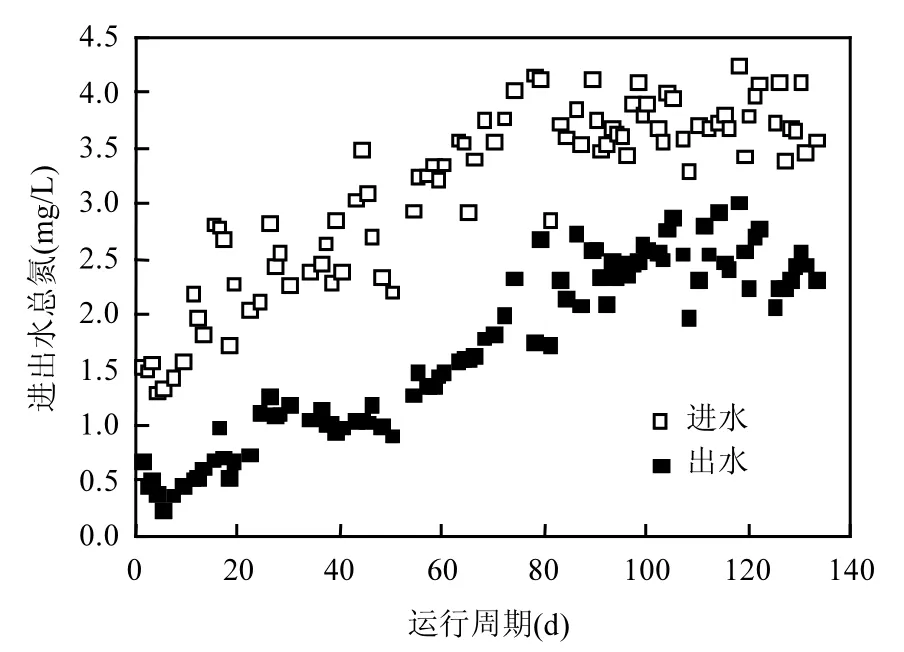
图5 生物滤柱运行过程中进出水总氮变化Fig.5 Variation of TN concentration during the period of operation of the biological filter
滤柱启动过程中,进出水总氮见图 5,出水总氮明显低于进水总氮,氮素在整个培养周期内均存在损失.取高浓度铁锰氨氮培养阶段(76~133d培养阶段)的水质(表 2),对除铁除锰生物滤池中的氨氮去除转化机制进行分析.该阶段各级滤柱进出水“三氮”见表3、4,由表3和表4知,两级生物净化工艺净化高浓度铁锰氨氮时,进出水氮素不守恒.当生物滤柱培养成熟(87~133d)后,一级滤柱NLR平均为45.22%,二级滤柱NLR平均为35.97%.
由于原水pH值属于中性偏弱酸性,Fe2+只能通过以化学氧化为主的作用去除[14-17],Mn2+只能通过生物氧化作用去除[15],因此,Fe2+和Mn2+的氧化过程DOC是定值,单位质量 (以mg/L计) 的Fe2+和Mn2+氧化DOC分别为0.143和0.29mg/L.如果硝化是氨氮转化去除的唯一途径,则单位质量 (以mg/L计)氨氮硝化DOC应该为4.57mg/L.滤柱培养过程中,DOCAc与 DOCTh如图 6所示,在整个运行阶段,DOCAc<DOCTh.当滤柱运行稳定后,一级滤柱中,DOCAc比DOCTh低24.67%,二级滤柱DOCAc比DOCTh低22.27%.如果氨氮全部是由硝化机制转化去除,则进出水氮素应该守恒,DOCAc应该与 DOCTh一致[10-13],由以上分析可见,除铁除锰生物滤池中,硝化并非是氨氮去除的唯一途径.

表2 高铁锰氨氮运行阶段试验水质Table 2 Experimental water quality during the operation of high Fe2+, Mn2+and NH4+-N

表3 一级滤柱氮素守恒分析Table 3 The conservation analysis of nitrogen in the primary filter column
根据 DO计量关系和氮素守恒规律,据式(1)、(2)、(5)、(7)计算发现,滤柱培养成熟后,除去氨氮硝化、铁锰氧化和 CODMn耗氧量外,各级滤柱仍有一部分 DO被消耗,如图 7所示,对TNloss和TNloss过程中的DOCAc进行线性拟合见图8和图9.由图知,一级滤柱和二级滤柱TNloss和TNloss的DOCAc线性拟合关系较好,R2值分别可达 0.970和 0.976,说明当滤柱培养成熟后,氮素损失的过程是一个耗氧的过程,一级滤柱和二级滤柱单位氮素损失(mg/L)平均DOCAc分别为1.921和1.986mg/L,低于氨氮硝化DOCTh的4.57mg/L.

表4 二级滤柱氮素守恒分析Table 4 Analysis of the nitrogen balance in the secondary filter column

图6 DO实际耗值与理论耗值Fig.6 Actual consumption and theoretical consumption of DO

图7 氨氮非硝化途径去除耗氧情况Fig.7 DOC during the remove of NH4+-N by non-nitrification
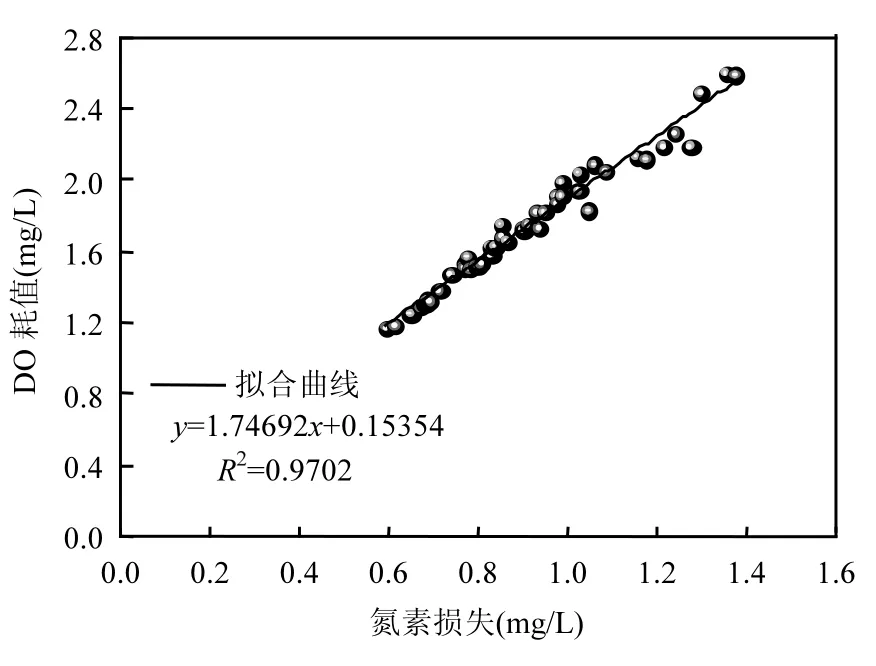
图8 一级滤柱氮素损失与DO耗值拟合关系Fig.8 Linear fitting relationship between TNlossand DOC in the primary filter

图9 二级滤柱氮素损失与DO耗值拟合关系Fig.9 Linear fitting relationship between TNlossand DOC in the secondary filter
2.3 氮素损失机制分析
2.3.1 吸附机制 在高浓度铁锰氨氮地下水处理中,水体中铁氧化物会吸附水分子,在其表面形成α-FeOOH等羟基官能团[13],该官能团可以作为某些阴离子和阳离子的吸附剂[18],吸附磷酸盐[19]、氨氮[20]、六价铬[21]等,因此,生物滤池中TNloss有可能是氨氮被羟基氧化铁吸附造成的.但是,由于除铁除锰生物滤池是MnOB与AOB、NOB等菌种的共生系统,如果TNloss确实是由于氨氮被吸附造成的,那么由于氨氮依旧停留在滤柱中,其最终还是会被生物滤柱中的硝化菌通过硝化反应转化成硝态氮,并不会造成 TNloss,氨氮硝化过程中的 DOCAc也应该与 DOCTh相同[10].即使滤料未培养成熟阶段,如果除铁除锰滤池滤料表面具有吸附氨氮的活性滤膜,且假设氨氮被其吸附造成 TNloss,那么,吸附掉的氨氮最终还是要通过催化氧化才能去除,终极产物也是硝氮,不会造成 TNloss,而且接触氧化途径去除的氨氮DOC与硝化反应DOC相当[22].这显然与图5和图6反映的事实相悖.另外,二级滤柱进水并不含有铁,但是滤柱中依旧存在 TNloss.综上可知,高铁锰氨氮生物净化工艺中的 TNloss并非是由于吸附作用造成的.
分析图 6,滤柱启动之初,由于新滤料物理吸附作用存在,导致一级滤柱 DOdif较大,随着生物滤柱培养成熟,滤料吸附饱和,生物作用成为铁锰氨去除的主要途径,DOdif逐渐减小并趋于稳定,由此进一步证明,滤柱培养成熟后,DOC异常是生物作用的结果,与吸附机制无关.滤柱启动之初,进入二级滤柱的氨氮浓度极低,DOdif几乎为零,随着后期二级进水氨氮浓度增加,二级滤柱的DOdif开始增大,并随着滤柱培养成熟而趋于稳定,这进一步说明,DOC异常与生物去除氨氮的过程有关.滤柱培养成熟后,一级滤柱的 DOdif大于二级滤柱的DOdif,说明氨氮浓度越高,DOdif越大.结合表3和表4知,进水氨氮浓度越大,TNloss也越大,说明氮素亏损与生物去除氨氮的过程有关,与物理吸附作用无关.
2.3.2 锰氧化耦合反硝化 Mn2+的氧化过程伴随着电子的释放,因此Mn2+可以作为生物反硝化的电子供体,还原等硝酸盐并造成 TNloss[23],其反应过程如式(10)所示.如果TNloss是锰氧化耦合反硝化作用造成的,并且假设进水中所有Mn2+参与锰氧化耦合反硝化过程,则单位质量浓度(mg/L)的 Mn2+导致的 TNloss为0.112mg/L,Mn2+的去除量与TNloss应该存在拟合度较高的曲线.对Mn2+的去除量与TNloss进行线性拟合,见图 10,两者的相关关系较差,一级滤柱R2=0.441、二级滤柱R2=0.628,且斜率与理论值相对偏差(一级滤柱 400%,二级滤柱 26%)都较大,由此证明除铁除锰生物滤池TNloss和DOC异常另有原因.

2.3.3 异养反硝化 在缺氧环境或者宏观好氧但是微环境是缺氧的条件下,反硝化菌可以利用有机物作为电子供体,还原水体中的 NO2--N、NO3--N等硝酸盐并造成TNloss.如果TNloss是由于异养菌的反硝化作用造成,则有机物的消耗量必定会随着 TNloss的增加而增加.高锰酸盐指数(CODMn)可以用来表征水体中可降解有机物的污染程度.试验期间原水的 CODMn<2.8mg/L,不足以为反硝化菌提供足量的电子供体而发生反硝化脱氮过程[15,24],此外,试验期间对进出水CODMn抽检表明,CODMn去除量约为进水的18%左右,并不随 TNloss的变化而波动变化,说明TNloss也并非是异养菌的反硝化作用造成的.
2.3.4 同化机制 微生物可以利用“三氮”作为自身代谢所需的营养物质,较之亚氮和硝氮,微生物更偏向于利用氨氮作为其自身代谢所需的氮素[10],因此 TNloss可能来源于生物同化.生物滤柱启动过程中,滤柱中的生物总量是逐渐增加的,如果TNloss是源自于生物同化,则TNloss应该随着启动周期的延长而增加.当滤柱启动成功后,生物总量处于动态平衡,此时 TNloss应该是一个定值.但是,滤柱启动过程中 TNloss并没有随着 MnOB、AOB和NOB等菌种的增加而增加,反而在一级滤柱中有下降的趋势,如图 11所示,生物同化机制不能解释TNloss的原因.并且,滤柱成熟后,二级滤柱 TNloss呈现上升趋势,见图 11,TNloss并非是一个定值,这也进一步说明同化作用机制不能解释TNloss损失的原因.
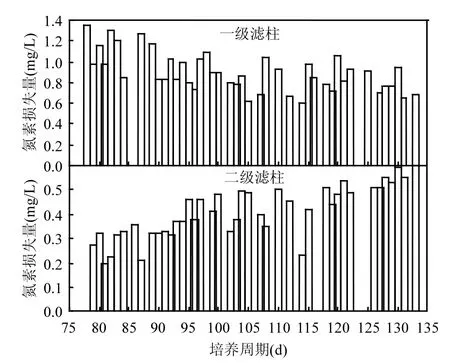
图11 滤柱运行过程中氮素损失量变化情况Fig.11 Variation of TNlossconcentration during the period of operation of the biological filter
2.3.5 自养脱氮(厌氧氨氧化)机制 在氨氮转化去除过程中,笔者发现有微量的亚氮积累,尤其在各个阶段滤速提升之初,如图12所示.滤柱沿程“三氮”检测表明,在亚氮积累最大的区间段,TNloss也最大,见图 13.根据前文论述分析,有以下结论:(1)氨氮在除铁除锰生物滤柱内转化去除的过程伴随有 TNloss,氨氮转化去除有硝化之外的途径;(2)氨氮的非硝化转化去除途径是耗氧过程,单位氮素损失 DOC 平均为1.921mg/L(一级滤柱)和 1.986mg/L(二级滤柱),低于氨氮硝化4.57mg/L的DOC;(3)滤层内发生TNloss的最大区间段同时也是亚氮积累量最大的区间段;(4)锰氧化耦合自养反硝化机制、异养反硝化机制、吸附机制、同化机制不是 TNloss和 DOC异常的主要原因.根据当前生物净化技术研究成果[24-26]和以上结论特征,主导除铁除锰生物滤柱内发生TNloss和DOC异常的最有可能的途径是自养脱氮的第二步,即厌氧氨氧化(ANAMMOX)过程.

图12 生物滤柱运行过程中进出水亚氮变化Fig.12 Variation of NO2--N concentration during the period of operation of the biological filter
Pynaert等[27]、郑平等[28]利用分子生物学手段揭示了限氧件下的 TNloss机理.氨氮的去除过程主要分为以下两步:(a)在生物膜外,好氧条件下,好氧AOB菌将NH4+-N氧化成NO2--N;(b)通过扩散作用,NH4+-N和第一步生成的NO2--N传递进入到缺氧的生物膜内部,再在厌氧 AOB菌的作用下,实现NH4+-N和NO2--N的同时去除,并造成 TNloss,其过程如式(11)所示.由式(11)知, 1mg/L的氨氮通过自养脱氮过程去除,DOCTh仅为1.94mg/L,低于氨氮硝化4.57mg/L的DOC,且该过程会有一部分氨氮转化成N2逸出反应器造成 TNloss,并且在氨氮转化去除过程中会伴有的生成和去除.本试验中,氮素损失过程所总结出的规律与该过程中的特征高度一致,且该过程的DOCTh为1.94mg/L,与本试验中氮素损失过程的 DO耗值 1.921mg/L(一级滤柱)和1.986mg/L(二级滤柱)较为接近,相对偏差仅为0.98%(一级滤柱)和2.37%(二级滤柱).
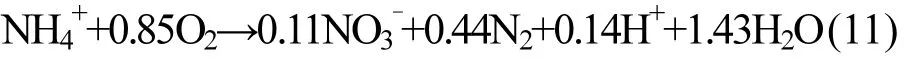
由式(11)知,如果氨氮的去除全部是由于ANAMMOX过程导致的,则ΔNH4+-N(氨氮的减少量)与ΔNO3-N(硝氮产生量)理论比值应该为8,如果全部的氨氮都是通过硝化反应转化去除,则ΔNH4+-N与ΔNO3-N 理论比值应该为 1[29]. ΔNH4+-N/ΔNO3-N比值越大,则ANAMMOX过程越强,参与自养脱氮的氨氮量越多,反之则说明NOB活性越高,参与硝化反应的氨氮越多.各个阶段的ΔNH4+-N/ΔNO3-N比值如图 14所示,由图知,随着滤柱培养成熟,一级滤柱ΔNH4+-N/ΔNO3-N 的比值逐渐趋于 2,二级滤柱ΔNH4+-N/ΔNO3-N的比值趋于 1.5,说明滤柱中氨氮的去除是介于硝化与ANAMMOX之间的过程,即是两者耦合作用的结果,且二级滤柱的自养脱氮性能稍低于一级滤柱.分析认为,一级滤柱中由于进水氨氮浓度较高,更易形成微缺氧环境,更有利于自养脱氮过程,所以氮素损失量较二级滤柱大,这与前文图7分析得出的结论一致.
根据DO计量关系和氮素计量关系,对除铁除锰生物滤柱中参与硝化反应和自养脱氮的氨氮比例进行定量计算,见表5和表6.由表5和表6知,在除铁除锰生物滤池内,氨氮浓度越高,参与自养脱氮的氨氮比例越高.滤柱运行培养成熟后,当一级滤柱进水氨氮平均浓度为3.38mg/L时,参与自养脱氮过程的氨氮比例平均为51.40%,这比Yu等[10]在生物滤池处理地表水氨氮污染(NH4+-N平均浓度为 3.76mg/L)时得出的 43.00%的比例高,比李冬等[15]在单级生物滤池处理常温低铁锰高氨氮(NH4+-N平均浓度为3.11mg/L)地下水时得出的68.10%的比例低.当二级滤柱进水氨氮浓度平均为 1.17mg/L时,参与自养脱氮的氨氮比例平均为 40.93%,这比 Cai[13]在单级生物滤池小试试验处理常温低铁锰氨氮(NH4+-N平均浓度为 1.03mg/L)时得出的 48.50%的比例低些.可见,由于水体环境不同,污染物种类不同,净化工艺和运行方式不同,氨氮转化去除的比例会有所差异.但是,以上试验分析证明,在低温高铁锰氨氮地下水两级生物净化工艺中,氨氮的去除的确是生物硝化耦合自养脱氮反应的结果,与Yu等[10]、Cai等[13]、李冬等[15]在处理氨氮污染的饮用水时得出的结论不谋而合.

图13 沿程亚氮变化情况Fig.13 Variation of NO2--N concentration in the filter layer

图14 ΔNH4+-N/ΔNO3--N比值Fig.14 Ratio of ΔNH4+-N/ΔNO3--N during the period of operation of the biological filter

表5 一级滤柱氨氮转化去除百分比Table 5 Percentage of removed NH4+-N in the primary filter column

表6 二级滤柱氨氮转化去除百分比Table 6 Percentage of removed NH4+-N in the secondary filter column
3 结论
3.1 “两级曝气+两级过滤”除铁除锰生物滤池在净化低温(5~7.8℃)高铁(Fe2+>8.0mg/L)高锰(Mn2+>3.0mg/L)高氨氮(NH4+-N>3.0mg/L)地下水时,自养脱氮是造成TNloss和DOCAc<DOCTh的原因,与吸附机制、同化机制、异养反硝化机制和锰氧化耦合反硝化机制无关,生物硝化与自养脱氮共同参与氨氮的转化去除.当生物滤池培养成熟后,一级滤池NLR为45.22%,二级滤池NLR为35.97%,一级滤池DOCAc比DOCTh少24.67%,二级滤池DOCAc比DOCTh少22.27%.
3.2 水体环境和处理工艺不同、污染物种类及浓度不同,通过硝化和自养脱氮途径转化去除氨氮的比例会有所差异.除铁除锰生物滤池培养成熟后,一级滤池中,51.40%的氨氮经由自养脱氮过程去除,二级滤池中,40.93%的氨氮经由自养脱氮过程去除.进水氨氮浓度越高,越易于形成微缺氧环境,自养脱氮过程去除氨氮的途径越明显.
[1] 2015年中国环境状况公报(摘录) [J]. 环境保护, 2016,11: 43-51.
[2] 张 杰,李 冬,杨 宏,等.生物固锰除锰机理与工程技术 [M].北京:中国建筑工业出版社, 2004.
[3] 李 冬,路 健,梁雨雯,等.低温生物除铁除锰工艺快速启动与滤速的探求 [J]. 中国环境科学, 2016,36(1):82-86.
[4] Mouchet P. From conventional to biological removal of iron and manganese in France [J]. Journal American Water Works Association, 1992,84(4):158-167.
[5] 曾辉平,李 冬,高源涛,等.高铁高锰高氨氮地下水的两级净化研究 [J]. 中国给水排水, 2010,26(11):142-144.
[6] 蔡言安,李 冬,曾辉平,等.生物滤池净化含铁锰高氨氮地下水试验研究 [J]. 中国环境科学, 2014,34(8):1993-1997.
[7] Andersson A, Laurent P, Kihn A, et al. Impact of temperature on nitrification in biological activated carbon (BAC) filters used for drinking water treatment [J]. Water Research, 2001,35(12): 2923-2934.
[8] Bouwer E J, Crowe P. Biological processes in drinking water treatment [J]. Journal American Water Works Association, 1988,80(9):82-93.
[9] 刘建广,张晓健,王占生.温度对生物炭滤池处理高氨原水硝化的影响 [J]. 中国环境科学, 2004,24(2):233-236.
[10] Yu X, Qi Z H, Zhang X J, et al. Nitrogen loss and oxygen paradox in full-scale biofiltration for drinking water treatment [J]. Water Research, 2007,41(7):1455-1464.
[11] 刘 冰,范 辉,余国忠,等.氨氮在饮用水生物滤池内的去除机制 [J]. 环境科学, 2012,33(7):2394-2401.
[12] 于 鑫,叶 林,李旭东,等.饮用水生物处理小试工艺中NH4+-N的非硝化去除途径分析 [J]. 环境科学, 2008,29(4):909-914.
[13] Cai Y A, Li D, Liang Y H, et al. Autotrophic nitrogen removal process in a potable water treatment biofilter that simultaneously removes Mn and NH4+-N [J]. Bioresource Technology, 2014,172: 226–231.
[14] 李 冬,曾辉平.高铁高锰地下水生物净化技术 [M]. 北京:中国建筑工业出版社, 2015.
[15] 李 冬,梁雨雯,杨 航,等.净化铁锰氨生物滤池内氨氮转化途径 [J]. 环境科学研究, 2016,29(2):240-245.
[16] Appelo C, Drijver B, Hekkenberg R, et al. Modeling in situ iron removal from ground water [J]. Ground Water, 1999,37(6): 811-817.
[17] 张 杰,杨 宏,李 冬.生物滤层中 Fe2+的作用及对除锰的影响 [J]. 中国给水排水, 2001,17(9):14-16.
[18] Edward H S. Surface complexation modeling of metal removal by recycled iron sorbent [J]. Journal of Environmental Engineering, 1998,124:913-920.
[19] Hesham A S, Philip R W. An XPS study of the adsorption of chromate on Goethite (ɑ-FeOOH) [J]. Applied Surface Science, 1997,108:371-377.
[20] 赵 达.载铁膜沸石制备及其控制河道污染物的试验研究 [D].哈尔滨:哈尔滨工业大学, 2015.
[21] Edwards M A, Benjamin M M. Adsorptive filtration using coated sand: a new approach for treatment of metal bearing wastes [J]. Journal Water Pollution Control Federation, 1989,61:1523-1533.
[22] 布 浩,黄廷林,郭英明,等.石英砂表面活性滤膜去除地下水中氨氮的试验研究 [J]. 中国环境科学, 2016,36(4):1045-1051.
[23] Vandenabeele J, De B D, Germonpre R, et al. Influence of nitrate on manganese removing microbial consortia from sand filters [J]. Water Research, 1995,29(2):579-587.
[24] 蔡言安.含铁锰氨氮地下水生物净化试验研究 [D]. 北京:北京工业大学, 2014.
[25] Gouzinis A, Kosmidis N, Vayenas D V, et al. Removal of Mn and simultaneous removal of NH3, Fe and Mn from potable water using a trickling filter [J]. Water Research, 1998,32(8):2442-2450.
[26] Zhang X J, Li D, Liang Y H, et al. Application of membrane bioreactor for completely autotrophic nitrogen removal over nitrite (CANON) process [J]. Chemosphere, 2013,93(11):2832-2838.
[27] Pynaert K, Smets B F, Wyffels S, et al. Characterization of an autotrophic nitrogen- removing biofilm from a highly loaded lab-scale rotating biological contactor [J]. Applied and environmental Microbiology, 2003,69(6):3626-3635.
[28] 郑 平,徐向阳,胡宝兰.新型生物脱氮理论与技术 [M]. 北京:科学出版社, 2004.
[29] 胡 石,甘一萍,张树军,等.一体化全程自养脱氮(CANON)工艺的效能及污泥特性 [J]. 中国环境科学, 2014,34(1):111-117.
Removal mechanism of ammonia nitrogen in bio-purification process for high iron and manganese removal from low temperature groundwater.
LI Dong1*, CAO Rui-hua1, YANG Hang2, WANG Yan-ju1, ZENG Hui-ping1, ZHANG Jie1,2(1.Key Laboratory of Beijing Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124, China;2.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2017,37(7):2623~2632
The removal mechanism of ammonia nitrogen (NH4+-N) was analyzed about “two-stage aeration and two-stage filtration” process that was used to remove high iron (Fe2+>8.0mg/L), manganese (Mn2+>3.0mg/L) and NH4+-N (>3.0mg/L) from low temperature (5~7.8℃) groundwater in a drinkingwater plant. The experiments showed that there was 45.22% and 35.97% nitrogen losses (TNloss) in the primary and secondary filter columns, respectively, and the actual DO consumption was 24.67% and 22.27% lower than the theoretical DO consumption. Moreover, the TNlossprocess was proved to be accompanied with DO consumption by DO measurement relationship. There was a good linear relationship between TNlossand its DO consumption, R2>0.970. The analysis demonstrated that autotrophic nitrogen removal (N-removal) was the cause of TNloss, which was independent on the adsorption, biological assimilation, heterotrophic denitrification and manganese oxidative coupling denitrification. The calculation based on quantitative relationship between nitrogen conservation and DO measurement indicated that the contribution of autotrophic N-removal to NH4+-N removal was 51.40% and 40.93% in the primary and secondary filter columns, respectively. Both the nitrification reaction and the autotrophic N-removal process were the significant removal mechanism of NH4+-N. Moreover, with the higher concentration of NH4+-N, the contribution of autotrophic N-removal was also higher.
low temperature;high iron and manganese; NH4+-N;groundwater;anammox;autotrophic N-removal
X523
A
1000-6923(2017)07-2623-10
李 冬(1976-),女,辽宁丹东人,教授,博士,主要研究方向为水质科学与水环境恢复关键技术.发表论文160余篇.
2016-11-24
国家自然科学基金优秀青年科学基金资助项目(51222807)
* 责任作者, 教授, lidong2006@bjut.edu.cn
