金属氧化物纳米颗粒对磷的吸附及回收潜力
2017-08-07李满林WangJim张增强李荣华西北农林科技大学资源环境学院陕西杨凌700西北农林科技大学理学院陕西杨凌700SchoolofPlantEnvironmentalandSoilSciencesLouisianaStateUniversityAgriculturalCenterBatonRougeLA7080USA农业部西北植物营养与农业环境重点实验室陕西杨凌700
梁 文,何 维,李满林,黄 辉,Wang Jim J,张增强,李荣华,4*(.西北农林科技大学资源环境学院,陕西 杨凌 700;.西北农林科技大学理学院,陕西 杨凌 700;.School of Plant, Environmental and Soil Sciences, Louisiana State University Agricultural Center, Baton Rouge, LA 7080, USA;4.农业部西北植物营养与农业环境重点实验室,陕西 杨凌 700)
金属氧化物纳米颗粒对磷的吸附及回收潜力
梁 文1,何 维1,李满林2,黄 辉1,Wang Jim J3,张增强1,李荣华1,4*(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.西北农林科技大学理学院,陕西 杨凌 712100;3.School of Plant, Environmental and Soil Sciences, Louisiana State University Agricultural Center, Baton Rouge, LA 70803, USA;4.农业部西北植物营养与农业环境重点实验室,陕西 杨凌 712100)
比较4种金属氧化物纳米颗粒(nMgO,nAl2O3,nTiO2和nFe2O3)对水体P的吸附性能,并探讨了pH、吸附时间、共存离子等因素对nMgO吸附P的影响,用XRD和XPS分析了nMgO对P的吸附机制,最后通过小青菜盆栽实验法探讨nMgO从养殖废水中吸附回收P的应用潜力.结果发现,在pH 3.0~8.0范围内,nMgO对P的吸附量显著高于nAl2O3、nTiO2和nFe2O3,4种纳米颗粒对P的吸附量分别可达40、31.77、15.93和13.08mg/g.吸附后P的解吸可逆性较差.nMgO对P的吸附能在0.5h内达到吸附平衡,P的吸附符合准二级动力学过程.体系共存的等量F-、Cl-、NO3-、SO42-、Na+、K+和NH4+离子对nMgO吸附P无显著影响, Mg2+和Ca2+离子对P吸附具有促进作用.nMgO对P的吸附等温线可用Langmuir模型描述,最大吸附量达139.3mg/g. XRD和XPS分析表明,nMgO对P的吸附是伴有静电吸引的以表面络合沉淀反应为主的吸附过程.nMgO能有效地从养殖废水中吸附回收 P,吸附 P的 nMgO作为肥料,能使小青菜干物质量从 0.31g/kg土增加到0.96g/kg土.
纳米颗粒;nMgO;P;吸附回收;养殖废水
磷(P)是重要的生命元素,对生物的生长繁衍具有重要作用,也是农作物种植过程不可缺少的植物影响元素.随着人类农业种植水平的提高,磷矿开采量持续增加和磷肥的盲目施用,导致全球水体的富营养化问题较为普遍[1].2012年美国地质调查局在全球范围内开展的调查指出,中国作为世界上最大的P肥生产国,若对自身的P矿资源开采规划不当,以现有的开采速度, P矿资源将在35a内耗竭[2].因此,一方面要加强控制P使用量,合理施肥以提升作物养分供给水平[3],另一方面要注重从水体中回收 P,才是从根本上解决 P资源短缺、实现P资源可持续循环利用的最终途径[4-5].
目前,从水体回收P的主要方式是向含P水体中投加水溶性钙盐或镁盐的方法获得沉淀形式的磷酸盐[6].但这种方法的应用要求是水体 P含量必须较高,才能推动磷酸盐难溶物的溶解-沉淀化学平衡移动;如果水体P含量不满足沉淀产生反应商要求时,则必须投加大量的钙盐或镁盐满足反应商.但在富营养化水体中P含量较低,低P含量体系(限值0.01mg/L)并不适用于钙镁盐沉淀回收法[4-5,7].虽然已有大量的研究报道证明,生物富集法[8]、离子交换法[9]、膜分离法[10]、电动富集法[11]、吸附法等均能有效从水体回收 P,但由于吸附法相比而言成本低廉、操作简单、适用于痕量污染物富集的优点,而被认为是最有应用前景的措施之一[4-5].在吸附法的应用中,许多学者已经在农业秸秆[12]、生物炭[13-14]、工业废弃物[15]、金属氧化物[16-17]、壳聚糖[18]、天然矿物[19-20]等吸附剂方面做了大量卓有成效的研究工作,但寻找新型高效吸附剂仍是推进吸附法应用的关键[5].
随着纳米技术的飞速发展,纳米材料因具有比表面积大、吸附能力强、易于功能化等优点,而被认为是一类潜在的污染物高效吸附材料[21].例如,ZrO2修饰CMK-3纳米颗粒[22]、镧氧化物负载Fe3O4@SiO2纳米颗粒[23]、ZrO2纳米颗粒[24]等均具有良好的水体P吸附性能,但目前的研究仍以模拟含P污水进行吸附剂性能探讨为主.为推进吸附法的应用,在吸附剂的筛选过程中,仍需要在相同试验条件下系统地比较不同吸附剂的吸附性能,同时需要加强吸附剂对实际污水中 P的吸附回收研究[7].但当前有关不同纳米材料吸附剂的P吸附性能系统比较研究仍鲜见报道,有关其在实际污水 P吸附回收方面的应用潜力仍缺乏探讨[4,7-8].
为此,本研究通过批处理实验法,系统的比较了金属氧化物纳米颗粒吸附剂(nMgO, nAl2O3, nTiO2和nFe2O3)对水体P的吸附性能,并进一步探讨了nMgO对P的吸附机制及其在养殖废水P回收中的应用潜力,以期为水体P回收提供新型纳米材料吸附剂,丰富纳米颗粒吸附剂在吸附法中的应用.
1 材料与方法
1.1 主要试剂与仪器
1.1.1 试剂 nMgO、nAl2O3、nTiO2和nFe2O3纳米颗粒(纯度 99.9%),购于阿拉丁试剂公司.钼酸铵购于陕西金堆城钼业股份有限公司,酒石酸锑钾、NaF、NaCl、KCl、NH4NO3、MgSO4、CaCl2和KH2PO4购于天津化学试剂公司,均为分析纯,实验用水为去离子水.
1.1.2 仪器 JEOL 200CX型高分辨透射电子显微镜(TEM),TD-3500型X射线衍射仪(XRD), TriStar II 3020型比表面积分析仪,Zetasizer Nano ZS型Zeta电位仪,Kratos AXIS Ultra DLD型X射线能谱仪(XPS),岛津UV-VIS-1800型紫外可见分光光度计.
1.2 实验方法
1.2.1 纳米颗粒的表征 用JEOL 200CX型高分辨透射电子显微镜观察材料形貌.77K下用Tristar II 3020型比表面积测定仪测定材料的N2吸附-解吸曲线,通过 Brumauer-Emmett-Teller (BET)法计算样品的比表面积.用 Zeta电位仪测试纳米颗粒的zeta电位.以Mg K 为X射线源进行X射线能谱分析(XPS).
1.2.2 金属氧化物纳米颗粒对P的吸附 采用批处理实验法,分别研究体系pH、吸附时间、离子强度、浓度、温度等因素对P吸附的影响.即将 20mL一定浓度的 P溶液(KH2PO4配制)于75mL聚乙烯离心管中控制好实验条件后,加入一定量的金属氧化物纳米颗粒吸附剂,室温振荡一定时间后,经12000r/min高速离心分离,0.10µm滤膜过滤,吸取5mL滤液,用岛津UV-VIS-1800型紫外可见分光光度计以钼蓝法测定P浓度.所有实验重复 3次.参考文献[5,25]的方法,根据吸附前后溶液中P的浓度,按qe=V(c0-ce)/m计算P吸附量 qe(mg/g).用准一级动力学模型 qt= qe⋅(1-e-k1t)和准二级动力学模型qt= k2⋅qe2⋅t/(1 + k2⋅qe⋅t)对吸附动力学数据进行拟合.式中: qt为 t时刻的吸附量, mg/g; k1和k2分别为一级和二级动力学速率常数.用 Langmuir模型 qe= qmax⋅KL⋅ce/[(1 + KL⋅ce)]和 Freundlich模型 qe= KF⋅ce1/n对吸附等温线进行拟合.式中: c0和ce分别为吸附前后溶液P的浓度, mg/L; V为P溶液的体积, L; m为吸附剂的质量, g; KL为Langmuir常数; qe和 qmax分别为吸附量和最大吸附量, mg/g; ce为吸附平衡时溶液P的浓度, mg/L; KF与n分别为Freundlich模型常数; T为温度, K; R为气体常数,取值8.314J/(mol·K).
1.3 养殖废水中P的回收应用研究
为评价nMgO纳米颗粒从含P水体吸附回收P的农业应用潜力,研究中首先自杨凌本香农业产业集团某大型肉猪养殖场(揉谷镇)采集养殖废水,经过滤除去悬浮固体后备用.该废水 pH 7.86,CaCO3碱度 1377.2mg/L,COD 2080.4mg/L, NH4+-N 218.8mg/L,总P 113.3mg/L,K+103.7mg/ L, Ca2+20.2mg/L,Na+13.3mg/L.然后将200mL养殖废水装入500mL聚乙烯硬质塑料瓶中(pH未调节),同时加入 0.25g nMgO 纳米颗粒,室温振荡2h后,用0.10µm滤膜过滤,吸取5mL滤液用钼蓝法测定总P浓度然后将滤膜小心取出,并投入盛有 500mL 去离子水的烧杯中,超声波振荡30min 使粘附在滤膜上的固体颗粒分散在液相中,获得乳白色悬液备用.将采集自杨凌某地的废弃窑洞周边的表层0~30cm黄褐土 (该区域土壤贫瘠,几乎寸草不生,土壤样品理化性质分析表明,pH 8.02,粘粒46.25%,EC 119.79 µS/cm,全K 4.03g/kg,全 N 0.25g/kg,全 P 0.53g/kg,有机质4.16g/kg)挑去碎石块后,实验室自然风干,用木棒压碎,过2mm尼龙筛.参考文献[26]的方法进行小青菜盆栽实验,具体为称取土壤样品 2kg装入塑料花盆中,加入吸附P后的乳白色悬液500mL并充分混匀,对照处理中仅加入 500mL 去离子水,室温静置2 周后,每盆播入10粒小青菜种子,等种子萌发至4个叶片后间苗至每盆5株,每一处理重复3盆,持续盆栽实验35d后收获小青菜地上部分,装入纸袋在120℃温度下杀青, 60℃烘干至恒重,计算小青菜地上部分干生物量(g/kg土).试验期间,不施用其他肥料,仅用去离子水保持土壤含水率约80%左右田间持水量.
2 结果与讨论
2.1 纳米颗粒的表征

图1 金属氧化物纳米颗粒的TEM照片Fig.1 The TEM images of metal oxides nanoparticles (a)nMgO; (b)nAl2O3;(c)nTiO2;(d)nFe2O3
纳米颗粒在无水乙醇中分散后,对 4种纳米颗粒进行的透射电镜观察见图 1.由图 1可知, nTiO2纳米颗粒的球形结构清晰,颗粒均匀且分散良好,粒径介于15~28nm之间;nMgO、nAl2O3和nFe2O3纳米颗粒的粘连较为严重,颗粒分散度相对较差,3种纳米颗粒的粒径介于 18~89nm、13~92nm和17~112nm 之间(图1), nTiO2纳米颗粒分散度较好,颗粒相对较为均匀,粒径约 40nm左右.4种纳米颗粒材料对N2的吸附呈现出IV型吸附-脱附曲线(图2(a)),这表明4种材料的孔隙结构较为均匀. nMgO、nAl2O3、nTiO2和nFe2O3纳米颗粒的比表面积分别为93.8, 101.2, 126.4和86.5m2/g.除nFe2O3纳米颗粒外,nTiO2、nMgO 和nAl2O3纳米颗粒的孔径分布较为均匀,分别集中在2.77nm、3.78nm和4.56nm(图2(b)).进一步采用X射线衍射仪对4种纳米颗粒进行了晶型分析,结果见图2(c).由图2(c)可知, 4种纳米颗粒的XRD衍射峰清晰对称,晶型良好,其衍射峰分别和粉晶数据库中的 JCPDS 75-0447、JCPDS 10-0425、JCPDS 71-1187和JCPDS 33-0664标准卡片相对应,说明研究的4种纳米颗粒分别是由MgO、TiO2、Al2O3和Fe2O3所组成.这和Li等[5]制备的 MgO-生物炭、Cheng等[27]制备的TiO2-碳纳米管、Xia等[28]制备的 Al2O3微管和Asfaram等[29]制备的Fe2O3吸附材料等纳米颗粒衍射峰位基本一致.Zeta电位分析表明,nMgO、nAl2O3、nTiO2和nFe2O34种纳米颗粒的零电荷电位pHzpc分别为>11、8.83、7.82和8.06.

图2 金属氧化物纳米颗粒的N2吸附-脱附等温线、孔径分布、XRD谱图和Zeta电位Fig.2 The N2adsorption-desorption isotherms、pore size distribution、XRD patterns and zeta potential of metal oxides nanoparticles
2.2 pH值对P吸附的影响及P的解吸
将一系列 20mL 浓度 50mg/L的 P溶液用0.1mol/L HNO3及NaOH 调节pH 3.0 ~11.0后,分别加入25mg nMgO、nAl2O3、nTiO2和nFe2O3,室温振荡12h. 4种纳米颗粒在不同pH值下对P吸附的影响见图3(a).由图3(a)可知,在pH 3.0~8.0 的范围内, nAl2O3、nTiO2和nFe2O3对P的吸附量基本维持平衡,分别可达 31.77mg/g (P被吸附79.42%)、15.93mg/g (P 被吸附 39.83%)和13.08mg/g (P被吸附32.70%),此后随着pH值的继续增大,吸附量逐渐降低.相比而言,在 pH 3.0~8.0的范围内, nMgO对P具有极高的吸附亲和力,吸附量基本维持 40mg/g (P全部被吸附),此后随着pH值增大至10.94,吸附量逐渐降低至24.42mg/g.一般而言,影响吸附剂吸附量的因素主要包括吸附剂的比表面积大小、吸附剂颗粒分散度、吸附剂表面活性点位密度和介质pH等因素[30].本研究中, 4种纳米颗粒对 P的吸附量表现出 nMgO>nAl2O3>nTiO2>nFe2O3的顺序.由此可见,对于本研究中的4种纳米颗粒而言,其对P的吸附量与材料本身的比表面积大小和颗粒分散度关系不大.但介质pH值会影响吸附剂表面的电荷特征和P在溶液中的存在形态[22,24].一般而言,水溶液中 P主要以 PO43-、HPO42-和 H2PO4-等形态存在[5,13].当pH<8.0时,溶液中P主要以带负电荷的H2PO4-和HPO42-为主[5,24],而此时 nAl2O3、nTiO2和 nFe2O3的表面会被质子化带正电荷,从而能通过静电吸引维持较高的吸附量[23].但当体系 pH值较高时,溶液中P主要以HPO42-和PO43-为主,吸附剂的表面质子化变弱,所带正电荷密度逐渐减少,静电吸引力减小,同时体系中较多的 OH-能与 HPO42-和PO43-发生竞争吸附,从而导致吸附量较低[23-24].

图3 pH值对P吸附的影响及P的解吸Fig.3 Effect of pH on phosphate adsorption andphosphate desorption
为考察 P的解吸情况,试验中,将一系列20mL 浓度 50mg/L的 P溶液用 0.1mol/L HNO3及NaOH 调节pH=7.0,并分别加入25mg nMgO、nAl2O3、nTiO2和nFe2O3,室温振荡12h,经 12000r/min高速离心分离,测定上清液中残余的P浓度,计算出P的吸附量.然后,将固体残渣小心用去离子水洗涤3次后,分别加入10mL pH值为 4.0和 9.0的去离子水,室温振荡 12h,测定液相中的P含量,计算P的解吸量,结果见图 3(b).由图 3(b)可见,在 pH=7.0时,nMgO、nAl2O3、nTiO2和nFe2O3对P的吸附量分别可达39.96、31.82、15.97和13.03mg/g,这一研究结果和图 3(a)具有一定的吻合性.然而,在pH=4.0的去离子水中,从nMgO、nAl2O3、nTiO2和nFe2O3中解吸的P仅占吸附量的40.49%、4.23%、12.02%和 2.92%;而在 pH=9.0时,从nMgO、nAl2O3、nTiO2和 nFe2O3中解吸的 P仅占吸附量的43.04%、9.11%、25.34%和5.99%.这表明对4种纳米颗粒吸附P后,P的解吸性较差.这一研究结果和前人分别用磁性MgO生物炭[5]、介孔 α-Fe2O3[31]和纳米氧化铝[32]进行 P吸附时P的解吸结果相类似,暗示了4种纳米颗粒对P的吸附可能与形成内层表面金属-P络合物有关[5,31-32].由于nMgO对P的吸附量远高于nAl2O3、nTiO2和 nFe2O3,因而后续试验仅以nMgO为吸附剂进行研究.
2.3 吸附时间对P吸附的影响
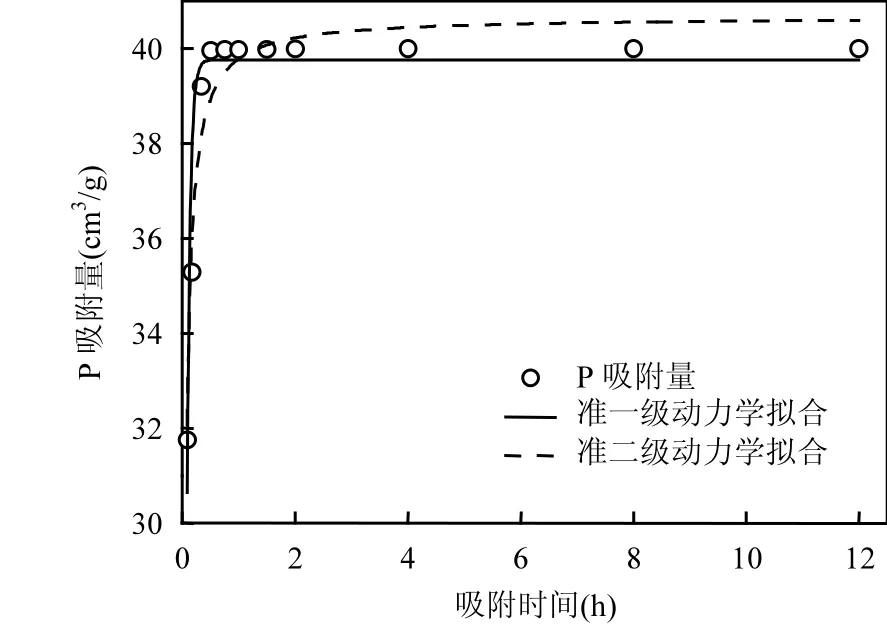
图4 吸附时间对P吸附的影响Fig.4 Effect of contact time on phosphate adsorption
在吸附时间影响研究中,将 200mL浓度50mg/L的P溶液调节pH=7.0后,加入250mg nMgO,室温振荡12h.结果发现, nMgO对P的吸附很迅速,能在 0.5h内达到吸附平衡(图 4).这和前人用氧化镧修饰 Fe3O4@SiO2[23], ZrO2[24]等纳米颗粒吸附 P的研究结果相类似.为保证吸附剂对 P的吸附效率,后续试验中吸附时间选用 2h.进一步对吸附数据进行动力学拟合发现,准一级动力学模型拟合结果为 k1= 0.5673h-1,决定系数 R2=0.8802;准二级动力学模型拟合结果为 k2=3.0308g/(mg·h),决定系数R2=0.9993.说明nMgO对P的吸附动力学过程可用二级动力学模型描述,暗示了其对 P的吸附是化学吸附[5].
2.4 共存离子和P浓度对P吸附的影响
为考察共存离子对 P吸附的影响,将 10mL浓度100mg/L的P溶液分别与10mL 100mg/L的NaF、NaCl、KCl、NH4NO3、MgSO4、CaCl2溶液混合后,调节pH=7.0并加入25mg nMgO,室温振荡2h.共存离子对P吸附的影响见图5(a).从图 5(a)可知,与对照(CK)相比,虽然体系共存的F-、Cl-、NO3-、SO42-、Na+、K+、NH4+等离子对nMgO吸附P没有显著影响, nMgO对P的吸附量基本维持在40mg/g左右,这暗示了nMgO对P的吸附具有较高的专一性[13,24].但Mg2+及Ca2+的存在会使P全部被吸附,这可能是由于Mg2+、Ca2+与P之间存在较高的化学亲和力所致[5,24].
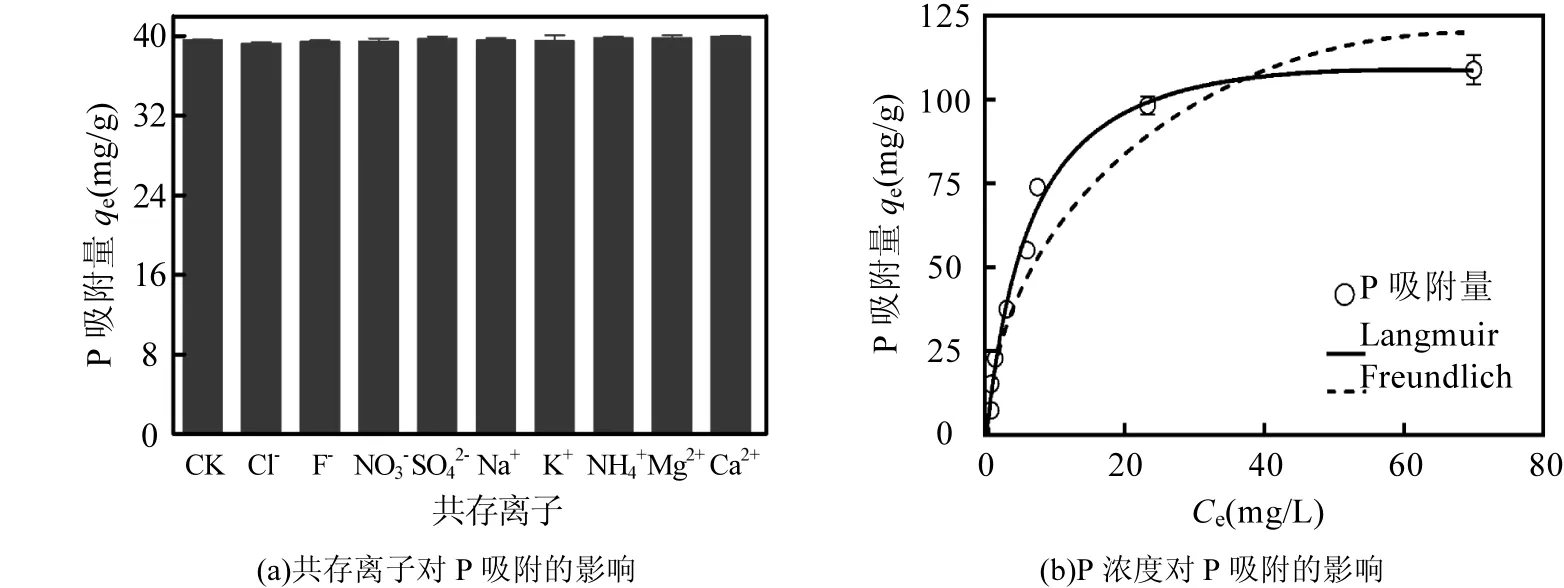
图5 共存离子和P浓度对nMgO吸附P的影响Fig.5 Effect of coexist ions (a) and phosphate concentration (b) on phosphate adsorption onto nMgO
表1 不同吸附剂对P的吸附比较Table 1 Comparison of P adsorption with other reported adsorbents

表1 不同吸附剂对P的吸附比较Table 1 Comparison of P adsorption with other reported adsorbents
吸附剂 pH值吸附剂用量(g/L )平衡时间(h) 吸附模型 qmax(mg/g) 文献Zr4+修饰壳聚糖膜 3 2 0.33 Langmuir 71.68 [10] Fe3O4纳米颗粒 2~6 0.6 2 Redlich–Peterson 5.03 [17] ZrO2修饰CMK-3 6.5 0.25 13 Freundlich 70 [22]镧氧化物Fe3O4@SiO2 5~9 1 0.17 Langmuir 27.8 [23] ZrO2纳米颗粒 6.2 0.1 8 Langmuir 99 [24] MgO纳米颗粒 3~8 1.25 0.5 Langmuir 139.3 本研究
在浓度影响研究中,将 20mL 浓度 5~200mg/L的P溶液调节至pH=7.0后,加入25mg nMgO,室温振荡2h. P初始浓度对吸附的影响见5(b).从图5(b)可知, nMgO对P的吸附量随着P的初始浓度的增加而增大并逐渐趋于平衡,这是因为吸附剂表面的吸附位点在浓度低时并未完全吸附,随着浓度增加,吸附位点逐渐饱和,吸附的量则逐渐趋于定值[18].用 Freundlich 及Langmuir模型对图5 (b)中的吸附数据进行拟合可知, Freundlich模型的KF=15.94mg1-1/n·L1/n/g, n = 2.16. Langmuir模型的qmax= 139.3mg/g, KL= 6.68L/mg, Langmuir模型的决定系数R2(0.9882)大于 Freundlich模型的决定系数 R2(0.8813), Langmuir模型更适合于描述nMgO对P的吸附等温线,说明nMgO对P的吸附可能是单层吸附过程.这一结果和前人用不同吸附剂进行P吸附的研究结果相类似(表1).但本研究中, nMgO对P的最大吸附量高于文献报道的诸多吸附剂(表1),这可能与吸附剂的化学组成有关,也有吸附剂和及其与 P的作用机制有关[4]. 有关这一问题,本研究将进一步开展探讨.
2.5 nMgO对P的吸附机制
为考察nMgO对P的吸附机制,在离心管中,将50mg吸附P后的nMgO颗粒分散于10mL无水乙醇中,然后离心 5min后,倾去上清液,再加入2mL无水乙醇,剧烈震荡至固体颗粒分散后,于60℃真空干燥箱中烘干 8h后,进行 XRD,结果见图6(a).将图2(c)和图6(a)进行比较可知,对吸附P后的nMgO颗粒中除了含有MgO外,还出现了一些新的衍射峰,这些新出现的衍射峰来自Mg(OH)2、Mg(H2PO4)2和 MgHPO4.为了分析新生成物质的比例,本研究进一步对吸附P前后的nMgO颗粒进行了XPS分析,结果如图6(b)~6(d)所示.从图6(b)可知,与吸附P前的nMgO相比,吸附P后的nMgO颗粒表面在135.1eV处出现了P 2p峰,证明了有P被吸附.进一步对P 2p峰进行分析可见,吸附P后的nMgO颗粒的P 2p峰中含有PO43-(135.5eV)、MgHPO4和 Mg(H2PO4)2(图 6(c));与此同时, 1304.6eV处的 Mg 1s峰中也存在 MgHPO4, Mg(H2PO4)2, Mg(OH)2和MgO(图6(d)).Mg 1s峰中MgHPO4和 Mg(H2PO4)2的峰面积比为0.96, P 2p峰中MgHPO4和 Mg(H2PO4)2的峰面积比为0.94,二者较为接近.结合XRD和XPS分析中Mg(OH)2的出现可知,虽然 nMgO在水中的溶解性很小,但nMgO水合后可能会被体系中共存的 HPO42-和H2PO4-离子促进溶解,通过化学反应MgO + H2O→ Mg(OH)2→ Mg2++2OH-,Mg2++ HPO42−→MgHPO4(s),Mg2++ 2H2PO4−→ Mg(H2PO4)2(s)等生成了Mg(H2PO4)2和MgHPO4[5].这一研究结果与前人在用磁性MgO修饰甘蔗叶生物炭[5]、富含镁的西红柿秸秆生物炭[33]及 MgO负载的锂电池碳粉[34]吸附P的研究结果基本一致.

图6 吸附P后nMgO的XRD图谱和吸附P前后nMgO的XPS图谱Fig.6 XRD pattern of nMgO sorbed phosphate and XPS pattern of nMgO before and after phosphate adsorption
基于以上研究结果,可认为, nMgO对P的吸附是以表面络合沉淀反应过程为主,同时伴有静电吸引过程,这一过程可示意为图7.

图7 nMgO对P的吸附机制Fig.7 Schematic illustration of the phosphate adsorption onto nMgO
2.6 nMgO对养殖废水中P的回收应用潜力
为探讨nMgO对养殖废水中P的回收潜力,向200mL养殖废水中投加了250mg nMgO 纳米颗粒,结果发现,经过 nMgO吸附后,养殖废水中几乎检测不到 PO43-,说明 nMgO 纳米颗粒能有效地从养殖废水中通过吸附回收 P.进一步将吸附P的nMgO 纳米颗粒作为肥料用于小青菜盆栽实验后发现,由于研究所选取的土壤样品养分十分贫瘠,对照处理中小青菜的地上部分干生物量仅为0.31g/kg土,而施入吸附P的nMgO 纳米颗粒后的小青菜地上部分干生物量则高达0.96g/kg土,这表明从养殖废水中吸附 P后的nMgO具有较好的P肥应用潜力.同时,由于养殖废水中除了含有P外还含有NH4+,因此从化学角度来看, nMgO还有望能从养殖废水通过化学反应Mg2++NH4++PO43-→ MgNH4PO4(s),同时实现对P和N的回收[35].
3 结论
3.1 纳米颗粒对P的吸附受体系pH值控制,在pH<8的条件下, 4种金属氧化物纳米颗粒对P均能保持稳定的吸附量,但nMgO对P的吸附量远高于nAl2O3、nTiO2和nFe2O3, nMgO对P的吸附能在0.5h内达到平衡.
3.2 体系共存的F-、Cl-、NO3-、SO42-、Na+、K+、NH4+等离子对 nMgO吸附 P没有显著影响,Mg2+和Ca2+对P吸附具有促进作用.nMgO对P的吸附等温线可用Langmuir模型描述,最大吸附量可达139.3mg/g. nMgO对P的吸附是伴有静电吸引以表面络合沉淀反应为主的吸附过程.
3.3 nMgO纳米颗粒能有效地从养殖废水中通过吸附回收P,吸附P后的nMgO具有较好的P肥应用潜力,能显著促进小青菜的生长.
[1] Conley D J. Controlling eutrophication: Nitrogen and phosphorus [J]. Science, 2009,323:1014–1015.
[2] US Geological Survey. (1950–2013) USGS Minerals Yearbook: Phosphate Rock [R]. 2012.
[3] Gilbert N. The disappearing nutrient [J]. Nature, 2009,461: 716–718.
[4] Loganathan P, Vigneswaran S, Kandasamy J, et al. Removal and recovery of phosphate from water using sorption [J]. Critical Review of Environmental Science & Technology, 2014,44:847–907.
[5] Li R H, Wang J J, Zhou B Y, et al. Recovery of phosphate from aqueous solution by magnesium oxide decorated magnetic biochar and its potential as phosphate-based fertilizer substitute [J]. Bioresource Technology, 2016,4:30271–30281.
[6] Xu K N, Li J Y, Zheng M, et al. The precipitation of magnesium potassium phosphate hexahydrate for P and K recovery from synthetic urine [J]. Water Research, 2015,80:71–79.
[7] Ye Y Y, Ngo H H, Guo W S, et al. Insight into chemical phosphate recovery from municipal wastewater [J]. Science of The Total Environment, 2017,576:159–171.
[8] Ye Y Y, Ngo H H, Guo W S, et al. Insight into biological phosphate recovery from sewage [J]. Bioresource Technology, 2016,218:874–881.
[9] Awual M R, Shenashen M A, Jyo A, et al. Preparing of novel fibrous ligand exchange adsorbent for rapid column-mode trace phosphate removal from water [J]. Journal of Industrial and Engineering Chemistry, 2014,20:2840–2847.
[10] Liu Q, Hu P, Wang J, et al. Phosphate adsorption from aqueous solutions by Zirconium (IV) loaded cross-linked chitosan particles [J]. Journal of the Taiwan Institute of Chemical Engineers, 2016,59:311–319.
[11] Huang H M, Zhang D D, Zhao Z J, et al. Comparison investigation on phosphate recovery from sludge anaerobicsupernatant using the electrocoagulation process and chemical precipitation [J]. Journal of Cleaner Production, 2017,141:429–438.
[12] Zong E M, Liu X H, Jiang J H, et al. Preparation and characterization of zirconia-loaded lignocellulosic butanol residue as a biosorbent for phosphate removal from aqueous solution [J]. Applied Surface Science, 2016,387:419–430.
[13] Li R H, Wang J J, Zhou B Y, et al. Enhancing phosphate adsorption by Mg/Al layered double hydroxide functionalized biochar with different Mg/Al ratios [J]. Science of the Total Environment, 2016,559:121–129.
[14] 马锋锋,赵保卫,钟金魁,等.牛粪生物炭对磷的吸附特性及其影响因素研究 [J]. 中国环境科学, 2015,35(4):1156-1163.
[15] Li F H, Wu W H, Li R Y, et al. Adsorption of phosphate by acid-modified fly ash and palygorskite in aqueous solution: Experimental and modeling [J]. Applied Clay Science, 2016,132-133:343–352.
[16] 孟文娜,谢 杰,吴德意,等.活性氧化铝对水中磷的去除与回收研究 [J]. 环境科学, 2013,34(1):231–236.
[17] Yoon S Y, Lee C G, Park J A, et al. Kinetic, equilibrium and thermodynamic studies for phosphate adsorption to magnetic iron oxide nanoparticles [J]. Chemical Engineering Journal, 2014,236: 341–347.
[18] Mahaninia M H, Wilson L D. Phosphate uptake studies of cross-linked chitosan bead materials [J]. Journal of Colloid and Interface Science, 2017,485:201–212.
[19] 韩梅香,尹洪斌,唐婉莹.热改性凹土钝化底泥对水体磷的吸附特征研究 [J]. 中国环境科学, 2016,36(1):100-108.
[20] He Y H, Lin H, Dong Y B, et al. Simultaneous removal of ammonium and phosphate by alkaline-activated and lanthanumimpregnated zeolite [J]. Chemosphere, 2016,164:387–395.
[21] Wang Z, W K, Xing M C, et al. A bench-scale study on the removal and recovery of phosphate by hydrous zirconia-coated magnetite nanoparticles [J]. Journal of Magnetism and Magnetic Materials, 2017,424:213–220.
[22] Ju X Q, Hou J F, Tang Y Q, et al. ZrO2nanoparticles confined in CMK-3as highly effective sorbent for phosphate adsorption [J]. Microporous and Mesoporous Materials, 2016,230:188–195.
[23] Lai L, Xie Q, Chi L N, et al. Adsorption of phosphate from water by easily separable Fe3O4@SiO2core/shell magnetic nanoparticles functionalized with hydrous lanthanum oxide [J]. Journal of Colloid and Interface Science, 2016,465:76–82.
[24] Su Y, Cui H, Li Q, et al. Strong adsorption of phosphate by amorphous zirconium oxide nanoparticles [J]. Water Research, 2013,47:5018–5026.
[25] 蒋顺成,秦 睿,李满林,等.EDTA-nSiO2纳米颗粒对 Cd2+的吸附 [J]. 环境科学, 2016,37(9):3480–3487.
[26] 蔡函臻,宁西翠,王 权,等.碱性固体对污泥的调质堆肥影响及产品对土壤的改良潜力 [J]. 环境科学, 2016,37(12):394–402.
[27] Cheng G, Xu F, Xiong J, et al. Enhanced adsorption and photocatalysis capability of generally synthesized TiO2-carbon materials hybrids [J]. Advanced Powder Technology, 2016,27(5): 1949-1962.
[28] Xia Y, Zhang L, Wang Y, et al. A facile strategy to fabricate well-defined mesoporous γ-Al2O3, microcubes with good adsorption performance towards Cr(VI) removal [J]. Materials Letters, 2015,143:294-297.
[29] Asfaram A, Ghaedi M, Hajati S, et al. Synthesis of magnetic γ-Fe2O3-based nanomaterial for ultrasonic assisted dyes adsorption: Modeling and optimization [J]. Ultrasonics Sonochemistry, 2016,32:418-431.
[30] 高宝云,邱 涛,李荣华,等.巯基改性玉米秸秆粉对水体重金属离子的吸附性能初探 [J]. 西北农林科技大学学报:自然科学版, 2012,40(3):185-190.
[31] Liang H, Liu K, Ni Y. Synthesis of mesoporous α-Fe2O3, via sol–gel methods using cellulose nano-crystals (CNC) as template and its photo-catalytic properties [J]. Materials Letters, 2015,159: 218-220.
[32] Mor S, Chhoden K, Negi P, et al. Utilization of nano-alumina and activated charcoal for phosphate removal from wastewater [J]. Environmental Nanotechnology Monitoring & Management, 2017,7:15-23.
[33] Yao Y, Gao B, Chen J, et al. Engineered biochar reclaiming phosphate from aqueous solutions: mechanisms and potential application as a slow-release fertilizer. [J]. Environmental Science & Technology, 2013,47(15):8700-8708.
[34] Zhang Y, Guo X, Yao Y, et al. Mg-Enriched Engineered Carbon from Lithium-Ion Battery Anode for Phosphate Removal. [J]. Acs Applied Materials & Interfaces, 2016,8(5):2905-2909.
[35] Xia P, Wang X J, Wang X, et al. Struvite crystallization combined adsorption of phosphate and ammonium from aqueous solutions by mesoporous MgO–loaded diatomite [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016,506:220–227.
Phosphate adsorption from solution by metal oxide nanoparticles and the potential on phosphate capture.
LIANG Wen1, HE Wei1, LI Man-lin2, HUANG Hui1, Wang Jim J3, ZHANG Zeng-qiang1, LI Rong-hua1,4*(1.College of Natural Resources and Environment, Northwest A&F University, Yangling 712100, China;2.College of Science, Northwest A & F University, Yangling 712100, China;3.School of Plant, Environmental and Soil Sciences, Louisiana State University Agricultural Center, Baton Rouge, LA 70803, USA;4.Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100, China). China Environmental Science, 2017,37(7):2557~2565
Effects of four different metal oxide nanoparticles (nMgO, nAl2O3, nTiO2and nFe2O3) on phosphate adsorption were compared in the batch experiment. The influences of solution pH, contact time and coexist ions on phosphate adsorbed by nMgO were examined. Further, the phosphate adsorption mechanism onto nMgO was evaluated by XRD and XPS analysis. And the potential of recovered phosphate by nMgO from pig breeding wastewater on fertilzer was assessed by pot experiment. The results showed that nMgO had higher phosphate adsorption ability than nAl2O3, nTiO2and nFe2O3. The phosphate amount reached 40、31.77、15.93 and 13.08mg/g in the range of pH 3.0 to 8.0 for nMgO, nAl2O3, nTiO2and nFe2O3, respectively. The phosphate adsorption was a inreversible process. The phosphate sorption onto nMgO could reach equilibrium within 0.5h, the adsorption process fitted the pseudo-second order kinetic model. The equal content of coexisted F-, Cl-, NO3-, SO42-, Na+, K+and NH4+ions had no negative influence on phosphate adsorbed onto nMgO, while the existence of Mg2+and Ca2+ions could promote the phosphate adsorption. Langmuir model could be used to describe the adsorption isotherm, by which the maximum phosphate adsorption capacity was around 139.3mg/g. Based on the results of XRD and XPS analysis, it can be concluded that phosphate adsorption was dominated by chemical precipitation reaction combined with electrostatic attraction process. nMgO particles effectively recovered phosphate from piggery wastewater, in turn the phosphate loaded nMgO nanoparticle could be used as a potential substitute for phosphate-basedfertilizer, which significantly improved the cabbage dry biomass from 0.31 to 0.96g/kg soil.
nanoparticle;nMgO;phosphate;adsorption recovery;piggery wastewater
X703
A
1000-6923(2017)07-2557-09
梁 文(1991-),女,陕西杨凌人,硕士研究生,主要研究方向为固体废弃物资源化利用与污染控制.
2016-11-21
中央高校基本科研业务费项目(2014YB064);美国农业部环保署项目(USDA-NRCS#69-3A75-10-156)
* 责任作者, 副教授, rh.lee@nwsuaf.edu.cn
