污泥超高温(65℃)厌氧消化系统启动方案
2017-08-07戴晓虎于春晓同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室上海200092
戴晓虎,于春晓,李 宁,董 滨 (同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海200092)
水污染与控制
污泥超高温(65℃)厌氧消化系统启动方案
戴晓虎,于春晓,李 宁*,董 滨 (同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海200092)
以高温(55℃)厌氧消化反应器的污泥为接种泥,以不同比例的牛粪和脱水污泥为基质,通过产甲烷潜力测试实验,对污泥超高温(65℃)厌氧消化系统的启动策略进行了初步的探讨.实验结果表明:污泥超高温(65℃)厌氧消化系统具有其可行性;65℃条件下,由于水解酸化过程加快,易发生 VFAs(尤其是乙酸和丙酸)的累积.同时,与中温(37℃)和高温(55℃)污泥厌氧消化系统相比,超高温(65℃)系统的产气量虽然较低,但所产沼气中CH4含量明显升高,可以达到79.0%.对系统细菌和古菌进行的多样性分析结果表明:超高温(65℃)条件下,反应器中的细菌以Coprothermobacter、Caldicoprobacter、Ruminiclostridium等极端嗜热的蛋白质水解菌和木质纤维素水解菌为主,不同反应器之间细菌种群多样性的差异是由所投加物料的不同造成的;所有反应器的古菌中,嗜热的氢营养型产甲烷菌 Methanothermabactor成为绝对优势菌群,占古菌的比例均超过96%.在超高温反应器(65℃)的启动初期,可适当提高投加基质中牛粪的比例,加快对嗜热产甲烷菌(氢利用型产甲烷菌)的富集,同时避免系统中的VFAs的积累,保证反应器顺利启动.
超高温;厌氧消化;启动策略;甲烷嗜热杆菌
厌氧消化技术作为一种在实现污泥稳定化同时可产生绿色能源-沼气的技术,一直被认为是污泥处理处置的合适选择之一[1].厌氧消化系统一般在中温(37℃)和高温(55℃)条件下运行.然而,中温厌氧消化系统中由于受到水解步骤的限制,有机颗粒物的降解率较低,所需的 SRT较长[2].即便在高温厌氧消化(55℃)系统中,微生物的降解潜能也仍没有得到充分地释放,有机物降解率也仅有 50%左右[3].因此,污泥厌氧消化的产气潜能还有较大的提高空间[4],其关键是提高污泥中有机物的水解效率[5].Nielsen等[6]与Scherer等[7]通过污泥厌氧消化的对比研究发现,与普通的中温(37℃)厌氧消化相比,高温(55℃)和超高温(超过 55℃)厌氧消化系统更有利于提高有机颗粒溶解性及沼气产量.这主要是由于水解酸化菌生长的最适温度为 55~70℃[8],当厌氧消化系统的温度从55℃上升到65℃时,污泥中蛋白质等难降解有机物的溶解性会显著提高,传质速率加快[2].同时,嗜高温的氢利用型产甲烷菌的最佳生存温度是 55~70℃[9],如若将厌氧消化的温度提升到65℃,氢利用型产甲烷途径的效率将有可能达到最大[10].
污泥热水解是一种能够加快污泥水解速率,提高甲烷产率的前处理技术,近年来在实际工程中得到了广泛的应用[11-12].热水解后污泥温度较高,利用热水解污泥中的剩余热量,进行超高温厌氧消化,能提高颗粒状污泥的溶解性和降解速率以及嗜高温的水解酸化微生物活性,并富集嗜高温的氢利用型产甲烷菌以提高产气效率[4].而且,氢利用型产甲烷途径的充分利用,能够减少 CO2排放,节省以乙酸等短链脂肪酸形式存在的碳源,方便对碳源进行后续的综合利用.此外,当温度上升至60℃以上时,污泥中的胶体物质降解率提高,丝状菌被杀死,能够明显提高污泥的脱水性[13];同时,污泥中的致病菌也能够被杀灭,初步满足污泥处理处置无害化的要求[14].
目前,国内外关于超高温厌氧消化的研究主要集中于牛粪或餐厨垃圾的可行性探索,对于系统中酸化和甲烷化过程的基础研究较少[15],纯污泥体系的超高温厌氧消化系统的相关研究更是几近空白.本研究主要通过产甲烷潜力测试实验(BMP),对超高温条件下反应器不同启动方案中的产气性能和各项指标进行分析对比,以确定超高温厌氧消化反应器的最佳启动条件,为污泥超高温厌氧消化反应器的启动提供理论依据.
1 材料与方法
1.1 实验材料
接种牛粪取自上海某生态园,取回后为了保证微生物的活性在 35℃下保存,并于 2d内完成接种;脱水污泥取自上海某污水处理厂,于 4℃下保存;所使用的接种泥取自本实验室稳定运行的高温(55℃)厌氧消化反应器.上述物料的基本参数如表1所示.使用前用去离子水分别将牛粪和脱水污泥稀释至含固率(TS)为8%.

表1 牛粪、脱水污泥和接种泥的相关参数Table 1 Characteristics of cow dung, dewatered sludge and inoculum
1.2 BMP实验设计
实验分2个批次进行.BMP实验通过全自动产甲烷潜力测试仪(AMPTS II,bioprocess control,瑞典)完成.第一批次的BMP实验主要为了完成超高温甲烷菌的富集并初步探索超高温厌氧消化反应器启动的可行性,第二批实验在第一批BMP实验的基础上,对超高温厌氧消化反应器的启动过程的稳定性和微生物种群分布特征进行了研究.

表2 实验设计参数Table 2 Designed experimental parameters
第一批次的实验以稳定运行的污泥高温(55℃)厌氧消化反应器的出料为接种泥.第二批次的接种泥为第一批次超高温(65℃)厌氧消化反应器的出料.第一批次实验的基质为牛粪和污泥的混合物,接种比(接种泥:基质(VS:VS))为1:1,反应器为有效容积600mL的双孔塞玻璃瓶.实验设置空白对照组和实验组,空白对照组的反应器中仅添加接种泥,实验组所投加基质设置为不同比例的牛粪和污泥,具体参数如表2所示.
反应器用双孔塞和止水夹密封,启动前用真空泵抽真空后,用氮气吹脱3min以进一步去除上层空间和溶液中的空气.实验设3组平行,结果分析取其平均值.反应器置于 65℃水浴锅中,搅拌设置为5min工作,5min停止,在反应器运行过程中,采集累积甲烷产量和产甲烷速率的数据.
1.3 测试方法
全自动产甲烷潜力测试仪能测定并记录累积甲烷产量和产甲烷速率.实验过程中以集气袋收集气体,通过气相色谱(GC112A,上海仪电,中国)测定气体成分.实验结束后反应器中样品的pH 值通过pH计(S210,梅特勒,瑞士)测定.样品取出并稀释离心后,上清液经0.45 µm滤膜过滤,测定其中的挥发性脂肪酸 (Volatile Fatty Acids, VFAs) (GC 2010plus,岛津,日本)和碱度(自动电位滴定仪 G20,梅特勒,瑞士).氨氮含量通过使用凯氏定氮仪(9860,海能,中国)由滴定法测定.
1.4 微生物种群结构分析
反应器出料于 2mL冻存管中,于-80℃冷冻保存.DNA 样品使用土壤 DNA 提取试剂盒(PowerSoil,MO BIO, USA)提取.提取出的 DNA经过 PCR 扩增,采用高通量测序(Miseq4000, Illumina)分析其中细菌与古菌的种群结构.PCR产物先利用QuantiFLuorTM系统(Promega)测定浓度,随后依据AxyPrep DNA 试剂盒(AXYGEN, USA)的凝胶回收的方法进行提纯[16].提纯的PCR 产物的质量通过凝胶电泳确定.引物设计根据Illumina 公司(San Diego, California, USA)的操作手册,针对细菌和古菌的 16s rRNA基因的通用扩增引物对分别为 338f(5'-ACTCCTACGGGAGGCAGCA-3')/806r(5'-GGACTACHV GGGTWTCTAAT-3')[17]和 524f(5'-TGYCAGCCGCCGCGGTAA-3')/958r(5'-YCCGGCGTTGAVTCCAATT-3')[18].
2 结果与讨论
2.1 厌氧消化产气性能
2.1.1 累积甲烷产量 图1为第一批次BMP实验中各反应器的产甲烷情况,从图1可以看出:各反应器的产甲烷过程均顺利进行,在第14~16d达到了累积甲烷产量的最大值,说明超高温(65℃)厌氧消化反应器的启动是可行的.且牛粪投加比例高的反应器的启动速度和累积甲烷产量明显高于污泥投加比例高的反应器,这主要由于牛粪中所存在的嗜热甲烷菌(氢利用型产甲烷菌)能够快速适应65℃环境[19],保证了厌氧消化产甲烷过程的顺利启动和进行.因此,在反应器启动初期,适当增加牛粪的比例能够加快嗜热产甲烷菌的富集,保证反应器快速稳定启动.

图1 第一批次实验累积甲烷产量Fig.1 Cumulative methane production of the first batch experiments
图2为第二批次BMP实验中各反应器的累积产甲烷情况.可以看出,和第一批次相比,各实验组的产甲烷速率和累积甲烷产量均明显上升,说明第一批次BMP实验有效地实现了嗜热产甲烷菌的初次富集,使体系中嗜热产甲烷菌的含量上升,再次确认了超高温厌氧消化反应系统启动的可行性.但是,即使在第二批次BMP实验中,各反应器的累积甲烷产量也只达到了600~800mL,低于相同条件下的中温和高温厌氧消化甲烷产量(约1200~1400mL).
2.1.2 气体成分 在 65℃条件下,厌氧消化所产沼气中,CH4含量在60%~80%之间(图3),明显高于中温(37℃)和高温(55℃)条件下的 CH4含量(48%~65%)[20].沼气中的 CO2含量在 20%~26%,低于中温(37℃)和高温(55℃)条件下的CO2含量(36%~41%)[20],这证明:氢利用型产甲烷途径在65℃条件下得到了强化,成为主要的产甲烷途径.另外,虽然随着投加物料中污泥比例的升高,产甲烷速率在一定程度上减慢,但CH4含量逐渐升高,纯污泥作为基质的反应器中,CH4含量甚至可以达到 79.0%,表明超高温条件下气体成分的差异与牛粪和污泥的物质组成相关.

图2 第二批次实验累积甲烷产量Fig.2 Cumulative methane production of the second batch experiments

Fig.3 第二批次实验各反应器产气中CH4和CO2含量Fig.3 Methane and carbon dioxide content in biogas of each reactor of the second batch experiments
2.2 液相指标
2.2.1 VFAs 图4为第一批次各样品中VFAs的浓度和组成情况,可以看出,各反应器均发生了较严重的VFAs累积,达到了1900~4000mg/L.当温度上升至 65℃时,达到水解酸化菌的最适温度(55~75℃)[6],水解酸化过程加快,VFAs快速产生,但是,在此温度条件下,乙酸利用型产甲烷菌的活性降低甚至丧失,导致乙酸向甲烷的转化过程被抑制,造成了VFA快速累积[14].
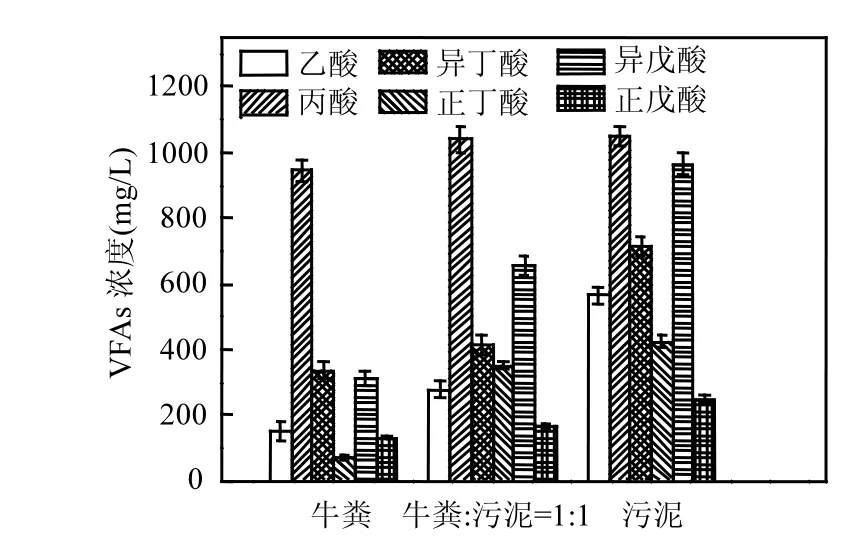
图4 第一批次各反应器中的VFAs浓度及组成(产气终止时取样)Fig.4 The concentrations and compositions of VFAs in each reactor of the first batch experiments (sampled when gas production stopped)
如图5所示,与第一批次实验中的反应器相比,第二批次实验的反应器中 VFAs累积更加明显(表3),说明反应器中的水解酸化过程继续加强,其中丙酸的累积最明显,且随着污泥比例的升高,累积程度也相应略微升高.丙酸的严重累积可能是由于:在 65℃条件下,微生物种群结构发生改变,乙酸利用型产甲烷菌失活.与此同时,嗜热的氢利用型产甲烷菌成为优势菌群.在氢利用型产甲烷途径为主的情况下,乙酸氧化菌将乙酸转化为H2/CO2,在氢利用型产甲烷菌的作用下转化为甲烷[21].乙酸氧化也会导致氢分压上升,使得丙酸氧化微生物活性下降,从而导致丙酸降解过程被抑制[22].而且,乙酸是丙酸的降解产物[23],反应器中乙酸的累积也会影响丙酸的降解速率[24-25],并进一步出现丙酸累积抑制甲烷菌生长的情况[26].由于牛粪和污泥的组成成分不同,牛粪中含有较多难生物降解的木质纤维素类物质,升温后仍不易降解,但污泥的主要成分是蛋白质,随着温度的上升,其溶解性和降解率提高[3],因此,投加了污泥的反应器(#2和#3)中,VFAs 累积更加严重,反应器的启动速率慢,甲烷产量低.
因此,在超高温厌氧消化反应器的启动初期,为避免 VFAs尤其是丙酸的大量累积,尽快完成嗜热产甲烷菌的富集,保证反应器顺利启动,宜采用较高比例的牛粪作为进料.污泥:牛粪(VS: VS)=1:1作为启动初期的投加方案是具有其可行性的.

表3 各反应器运行性能参数 (产气终止时取样)Table 3 The performance characteristics in each digester (sampled when gas production stopped)

图5 第二批次各反应器中的VFAs浓度及组成(产气终止时取样)Fig.5 The concentrations and compositions of VFAs in each digester of the second batch experiments (sampled when gas production stopped)
2.2.2 氨氮在本实验中,各反应器中的氨氮浓度均在 2000~2500mg/之间,远低于氨抑制浓度(5880~6000mg/L),因此,在所实验的 TS和温度(65℃)条件下,氨抑制情况并不容易发生[27].而且,由于牛粪中木质纤维素的含量较高[3],牛粪投加比例较高的反应器中物料碳氮比较高,氨氮浓度相对较低.
2.2.3 pH值和碱度 两个批次BMP实验中的反应器的pH值分别为7.7~7.9和7.6~7.7,略高于产甲烷菌的最佳pH值范围(6.8~7.2)[20].
碱度能够反映厌氧消化系统的缓冲能力[28].如表3所示,BMP实验中各组反应器中的碱度均在 4000~6000mg/L(以 CaCO3计)之间,且随着污泥比例的增加,系统碱度(尤其是第一批 BMP实验中)基本呈现上升趋势.这主要由于与牛粪相比,污泥中的蛋白质含量较高,蛋白质降解过程中会产生较高浓度的游离氨,提高系统碱度[20].较强的缓冲性能使得各反应器在较高浓度的VFAs累积的情况下,没有发生pH值明显降低的现象.
VFAs/碱度是表征厌氧消化系统稳定性的参数:当 VFAs/碱度值小于 0.4时,系统稳定,当VFAs/碱度值在0.4~0.8之间时,系统可能会发生失稳现象;当VFA/碱度值大于0.8时,系统严重失稳[29-30].两批BMP实验中各反应器的VFAs/碱度值均在0.4~0.8之间,这说明,在目前的TS和实验条件下,反应器是不稳定的,且随着污泥投加量的增加,反应失稳的可能性增大.与第一批次 BMP实验相比,第二批次实验中,各反应器的稳定性有提高,这说明,对嗜热微生物的富集是有效的,反应器启动初期增加牛粪的投加量和富集次数,能够提高反应器的稳定性,保证反应器稳定启动.
2.3 微生物种群结构分析
2.3.1 细菌种群结构 图 6为各个反应器中细菌多样性分析结果:在各反应器中,细菌种群均呈现明显的多样性,但各反应器中细菌种群的分布差异比较明显.#1反应器中,Caldicoprobacter、Ruminiclostridium、 OPB54_norank、 D8A-2_norank和Coprothermobacter五种细菌含量均较高,分别达到了细菌总量的16.93%、13.90%、13.10%、9.90%和 9.62%.#2 反应器的优势菌种为Caldicoprobacte和Coprothermobacter,分别占细菌的 18.74%、17.51%.#3 反应器中, Coprothermobacter成为了最主要的优势菌种,所占比例达到了 21.85%.Coprothermobacter、Caldicoprobacter、Ruminiclostridium都是极端嗜热的水解菌[15,31-32],而多存在于中温和高温反应器中的水解酸化菌,如:Bacteroidetes 和Proteobacteria[33]在超高温反应器中没有检测到,Firmicutes所占的比例很低,仅1.5%~3.5%,这说明,与中温和高温反应器相比,超高温条件下,细菌的种群结构发生了明显的改变,极端嗜热的细菌成为优势菌种.随着反应器中所投加污泥比例的升高,Coprothermobacter的种群优势逐渐增大,而其比例的变化与牛粪和污泥的组成成分相关.Coprothermobacter是一种极端嗜热的蛋白质水解菌,在厌氧消化过程中主要参与蛋白质和多肽的降解,在70℃仍能存活[15,34-35],在牛粪厌氧消化反应器[36]和污泥高温厌氧消化反应器[37-38]中均有发现,牛粪厌氧消化反应器中Coprothermobacter的含量较低[39].与牛粪相比,污泥中蛋白质含量较高,因此,在#3反应器中,Coprothermobacter的所占细菌的比例要明显高于其在#1号反应器中的比例.
Caldicoprobacter是一种严格厌氧的嗜热菌,最适生长温度为 65℃(55~75℃),最适生长的 pH值为6.9(6.2~8.3),是污泥高温厌氧消化反应器重要的水解菌[31,40].Caldicoprobacter能够产生耐高温的木聚糖酶,一般参与半纤维素(木聚糖等)的降解[41].Ruminiclostridium是一种嗜热厌氧菌,最佳的生长温度为55 ~60℃,pH值为 7.3~7.5,能够合成纤维素降解酶,降解木质纤维素类物质(纤维素、半纤维素和植物细胞壁多糖等),普遍存在于纤维素类物质的堆肥中[32,42-44].牛粪中纤维素和半纤维素等物质的含量较高,因此,在投加了牛粪的#1和#2反应器中,Caldicoprobacter、Ruminiclostridium所占比例均较高.
由于Coprothermobacter、Caldicoprobacter、Ruminiclostridium的水解终产物均为乙酸、H2和CO2等,这些的细菌的存在有利于促进氢利用型产甲烷菌的活性,从而促进 CO2/H2产甲烷途径[36,40,44].
另外,Intrasporangiaceae、Tepidimicrobium、Proteiniphilum等均存在于3个反应器中,这些细菌大多是嗜热的蛋白质和碳水化合物水解菌[45-47],能利用多种碳源,因此这些细菌的含量在各个反应器中的差别并不明显.

图6 各反应器中的细菌相对丰度对比Fig.6 the relative abundance of bacteria in each digester
综上所述,在超高温(65℃)条件下,3个反应器中细菌主要为极端嗜热的蛋白质和木质纤维素水解菌,不同反应器中细菌种群多样性的差异部分来源于牛粪和污泥中本身所含细菌种类的不同,本质上是由牛粪和污泥的组成成分的不同决定的.
2.3.2 古菌种群结构 图 7为第二批次实验中各反应中的古菌多样性分析结果.可以看出,与细菌相比,各反应器中古菌的种类较少,且分布情况相近,经过二次富集后,各反应器中的古菌均以嗜热产甲烷菌Methanothermabactor为主,所占比例超过 96%.这说明,Methanothermabactor在牛粪和高温厌氧消化污泥中都存在,这与Chachkhiani[48]和Zeikus[49]等的结论一致.且在超高温条件(65℃)下,Methanothermabactor能够被富集,最终成为优势菌群.Methanothermabactor是一种氢利用性产甲烷菌,利用H2和CO2途径产甲烷,最佳pH值范围为7.2~7.6,最适温度范围在65~70℃[49-50].各反应器终止时的 pH 值接近Methanothermabactor的最适 pH值范围,均在7.6~7.7之间,保证了过程中Methanothermabactor的生长.而中温和高温厌氧消化反应器中普遍存在的乙酸利用型产甲烷菌 Methanosaeta[51-52]所占的比例很低,分别只占 0.38%、1.86%和2.61%,3个反应器中均未检测到Methanosarcina.这为反应器中以氢利用型产甲烷过程为主的甲烷化过程提供了直接证据,而乙酸利用型产甲烷途径几乎终止,从而导致乙酸等挥发性脂肪酸大量累积.另外,与投加生污泥的反应器相比,投加牛粪的反应器中Methanosaeta的含量更低. Methanothermabactor的成功富集保证了反应器中产甲烷过程的顺利进行,为超高温厌氧消化系统顺利启动提供了条件.

图7 各反应器中的古菌相对丰度对比Fig.7 The abundance of archaea in each digester
在污泥超高温(65℃)厌氧消化系统中,CO2/ H2产甲烷途径成为主要的产甲烷途径,乙酸产甲烷途径几乎不再进行,在实现CO2减排的同时,能够节省以短链脂肪酸为代表的有机碳源.这些富含短链脂肪酸的厌氧消化沼液可以作为碳源,补充到污水处理的反硝化池中,促进脱氮除磷,节省污水处理的成本,提高污水处理效果,实现碳源的综合利用.
3 结论
3.1 研究证实了污泥超高温(65℃)厌氧消化反应器启动的可行性,在进料中混合投加含有嗜热产甲烷菌(氢利用型产甲烷菌)的牛粪能够加快反应器的启动速率.
3.2 65℃条件下,污泥中蛋白质等有机颗粒的溶解性提高,水解酸化菌的活性提高,易造成VFAs累积,反应器启动初期,宜通过逐步降低牛粪比例的方式来保证反应器启动过程的稳定性,研究中所采用的方案-牛粪:污泥(VS:VS)=1:1可以作为启动的初始投加方案.
3.3 与中温(37℃)和高温(55℃)污泥厌氧消化相比,超高温(65℃)的产气量较低,但所产生物气中CH4含量高79.0%,CO2含量低(20.0%).
3.4 超高温(65℃)条件下,各反应器中的细菌以嗜热的木质纤维素和蛋白质的水解菌为主,包括 Coprothermobacter、Caldicoprobacter、Ruminiclostridium,不同反应器之间细菌种群多样性的差异主要由所投加物料的不同造成.氢利用型产甲烷菌Methanothermabactor成为主要的产甲烷菌,占各反应器的甲烷菌的总量中占 96%以上,而乙酸利用型产甲烷菌 Methanosaeta、Methanosarcina等已经几乎不存在了.
[1] 李建华,刘文静,李 宁.沼液中溶解游离氨基酸的测定——柱前衍生-反相高效液相色谱法 [J]. 中国环境科学, 2016,36(8): 2355-2363.
[2] Lee M Y, Cheon J H, Hidaka T, et al. The performance and microbial diversity of temperature- phased hyperthermophilic and thermophilic anaerobic digestion system fed with organic waste [J]. Water Science and Technology, 2008:283-289.
[3] Nielsen H B, Mladenovska Z, Westermann P, et al. Comparison of two-stage thermophilic (68℃/55 ℃) anaerobic digestion with one-stage thermophilic (55℃) digestion of cattle manure [J]. Biotechnology and Bioengineering, 2004,86(3):291-300.
[4] Lu J, Gavala H N, Skiadas I V, et al. Improving anaerobic sewage sludge digestion by implementation of a hyper-thermophilic prehydrolysis step [J]. Journal of Environmental Management, 2008,88(4):881-889.
[5] Frolund B, Griebe T, Nielsen P H. Enzymatic activity in the activated-sludge floc matrix [J]. Applied Microbiology and Biotechnology, 1995,43(4):755-761.
[6] Nielsen B, Petersen G. Thermophilic anaerobic digestion and pasteurisation. Practical experience from Danish wastewater treatment plants [J]. Water Science and Technology, 2000,42(9): 65-72.
[7] Scherer P A, Vollmer G R, Fakhouri T, et al. Development of a methanogenic process to degrade exhaustively the organic fraction of municipal “grey waste” under thermophilic and hyperthermophilic conditions [J]. Water Science and Technology,2000,41(3):83-91.
[8] Wiegel J. Temperature spans for growth: hypothesis and discussion [J]. FEMS Microbiology Reviews, 1990,6(2/3):155-169.
[9] Wasserfallen A, Nölling J, Pfister P, et al. Phylogenetic analysis of 18 thermophilic Methanobacterium isolates supports the proposals to create a new genus, Methanothermobacter gen. nov., and to reclassify several isolates in three species, Methanothermobacter ther mautotrophicus comb. nov., Methanothermobacterwolfeii comb. nov., and Methanothermobacter marburgensis sp. nov [J]. International Journal of Systematic and Evolutionary Microbiology, 2000,50(1):43-53.
[10] Ahring B K. Status on science and application of thermophilic anaerobic digestion [J]. Water Science and Technology, 1994, 30(12):241-249.
[11] Souza T S O, Ferreira L C, Sapkaite I, et al. Thermal pretreatment and hydraulic retention time in continuous digesters fed with sewage sludge: assessment using the ADM1 [J]. Bioresource Technology, 2013,148:317-324.
[12] Xue Y, Liu H, Chen S, et al. Effects of thermal hydrolysis on organic matter solubilization and anaerobic digestion of high solid sludge [J]. Chemical Engineering Journal, 2015,264:174-180.
[13] Wang F, Hidaka T, Tsuno H, et al. Co-digestion of polylactide and kitchen garbage in hyperthermophilic and thermophilic continuous anaerobic process [J]. BioresourceTechnology, 2012, 112:67-74.
[14] Ahring B K, Ibrahim A A, Mladenovska Z. Effect of temperature increase from 55 to 65℃ on performance and microbial population dynamics of an anaerobic reactor treating cattle manure [J]. Water Research, 2001,35(10):2446-2452.
[15] Lee M, Hidaka T, Hagiwara W, et al. Comparative performance and microbial diversity of hyperthermophilic and thermophilic co-digestion of kitchen garbage and excess sludge [J]. BioresourceTechnology, 2009,100(2):578-585.
[16] 戴晓虎,何 进,严 寒,等.游离氨调控对污泥高含固厌氧消化反应器性能的影响 [J]. 环境科学, 2017,38(2):679-687.
[17] Lee C K, Barbier B A, Bottos E M, et al. The Inter-Valley soil comparative survey: the ecology of dry valley edaphic microbial communities [J]. Isme Journal, 2012,6(5):1046-57.
[18] Pires A C C, Cleary D F R, Almeida A, et al. Denaturing gradient gel electrophoresis and barcoded pyrosequencing reveal unprecedented archaeal diversity in mangrove sediment and rhizosphere samples [J]. Applied and Environmental Microbiology, 2012, 78 (16):5520-5528.
[19] Krakat N, Westphal A, Satke K, et al. The microcosm of a biogas fermenter: comparison of moderate hyperthermophilic (60℃) with thermophilic (55℃) conditions [J]. Engineering in Life Sciences, 2010,10(6):520-527.
[20] Khalid A, Arshad M, Anjum M, et al. The anaerobic digestion of solid organic waste [J]. Waste Management, 2011,31(8):1737-1744.
[21] Lepistö S S, Rintala J A. Thermophilic anaerobic digestion of the organic fraction of municipal solid waste: start-up with digested material from a mesophilic process [J]. Environmental Technology, 1995,16(2):157-164.
[22] Fukuzaki S, Nishio N, Shobayashi M, et al. Inhibition of the fermentation of propionate to methane by hydrogen, acetate, and propionate [J]. Applied and Environmental Microbiology, 1990, 56(3):719-723.18.
[23] Wu W M, Bhatnagar L, Zeikus J G. Performance of anaerobic granules for degradation of pentachlorophenol [J]. Applied and Environmental Microbiology, 1993,59(2):389-397.
[24] Ahring B K, Westermann P. Product inhibition of butyrate metabolism by acetate and hydrogen in a thermophilic coculture [J]. Applied and Environmental Microbiology, 1988,54(10):2393-2397.
[25] Van Lier J B, Grolle K C, Frijters C T, et al. Effects of acetate, propionate, and butyrate on the thermophilic anaerobic degradation of propionate by methanogenic sludge and defined cultures [J]. Applied and Environmental Microbiology, 1993, 59(4):1003-1011.
[26] Park Y J, Tsuno H, Hidaka T, et al. Evaluation of operational parameters in thermophilic acid fermentation of kitchen waste [J]. Journal of Material Cycles and Waste Management, 2008,10(1): 46-52.
[27] Ahring B K, Angelidaki I, Johansen K. Anaerobic treatment of manure together with industrial waste [J]. Water Science and Technology, 1992,25(7):311-318.
[28] Gao S, Zhao M, Chen Y, et al. Tolerance response to in situ ammonia stress in a pilot-scale anaerobic digestion reactor for alleviating ammonia inhibition [J]. BioresourceTechnology, 2015, 198:372-379.
[29] Borja R, Rincon B, Raposo F, et al. Mesophilic anaerobic digestion in a fluidised-bed reactor of wastewater from the production of protein isolates from chickpea flour [J]. Process Biochem., 2004,39:1913–1921.
[30] Raposo F, Borja R, Martín M A, et al. Influence of inoculum–substrate ratio on the anaerobic digestion of sunflower oil cake in batch mode: process stability and kinetic evaluation [J]. Chem. Eng. J. 2009,149:70–77.
[31] Yokoyama H, Wagner I D, Wiegel J. Caldicoprobacteroshimai gen. nov., sp. nov., an anaerobic, xylanolytic, extremely thermophilic bacterium isolated from sheep faeces, and proposal of Caldicoprobacteraceae fam. nov [J]. International Journal ofSystematic and Evolutionary Microbiology, 2010,60(1):67-71.
[32] Koeck D E, Wibberg D, Maus I, et al. Complete genome sequence of the cellulolytic thermophile Ruminoclostridiumcellulosi wild-type strain DG5isolated from a thermophilic biogas plant [J]. Journal of Biotechnology, 2014,188:136-137,23.
[33] Sun W, Yu G, Louie T, et al. From mesophilic to thermophilic digestion: the transitions of anaerobic bacterial, archaeal, and fungal community structures in sludge and manure samples [J]. Applied Microbiology and Biotechnology, 2015,99(23):10271-10282.
[34] Etchebehere C, Pavan M E, Zorzopulos J, et al. Coprothermobacter platensis sp. nov., a new anaerobic proteolytic thermophilic bacterium isolated from an anaerobic mesophilic sludge [J]. International Journal of Systematic and Evolutionary Microbiology, 1998,48(4):1297-1304.
[35] Cai H, Gu J, Wang Y. Protease complement of the thermophilic bacterium Coprothermobacter proteolyticus [J]. Proceeding of the International Conference on Bioinformatics and Computational Biology BIOCOMP, 2011,11:18-21.
[36] Liao W, Liu Y, Wen Z, et al. Studying the effects of reaction conditions on components of dairy manure and cellulose accumulation using dilute acid treatment [J]. Bioresource Technology, 2007,98(10):1992-1999.
[37] Kobayashi T, Li Y Y, Harada H. Analysis of microbial community structure and diversity in the thermophilic anaerobic digestion of waste activated sludge [J]. Water Science and Technology, 2008,57(8):1199-1205.
[38] Cheon J H, Hidaka T, Mori S, et al. Applicability of random cloning method to analyze microbial community in full-scale anaerobic digesters [J]. Journal of Bioscience and Bioengineering, 2008,106(2):134-140.
[39] Tandishabo K, Nakamura K, Umetsu K, et al. Distribution and role of Coprothermobacter spp. in anaerobic digesters [J]. Journal of Bioscience and Bioengineering, 2012,114(5):518-520.
[40] Bouanane-Darenfed A, Fardeau M L, Grégoire P, et al. Caldicoprobacter algeriensis sp. nov., a new thermophilic anaerobic, xylanolytic bacterium isolated from an algerian hot spring [J]. Current Microbiology, 2011,62(3):826-832.
[41] Bouacem K, Bouanane-Darenfed A, Boucherba N, et al. Partial characterization of xylanase produced by Caldicoprobacter algeriensis, a new thermophilic anaerobic bacterium isolated from an algerian hot spring [J]. Applied Biochemistry and Biotechnology, 2014,174(5): 1969-1981.
[42] Ravachol J, Borne R, Meynial-Salles I, et al. Combining free and aggregated cellulolytic systems in the cellulosome-producing bacterium Ruminiclostridiumcellulolyticum [J]. Biotechnology for Biofuels, 2015,8(1):1.
[43] Dumitrache A, Akinosho H, Rodriguez M, et al. Consolidated bioprocessing of Populus using Clostridium (Ruminiclostridium) thermocellum: a case study on the impact of lignin composition and structure [J]. Biotechnology for Biofuels, 2016,9(1):1.
[44] Ravachol J, de Philip P, Borne R, et al. Mechanisms involved in xyloglucan catabolism by the cellulosome-producing bacterium Ruminiclostridiumcellulolyticum [J]. Scientific Reports, 2016,6.
[45] Jung S Y, Kim H S, Song J J, et al. Kribbiadieselivorans gen. nov., sp. nov., a novel member of the family Intrasporangiaceae [J]. International Journal of Systematic and Evolutionary microbiology, 2006,56(10):2427-2432.
[46] Lee S D, Lee D W. Lapillicoccusjejuensis gen. nov., sp. nov., a novel actinobacterium of the family Intrasporangiaceae, isolated from stone [J]. International Journal of Systematic and Evolutionary Microbiology, 2007,57(12):2794-2798.
[47] Phitsuwan P, Tachaapaikoon C, Kosugi A, et al. A cellulolytic and xylanolytic enzyme complex from an alkalothermoanaerobacterium, Tepidimicrobium xylanilyticum BT14 [J]. Journal of Microbiology and Biotechnology, 2010, 20(5):893-903.
[48] Chachkhiani M, Dabert P, Abzianidze T, et al. 16S rDNA characterisation of bacterial and archaeal communities during start-up of anaerobic thermophilic digestion of cattle manure [J]. Bioresource Technology, 2004,93(3):227-232.
[49] Zeikus J G, Wolee R S. Methanobacterium thermoautotrophicus sp. n., an anaerobic, autotrophic, extreme thermophile [J]. Journal of Bacteriology, 1972,109(2):707-713.
[50] Kaster A K, Goenrich M, Seedorf H, et al. More than 200genes required for methane formation from H2and CO2and energy conservation are present in Methanothermobacter marburgensis and Methanothermobacter Thermautotrophicus [J]. Archaea, 2011,2011.
[51] Stams A J M. Metabolic interactions between anaerobic bacteria in methanogenic environments [J]. Antonievan Leeuwenhoek, 1994,66(1-3):271-294.
[52] Smith K S, Ingram-Smith C. Methanosaeta, the forgotten methanogen? [J]. Trends in Microbiology, 2007,15(4):150-155.
Start-up strategy for hyperthermophilic anaerobic digestion system of sewage sludge.
DAI Xiao-hu, YU Chun-xiao, LI Ning*, DONG Bin (State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 20092, China). China Environmental science, 2017,37(7):2527~2535
The feasibility of hyperthermophilic anaerobic digestion system of sewage sludge is evaluated in the study, which is conducted with biochemical methane potential experiments using thermophilic anaerobic digestate as inoculum and cow dung and dewatered sludge as substrate. The results show that:①the start-up of hyperthermophilic sludge anaerobic digestion system is practicable;②the accumulation of VFAs (particularly propionic acid) is easy to occur due to the acceleration of hydrolysis and acidification process under 65℃;③compared with mesophilic(37℃) and thermophilic (55℃) anaerobic digestion systems, the total gas production of hyperthermophilic (65℃) system is relatively lower, while the methane content is elevated significantly, even reaching 79.0%;④under hyperthermophilic (65℃) condition, the extremely thermophilic bacteria responsible for lignocellulose and protein degradation such as Coprothermobacter、Caldicoprobacter、Ruminiclostridiumwere dominant, the difference of which is due to the different substrate addition; hydrogenotrophic methanogens-Methanothermobacter accounted for nearly 96% of archaea in all the digesters. Thus, in the start-up period, the addition of cow dung can not only accelerate the accumulation of hyperthermophilic methanogens (Hydrogenotrophic methanogens), but also avoid the accumulation of VFAs, particularly the accumulation of propionic acids, ensuring successful start-up of the system.
hyperthermophilic;anaerobic digestion;start-up strategy;Methanothermobacter
X703.1
A
1000-6923(2017)07-2527-09
戴晓虎(1962-),男,江苏镇江人,教授,博士,主要研究方向为城市有机废弃物的处理与处置.发表论文120余篇.
2016-11-31
国家自然科学基金项目(51678429,51308402,51538008)
* 责任作者, 博士, lining@tongji.edu.cn
