乌梅提取物对纳米细菌致大鼠肾损伤的修复与拮抗结石生成的关系研究
2017-08-07夏剑锋谷江张永春刘淼董安涛杨锦春
夏剑锋,谷江,张永春,刘淼,董安涛,杨锦春
(贵州医科大学附属医院泌尿外科,贵阳550004)
乌梅提取物对纳米细菌致大鼠肾损伤的修复与拮抗结石生成的关系研究
夏剑锋,谷江,张永春,刘淼,董安涛,杨锦春
(贵州医科大学附属医院泌尿外科,贵阳550004)
目的构建纳米细菌(NB)致肾结石大鼠模型,观察乌梅提取物对早期肾损伤分子1(KIM-1)和骨桥蛋白(OPN)的影响,分析乌梅提取物对早期肾结石的治疗意义。方法从人上尿路结石分离并培养NB。将54只雄性SD大鼠随机分为空白组、诱石组和治疗组,采取尾静脉注射NB构建肾结石模型,以乌梅提取物干预模型,并在不同时期分批处死大鼠,实时PCR检测肾组织KIM-1 mRNA的表达,ELISA检测尿KIM-1浓度,HE染色观察肾组织结石晶体情况,并用免疫组化方法检测OPN表达。结果诱石组及治疗组肾结石模型大鼠出现肾小管扩张,肾小管结石晶体形成,早期KIM-1和OPN的表达升高,上述变化与NB的注射时间呈正相关,乌梅提取物可拮抗该类变化。结论乌梅提取物可能通过修复肾损伤减少肾结石形成,该机制可能与乌梅提取物对KIM-1、OPN的基因调节有关。
乌梅提取物;纳米细菌;肾结石;损伤修复
泌尿系结石是泌尿外科常见病,以肾结石为主,主要成分是草酸钙,具有复发率高的特点[1-2]。研究[3]发现,肾集合管、肾乳头细胞受到纳米细菌(nanobacteria,NB)的破坏损伤,并形成碳灰石晶核,成为结石核心基质,继而诱发结石形成。乌梅含多种有机酸,其中柠檬酸是纳米细菌矿化的显著抑制物[4],且乌梅在免疫损伤、氧化损伤中的修复作用逐渐被认识[5],故研究选取乌梅提取物作为治疗干预药物。同时,检测肾损伤分子1(kidney injury molecule-1,KIM-1)、骨桥蛋白(osteopontin,OPN)的早期变化,探寻其作为评估早期肾结石形成的预警指标价值。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器:兔抗大鼠多克隆抗体、多聚体抗兔IgG-HRP免疫组化试剂盒、DAB显色试剂盒、大鼠KIM-1 ELISA试剂盒(武汉博士德生物工程有限公司),Trizol裂解液、逆转录试剂盒和PCR Master-Mix(上海生工生物工程有限公司),柠檬酸含量测试盒(南京建成生物工程研究所),草酸检测试剂盒(北京中杉金桥生物技术有限公司),紫外可见光分光光度计[岛津仪器(苏州)有限公司],多功能酶标仪(Bio-tech公司)。
1.1.2 实验动物:健康雄性SD大鼠54只,体质量200~230 g,购于贵州医科大学实验动物中心,动物合格证编号为01201224。
1.2 方法
1.2.1 NB细菌的分离及培养:将收集的人上尿路结石经去矿物质处理(1 mol/L HCl,30 min)、中和(PBS)、碾碎、离心(20 000 r/min,40 min)、过滤(0.22 μm)等步骤,留取滤液加入含γ-FBS的PMBI1640中培养8周,培养条件为37℃、pH7.4、5% CO2和95%空气,30 d换液1次;以生理盐水(经上述相同步骤)作为阴性对照,每周记录NB的生长情况,留取培养出的NB混悬液。
1.2.2 动物分组及给药方法:大鼠适应性喂养3 d后,随机分为空白组、诱石组和治疗组,每组18只(6只/笼),其中,空白组第1日尾静脉注射生理盐水(1 mL/只),每日以生理盐水灌胃(2 mL/只);诱石组第1日尾静脉注射NB混悬液[6](1 mL/只),每日以生理盐水灌胃(2 mL/只);治疗组第1日尾静脉注射NB混悬液(1 mL/只),每日以乌梅提取物(0.15 g/mL,2 mL/只)悬液灌胃。标准鼠粮喂养,自由饮水。在乌梅给药的第1、2、4周后分别随机处死各组大鼠6只及留取肾,处死前收集大鼠24 h尿液。
1.2.3 检测指标:将一侧肾制成肾组织匀浆,实时PCR检测其KIM-1mRNA的表达水平。将留取的肾组织匀浆保存于Trizol中,按说明书操作提取总RNA,分别使用one-drop检测其浓度和凝胶电泳检测其完整性。取7 μL逆转录合成cDNA。引物序列为β-actin上游5’-TCATGAAGTGTGACGTTGA CATCCGT-3’,下游5’-CCTAGAAGCATTTGCGGTG CACGATG-3’,产物长度285 bp。KIM-1上游5’-TG GAGATTCCTGGATGGT-3’,下游5’-GAGGTG GAGACTCTGGTTGA-3’,产物长度175 bp。反应条件为94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,30个循环后,72℃5 min终止反应。反应结束后,以2.0%琼脂糖凝胶电泳成像。将另一侧肾以10%福尔马林固定,制备石蜡病理切片,HE染色观察肾组织结晶情况,以及应用免疫组化检测肾组织OPN表达程度,24 h尿液离心(3 000 r/ min,20 min,4℃)后送我院生化科检测尿Ca2+、尿Mg2+、尿酸(uric acid,UA)含量;采用Cr3+比色法和高锰酸钾褪色法测定尿柠檬酸(citric acid,CA)和草酸(oxalic acid,Oxa)含量;ELISA检测尿液KIM-1浓度。
1.3 统计学分析
应用SPSS 22.0软件进行统计学分析,结果以x±s表示,OPN表达强度数量比较采用秩和检验(Kruskal-Wallis H),其余数据均采用单因素方差(oneway ANOVN)分析,P<0.05为差异有统计学意义。
2 结果
2.1 24 h尿液生化指标
各组大鼠Ca2+、Mg2+、UA、Oxa、CA在尿液的含量如表1所示,诱石组和治疗组较空白组各项指标均有不同程度变化,其中尿Ca2+、UA和Oxa的排出量均增加,尿Mg2+排出量减少,诱石组CA显著下降,治疗组CA则明显上升。
2.2 大鼠肾结石模型形成结晶
喂养时间最长(第4周)的诱石组大鼠可见肾小管明显扩张,小管内形成结石晶体,且结晶较密集甚至链接成片堵塞小管;而治疗组结晶形成程度较诱石组轻,以散在不链接为主,见图1。
2.3 肾组织KIM-1mRNA的表达
以β-actin作内参,观察扩增后KIM-1mRNA表达水平,可见治疗组表达水平略低于诱石组,而空白组表达水平明显低于诱石组及治疗组,见图2。
2.4 大鼠尿液KIM-1含量变化
诱石组第1周KIM-1尿液浓度显著增加,约为空白组的3倍,其后随时间延长而逐渐增加;而治疗组在第1周的排出量也增加,但在第4周的排出量较第2周减少,治疗组的变化量较诱石组稍弱,见表2。
2.5 肾组织OPN免疫组化检测结果
OPN在3组肾小管均有表达(图3),以髓质肾小管为主,空白组只能检测到有微弱表达(+),而诱石组第1周就能检测到阳性表达,且随时间延长其表达强度逐渐增加(++~+++),在第2周之后即出现所有处死大鼠强阳性表达(P<0.05);治疗组亦检测到OPN的表达,但是表达明显弱于诱石组(+~++);OPN表达的大鼠数量(表3)第1周其Kruskal-Wallis H检验结果(P<0.05)提示,空白组、诱石组和治疗组的平均秩次分别为6.00、13.50和9.00,表明在第1周时,诱石组OPN表达最强,治疗组次之,空白组最低(+,肾小管胞质浅黄色;++,肾小管胞质黄色;+++,肾小管胞质黄色深染,能看到深棕色颗粒)。

表1 2 4 h尿液生化指标(x±s)Tab.1 Twenty-four-hour biochem ical indexes in urine(x±s)
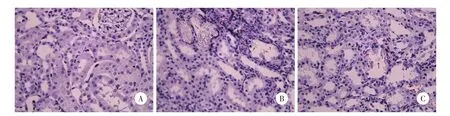
图1 肾小管草酸钙晶体HE×200Fig.1 Ca lcium oxa late crystal in renal tubular HE×200
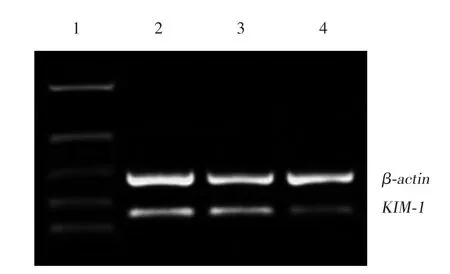
图2 各组大鼠第1周肾组织KIM-1 mRNA的表达水平Fig.2 The KIM-1 mRNA expression leve l in the renal tissue of rats on the first week
3 讨论
肾结石的最初形成需要结晶盐的析出、结石核心形成和肾小管上皮细胞提供可粘附的受创平面[7-8]。NB致肾结石产生的学说符合上述条件,NB在生理性钙磷浓度环境下可形成羟磷灰石碳酸盐结晶,从而形成结石核心,NB的毒性作用可导致细胞的空泡形成、组织炎症反应和肿胀[3]。本研究发现,各实验组可见肾小管扩张,结石晶体形成,随着NB浸染时间的延长,肾小管扩张程度增大,细胞出现空泡变性和坏死,管内结晶量也增多,该结果符合上述观点。乌梅富含多种能明显抑制结石形成的有机酸,其中柠檬酸是纳米细菌矿化的显著抑制物,而有机酸的协同作用能与钙离子螯合降低结石的形成[9]。同时,乌梅中多种有机酸的协同效应具有较强的抗氧化和抗免疫损伤作用,进而修复组织和细胞的损伤[10-11]。而本研究中尿生化指标的变化结果与柠檬酸抑制结石矿化、修复组织和细胞损伤的作用相符。
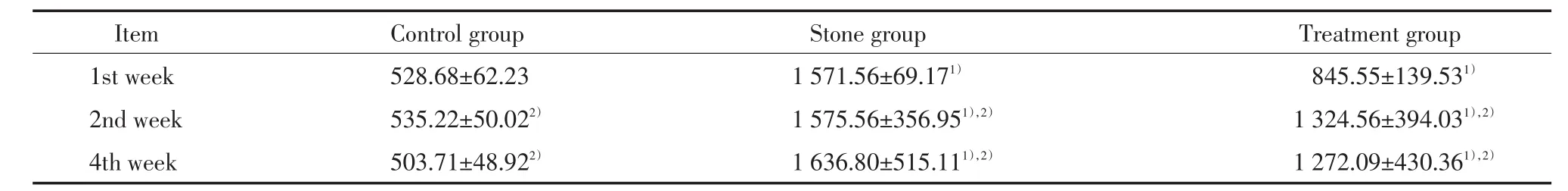
表2 空白组、诱石组和治疗组尿KIM-1含量(x±s,pg/m L)Tab.2 Urinary KIM-1 content in the control,stone and treatm ent groups(x±s,pg/m L)

图3 免疫组化染色检测OPN在肾小管的表达×200Fig.3 Immunohistochem ical staining of OPN in renal tubules×200

表3 不同时间点大鼠OPN蛋白表达强度的数量比较Tab.3 Com parison of the number o f OPN protein exp ression intensity at different tim e points
KIM-1是一种Ⅰ型跨膜糖蛋白,因其在尿液中稳定、不易变性[12],故KIM-1被认为是肾小管损伤与修复的生物学标记[13]。在本研究KIM-1的2组实验中,第1周肾组织KIM-1mRNA条带亮度诱石组高于空白组,诱石组尿KIM-1第1周出现高表达,表明KIM-1在结石形成的早期即出现了表达。根据研究[14-16]报道,KIM-1高表达会导致活性氧(reactive oxygen species,ROS)的增加,ROS的升高加剧了氧化应激,进一步造成肾小管细胞损伤,使草酸钙晶体在损伤肾小管细胞沉积并黏附聚集,并且肾小管细胞损伤增强了巨噬细胞的趋化作用,导致巨噬细胞浸润使KIM-1增加,而草酸钙晶体的沉积黏附又使肾小管细胞损伤进一步加重,这样恶性循环最终形成结石。
OPN是一种分泌型的磷酸化糖蛋白,主要在远端小管和集合管表达,与结石的形成密切相关[17]。本研究中,诱石组OPN在第1周出现阳性表达,并强于空白组和治疗组,说明OPN在结石形成的早期即出现了表达。有研究[17]表明,OPN能促进炎症发生,加速肾小管损伤,从而提供结晶附着位点,草酸钙沉积会诱导产生ROS[15],一水草酸钙(calcium oxalate monohydrate,COM)在ROS的作用下产生OPN和单核细胞趋化因子1(monocyte chemoattractant protein-1,MCP-1),而OPN和MCP-1对炎症均具有促进作用,进而导致形成结石[15,18];COM表面带正电荷,肾小管上皮细胞带负电荷,因电荷的相互作用加速了结石的形成[19]。
综上所述,乌梅提取物可能通过修复肾损伤减少肾结石形成,该机制可能与乌梅提取物对KIM-1、OPN的基因调节有关,KIM-1、OPN可作为早期肾结石形成的检测指标,为早期诊断结石形成和预防结石复发提供新的研究方向。
[1]DAGGULLI M,UTANGAC MM,DEDE O,et al.Potential biomarkers for the early detection of acute kidney injury after percutaneous nephrolithotripsy[J].Ren Fail,2015,38(1):1-6.DOI:10.3109/ 0886022X.2015.1073494.
[2]CAO Z,YU W,LI W,et al.Acute kidney injuries induced by various irrigation pressures in rat models of mild and severe hydronephrosis[J].Urology,2013,82(6):1453.e9-16.DOI:10.1016/j. urology.2013.08.024.
[3]WU CY,YOUNG L,YOUNG D,et al.Bions:a family of biomimetic mineralo-organic complexes derived from biological fluids[J]. PLoS One,2013,8(9):e75501.DOI:10.1371/journal.pone.00755 01.
[4]CIFTCIOGLU N,MILLERHJELLE MA,HJELLE JT,et al.Inhibition of nanobacteria by antimicrobial drugs as measured by a modified microdilution method[J].Antimicrob Agents Chemother,2002,46(7):2077-2086.DOI:10.1128/AAC.46.7.2077-2086. 2002.
[5]张保伟,赵志敏,李爱峰.乌梅丸对免疫损伤性大鼠肝纤维化α1(Ⅰ)型前胶原mRNA表达的影响[J].世界中西医结合杂志,2006,1(1):19-21.DOI:10.3969/j.issn.1673-6613.2006.01.009.
[6]ZENG J,FANG Y,WEI Z,et al.Association between dental pulp stones and calcifying nanoparticles[J].Int J Nanomedicine,2011,6(12):109-118.DOI:10.2147/IJN.S13267.
[7]LIESKE JC,TOBACK FG.Regulation of renal epithelial cell endocytosis of calcium oxalate monohydrate crystals[J].Am J Physiol,1993,264(2):800-807.
[8]BIGELOW MW,WIESSNER JH,KLEINMAN JG,et al.Calcium oxalate-crystal membrane interactions:dependence on membrane lipid composition[J].J Urol,1996,155(3):1094-1098.DOI:10.1016/ S0022-5347(01)66398-5.
[9]王萍,沈玉华,谢安建,等.乌梅提取液对草酸钙晶体生长的抑制作用研究[J].无机化学学报,2008,24(10):1604-1609.DOI:10.3321/j.issn:1001-4861.2008.10.009.
[10]邓婉婷,管淑玉,李瑶,等.乌梅总有机酸的提取优化工艺及其抗氧化活性研究[J].广东药学院学报,2015,31(2):171-175. DOI:10.3969/j.issn.1006-8783.2015.02.007.
[11]GE F,ZENG F,LIU S,et al.In vitro synergistic interactions of oleanolic acid in combination with isoniazid,rifampicin or ethambutol against Mycobacterium tuberculosis[J].J Med Microbiol,2010,59(5):567-572.DOI:10.1099/jmm.0.014837-0.
[12]FAHMY N,SENER A,SABBISETTI V,et al.Urinary expression of novel tissue markers of kidney injury after ureteroscopy,shockwave lithotripsy,and in normal healthy controls[J].J Endourol,2013,27(12):1455-1462.DOI:10.1089/end.2013.0188.
[13]徐维佳,牟姗.肾损伤分子-1:早期肾小管损伤与修复的生物学标记[J].中国中西医结合肾病杂志,2012(6):558-562.DOI:10.3969/j.issn.1009-587X.2012.06.033.
[14]KANDHARE AD,PATIL MV,BODHANKAR SL.l-Arginine attenuates the ethylene glycol induced urolithiasis in ininephrectomized hypertensive rats:role of KIM-1,NGAL,and Nos[J].Ren Fail,2015,37(4):1-13.DOI:10.3109/0886022X.2015.1011967.
[15]HONG SH,LEE HJ,SOHN EJ,et al.Anti-nephrolithic potential of resveratrol via inhibition of ROS,MCP-1,hyaluronan and osteopontin in vitro and in vivo[J].Pharmacol Rep,2013,65(4):970-979. DOI:10.1016/S1734-1140(13)71078-8.
[16]PENG J,LI D,CHAN YK,et al.Effects of water uptake on melamine renal stone formation in mice[J].Nephrol Dial Transplant,2012,27(6):2225-2231.DOI:10.1093/ndt/gfr577.
[17]VERNON HJ,CHRISTINE O,TZORTZAKI EG,et al.Aprt/opn double knockout mice:osteopontin is a modifier of kidney stone disease severity[J].Kidney Int,2005,68(3):938-947.DOI:10.1111/j.1523-1755.2005.00487.x.
[18]UMEKAWA T,TSUJI H,UEMURA H,et al.Superoxide from NADPH oxidase as second messenger for the expression of osteopontin and monocyte chemoattractant protein 1 in renal epithelial cells exposed to calcium oxalate crystals[J].BJU Int,2009,104(1):115-120.DOI:10.1111/j.1464-410X.2009.08374.x.
[19]ZUO L,TOZAWA K,OKADA A,et al.A paracrine mechanism involving renal tubular cells,adipocytes and macrophages promotes kidney stone formation in a simulated metabolic syndrome environment[J].J Urol,2014,191(6):1906-1912.DOI:10.1016/j.juro.2014.01.013.
(编辑于溪)
Effect of Fructus Mume Extract on Repair of Renal Injury Induced by Nanobacteria in Rats and Its Relationship with Antagonistic Stone Formation
XIA Jianfeng,GU Jiang,ZHANG Yongchun,LIU Miao,DONG Antao,YANG Jinchun
(Department of Urology,The Hospital Affiliated of Guizhou Medcial University,Guiyang 550004,China)
Objective To observe the early effect of Fructus mume extract on KIM-1 and OPN levels in rats with kidney stone formation induced by nanobacteria and to investigate the therapeutic significance of F.mume extract on early kidney stone formation.Methods Nanobacteria were separated and cultured from human upper urinary calculi.The study group appropriately included 54 healthy male SD rats.The renal calculus model was constructed by tail vein injection of nanobacteria.A kidney stone model was created with an F.mume extract intervention,and rats were killed at different stages of the intervention.Real-time polymerase chain reaction was used to detect the KIM-1mRNA expression in rat renal tissue,and the KIM-1 concentration in urine was detected by using enzyme-linked immunosorbent assay.We detected kidney tissue stone crystals and OPN expression by using hematoxylin-eosin staining and immunohistochemistry.Results Renal tubules of the experimental model were significantly expanded,thatis,the formationof renal tubularstones.Theearly KIM-1and OPNexpression levelswere increased.Theabove-mentioned changespositively correlated with the injection time of the nanobacteria,and F.mume extract antagonized the changes.Conclusion F.mume extract may be useful for the repairofrenalinjury to reducekidney stone formation,whichmaybe related to thegene regulationofKIM-1and OPN.
fuctus mume extract;nanobacteria;kidney stones;injury repair
R692.4
A
0258-4646(2017)07-0640-05
10.12007/j.issn.0258-4646.2017.07.015
贵阳市科技计划(2014100145)
夏剑锋(1989-),男,硕士研究生.
谷江,E-mail:gj0851@Gmail.com
2016-11-09
网络出版时间:
