槲皮素PLGA-TPGS纳米粒在荷HCa-F细胞小鼠体内肝靶向性的研究
2017-08-07徐红高萌关欣董浩刘颖涵金小涵张成鸿田燕
徐红,高萌,关欣,董浩,刘颖涵,金小涵,张成鸿,田燕
(大连医科大学1.基础医学院机能学实验室;2.药学院药剂学教研室;3.2015级八年制临床医学专业,辽宁大连116044)
槲皮素PLGA-TPGS纳米粒在荷HCa-F细胞小鼠体内肝靶向性的研究
徐红1,高萌2,关欣2,董浩2,刘颖涵3,金小涵3,张成鸿1,田燕2
(大连医科大学1.基础医学院机能学实验室;2.药学院药剂学教研室;3.2015级八年制临床医学专业,辽宁大连116044)
目的评价槲皮素(QT)/香豆素6(C6)乳酸羟基乙酸共聚物-水溶性维生素E纳米粒(QCPTN)在荷肝癌细胞HCa-F异位实体瘤小鼠体内的分布及对小鼠肝脏的靶向性。方法建立RP-HPLC法测定QT在荷肝癌细胞HCa-F异位实体瘤小鼠血浆及肝、实体瘤、脾、肺、肾和心的浓度。将QCPTN和QT溶液(QTS)经小鼠尾静脉注射后,测定不同给药时间后小鼠血浆及各组织中的QT浓度。采用相对靶向效率(Re)和靶向效率(Te),同时通过对各组织进行冰冻切片、荧光倒置显微镜下观察荧光纳米粒QCPTN在各组织的分布,定性、定量地全面评价QCPTN对肝脏的靶向性。结果QCPTN在血浆、实体瘤、脾、肺、肾、心中的Te均>3,表明QT在肝脏比血浆和其他组织匀浆中的曲线下面积(AUC)高3倍以上。冰冻切片图可见在1 h的QCPTN组小鼠各组织中,肝中荧光分布面积最大。结论QCPTN对荷肝癌细胞HCa-F异位实体瘤小鼠肝脏有良好的靶向作用。
槲皮素/香豆素6乳酸羟基乙酸共聚物-水溶性维生素E纳米粒;小鼠;实体瘤;体内;肝;靶向性
槲皮素(quercetin,QT),化学名为3,5,7,3’,4’-五羟基黄酮,分布在近百种中草药或其他植物的花、叶、果实中,具有抗炎、抗病毒、降糖、降压及抗肝癌等作用[1-5]。
纳米粒(nanoparticles,NPs)是常用的靶向给药载体,在抗肿瘤方面具有一定的优势[6]。本研究以QT为模型药物,以自制高分子材料乳酸羟基乙酸共聚物-维生素E聚乙二醇1000琥珀酸酯(polylacticco-glycolic acid-D-α-tocopherol polyethylene glycol 1000 succinate,PLGA-TPGS)为载体[7-8],制备同时包载QT和香豆素6(coumarin-6,C6)的荧光纳米粒槲皮素/香豆素6 PLGA-TPGS纳米粒(QT/C6-loaded PLGA-TPGS nanoparticles,QCPTN),在前期研究中已经测得QCPTN平均粒径为(193.6±2.8)nm,Zeta电位为(-23.1±1.4)mV(n=3),易被动靶向于肝脏[6],同时由于载体材料中的TPGS可以改善纳米粒的渗透性[9],可使QCPTN更好地实现对肝癌的治疗作用。
本研究在此基础上,建立荷小鼠腹水型高淋巴道转移肝癌细胞HCa-F异位移植实体瘤模型,定量、定性地全面评价QCPTN在荷瘤小鼠体内对肝脏的靶向性。
1 材料与方法
1.1 材料
1.1.1 仪器:HM500冰冻切片机(德国Microm International GmbH公司);Olympus IX81荧光倒置显微镜(日本Olympus公司);1200高效液相色谱仪(美国Agilent公司);Sorvall ST 16R台式离心机(美国Thermo Fisher公司,离心半径为13.5 cm);MS105DU电子天平(瑞士梅特勒托利多有限公司,0.01 mg)。
1.1.2 药品与试剂:QT对照品(中国药品生物制品检定所,批号为100081-200907,纯度99%);QT(美仑生物公司,批号为20140105,纯度96%);QCPTN(药剂学教研室自制,批号为20140510,规格:105 mg/g);香兰素(分析纯,北京化学试剂公司,批号为010901,纯度99%);乙腈(色谱纯,美国Tedia公司,批号为14015027)。
1.1.3 实验动物:健康8周昆明种小鼠(SPF级),体质量20~25 g,由大连医科大学实验动物中心提供,许可证号为SCXK(辽)2008-0002。
1.2 方法
1.2.1 体内测定QT的色谱条件:色谱柱为Hypersil C18(4.6 mm×250 mm,5 μm);检测波长为360 nm;流速为0.8 mL/min;流动相为乙腈-0.03%磷酸水溶液(33∶67);柱温为30℃;进样量为20 μL。
1.2.2 小鼠HCa-F肝癌模型建立:常规方法将冻存的HCa-F细胞复苏后,用台盼蓝染色计数法计活细胞数,用无菌生理盐水调整细胞浓度约为3×107/mL,取200 μL细胞悬液进行小鼠腹腔注射,1周后小鼠腹部微微隆起,即得腹水。无菌条件下抽取小鼠腹水,调整细胞浓度为(2~2.3)×107/mL,注射在小鼠的腋下(0.01 mL/g),10 d左右腋下可见明显的实体瘤,用游标卡尺测量小鼠肿瘤的长径,选取长径在12~15 mm范围内的荷瘤小鼠备用。
1.2.3 生物样品的预处理:从小鼠的心尖取血。按1∶9的比例加入浓度为109 mmol/L的枸橼酸钠抗凝,5 000 r/min离心10 min,取出上层血浆;同时取出小鼠的肝脏、实体瘤、脾脏、肺脏、肾脏、心脏,分别精密称重,加入4倍量的生理盐水后研磨成匀浆,备用。
1.2.4 生物样品中QT含量的测定:
1.2.4.1 QT和香兰素对照贮备液的配制精密称取干燥至恒重的QT对照品5.0 mg,用甲醇溶解、定容至50 mL,配成浓度为100 μg/mL的QT对照贮备液。精密称取香兰素对照品25.0 mg,加甲醇溶解、定容至10 mL中,配成浓度为2.5 mg/mL的内标对照贮备液,4℃贮存备用。
1.2.4.2 QT系列浓度对照溶液的配制精密量取QT对照贮备液5、20、40、80、160、320、640 μL于10 mL量瓶中,分别加入香兰素内标对照贮备液100 μL,加甲醇定容至刻度,配成浓度为0.5、2.0、5.0、8.0、16.0、32.0、64.0 μg/mL的QT系列对照品溶液(含香兰素25.0 μg/mL),4℃贮存备用。
1.2.4.3 QT标准曲线的绘制称取1.2.3项下制备的血浆及各组织匀浆400 μL,置5 mL离心管中,分别加入QT系列浓度对照品溶液100 μL,涡旋1 min混合均匀,加入乙酸乙酯2 mL萃取,涡旋混合1 min,10 000 r/min离心10 min。分离出有机层并用氮气流吹干,残留物加入甲醇0.1 mL复溶,涡旋1 min后,按1.2.1项下色谱条件测定。
1.2.4.4 绝对回收率试验精密量取QT对照贮备液0.12、1.0、5.0 mL置10 mL量瓶中,分别加入香兰素内标对照贮备液100 μL,用甲醇定容至刻度,配成浓度为1.2、10.0、50.0 μg/mL的低、中、高3个浓度的样品溶液(含香兰素25.0 μg/mL),按1.2.1项下色谱条件测定峰面积比A1。精密量取按1.2.3项下制备的血浆及各组织匀浆400 μL 9份,分别精密加入上述样品溶液100 μL,按1.2.4.3项下方法处理,配成低(1.2 μg/mL)、中(10.0 μg/mL)、高(50.0 μg/mL)3个浓度的生物样品溶液各3份,按照1.2.1项下色谱条件测定峰面积比A2。
1.2.4.5 相对回收率试验精密量取1.2.3项下制备的血浆及各组织匀浆400 μL 9份,按1.2.4.3项方法配成低(1.2 μg/mL)、中(10.0 μg/mL)、高(50.0 μg/mL)3个浓度的生物样品溶液各3份。按照1.2.1项下色谱条件测定峰面积。
1.2.5 QT在小鼠体内的肝靶向性评价:小鼠体内给药方案如下,将实体瘤长径在12~15 mm范围内的荷瘤小鼠随机分为2组,禁食12 h后,取3只颈椎脱位法处死,剖取每只小鼠的肝脏、实体瘤、脾脏、肺脏、肾脏、心脏,分别在-80℃冰箱中冻存20 min,作为冰冻切片的空白对照,其余进行尾静脉注射给药。(1)QCPTN组98只,根据小鼠体质量,尾静脉注射给予10 mg/kg(以QT计)的QCPTN[自制,批号为20150410,规格为105 mg/g,用20%(V/V)PEG400生理盐水溶液分散,并在100 W冰水浴中超声1 min];(2)QTS组80只,根据小鼠体质量,经尾静脉按10 mg/kg的剂量注射浓度为1 mg/mL的QT溶液(精密称取QT原料药10 mg,置10 mL量瓶中,加20% PEG400的生理盐水溶液溶解、定容至10 mL,得浓度为1 mg/mL的QT溶液)。分别于给药0.08(即5 min)、0.5、1、2、4、8、12、24 h时每组各处死10只小鼠,按1.2.3项下处理生物样品,得到各时间点下的样品溶液。将各时间点下的样品溶液按照1.2.4.3项下方法测定峰面积。另取QCPTN组在0.5、1、2、4、8、12 h时的小鼠各3只,分别用颈椎脱位法处死,剖取每只小鼠的肝脏、心脏、脾脏、肺脏、肾脏、实体瘤,分别在-80℃冰箱中冻存20 min后取出,用冰冻切片机进行冰冻切片,每个组织厚度为7 μm,在荧光倒置显微镜下观察各组织在不同时间点的冰冻切片。
1.3 统计学分析
应用SPSS 13.0统计软件进行统计分析,数据用x±s表示,2组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 生物样品中QT含量的测定
2.1.1 体内测定QT的色谱条件:在1.2.1色谱的条件下,QT及其他各组分峰与内标物香兰素(1.0 μg/mL)色谱峰能达到基线分离,空白小鼠血浆和各组织匀浆对样品的测定均无干扰,保留时间分别为7.1 min、5.1 min,理论板数按QT峰计算不低于3 000,其血浆和各组织匀浆的色谱图见图1。
2.1.2 QT的标准曲线:以QT与香兰素峰面积(A)的比值对浓度C进行线性回归,得到血浆及各组织匀浆中QT的标准曲线方程,见表1。结果表明,QT在血浆及各个组织匀浆中0.5~64.0 μg/mL范围内线性关系良好。以信噪比(signal to noise ratio,S/N)=3及S/N=10作为QT的检测限与定量限,测得二者分别为0.3 μg/mL与0.5 μg/mL。
2.1.3 绝对回收率和相对回收率试验:根据1.2.4.4方法测定低、中、高3个浓度的样品溶液的峰面积,再根据公式:绝对回收率(%)=A2/A1×100计算。结果表明,3个浓度的绝对回收率均>80%,RSD值均<3.0%,表明此法用于提取QT的效率高。根据
1.2.4.5 方法测定低、中、高3个浓度的样品溶液的峰面积,再根据相对回收率公式[相对回收率(%)=测得量/加入量×100]计算。结果测得3个浓度的相对回收率RSD均<3.0%,表明此法用于测定QT在血浆及各组织中的含量准确度好。
2.2 QT在小鼠体内的分布
将各时间点下的样品溶液按照1.2.4.3项下方法测定,QCPTN组和QTS组各时间点QT在血浆和各组织匀浆中的药物浓度见图2。结果测得QCPTN经尾静脉注射后,QT在小鼠血浆中缓慢释放至4 h,在肝脏中可达到24 h;而QTS经尾静脉注射后测得QT在小鼠血浆和肝脏中只能滞留约2 h,表明NPs能有效延长QT在小鼠肝脏中的滞留时间,也明显提高了QT在肝脏中的浓度。QCPTN在整个考察时间范围内1 h时在肝脏中的浓度达到最大值。另外QCPTN的QT在实体瘤中的滞留时间也达到24 h,但是各时间点测得的QT浓度比相应的肝中的浓度低,差异有统计学意义(P<0.05或P<0.01)。
2.3 药物浓度法评价QCPTN的肝靶向性
用梯形法计算0~24 h QT在小鼠血浆及各组织匀浆中的药物浓度-时间曲线下面积(area under the concentration-time curve,AUC0~24h)。采用相对靶向效率(relative targeting efficiency,Re)、靶向效率(targeting efficiency,Te)评价QCPTN对肝脏的靶向性。
2.3.1 Re的评价:Re是指尾静脉注射载药纳米粒QCPTN(T)和游离药物QTS(S)后,各器官AUC的比值,即Re=AUCT/AUCS,见表1。肝脏的Re值最大,是QTS的50.8倍,表明QCPTN具有较大的肝靶向性。
2.3.2 Te的评价:Te是指给予小鼠QCPTN或QTS后,靶器官(肝脏)与各非靶器官(脾脏、肺脏、心脏、肾脏、实体瘤)的AUC之比,即Te=AUC靶器官/ AUC非靶器官,见表2。QCPTN经尾静脉注射后,各组织中的Te值均远高于相应的药物溶液,同时QCPTN在肝脏中的AUC较其他组织匀浆的AUC高,表明QCPTN对肝脏有很好的靶向性作用。
2.4 冰冻切片法评价QCPTN的肝靶向性

图1 QT的反相高效液相色谱图Fig.1 RP-HPLC images o f QT
在荧光倒置显微镜下观察各组织在不同时间点的冰冻切片,各正常组织没有显现任何荧光,其中不同组织1 h时的典型切片图结果见图3。显绿色荧光的区域在肝脏中最大,其次是肺脏、脾脏、实体瘤,最后是肾脏和心脏。表明QCPTN静脉注射后对肝脏有较好的靶向性,而在心脏、肾脏中分布很少;同时各个组织(实体瘤除外)中都是1 h时荧光最强,QCPTN在该时间时在组织中分布的最多,这与用血药浓度法测定小鼠体内的AUC和Cmax是一致的。二者结合,能更直观形象定性、定量的表明QCPTN对小鼠肝脏具有较强的靶向性。
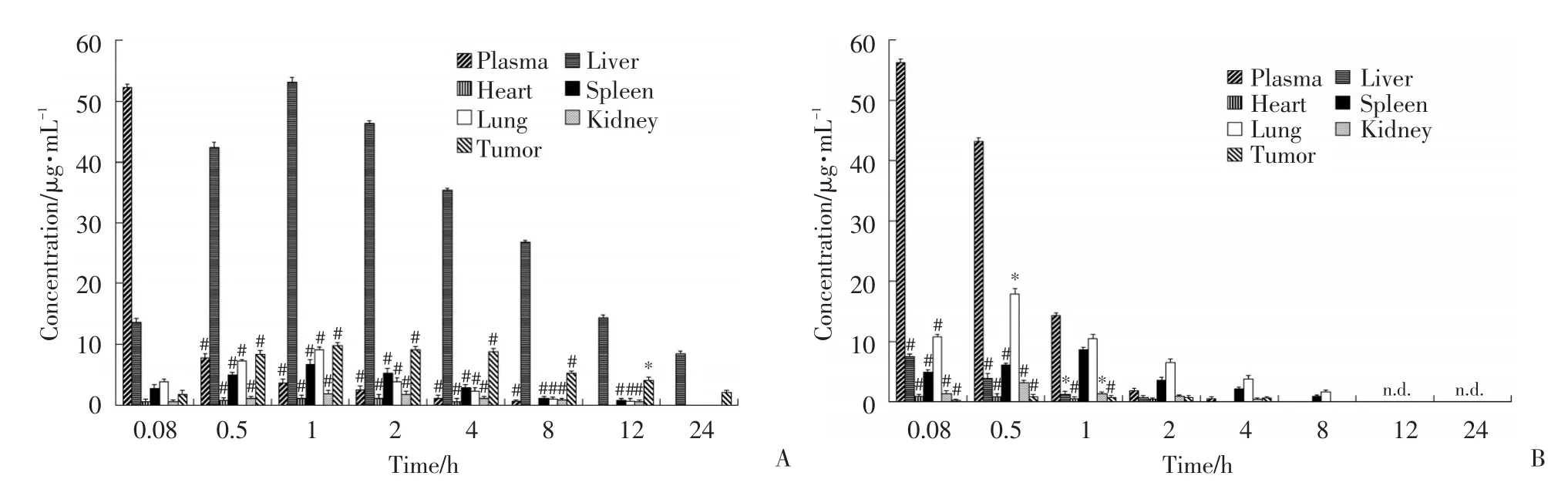
图2 荷实体瘤小鼠注射QCPTN和QTS后,QT在血浆和各组织匀浆中的浓度(x±s,n=10)Fig.2 Concentration of QT in plasma and different tissues of solid tumor-bearing m ice injected w ith QCPTN and QTS(x±s,n=10)

表1 QT在荷实体瘤小鼠血浆和各组织匀浆中的AUC和Re(n=10,x±s)Tab.1 AUC and Re values o f QT in p lasma and different tissues o f solid tum or-bearing m ice(n=10,x±s)

表2 荷实体瘤小鼠尾静脉注射QCPTN和QTS后的Te值Tab.2 Te va lues of both,QCPTN group and QTS group in solid tumor-bearing m ice a fter intravenous adm inistration in the tail
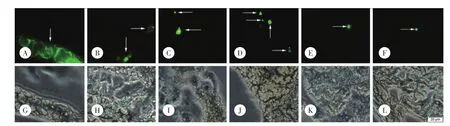
图3 QCPTN组荷实体瘤小鼠给药1 h后各组织的冰冻切片荧光显微镜图×200Fig.3 Fluorescence m icroscopy im ages of frozen slices o f different tissues from the so lid tum or-bearing m ice injected w ith QCPTN at 1 h×200
3 讨论
由于药物被包载到纳米粒载体内部,药物的理化性质被隐藏,因此其在体内的转运过程依赖于载体的理化特性,一定程度上可改善水溶性差药物的体内吸收。通过将纳米粒与荧光标记物结合,利用显像方法观察药物在体内转运过程,可实现对药物体内吸收进行实时监测的目的[10]。常用的脂溶性荧光染料C6是一种激光转化率较高、性能比较稳定的荧光标记物,有文献[10]报道包载0.05%C6的纳米粒在荧光显微镜下即能观察到较强烈的荧光,并可用HPLC进行定量测定[11-12]。由于模型药物QT无荧光,故无法直观地观察QT纳米粒在小鼠体内的分布情况。本研究首次制备同时包载QT和荧光标记物C6的QCPTN,采用血药浓度测定和冰冻切片观察相结合的方法,定量、定性地全面评价QCPTN在小鼠体内对肝脏的靶向性。本研究采用荷瘤小鼠模型考察QCPTN在其体内对肝脏的靶向性,由于实体瘤是长在小鼠的腋下,该处血流比肝脏中小,但淋巴循环相对丰富,又由于肿瘤细胞有较强的吞噬能力,肿瘤等病变组织中血管丰富且形态不规则,血管内皮细胞的间隙远大于正常组织内皮细胞的间隙,纳米粒更易渗入肿瘤毛细血管壁的间隙并被肿瘤细胞摄取进入细胞内部,同时由于淋巴回流系统不完善导致淋巴回流受阻,因而QCPTN会在肿瘤组织聚集,故24 h内在实体瘤中分布比肝脏中少,但比相应的其他器官中多,而QTS中的QT在实体瘤中持续分布仅约4 h。
本研究制备的QCPTN使QT在肝脏和血浆中维持时间明显延长,在肝脏中的浓集作用明显加强,这是QCPTN的缓释效应和肝靶向性所致。在血浆中QCPTN组的QT可维持到4 h,而QTS组仅能维持到2 h;在肝脏中QCPTN组可维持到24 h,而QTS组也只能维持到2 h。冰冻切片中各时间点时C6荧光强度与用QCPTN靶向性评价参数在小鼠体内的Cmax是一致的,表明纳米粒在小鼠体内1 h左右就可以多数分布聚集在肝脏细胞中,然后随着材料的部分溶解和降解缓慢的将QT释放出来,更好地发挥其对肝癌的治疗作用。
[1]张志琴,朱双雪.槲皮素的药理活性与临床应用研究进展[J].药学研究,2013,32(7):400-403.
[2]舒毅,谭陶,张思宇,等.槲皮素的药理学研究进展[J].华西药学杂志,2008,23(6):689-691.
[3]TAN J,WANG B,ZHU L.Regulation of survivin and Bcl-2 in HepG2 cell apoptosis induced by quercetin[J].Chem Biodivers,2009,6(7):1101-1110.DOI:10.1002/cbdv.200800141.
[4]DAJAS F.Life or death:neuroprotective and anticancer effects of quercetin[J].J Ethnopharmacol,2012,143(2):383-396.DOI:10.1016/j.jep.2012.07.005.
[5]赵旭林,徐国昌,贺利民,等.槲皮素诱导人肝癌HepG2细胞凋亡的实验研究[J].实用心脑肺血管病杂志,2010,18(3):310-311.
[6]方晓玲.药剂学[M].北京:人民卫生出版社,2007:370-371.
[7]LIONG M,LU J,KOVOCHICH M,et al.Multifunctional inorganic nanoparticles or imaging,targeting,and drug delivery[J].ACS Nano,2008,2(5):889-896.DOI:10.1021/nn800072t.
[8]LIU H,GAO M,XU H,et al.A promising emodin-loaded poly(lactic-co-glycolic acid)-d-α-tocopheryl polyethylene glycol 1000 succinate nanoparticles for liver cancer therapy[J].Pharm Res,2016,33(1):217-236.DOI:10.1007/s11095-015-1781-4.
[9]GUO Y,LUO J,TAN S,et al.The applications of Vitamin E TPGS in drug delivery[J].Eur J Pharm Sci,2013,49(2):175-186.DOI:10.1016/j.ejps.2013.02.006.
[10]PANYAMA J,SAHOO SK,PRABHA S,et a1.Fluorescence and electron microscopy probes for cellular and tissue uptake of poly(d,l-lactide-co-glycolide)nanoparticles[J].Int J Pharm,2003,262(1/2):1-11.DOI:10.1016/S0378-5173(03)00295-3.
[11]鲍旭,高萌,徐红,等.两种齐墩果酸纳米粒的体外细胞摄取研究[J].中国药房,2014,29(9):800-803.DOI:10.6039/j.issn.10 01-0408.2014.09.11.
[12]BAO X,GAO M,XU H,et al.A novel oleanolic acid-loaded PLGATPGS nanoparticle for liver cancer treatment[J].Drug Dev Ind Pharm,2015,41(7):1193-1203.DOI:10.3109/03639045.2014. 938081.
(编辑于溪)
Investigation of the Liver-targeting Properties of Quercetin-loaded PLGA-TPGS Nanoparticles in HCa-F Cell-bearing M ice
XU Hong1,GAO Meng2,GUAN Xin2,DONG Hao2,LIU Yinghan3,JIN Xiaohan3,ZHANG Chenghong1,TIAN Yan2
(1.Laboratory of Medical Function,College of Basic Medical Sciences,Dalian Medical University,Dalian 116044,China;2.Department of Pharmaceutics,College of Pharmacy,Dalian Medical University,Dalian 116044,China;3.Students at Grade 2015 in Clinical Medical Eight Grade,Dalian Medical University,Dalian 116044,China)
Objective The aim of this study was to investigate the distribution and liver-targeting properties of quercetin(QT)/coumarin 6(C6)-loaded polylactic-co-glycolic acid-D-α-tocopherol polyethylene glycol 1000 succinate(PLGA-TPGS)nanoparticles(QCPTN)in a hepatocarcinoma ectopic transplantation solid tumor model using HCa-F cell-bearing mice.Methods The QT concentrations in biological samples were determined using reverse phase-high performance liquid chromatography(RP-HPLC)analysis.After intravenous administration to mice in the QCPTN and QTS groups,the QT concentration in plasma and in different tissues was simultaneously analyzed at the different time points.Detection indexes(relative targeting efficiency,Re;targeting efficiency,Te)and fluorescence inversion microscopy images of the frozen tissue(liver,solid tumor,spleen,lungs,kidneys,and heart)slices were used for quantitatively and qualitatively evaluating the liver-targeting properties of QCPTN in solid tumor-bearing mice.Results Te of the QCPTN group in the plasma,liver,solid tumor,spleen,lungs,kidneys,and heart were all greater than 3,indicating that the area under the concentration-time curve(AUC)of liver was more than three times that of the plasma and other organs.Fluorescence inversion microscopy images showed that the green fluorescence of QCPTN was mostly observed in the liver.Conclusion Using HCa-F cellbearing mice,QCPTN was found to have better in vivo liver-targeting properties in hepatocarcinoma ectopic transplantation solid tumor.
quercetin/coumarin 6-loaded PLGA-TPGS nanoparticles;mice;solid tumor;in vivo;liver;targeting properties
R944.9
A
0258-4646(2017)07-0613-06
10.12007/j.issn.0258-4646.2017.07.009
辽宁省自然科学基金(2015020308)
徐红(1970-),女,实验师,本科.
田燕,E-mail:tiany2004@126.com
2016-12-08
网络出版时间:
