粘虫中肠总蛋白质双向电泳体系的优化方法
2017-08-02艾贤龙张雅林
艾贤龙,张雅林
粘虫中肠总蛋白质双向电泳体系的优化方法
艾贤龙,张雅林*
(西北农林科技大学植物保护学院,陕西杨凌 712100)
为了今后更好的利用双向电泳技术研究不同处理后粘虫Mythimnaseparata中肠蛋白表达差异,本研究比较了不同的蛋白提取方法、IPG胶条、二硫苏糖醇(DTT)浓度和等电聚焦条件,建立了适用于粘虫中肠总蛋白质的双向电泳体系。结果表明:采用Tris-饱和酚法提取蛋白质,选取pH为5-8的线性IPG胶条进行第一向等电点分离,按照DTT浓度I和等电聚焦程序II进行双向电泳分离,获得了蛋白质点数多、背景清晰、分辨率高的蛋白质双向电泳图谱。
粘虫;中肠;双向电泳;蛋白质
粘虫Mythimnaseparata是一种典型的季节性远距离迁飞性农业害虫,每年南北往返迁飞危害(王玉正和张孝羲,2001)。近年来,粘虫在中国的东北、华北、黄淮部分地区多次出现高密度集中危害情况,严重影响着玉米、小麦和水稻等粮食作物的食品安全(潘蕾等,2014)。中肠是昆虫的第二大组织,是消化道最主要的部分,昆虫的许多消化酶合成和分泌都是在中肠完成的。除此之外,中肠还是许多致病微生物、农药和天然毒素的靶标(Dow,1986)。对于昆虫中肠的研究,无论是对药物毒理探索,还是对昆虫抗药性研究都有十分重要的意义。利用蛋白质组技术研究昆虫中肠取得了一定的成果。Bt的作用受体是昆虫中肠内的氨肽酶(Am inopeptidase N,APN)(Knowles and Ellar,1986;Hofmannetal.,1988;RIEetal.,1989)。McNall和Adang(2003)利用双向电泳结合免疫印迹从烟草天蛾Manducasexta中肠上的Bt结合位点上鉴定出了肌动蛋白、氨肽酶N、和碱性磷酸酶(McNall and Adang,2003)。而Candas等利用蛋白质组学技术证实了昆虫对Bt抗性的产生与生理适应性是多层面的,包括蛋白修饰以及特定的幼虫中肠蛋白合成的变异(Candasetal.,2003)。
蛋白质组学研究的是一个组织或者细胞的蛋白表达情况,是一种准确鉴定高通量蛋白的方法,研究的关键技术包括双向电泳技术(2-DE)、质谱鉴定技术、核磁共振、蛋白质芯片、噬菌体展示技术、酵母双杂交系统、蛋白质组生物信息学等。其中双向电泳技术和质谱技术是当前分离鉴定蛋白质的两大支柱技术。在双向电泳中,要得到高分辨率、重复性好的2-DE图谱,样品制备是十分重要的一步(Wangetal.,2006),而不同的样品或者组织需要选择不同的蛋白制备方法。双向电泳第一向为等点聚焦,其原理是依靠蛋白质等电点来分离蛋白质,所使用的IPG胶条能够在等点聚焦的过程中保持稳定的pH梯度,从而使的带不同浄电荷的蛋白质有效分离,目前已经有不同范围的pH胶条可供选择(Sahabetal.,2005)。第一向等点聚焦程序的步骤分为:水化;除盐;升压;聚焦,选择最合适的程序有利于蛋白质分离。第二向为SDS-PAGE凝胶电泳分离,按照分子量大小分离蛋白质。碱性蛋白2-DE分离效果的提高一直是蛋白组学研究领域关注的问题(Görgetal.,1995;Roberts and van Oostrum,2002;Baeetal.,2003;Penningtonetal.,2004)。碱性蛋白是组织和细胞中重要的组成部分,研究碱性蛋白有重要的意义(曹晶等,2004),例如组蛋白、精蛋白和核糖体蛋白均属于碱性蛋白质(Wangetal.,2002)。在碱性条件下,DTT会干扰等点聚焦pH梯度,DTT带有负电荷,在等点聚焦过程中可能会跑出胶条,因此改变DTT浓度会改善碱性端蛋白分布。目前,尚未见到关于粘虫中肠蛋白质组学的报道,研究适宜的双向电泳条件需要大量的试验。
本研究通过探索不同的等点聚焦程序,不同的DTT浓度,不同的提取蛋白质方法以及不同pH梯度的胶条,建立了适用于粘虫中肠的双向电泳条件。
1 材料与方法
1.1 试剂和仪器
尿素、硫脲、CHAPS、二硫苏糖醇(DTT)、十二烷基硫酸钠(SDS)、考马斯亮蓝G-250、低熔点琼脂糖、碘乙酰胺、Tris-平衡酚均产于Solarbio公司。四甲基二乙胺(TEMED)和β-巯基乙醇产于MP Biomedicals公司。IPG胶条(17 cm,pH3-10,非线性)IPG胶条(17 cm,pH5-8,线性)40%Bio-lyte(pH 3-10)为Bio-Rad公司生产。溴酚蓝、牛血清蛋白、Tris-base、过硫酸铵、甘氨酸硫酸铵、蔗糖、EDTA、乙酸铵、磷酸二氢钾、磷酸氢二钾、氢氧化钠、氯化钠、丙酮、三氯醋酸(TCA)、30%Acr-bis、乙醇冰醋酸、磷酸、甘油为国产分析纯。
Infinite M 200 PRO型酶标仪(Tecan)、等电聚焦电泳仪(Bio-Rad)、垂直电泳仪(Bio-Rad)、彩色扫描仪(Umax)。
1.2 试虫处理
粘虫购自西北农林科技大学无公害农药研究中心,所有试虫喂食野燕麦叶片,饲养于25℃±2℃,50%相对湿度的环境中。挑选刚蜕皮的五龄幼虫提取中肠,以保证中肠内没有食物残留。提取出的中肠置于速冻管中在液氮中速冻、在-80℃冰箱中保存。
1.3 蛋白提取
1.3.1 磷酸抽提法
在研钵中加入组织和液氮,用液氮将组织研磨成极细的粉末,取出粉末置于Ep管中并迅速投入液氮中。将磷酸抽提缓冲液(2.6 mM KH2PO4, 32.5 mM K2HPO4, 400 mM NaCl, pH7.6)加入到Ep管中;在4℃、12000 g 离心10 min,保存沉淀;上清液继续15000 g离心10 min;吸掉脂肪层,收集上清至另一Ep管中,保存沉淀;两次沉淀合并后加入磷酸抽提缓冲液,冰上研磨后15000 g离心10 min,收集上清;沉淀中加入蛋白溶解缓冲液(2 M硫尿,8 M尿素,20 mM Trisbase, 4% CHAPS,30 mM DTT, 0.5% Bio-lyte),15000 g离心10 min 2次,收集上清;合并上清加入TCA,使其浓度达到10%,冰浴静置10 min;4℃,15000 g离心2次,弃上清液;沉淀加入蛋白溶解缓冲液冰上溶解、置于-80℃冰箱保存。
1.3.2 Tris-饱和酚法
研磨同1.3.1;在冰上加匀浆缓冲液(20 mM Tris-Hcl pH 7.5,250 mM蔗糖,10 mM EDTA,1 mM DTT,1% CHAPS,1 m Mβ-巯基乙醇)继续研磨成匀浆;加入等体积Tris-饱和酚,震荡30 min,-4℃ 15000 g离心20 min,取酚相;加入3倍体积含.01 M乙酸铵的甲醇溶液过夜沉淀蛋白;沉淀用甲醇溶液洗1次,用含有13 mM DTT的冷丙酮溶液洗2次,每次均在4℃,15000 g条件下离心15 min;在-20℃下冻干,使用时用蛋白溶解缓冲液(2 M硫尿,8 M尿素,20 mM Trisbase,4% CHAPS,30 mM DTT,0.5%Bio-lyte)溶解。
1.3.3 蛋白定量
利用Bradford方法进行蛋白浓度定量(Bradford,1976)。
1.4 胶条选择
选用两种IPG胶条:IPG胶条(17 cm,pH 3-10,非线性)和IPG胶条(17 cm,pH5-8,线性)。
1.5 双向凝胶电泳
1.5.1 第一向等点聚焦
在-20℃冰箱中取出水化上样缓冲液(7 M尿素, 4%CHAPS,0.001%溴酚兰,1% DTT/1.3% DTT,0.2% Bio-lyte)(DTT、Bio-lyte为用前加)溶解;取出蛋白样品冰上溶解后,4℃ 15000 g离心10 min;将水化上样缓冲液与样品以1∶4混合作为上样液;取出IPG胶条,室温溶解10 min;将上样液缓慢加入聚焦槽中,去除胶条保护膜,胶面朝下置于槽中,中间不能有气泡;滴加矿物油覆盖后置于双电电泳仪中,设定程序I(50 V主动水化16 h;250 V除盐30 min,线性;1000 V除盐30 min,线性;8000 V升压3 h,线性;8000 V聚焦83000 Vh,线性;500 V保持24 h)程序II(50 V主动水化14 h;250 V除盐30 min,500 V除盐30 min,线性;1000 V除盐30 min,线性;8000 V升压3 h,线性;8000 V聚焦75000 Vh,线性;500 V保持24 h);聚焦结束的胶条若不立即进行第二向电泳,则置于样品水花盘中,-20℃保存。
1.5.2 IPG胶条平衡和第二向SDS-PAGE电泳
组装灌胶模具,配制12.5%丙烯酰胺凝胶灌入已组装好的模具中,上部留1.5 cm左右的空间,用异丙醇封层;取出胶条使其溶解,用电泳缓冲液洗掉胶条表面矿物油,湿滤纸吸干多余液体;在水化盘中用胶条平衡缓冲液I(0.375 M Tris-Hcl(pH8.8),6 M尿素,2% SDS,20% 甘油,2% DTT/2.3% DTT)浸没胶条并且震荡15 min;胶条取出用电泳缓冲液洗净后置于胶条平衡缓冲液II(0.375 M Tris-Hcl(pH 8.8),6 M尿素,20%甘油,2% SDS,2.5%碘乙酰胺/2.9%碘乙酰胺)中浸没震荡15 min;结束后取出胶条,用电泳缓冲液洗净胶条,并用湿滤纸吸尽多余液体。
将胶条推入电泳模具使之与胶面完全贴合,在上方加入1-2 mL封胶液(0.5%低熔点琼脂糖,0.001%溴酚兰,1×电泳缓冲液);5 min后将其转入垂直电泳仪中,加入缓冲液设置程序(15 μA/根,30 min;25 μA/根,溴酚蓝到达底部边缘);电泳结束后,撬开玻璃板,取出凝胶板,切角做标记。
1.5.3 染色
将凝胶置于固定液(40%乙醇,10%醋酸)中在摇床上震荡4 h(速度适中);取出凝胶置于染色液((NH4)2SO48%,CBB G-250 0.08%,85%磷酸 1.6%,无水甲醇20%)中,震荡12 h;利用脱色液(乙醇23.75%,冰醋酸8%)将染好的胶脱色至背景干净。
1.5.4 扫描及图片分析
利用PowerLook 2100XL-USB彩色扫描仪扫描;每种方法进行三次重复,然后利用PDQuest 2-D Analysis Software计算蛋白点数,用GraphPad Prism 5进行蛋白点数分析。
2 结果与分析
2.1 不同等点聚焦程序
粘虫中肠蛋白经过不同的等点聚焦程序得到的2-DE图谱如图1所示,其中图A为程序I得到的结果,而图B为程序II得到的结果。程序I聚焦到了83000 Vh,图A中的横条纹与纵条纹较为严重,而且碱性端的蛋白点几乎没有成功分离,分子量在40 kDa-100 kDa蛋白点横向拖尾较为严重。程序II聚焦到75000 Vh,与图A相对比,图B的质量明显提高,横纵条纹减少了许多,碱性端可以看到成功分离的蛋白点,而且蛋白点的拖尾也有所改善。这说明聚焦到75000 Vh已经可以较好地分离蛋白点,到83000 Vh非但没有改善碱性端蛋白点图谱不清晰的问题,过度聚焦反而增加了横纵条纹。当然在这其中,程序II增加了500 V除盐的步骤,这也改善了盐离子对图谱的影响。如图2所示,不同的程序分别得到了1084个和1365个蛋白点,程序II的蛋白点明显多于程序I,进一步证实了程序II要优于程序I。
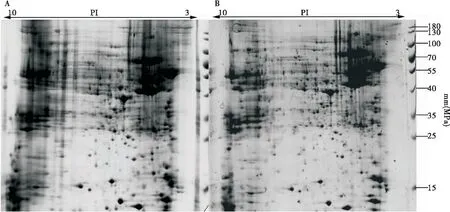
图1 不同电泳条件的2-DE图谱Fig.1 The 2-DE maps of different electrophoretic programs注:A,系统I;B,系统II。Note: A, program I; B, program II.
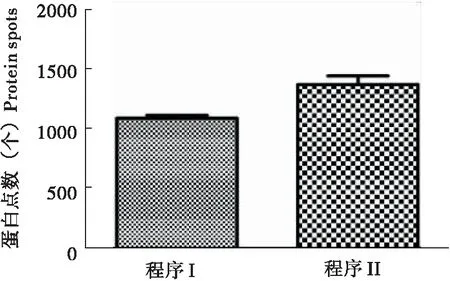
图2 不同电泳条件的蛋白点数Fig.2 Protein spots number of different electrophoretic programs

图3 不同DTT浓度的2-DE图谱Fig.3 2-DE maps of different DTT concentration注:A,DTT浓度I(上样缓冲液中为1%,平衡缓冲液中为2%);B,DTT浓度II(上样缓冲液中为1.3%,平衡缓冲液中为2.3%。Note: A, concentration I (1% DTT in loading buffer and 2% DTT in equilibration buffer);B, concentration II (1.3% DTT in loading buffer and 2.3% DTT in equilibration buffer).
2.2 不同浓度DTT
如图3所示,得到的2-DE图谱为在进行双向电泳时使用含不同浓度DTT,图A为浓度I(在上样缓冲液中为1%,在平衡缓冲液中为2%),图B为浓度II(在上样缓冲液中为1.3%,在平衡缓冲液中为2.3%)。图A的电泳图明显好于图B,图A的酸性端蛋白点没有发生图B中的拖尾现象,碱性端的蛋白点也较为清晰,而且图B的背景中条纹影响严重。这说明虽然DTT有利于得到更好的图谱,但是仅增加DTT浓度不能使图谱更清晰,即DTT的使用不能过量。如图4,对图谱分析后两张图分别检测到了1218个和1059个蛋白点,这也说明了高浓度DTT并未使2-DE图谱质量提高。
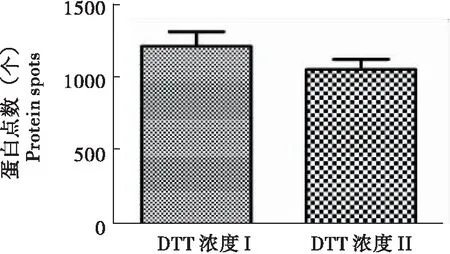
图4 不同DTT浓度的蛋白点数Fig.4 Protein spots number of different DTT concentration
2.3 不同PH梯度的IPG胶条
使用不同的IPG胶条得到了如图5所示结果,其中图A为PH 3-10的非线性胶条,图B为PH 5-8的线性胶条。图B中的蛋白点分布要更加均匀,背景更加清晰,图谱上没有大面积未分离的蛋白点。而图A中的酸性端蛋白点分离的较为理想,但碱性端蛋白并未完全分离开来,图中的横条纹较多,背景色也较重。从图A可以看出,蛋白分布基本上都在pH 4-8,更为重要的是在图B中,高丰度蛋白分离的同时,低丰度蛋白也显现的较多,而研究较多的往往是低丰度蛋白,所以对于粘虫中肠蛋白而言,选取pH 5-8的胶条更为合适。如图6,这2张图谱分别得到了1428个和1384个蛋白点,虽然pH 3-10图谱中的蛋白点比图pH 5-8的多,但后者的低丰度蛋白较多,说明要优先选取pH 5-8的胶条。

图5 不同PH条件下IPG胶条的2-DE图谱Fig.5 2-DE maps of IPG strips in different PH注:A,pH 3-10,非线性;B,pH 5-8,线性。Note: A: pH 3-10, L;B: pH 5-8, NL.

图6 不同PH胶条的蛋白点数Fig.6 Protein spots number of IPG strips in different pH
2.4 不同蛋白提取方法
利用磷酸抽提法和Tris-饱和酚法提取粘虫中肠的提取率有明显不同,前者的提取率较低,为4.4574 μg/uL,而后者提取率则较高,为6.5674 μg/uL,利用SPSS 19.0进行独立样本T检验,结果(如图7)表明两种蛋白质提取方法存在极显著性差异(P<0.01)。

图7 不同提取方法的蛋白质提取率Fig.7 The rate of protein in extraction from differentethods
两种蛋白质提取方法分别得到了如图8所示的2-DE图谱。2张图谱蛋白点分离的都较为均匀,蛋白点没有拖尾现象,凝胶背景较为清晰,没有明显的横纵条纹,也有较多的低丰度蛋白,但是图B中的高丰度蛋白比图A中的清晰。如图9,Tris-饱和酚法图谱的蛋白点明显多于磷酸抽提法图谱,经过分析,2张图谱蛋白点分别为1308个和1569个,表明Tris-饱和酚法提取的蛋白质种类明显多于磷酸抽提法提取的蛋白质。

图8 不同蛋白质提取方法的2-DE图谱Fig.8 2-DE maps of different protein extraction methods注:A,磷酸抽提法;B,Tris-饱和酚法。Note: A, extract with phosphate buffer; B, Tris-saturated phenol law.
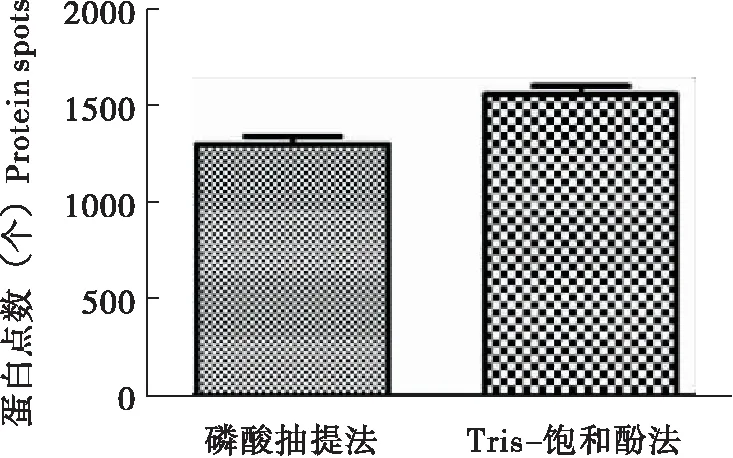
图9 不同蛋白质提取方法的蛋白点数Fig.9 Protein spots number of different protein extraction methods
3 结论与讨论
3.1 不同等电聚焦程序对双向电泳结果的影响
等点聚焦程序直接影响到2-DE图谱的分辨率和重复性,不合适的聚焦程序会导致图谱中出现横纵条纹,蛋白点拖尾,不规则蛋白点等现象。如果聚焦不完全,会出现横条纹,但若过度聚焦,则会出现蛋白飘移和电渗现象。本实验中程序I聚焦到了83000 Vh,程序II聚焦到了75000 Vh 。从实验结果看过高的聚焦电压得到2-DE图谱反而不如低聚焦电压,这可能是低的聚焦电压延长了聚焦时间,反而使得碱性端蛋白有了一定的分布,所以碱性端蛋白分布效果不好的原因可能不是未聚焦完全。在程序中增加了一步500 V除盐后,图谱中的纵条纹减少了许多,横条纹的减少则与较好地聚焦条件有关。
3.2 不同浓度DTT对双向电泳结果的影响
DTT能够打开蛋白质中的二硫键,使蛋白去折叠,减少蛋白聚集(解建勋和蒲小平,2001)。在碱性条件下,DTT会干扰等点聚焦PH梯度,DTT带有负电荷,在等点聚焦过程中可能会跑出胶条,因此改变DTT浓度会改善碱性端蛋白分布。实验中改变了DTT浓度后,发现过高浓度的DTT反而使得碱性端蛋白图谱更模糊,使得图谱质量下降,这说明过量使用DTT也并不能更好的分离碱性端蛋白。在今后的实验中可以尝试选择使用三正丁基膦,TBP,它的还原性要强于DTT,而且可以提高蛋白溶解度(Herbert,1999),但是半衰期短,所以要慎重选择。
3.3 不同pH梯度的IPG胶条对双向电泳结果的影响
我们在实验中用了2种pH梯度的胶条,虽然pH 5-8的胶条分离的蛋白点相对少一点,但是分离到的低丰度蛋白较多,蛋白点分布更均匀,背景更清晰。而且从pH 3-10的胶条上可以看出来,粘虫中肠蛋白点大多集中于pH 4-8的区域,所以选择pH 5-8的胶条更好。等点聚焦有用于不同目的的多种pH梯度的胶条(Kasketal.,2009),而不同pH梯度的胶条分离蛋白质的效果不同(Zhangetal.,2004)。选择IPG胶条需要根据目的蛋白的分布、性质及丰度等进行选择,对于未知蛋白,可先使用pH范围较宽的IPG胶条,如若不能彻底分离,则应该使用范围较窄的胶条。
3.4 不同蛋白提取方法对双向电泳结果的影响
本实验采用了两种方法提取粘虫中肠蛋白:磷酸抽提法和Tris-饱和酚法。其中Tris-饱和酚法可以使盐、核酸、色素、酚和多糖等可溶性物质进入水相,蛋白质和脂类则进入酚相(Yaoetal.,2006),酚相中的蛋白质通过含有乙酸铵的丙酮溶液沉淀出来。虽然Tris-饱和酚法步骤较为繁琐,但可以去除糖和多酚,很大程度上减少了杂质的影响,在提取含有杂质的中肠较为合适。钟伯雄等人建立了系统的磷酸抽提法提取家蚕蛋白质(钟伯雄等,2003)。本实验也利用磷酸抽提法提取了粘虫中肠蛋白,但从蛋白点分布来看,提取质量没有Tris-饱和酚法好。本实验没有用其他的一些经典方法(TCA-丙酮法、Trizol沉淀法、Tris-丙酮-酚法等)提取中肠蛋白质,在今后的实验中也可尝试。
References)
Bae SH, Harris AG,Hains PG,etal.Strategies for the enrichment and identification of basic proteins in proteome projects[J].Proteomics, 2003, 3(5): 569-579.
Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal.Biochem., 1976, 72(1): 248-254.
Candas M, Loseva O, Oppert B,etal.Insect resistance toBacillusthuringiensisalterations in the indianmeal moth larval gut proteome[J].Mol.Cell.Proteomics, 2003, 2(1): 19-28.
Cao J,Xie JY, Zhang LJ,etal.The application of 2-DE technique to hydrophobic proteins and alkaline proteins[J].LifeScienceResearch, 2004, 8(3): 207-214.[曹晶,谢锦云,张丽军,等.2-DE技术中疏水性和碱性蛋白质的研究进展[J].生命科学研究, 2004, 8(3): 207-214]
Dow JA.Insect midgut function[J].Adv.InsectPhysiol, 1986, 19: 187-328.
Görg A, Boguth G, Obermaier C,etal.Two-dimensional polyacrylamide gel electrophoresis with immobilized pH gradients in the first dimensin (IPG-Dalt): The state of the art and the controversy of vertical versus horizontal systems[J].Electrophoresis, 1995, 16(1): 1079-1086.
Herbert B.Advances in proteinsolubilisation for two-dimensional electrophoresis[J].Electrophoresis, 1999, 20(4-5): 660-663.
Hofmann C,Vanderbruggen H, Höfte H,etal.Specificity ofBacillusthuringiensisdelta-endotoxins is correlated with the presence of high-affinity binding sites in the brush border membrane of target insect midguts[J].Proc.Natl.Acad.Sci., 1988, 85(21): 7844-7848.
Kask L, Larsson K, Bjellqvist B.Elimination of basic gaps at high pH values in 2‐DE[J].Proteomics, 2009, 9(24): 5558-5561.
Knowles BH, Ellar DJ.Characterization and partial purification of a plasma membrane receptor forBacillusthuringiensisvar.kurstakilepidopteran-specific delta-endotoxin[J].J.CellSc.i, 1986, 83(1): 89-101.
Mcnall RJ, Adang MJ.Identification of novelBacillusthuringiensisCry1Ac binding proteins inManducasextamidgut through proteomic analysis[J].InsectBiochem.Mol.Biol., 2003, 33(10): 999-1010.
Pan L, Wu QL, Chen X,etal.The formation of outbreak populations of the 3rdgeneration ofMythimnaseparata(Walker) in northern China[J].ApplicationofInsects, 2014, 51(4): 958-973.[潘蕾,吴秋琳,陈晓,等.华北三代粘虫大发生虫源的形成[J].应用昆虫学报, 2014, 51(4): 958-973]
Pennington K,Mcgregor E, Beasley CL,etal.Optimization of the first dimension for separation by two-dimensional gel electrophoresis of basic proteins from human brain tissue[J].Proteomics, 2004, 4(1): 27-30.
Rie J, Jansens S, Höfte H,etal.Specificity ofBacillusthuringiensisδ-endotoxins[J].Eur.J.Biochem., 1989, 186(1-2): 239-247.
Roberts RC, VanOostrum J.Preparative two-dimensional gel electrophoresis at alkaline pH using narrow range immobilized pH gradients[J].Proteomics, 2002, 2: 127-134.
Sahab ZJ, Suh Y, Sang QXA.Isoelectric point-based prefractionation of proteins from crude biological samples prior to two-dimensional gel electrophoresis[J].J.Proteome.Res., 2005, 4(6): 2266-2272.
Wang JY, Zhu SG, Xv CF.Biochemistry[M].Beijing: China Higher Education Press, 2002, 9: 112-116.[王镜岩,朱圣更,徐长法.生物化学[M].北京:高等教育出版社, 2002, 9: 112-116]
Wang W,Vignani R, Scali M,etal.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis, 2006, 27(13): 2782-2786.
Wang YZ, Zhang XX.Studies on the migratorybehaviours of oriental armuworm,Mythimnaseparata(Walker)[J].ActaEcologicaSinica, 2001, 21(5): 772-779.[王玉正,张孝羲.粘虫 (Mythimnaseparata) 迁飞行为研究[J].生态学报, 2001, 21(5): 772-779]
Xie JX, Pu XP.Research development of proteomic analysis[J].ActaBiophysicaSinica, 2001, 17(1): 19-26.[解建勋,蒲小平.蛋白质组分析技术进展[J].生物物理学报,2001, 17(1): 9-26]
Yao Y, Yang YW, Liu JY.An efficient protein preparation for proteomic analysis of developing cotton fibers by 2-DE[J].Electrophoresis, 2006, 27(22): 4559-4569.
Zhang YP,Jin F, Chai XQ,etal.2-DE Method and proteomic map analysis in rice leaves under iron deficient stress[J].Bioinformatiocs, 2004, 3: 001.
Zhong BX, Yan HY, Shen FY,etal.protein extraction method of silkworm for two-dimensional electrophoresis[J].ScienceofSericulture,2003, 29(4): 427-432.[钟伯雄,颜海燕,沈飞英,等.家蚕蛋白质双向电泳的样品制备方法[J].蚕业科学,2003, 29(4): 427-432]
Optimizing method of two-dimensional electrophoresis system of armyworm(Mythimnaseparata) midgut
AI Xian-Long,ZHANG Ya-Lin*
(College of Plant Protection, Northwest A & F University, Yangling 712100, Shaanxi Province, China)
To study the expression differences of armyworm(Mythimnaseparata) midgut proteins after different treated, we established the two-dimensional electrophoresis system for midgut proteomic analysis of armyworm by comparing the parameters including protein extraction, IPG strip, dithiothreitol(DTT) concentration and isoelectric focusing conditions.The results indicated that the proposed better system is as follows: Tris-phenol extraction method was used to extract the total protein from the midgut of armyworm, separate the proteins with pH 5-8(L) strip, with DTT concentration I and isoelectric focusing program II.After optimizing the two-dimensional electrophoresis system, the 2-DE maps are obtained with more protein spots, clearer background and higher-resolution.
Armyworm; midgut; two-dimensional electrophoresis; protein
艾贤龙,张雅林.粘虫中肠总蛋白质双向电泳体系的优化方法[J].环境昆虫学报,2017,39(3):548-555.
国家公益性行业(农业)科研专项(200903052);陕西省“13115”科技创新工程重大科技专项项目(2007ZDKG-14);中央高校基本科研业务费专项资金(Z109021514)
艾贤龙,男,硕士研究生,研究方向为资源昆虫和昆虫毒理学,E-mail:ai212sc@126.com
*通讯作者Author for correspondence,E-mail:yalinzh@nwsuaf.edu.cn
Received:2016-03-18;接受日期Accepted:2016-04-13
Q966;S433.4
A
1674-0858(2017)03-548-08
