番木瓜水溶性多糖的提取、分离与结构分析
2017-08-02唐若宓
番木瓜水溶性多糖的提取、分离与结构分析
分别采用常规水提醇沉和复合酶法,从番木瓜中提取水溶性粗多糖。苯酚-硫酸法测定多糖含量分别为36.48%和53.82%。粗多糖经脱蛋白,大孔吸附树脂脱色,透析及DEAE-纤维素52型阴离子交换层析,得到番木瓜精多糖CPP1和CPP2。Sepharose 6B琼脂糖凝胶柱层析和醋酸纤维素薄膜电泳初步表明CPP1和CPP2为纯度较高的均一组分。红外光谱分析发现典型多糖吸收峰。离子色谱分别测得CPP1、CPP2的主要单糖组成为鼠李糖、阿拉伯糖、半乳糖、葡萄糖和甘露糖。实验结果表明,两者均为结构复杂的杂多糖,是首次从该植物中分离得到。
材料与仪器
主要材料与试剂
番木瓜(Carica papaya L.):广州天河区石牌菜市场销售的夏威夷“Sunrise”品种番木瓜。
Sepharose 6B和各标准单糖:美国Pharmacia公司;AB-8型大孔吸附树脂:天津南开大学化工厂;牛血清蛋白:上海伯奥生物科技有限公司;DEAE-52(进口分装),考马斯亮蓝G-250,大茴香醛,果胶酶(酶活力单位≥50万u/g):国药集团化学试剂有限公司;纤维素酶:广东光华化学厂有限公司;其它试剂均为国产分析纯。
主要仪器与设备
ICS-2500型色谱仪:美国Dionex公司;Equinox 55型傅立叶变换红外光谱仪:德国Bruker公司;D-1冷冻干燥机:北京博医实验仪器有限公司;BS2-100自动部分收集器:上海沪西分析仪器厂有限公司;Spectrum Lab 53型紫外分光光度计:上海棱光技术有限公司;JY 600电泳仪:北京君意东方电泳设备有限公司。
实验方法
粗多糖的提取
复合酶法:在热水浸提前,调整温度至50℃,pH值至4.0,将1 g/L纤维素酶溶液和滤渣液以5:100的体积比混匀,保温2h。再以相同比例加入1g/L果胶酶溶液,调整pH值至3.5,50℃保温2h后,按常规法操作提取多糖。
多糖的纯化
脱蛋白质:将木瓜蛋白酶和菠萝蛋白酶配制成1g/L的酶溶液,粗多糖用少量蒸馏水溶解,将酶液及多糖液以体积比5:100混匀,55℃保温2h。再按多糖水溶液体积1/3~1/4加入Seveg试剂(氯仿:正丁醇=4:1),混合振荡20min,重复操作10次以上,直至除尽蛋白质。
脱色素:预先用蒸馏水把AB-8型大孔吸附树脂浸泡过夜。抽滤后,分别用质量分数为5%的HCl、5%的NaOH浸泡6h,使其充分溶胀。经蒸馏水冲洗至中性后,再用质量分数为95%的乙醇继续浸泡6h,最后用蒸馏水洗至无乙醇味。称取450g经预处理的树脂装入层析柱(45mm×600mm),蒸馏水平衡24h。取120mL经脱蛋白的多糖溶液进行上柱,以蒸馏水洗脱,收集洗脱液置100mL锥形瓶中。经TLC点板跟踪检测多糖洗脱进程。
脱盐:将脱色后的多糖溶液,置于半透膜透析袋(截留分子量14000Da)中,扎紧袋口后在大烧杯中室温下用蒸馏水透析80h。透析过程中,用磁力搅拌器保证透析袋处于流动状态,中间换水9次,以除去盐类及低聚糖等小分子杂质。将袋内的多糖溶液真空浓缩,95%乙醇沉淀,真空干燥即得番木瓜纯化多糖CPP。
多糖的分级:称取100g DEAE-52纤维素,用蒸馏水浸泡过夜后抽滤,分别用0.5mol/L NaOH、0.5mol/ L HCl、0.5mol/L NaOH浸泡1 h,再用蒸馏水依次处理至中性。抽气装入层析柱(25mm×600mm),蒸馏水平衡24h。称取0.7g番木瓜纯化多糖CPP,溶于适量蒸馏水中,上柱,分别用0.0,0.2,0.4,0.6mol/L NaCl溶液洗脱。控制流速为1mL/min,自动部分收集器收集,10mL/管,各管取样,以苯酚-硫酸法隔管跟踪检测,作洗脱曲线,合并同一洗脱峰的各管样品。洗脱液经过真空浓缩、透析、冷冻干燥、得白色番木瓜多糖洗脱组分CPP1和CPP2。
多糖纯度的鉴定
凝胶色谱法:将Sepharose 6B经蒸馏水溶胀处理后装柱(20mm×300mm),用蒸馏水平衡24h。将番木瓜多糖洗脱组分CPP1和CPP2分别溶于0.1mol/L NaCl溶液中,上柱,检查番木瓜多糖的纯度。以0.1mol/L NaCl溶液洗脱,流速为1mL/min,自动部分收集器收集,每管收集5mL,用苯酚-硫酸法隔管跟踪检测多糖,作洗脱曲线。
结果与分析
粗多糖的提取 在相同条件下,常规水提醇沉法和复合酶法分别进行3次平行实验。复合酶法的番木瓜粗多糖平均得率为15.87%,苯酚-硫酸法测定其多糖含量为53.82%。而常规水提醇沉法提取粗多糖,得率仅为13.17%,多糖含量在36.48%左右。采用常规热水提取法时,多糖很难从细胞壁中释放出来,得率低。酶法提取与常规热水浸提法相比,不仅使提取的条件更为温和、更有针对性,效率更高,且番木瓜粗多糖的得率及含量均有显著提高,初步证明是一种理想的提取方法。
粗多糖的纯化 粗多糖经脱蛋白、脱色、脱盐后,外观形态为大小均一的纯白色细粉末颗粒。这表明AB-8大孔吸附树脂对多糖色素吸附效果显著。
多糖的分级 纯化多糖经DEAE-52纤维素柱层析,在用0.0~0.6mol/L NaCl溶液梯度洗脱下,共出现两个显著单一对称峰,DEAE-52纤维素柱分离效果较好。对两个主导洗脱组分进行收集,并作进一步的纯度鉴定和结构分析。两个组分分别记为CPP1和CPP2,其中CPP1属于中性多糖,CPP2为酸性多糖。
多糖纯度的鉴定
Sepharose 6B琼脂糖凝胶柱层析:将DEAE-52纤维素分离获得的多糖CPP1和CPP2,加入至Sepharose 6B琼脂糖凝胶柱进行洗脱,CPP1的洗脱曲线上一共出现了三个洗脱峰。两个相对狭窄的小峰出现在第13至22号试管中。但两个杂峰只占了很小的比例,表明多糖CPP1的纯度较高,其分子达到了一定的均一程度。多糖CPP2的洗脱峰单一对称,显示样品为均一多糖,即番木瓜多糖已被纯化。
多糖的结构分析
红外全波长扫描:多糖CPP1和CPP2经红外光谱检测,从红外光谱图可知,CPP1和CPP2都具有典型的多糖吸收峰,并且两者结构相似,其特征吸收峰及所对应的功能基团见表1。
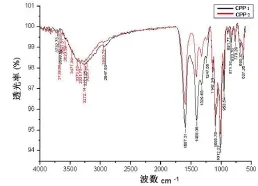
图1 CPP1和CPP2红外吸光光谱
离子色谱法测定:经过与标准样色谱图对照,多糖水解液CPP1与CPP2都含有鼠李糖、阿拉伯糖、半乳糖、葡萄糖和甘露糖等五种单糖。并且五种单糖在CPP1样品中的摩尔比例很接近,为15.13:16.87:26.17:17.92:10.26。但在样品CPP2中,葡萄糖是最主要成分,其含量达到88.25%。这一结果也与IR分析一致。因为在CPP2的IR图谱中,在856 cm-1处的伸缩振动峰表明CPP2中含有α-D-吡喃葡萄糖。
另外除了单糖,一定含量的双糖海藻糖也存在于CPP1与CPP2的两个样品中。这表明多糖的水解还没有完全。海藻糖是由两分子葡萄糖组成的二糖,因此番木瓜两种多糖的实际葡萄糖含量会更高。
复合酶法与常规水提醇沉法相比,具有高提取率、高选择性的特点。酶法的提取率和粗多糖含量分别为15.87%和53.82%。而常规方法的提取率和粗多糖含量仅为13.17%和36.48%。
番木瓜粗多糖经脱蛋白、脱色、脱盐和DEAE-52纤维素柱层析后,获得番木瓜多糖CPP1和CPP2两个组分。经Sepharose 6B和醋酸纤维膜电泳试验,初步证明番木瓜多糖CPP1和CPP2均为纯度较高的单一组分。离子色谱测得CPP1和CPP2都是由鼠李糖、阿拉伯糖、半乳糖、葡萄糖和甘露糖组成。实验结果表明,两者均为结构复杂的杂多糖,是首次从该植物中分离得到。
□ 唐若宓 广东省轻工业高级技工学校
