基于人胎盘屏障体外模型评价双黄连的胚胎毒性
2017-08-02宋殿荣张崴赵丽颖郭洁李会娟杜文欣
宋殿荣,张崴,赵丽颖,郭洁,李会娟,杜文欣
(1.天津中医药大学第二附属医院妇产科,天津300150;2.天津中医药大学研究生院,天津300070)
基于人胎盘屏障体外模型评价双黄连的胚胎毒性
宋殿荣1,张崴1,赵丽颖2,郭洁1,李会娟2,杜文欣1
(1.天津中医药大学第二附属医院妇产科,天津300150;2.天津中医药大学研究生院,天津300070)
目的 联合应用人胎盘屏障体外模型和胚胎干细胞(ES)实验模型,评价双黄连的胚胎毒性。方法利用胎盘组织薄片培养技术与尤斯(Ussing)扩散池实验相结合建立人胎盘屏障体外模型。于胎盘屏障母体侧给予双黄连0.2,0.4,0.8,1.6,3.2,6.4和12.8 g·L-1,于药后60 min分别取母体侧和胎儿侧培养液作为含药上清,与ES(D3系)和BALB/c小鼠胚胎成纤维细胞(3T3)共培养10 d,MTT法检测细胞存活率,分别计算两侧含药上清抑制ES和3T3细胞存活的IC50。利用悬滴-悬浮-贴壁方法,体外培养ES向心肌细胞分化,实时定量PCR检测心肌细胞特异基因肌球蛋白重链基因β(β-MHC)的表达,表示ES向心肌细胞的分化率,分别计算抑制ES细胞分化的IC50。根据胚胎毒性评价标准,预测双黄连的胚胎毒性。结果 胎盘屏障母体侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为1.97,0.84和0.48 g·L-1;根据胚胎毒性评价标准判定,双黄连在母体侧具有弱胚胎毒性。胎盘屏障胎儿侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为3.19,2.57和0.95 g·L-1;根据胚胎毒性评价标准判定,双黄连透过胎盘屏障后,在胎儿侧无胚胎毒性。结论母体侧给予所测试浓度范围内的双黄连透过胎盘屏障后,无明显胚胎毒性。以透过胎盘屏障的含药上清作为受试物检测药物的胚胎毒性,对于评价妊娠期用药的安全性更具有科学性,对临床合理用药具有参考价值。
双黄连;胚胎毒性;胎盘屏障;胚胎干细胞
DOl:10.3867/j.issn.1000-3002.2017.06.022
双黄连冻干粉为金银花、黄芩和连翘3味中药经现代工艺制成的中药粉针剂,具有清热解毒和抗菌抗病毒的双重作用,广泛用于治疗各种感染性疾病,特别是屡见于妊娠期使用并取得良好疗效的临床报道[1]。2009年宋殿荣等[2]研究报道,双黄连冻干粉透过大鼠胎盘屏障造成胎儿宫内暴露的主要药物成分为黄芩苷(baicalin),同时应用胚胎干细胞(embryonic stem cells,ES)模型进行评价,提出了黄芩苷具有弱胚胎毒性[3]。但由于存在种属差异,动物实验结果 不能直接外推到人体,2013年宋殿荣等[4]建立了人胎盘屏障体外模型,该模型具有在体胎盘的内分泌和物质转运功能,能避免种属差异,模拟人体环境,明确透过人胎盘屏障的中药成分。故本研究联合应用人胎盘屏障体外模型和ES实验(ES test,EST),进一步评价双黄连的胚胎毒性,为临床合理用药提供实验资料。
1 材料与方法
1.1 细胞和动物
新鲜胎盘来源于天津市南开医院产科。ES(D3系)细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。BALB/c小鼠胚胎成纤维细胞(3T3)为天津医科大学肿瘤医院研究所惠赠。BALB/c小鼠〔SPF级,实验动物生产许可证号:SCXK-(军)2007-004〕购自军事医学科学院实验动物中心。
1.2 药物、主要试剂和仪器
黄芩苷购自中国药品生物制品检定所,批号110715-200815。Knock out-DMEM培养基、Knock out-serum replacement(KSR)、1%非必需氨基酸、β-巯基乙醇、谷氨酰胺和胰蛋白酶购自美国Gibco公司;胎牛血清购自美国Hyclone公司;小鼠白血病抑制因子1000 kU·L-1购自美国Chemicon公司;荧光素、异硫氰酸荧光素标记的葡聚糖、乙二醇、二甲亚砜、明胶、MTT和丝裂霉素购自美国Sigma公司。倒置显微镜(Nikon TE2000-u,日本Nicon公司),酶联免疫检测仪(Σ960,中国台北),Chromo4四通道实时定量PCR仪(美国Bio-Rad公司),尤斯扩散池(Ussing chamber EM-CSYS-2,美国PI公司),样本夹片P2314和Leica VT1000振动切片机(德国徕卡公司)。
1.3 人胎盘屏障体外模型的建立
参照文献[4]方法建立人胎盘屏障体外模型,选择孕14~24周无妊娠合并症和妊娠并发症非计划妊娠妇女经水囊引产的胎盘,年龄25~30岁。排除HIV、HBV、HCV、苍白密螺旋体(梅毒密螺旋体)和巨细胞病毒感染等。由天津中医药大学第二附属医院医学伦理委员会批准,并获得患者知情同意。选择胎盘终末绒毛部位,即胎盘母体面底板区的中间带的丛密绒毛处,取约3 cm×3 cm×1 cm大小的组织块,玻璃化冷冻方法固定,切割成为厚度500 μm的组织薄片,复苏,按照母体面-胎儿面的方向固定于扩散池的夹片上,放置于尤斯扩散池,胎儿侧和母体侧分别加入37℃,pH 7.4的K氏缓冲液(g·L-1:NaCl 6.923,KCl 0.354,NaHCO32.1,Na2HPO40.136,MgSO4·7H2O 0.288,CaCl2·6H2O 0.56,葡萄糖1.8,L-丙氨酸0.178)2 mL,建立人胎盘屏障体外模型系统装置。该模型系统由尤斯扩散池、温度加热块、恒温水浴箱及95%O2和5%CO2混合气体循环系统4部分组成,分别构成人胎盘屏障体外模型的扩散系统、温度控制系统和气流控制系统。
1.4 人胎盘屏障体外模型功能鉴定
胎盘屏障体外模型预平衡30 min后,即刻在扩散池的母体侧和胎儿侧同时加入已预温到37℃,pH 7.4的K氏缓冲液2 mL,于给定的时间间隔(1,2,3,4,5,12,24和48 h)在母体侧取样100 μL,同时立刻补充同温度等体积的K氏缓冲液。各样本1000×g离心10 min,取上清液,4℃保存。ELISA检测胎盘滋养细胞人绒毛膜促性腺激素β(β-human chorionic gonadotropin,β-HCG)的分泌水平。
1.5 双黄连含药上清样品的制备
精密称取双黄连冻干粉256 mg于10 mL容量瓶中,用K氏缓冲液标定,得到25.6 g·L-1双黄连溶液,用K氏缓冲液逐级稀释,分别得到不同浓度的供试品,-4℃冰箱保存。在胎盘屏障体外模型母体侧加入已预温到37℃,浓度分别为0,0.2,0.4,0.8,1.6,3.2,6.4和12.8 g·L-1的双黄连溶液7 mL,胎儿侧同时加入同温度等体积K氏缓冲液。于加药后60 min,将两侧样品全部取出,1000×g离心10 min,取上清液分别为两侧双黄连含药上清样品,置于-20℃冰箱冷冻保存备用。
1.6 小鼠胚胎干细胞培养
取孕期12.5~14.5 d的BALB/c小鼠,颈椎脱臼处死,浸泡,洗刷,消毒,剖腹取出胚胎,去除头、肝和四肢,培养液冲洗,充分剪碎。加入0.25%胰酶-0.04%EDTA 10 mL,分阶段消化,吸取上层悬液并离心收集细胞,接种于T75培养瓶培养。倒置显微镜下观察滋养层细胞铺满培养瓶底,加入丝裂霉素10 mg·L-1混匀,培养4 h,消化,接种于明胶化的培养皿中备用。
从液氮中取出ES复苏,接种于已铺好滋养层细胞的6 cm培养皿中培养,每天更换细胞培养液(HDMEM、15%胎牛血清、谷氨酰胺2 mmol·L-1、1%非必需氨基酸、2-巯基乙醇0.1 mmol·L-1、青霉素50 kU·L-1、链霉素50 mg·L-1和小鼠白血病抑制因子1000 kU·L-1)。ES细胞增殖3 d,形成大小均一的克隆,克隆紧密,立体感强,折光性好,细胞克隆于培养皿铺满60%~70%时传代。
1.7 MTT法检测胚胎干细胞和3T3细胞的存活
将ES或3T3细胞200 μL(含500个细胞)接种于96孔板上,将胎盘屏障胎儿侧和母体侧双黄连含药上清样品(加入10%FBS、谷氨酰胺2 mmol·L-1、青霉素50 kU·L-1和链霉素50 mg·L-1)加入96孔板,与ES或3T3细胞共培养。同时设细胞对照组。第3和第5天更换培养液。第10天相差显微镜下观察细胞形态,形态正常则应用MTT法检测细胞存活率。细胞存活率(%)=细胞对照组A570nm均值/药物组A570nm均值×100%。分别以双黄连初始浓度(母体侧)为横坐标,细胞存活率为纵坐标,绘制浓度-细胞存活率曲线,应用GraphPadPrism5软件计算抑制ES或3T3细胞存活50%的双黄连浓度。
1.8 胚胎干细胞向心肌细胞的体外分化培养[5]
①悬滴培养:调整ES细胞密度至3.75×107L-1,分别将单细胞悬液置于6 cm培养皿中,从中取单细胞悬液以每滴20 μL、每培养皿80滴置于10 cm细胞培养皿内,加盖。翻转培养皿盖子至正常位置,盖在培养皿上,使之悬滴生长,培养皿内加入PBS 5 mL。置37℃,5%CO2和饱和湿度培养箱内培养3 d。②悬浮培养:第4天于倒置显微镜下观察,每个悬滴内均含有1个拟胚体。吸弃PBS,分别加入胎盘屏障胎儿侧和母体侧双黄连含药上清样品(加入15%FBS、谷氨酰胺2 mmol·L-1、1%NEAA、2-巯基乙醇0.1 mmol·L-1、青霉素50 kU·L-1和链霉素50 mg·L-1)。将拟胚体冲入培养皿底,并移至6 cm培养皿悬浮培养2 d。③贴壁培养:第6天时肉眼观察,每个培养皿中均可见数十个拟胚体。分别接种至事先用明胶包被的24孔板内,每孔中加入2 mL上述胎儿侧和母体侧双黄连含药上清。37℃,5%CO2和饱和湿度培养箱内培养5 d,实时定量PCR法检测心肌细胞特异基因肌球蛋白重链基因β(myosin heavy chain gene-β,β-MHC)mRNA表达。
1.9 实时定量PCR法检测β-MHC mRNA的表达
Trizol试剂一步法提取细胞总RNA,检测总RNA浓度,鉴定其纯度及完整性。以2 μg RNA为模板逆转录合成cDNA。β-MHC引物:GCCCCTCCTCACATCTTCTCC(F)和CAGGGTTGGCTTGGATGATTT(R);内参照GAPDH引物:CCTTCCGTGTTCCTACCC(F)和CAACCTGGTCCTCAGTGTAG(R)。PCR扩增的反应体系为SYBR Green Real time PCR Master Mix 12.5 μL,样品溶液2.5 μL,引物各1.0 μL,加双蒸水至总体积25 μL。反应条件:95℃预变性60 s;95℃变性15 s,60℃退火15 s,72℃延伸30 s,40个循环,熔解曲线72~95℃,每0.4℃读数1次,持续1 s。用基因相对定量法(2-ΔΔCt)计算各组β-MHC mRNA相对于对照组的表达倍数。β-MHC表达水平表示ES细胞分化率。ES细胞分化率(%)=药物组2-ΔΔCt/细胞对照组2-ΔΔCt× 100%。以初始双黄连浓度(母体侧)为横坐标,ES分化率为纵坐标绘制浓度-反应曲线。应用GraphPadPrism5软件计算抑制ES 50%分化的双黄连浓度。
10胚胎毒性结果 评价[6]
公式Ⅰ:5.916 lg(3T3存活IC50)+3.500 lg(ES存活IC50)-5.307〔(3T3存活IC50-ES分化IC50)/ 3T3存活IC50〕-15.72;公式Ⅱ:3.651 lg(3T3存活IC50)+2.394 lg(ES存活IC50)-2.033〔(3T3存活IC50-ES分化IC50)/3T3存活IC50〕-6.85;公式Ⅲ:-0.125 lg(3T3存活IC50)+1.917 lg(ES存活IC50)+ 1.500〔(3T3存活IC50-ES分化IC50)/3T3存活IC50〕-2.67。胚胎毒性判定标准:Ⅰ>Ⅱ且Ⅰ>Ⅲ,受试物胚胎毒性为一级,即无胚胎毒性;Ⅱ>Ⅰ且Ⅱ>Ⅲ,受试物胚胎毒性为二级,即弱胚胎毒性;Ⅲ>Ⅰ且Ⅲ>Ⅱ,受试物胚胎毒性为三级,即强胚胎毒性。
2 结果
2.1 人胎盘屏障体外模型功能鉴定
测定人胎盘屏障体外模型建立后母体侧胎盘组织薄片48 h内的分泌功能。结果 显示,胎盘终末绒毛组织薄片在扩散池培养条件下,48 h内均存在β-HCG的分泌,呈先上升后下降的趋势,分泌的峰值在培养5 h(图1),表明该模型在48 h内能很好地维持胎盘的在体功能。
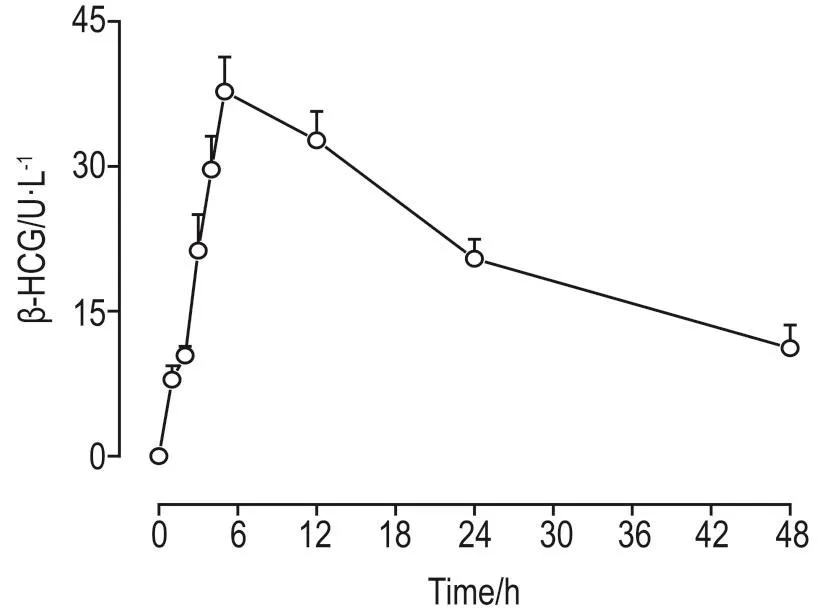
Fig.1 Human chorionic gonadotropin-β(β -HCG)expression level in placenta tissue slice within 48 h in human placental barrierin vitrodetected by ELlSA.After the placenta barrier model was pre-equilibrated 30 min,K buffer 2 mL was added to the maternal and fetal sides of the diffusion chamber at once,and the level of β-HCG in the maternal side buffer was detected by ELISA at a given time interval.x±s,n=3.
2.2 双黄连对3T3细胞存活的影响
胎盘屏障母体侧和胎儿侧双黄连对3T3细胞存活的影响见表1。培养10 d后,随母体侧双黄连初始浓度的加大,细胞存活率明显下降(P<0.05);在双黄连浓度为3.2和6.4 g·L-1时,母体侧含药上清的细胞毒性较胎儿侧含药上清更加明显(P<0.05)。根据双黄连初始浓度-3T3细胞存活率反应曲线,母体侧双黄连抑制3T3细胞存活的IC50为1.97 g·L-1(初始浓度);透过胎盘屏障后,胎儿侧双黄连IC50为3.18 g·L-1(初始浓度)。
2.3 双黄连对胚胎干细胞存活的影响
胎盘屏障母体侧和胎儿侧双黄连对ES细胞存活的影响见表2。培养10 d后,随母体侧双黄连初始浓度的加大,细胞存活率明显下降(P<0.05);双黄连浓度6.4 g·L-1时,母体侧含药上清的细胞毒性较胎儿侧含药上清更加明显(P<0.05)。根据双黄连初始浓度-ES存活率反应曲线,母体侧双黄连抑制ES细胞存活的IC50为0.84 g·L-1(初始浓度);透过胎盘屏障后,胎儿侧双黄连IC50为2.57 g·L-1(初始浓度)。
2.4 双黄连对胚胎干细胞向心肌细胞分化的影响
实时定量PCR检测心肌β-MHC表达结果 (图2)表明,随母体侧双黄连初始浓度的加大,ES向心肌细胞分化程度下降。根据双黄连初始浓度-ES分化率效应曲线计算,母体侧双黄连抑制ES细胞分化的IC50为0.48 g·L-1(初始浓度);透过胎盘屏障后,胎儿侧双黄连IC50为0.95 g·L-1(初始浓度)。
2.5 基于胎盘屏障体外模型预测双黄连胚胎毒性
胎盘屏障母体侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为1.97,0.84和0.48 g·L-1。根据胚胎毒性评价公式,计算得到Ⅰ= 10.005,Ⅱ=10.649,Ⅲ=4.482;显然Ⅱ>Ⅰ,Ⅱ>Ⅲ,提示母体侧双黄连具有弱胚胎毒性。胎盘屏障胎儿侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为3.19,2.57和0.95 g·L-1。根据胚胎毒性评价公式,计算得到Ⅰ=13.219,Ⅱ=12.679,Ⅲ= 5.359;显然Ⅰ>Ⅱ,Ⅰ>Ⅲ,提示双黄连透过胎盘屏障后无胚胎毒性。
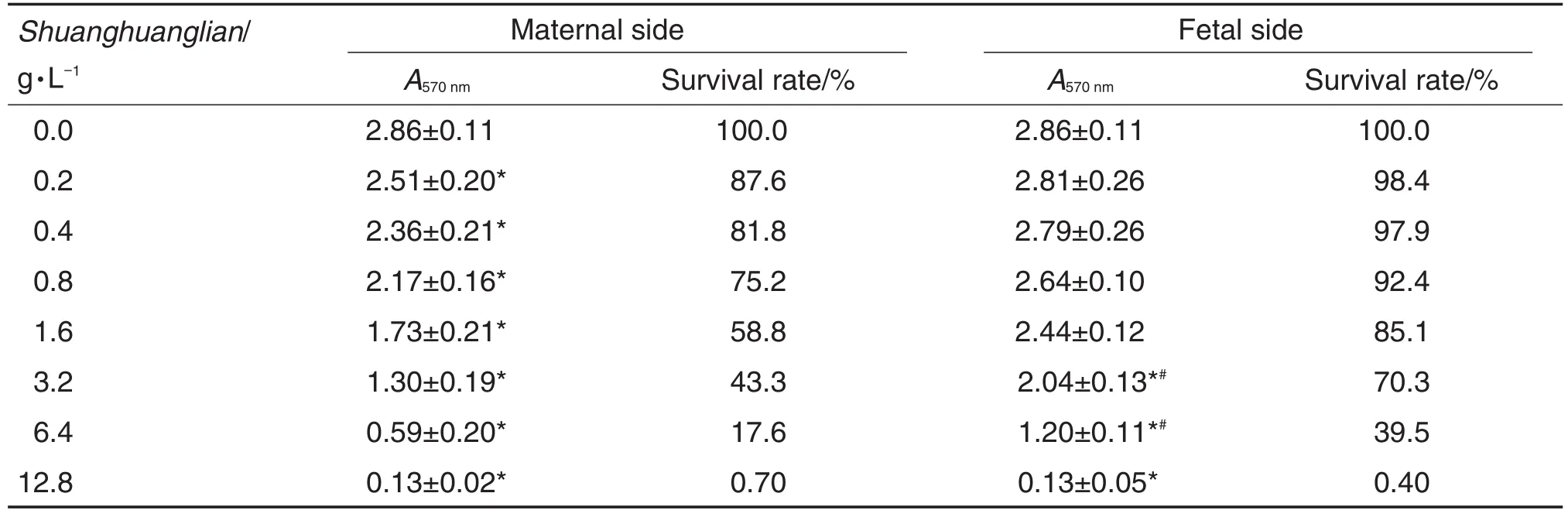
Tab.1 Effect ofShuanghuanglianon survival of 3T3 cells
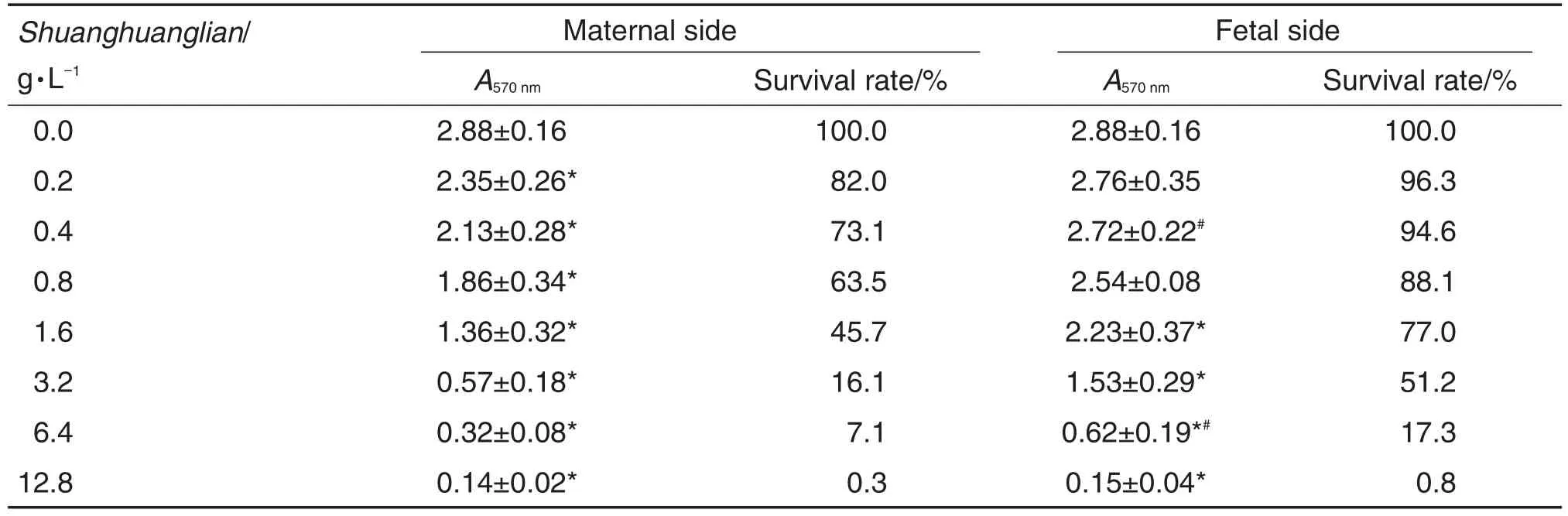
Tab.2 Effect ofShuanghuanglianon survival of embryonic stem cells(ESCs)
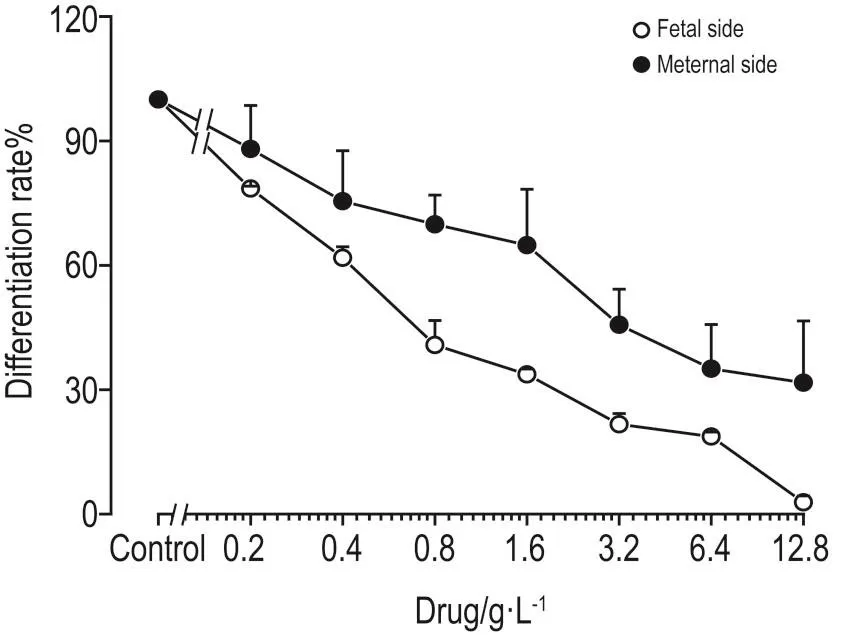
Fig.2 lnhibitory effect ofShuanghuanglianon differentiation of ESCs to cardiomyocytes.See Tab.1 for the preparation of fetal and maternal side supernatant withshuanghuanglian.The differentiation of ESCs to cardiomyocytes was detected through hanging drop-suspension attachment method. Real-time quantitative PCR assay was used to detect the expression of heart muscle myosin heavy chain(β-MHC)mRNA in ESCs.The relative quantitative expression of β-MHC mRNA was by 2-△△Ct.Differentiation rate of ESCs(%)=2-ΔΔCtof experimental group/2-ΔΔCtof cell control group×100%.x±s,n=6.
3 讨论
本课题组前期研究结果 显示,双黄连透过大鼠胎盘屏障造成胎儿宫内暴露的药物成分为黄芩苷,应用EST方法评价黄芩苷的胚胎毒性为弱胚胎毒性[3]。然而,由于中药具有组成成分的多样性和可变性以及成分间相互作用的难以预测性等特点,仅考察中药单一组分的胚胎毒性尚不能全面客观地评价中药的安全性[7]。因此,黄芩苷的胚胎毒性并不能完全代表双黄连的胚胎毒性。根据血清药理学理论,应用中药后只有被吸收入血或在体内代谢最终存在于血液中含量较高的成分,才是发挥药效或毒性作用的成分。本研究充分考虑到药物在体内的代谢更为接近人体,以胎盘屏障体外模型母体侧和胎儿侧含药上清作为双黄连胚胎毒性研究的受试物,结果 亦显示双黄连在母体侧具有弱胚胎毒性,与以往研究结果 一致。
妊娠期胎盘作为母体与胎儿之间的重要器官,具有保护胎儿的屏障作用,药物只有透过胎盘屏障进入胎儿体内,才可能对胎儿的生长发育造成影响。因此,检测透过胎盘屏障的药物成分的胚胎毒性更具临床价值。本研究成功复制了人胎盘屏障体外模型,该模型在48 h内能保持胎盘活性,很好地模拟在体环境。因此,本研究以透过胎盘屏障模型的胎儿侧含药上清作为双黄连胚胎毒性评价的受试物。EST结果 显示,透过胎盘屏障后,双黄连无胚胎毒性,这与文献[8-9]报道结果 一致,即妊娠期应用双黄连治疗上呼吸道感染和泌尿系统感染,未发现对孕妇心、肝、肾及造血系统的影响,经随访亦未发现流产、早产及新生儿畸形。本研究结果 显示,胎盘屏障母体侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为1.97,0.84和0.48 g·L-1;透过胎盘屏障胎儿侧双黄连抑制3T3细胞存活及ES细胞存活和分化的IC50分别为3.19,2.57和0.95 g·L-1,说明双黄连透过胎盘屏障造成胎儿宫内暴露的浓度至少要增加至2倍,才能抑制ES细胞50%存活及向心肌细胞50%分化。提示胎盘屏障可减少双黄连透过胎盘、减弱其宫内暴露对胎儿的影响。在所观察浓度范围内,母体侧给予双黄连,透过胎盘屏障后,对胚胎无明显胚胎毒性。
以透过胎盘屏障的含药上清作为受试物进行EST,检测药物的胚胎毒性,对于评价妊娠期应用中药的安全性更具有科学性,对临床合理用药更具有参考价值。但胎盘是孕期特有的组织器官,具有物质转运、屏障和内分泌代谢等功能,不同孕期胎盘功能不尽相同。在孕早期胎盘尚未形成,其功能并不完善。孕中期胎盘屏障由合体滋养细胞、细胞滋养细胞及基膜、绒毛内薄层结缔组织、绒毛内毛细血管内皮细胞和基膜构成,其结构最为完整,在整个孕期具有最强的屏障功能。妊娠后期母体血与胎儿血之间只隔合体滋养层、血管内皮及两者之间的基膜,故通透性很强。本研究选择胎盘屏障功能最完善的孕中期胎盘组织作为研究对象,考察胎盘对药物的通透性。然而不同药物在不同孕期对胚胎或胎儿的影响不尽相同,因此要考察药物在不同孕期的胚胎毒性,需选择相应孕期的胎盘组织建立胎盘屏障体外模型,以获得更加科学可靠的实验结果 。另外,体外培养ES细胞向心肌细胞分化的技术要求高,耗时长,费用昂贵;EST过程中需要利用生物统计公式对实验所得数据进行分析,过程繁琐,耗时耗力,不适于高通量筛选中药的胚胎毒性。因此,建立一种高通量的胚胎毒性筛选模型,与人胎盘屏障体外模型联合快速筛选药物胚胎毒性,将成为今后研究的重点。
[1]Wang LW,Yang J.Clinical application of Shuanghuanglian in pregnancy complication[J].J Chengde Med Coll(承德医学院学报),2007,24(2):157-158.
[2]Song DR,Guo J,Wang YF,Pan GX,Li PL,Zhang W,et al.Ingredients of Shuanghuanglian injection powder permeation through placental barrier of rat in pregnancy[J].China J Chin Mater Med(中国中药杂志),2010,35(12):1626-1629.
[3]Zhang W,Song DR,Wang YN,Zhu Z.Evaluation of embryotoxicity of baicalin based on embryonic stem cell test system[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(6):864-869.
[4]Song DR,Guo J,Han F,Zhang W,Wang YN,Wang YH.Establishment of an in vitro model of the human placental barrier by placenta slice culture and Ussing chamber[J].Biosci Biotechnol Biochem,2013,77(5):1030-1034.
[5]Kuang NZ,Fu YY,Huang BH,Zhou ZX,Zeng XP. An experimental study on inhibitory effect of baicalin on human hepatic carcinoma cell line SMMC7721 in vitro[J].Lishizhen Med Mater Med Res(时珍国医国药),2008,19(6):1422-1424.
[6]Genschow E,Scholz G,Brown NA,Piersma AH,Brady M,Clemann N,et al.Development of prediction models for three in vitro embryotoxicity tests which are evaluated in an ECVAM validation study[J].Altex,1999,16(2):73-83.
[7]Zaffani S,Cuzzolin L,Benoni G.Herbal products:behaviors and beliefs among Italian women[J]. Pharmacoepidemiol Drug Saf,2006,15(5):354-359.
[8]Qi LW,Zhou JL,Hao HP,Li HJ,Wen XD,Chen J,et al.Biological-chemical profiling of in vitro and in vivo bioactive compounds from traditional Chinese medicines with holistic views[J].J China Pharm Univ(中国药科大学学报),2010,41(3):195-202.
[9]Wang QL.Clinical observation of Shuanghuanglian Injection in treatment of upper respiratory tract infection during pregnancy[J].Res Tradit Chin Med(中医药研究),1999,15(3):33.
[10]Zhou CH,Wang Q,Hu XF.Clinical observation of Shuanghuanglian Injection in treating 29 cases of urinary tract infection during pregnancy[J].Clin J Anhui Tradit Chin Med(安徽中医临床杂志),1998,10(1):13.
Evaluation of embryo toxicity of Shuanghuanglian based on human placental barrier model
SONG Dian-rong1,ZHANG Wei1,ZHAO Li-ying2,GUO Jie1,LI Hui-juan2,DU Wen-xin1
(1.Department of Obstetrics and Gynecology,the Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300150,China;2.Graduate School,Tianjin University of Traditional Chinese Medicine,Tianjin 300070,China)
OBJECTlVETo evaluate the embryo toxicity of Shuanghuanglian(SHL)by the combination of a human placental barrier model and embryonic stem(ES)cell test model.METHODSA human placental barrier model was set up by placenta slice culture and Ussing chamber.SHL 0.2,0.4,0.8,1.6,3.2,6.4 and 12.8 g·L-1was added into the maternal side of the human placental model,respectively.All the media was collected respectively from the maternal side and fetal side 60 min later and taken as the SHL containing medium.ES cells(D3 line)and embryonic fibroblast cells(BALB/c 3T3)were cultured with the SHL containing medium respectively from the maternal side and the fetal side for 10 d.Cell viability was detected by MTT assay,and 50%survival inhibitory ratio of ES and 3T3 cells by SHL was calculated.ES cells were incubated with the SHL containing medium from the maternal side or fetal side when they differentiated to cardiac myoblasts using hanging drop-suspension-attachment method.Messenger RNA of myosin heavy chain genes(β-MHC)was detected by Q-PCR for differentiation ratio,and 50%differentiation inhibitory ratio of ES cells by SHL was calculated.A statistics formula was used for prediction of SHL embryotoxicity potential.RESULTSThe IC50of SHL in the maternal side of the human placental model for 3T3 cell survival,ES cell survival and ES differentiation was 1.97,0.84 and 0.48 g·L-1,respectively.According to the criteria for embryo toxicity evaluation,SHL had weak embryo toxicity.However,the IC50of SHL in the fetal side of the human placental model for 3T3 cell survival,ES cell survival and ES differentiation was 3.19,2.57 and 0.95 g·L-1,respectively.According to the criteria for embryo toxicity evaluation,the supernatant containing SHL that went through the placental barrier had no embryo toxicity.CONCLUSlONSHL is safe in the test concentration range during pregnancy.It is more scientific to evaluate embryo toxicity of drugs by ES cell test with the samples obtained through the placental barrier during pregnancy.
Shuanghuanglian;embryotoxicity;placental barrier;embryonic stem cells
The project supported by National Natural Science Foundation of China(81273938)
SONG Dian-rong,E-mail:songdr58@126.com
R285.1
A
1000-3002-(2017)06-0649-06
2017-02-04接受日期:2017-06-16)
(本文编辑:齐春会)
国家自然科学基金(81273938)
宋殿荣,女,主任医师,教授,主要从事妊娠期用药安全性研究。
宋殿荣,E-mail:songdr58@126.com
