牛呼吸道合胞体病毒双抗体夹心ELISA检测方法的建立
2017-08-01李艳婷侯喜林
李艳婷,侯喜林
牛呼吸道合胞体病毒双抗体夹心ELISA检测方法的建立
李艳婷,侯喜林
目的 建立牛呼吸道合胞体病毒(BRSV)双抗体夹心ELISA(DAS-ELISA)检测方法。方法 以重组纯化的BRSV-G蛋白免疫家兔和小鼠,制备抗G蛋白的多克隆抗体(PcAb)和单克隆抗体(MAb),方阵滴定法优化DAS-ELISA方法抗体工作浓度及反应条件,并对其敏感性、特异性、符合率进行验证。结果 获得5株稳定分泌抗G蛋白MAb的杂交瘤细胞株,分泌抗体亚类均为IgG1型κ链,Western blot、IFA试验表明PcAb和MAb均与G蛋白和BRSV发生特异性反应,MAb作为捕获抗体的最佳包被浓度为2.5 μg/mL,PcAb作为检测抗体最佳工作浓度为5 μg/mL,判定临界值为0.22,最低检测限为1.43 μg/mL,批内和批间重复性试验变异系数均小于10%,与常引起牛呼吸道疾病的几种病原均无交叉反应,与RT-PCR的敏感性、特异性、符合率分别为92.0%、100%、95.6%。结论 建立的检测BRSV的DAS-ELISA方法可用于临床样品的大规模检测,为BRSV疫情的监测和快速诊断奠定了基础。
牛呼吸道合胞体病毒;G蛋白;多克隆抗体;单克隆抗体;DAS-ELISA
牛呼吸道合胞体病毒(Bovine respiratory syncytial virus,BRSV)是引起犊牛呼吸道疾病的主要病原[1]。BRSV感染引起犊牛的高发病率和高死亡率,给养牛业造成了巨大的经济损失[2]。自2007年王红等[3]首次从黑龙江省某牛场成功分离出牛呼吸道合胞体病毒以来,之后我国多个省份陆续报道检出BRSV病毒[4],证明BRSV病毒已在我国普遍存在。牛是BRSV的天然宿主且感染率非常高,牛群中血清阳性率可达30%~70%,BRSV感染可引起60%~80%的发病率,20%的死亡率[5]。随着我国集约化的养殖,需不断从国外进口优质犊牛,而我国尚未将BRSV列入检疫范围[6],有可能从有该病国家引进带毒的牛,严重制约我国养牛业的发展,因此建立有效地检测方法对于我国BRSV感染的快速诊断和科学防治具有重要意义。
牛呼吸道合胞体病毒为有囊膜,非节段负链RNA病毒,属于副粘病毒科肺病毒属,BRSV RNA基因编码11种蛋白[7],其中G蛋白促进BRSV病毒与宿主的结合,是主要的保护性抗原,能够诱导病毒中和抗体的产生[8]。本研究基于冯军科等[9]对BRSV G蛋白的截短与表达的基础上,利用有抗原性和特异性的一段基因表达的蛋白进行免疫新西兰大白兔和BABL/c小鼠,分别制备抗G蛋白的多克隆抗体和单克隆抗体,建立检测BRSV双抗体夹心ELISA检测方法,可为临床诊断提供简便快速的检测工具。
1 材料与方法
1.1 主要试剂 His-Binding-resin为上海点创生物科技有限公司产品;RPMI-1640培养基为HyClone产品;双抗为Biosharp产品;胎牛血清为GIBCO产品;BCA蛋白浓度测定试剂盒、弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇融合剂(PEG1450)、HAT、HT均为Sigma产品;单克隆抗体亚类鉴定试剂盒为SouthernBiotech产品;Hi Trap Protein G亲和层析柱为GE公司产品;HRP-羊抗鼠IgG为博奥森产品。
1.2 病毒、细胞及实验动物 BRSV HJ株由黑龙江八一农垦大学预防兽医实验室分离鉴定;牛轮状病毒(BCV)、牛冠状病毒(BRV)、牛传染性鼻气管炎病毒(IBRV)、牛副流感病毒3型(BPIV3)均由本研究室保存;牛鼻拭子样品采自黑龙江某规模化养殖场;SP2/0细胞为本研究室保存;清洁级体质量1.5 kg~2.0 kg新西兰大白兔和6~8周龄SPF级雌性BALB/c小鼠购自哈尔滨华兴家兔养殖基地。
1.3 重组蛋白的制备及抗体制备
1.3.1 重组G蛋白的制备 将构建的pET30a-G重组质粒转化至大肠杆菌BL21感受态细胞,涂布于LB/Kan+平板,37 ℃培养过夜,挑取阳性克隆接种于含50 μg/mL Kan+的LB液体培养基中,37 ℃ 180 r/min振荡培养12~14 h。按照1∶100的比例将菌液加入到含Kan+的LB液体培养中,37 ℃ 180 r/min振荡培养至OD600值达到0.3~0.4时,取1 mL作为对照,加入IPTG至终浓度为1 mmol/L,继续振荡培养,分别在诱导1 h、2 h、3 h、4 h、5 h、6 h 后各取1 mL菌液,12 000 r/min离心2 min,收集菌体沉淀加入上样缓冲液进行SDS-PAGE电泳,检测蛋白表达量,按照His-Binding-resin说明书纯化重组G蛋白,BCA蛋白浓度测定试剂盒测定纯化的重组蛋白浓度,分装,-80 ℃保存备用。
1.3.2 多克隆抗体的制备 取纯化后的重组蛋白2 mg,与等体积的弗氏完全佐剂充分乳化后皮下多点注射新西兰大白兔。15 d后,与首免相同剂量的抗原和等体积的弗氏不完全佐剂充分乳化,皮下多点注射。30 d后,与二免相同的剂量及接种方式进行接种。37 d后,静脉单独注射相同剂量的蛋白抗原进行加强免疫。加强免疫7 d后,心脏采血分离血清,Western blot和IFA鉴定其特异性,血清按照Protein G亲和层析柱说明书方法进行抗体纯化,分装,-80 ℃保存备用。
1.3.3 单克隆抗体的制备 用纯化的重组蛋白免疫6~8周龄雌性BALB/c小鼠,免疫剂量为100 μg/只,免疫程序参考文献[10],每次免疫间隔时间为2周,融合前3 d,检测小鼠血清抗体效价,效价达到1∶10 000以上时,腹腔单独注射50 μg抗原进行加强免疫。细胞融合后经过3次亚克隆纯化阳性杂交瘤细胞,之后进行扩大培养和冻存。采用SouthernBiotech分型试剂盒对分泌的抗体进行分型,将杂交瘤细胞注射BALB/c小鼠腹腔进行腹水的采集,Western blot和IFA鉴定其特异性,按照Protein G亲和层析柱说明书介绍的方法进行抗体纯化,-80 ℃保存备用。
1.3.4 间接免疫荧光试验 参照文献[11]方法分别验证多克隆抗体和5株单克隆抗体的特异性。
1.4 双抗体夹心ELISA方法的建立
1.4.1 操作程序 用0.05 mmol/L pH9.6的碳酸盐缓冲液稀释单克隆抗体,加入到96孔酶标板内,100 μL/孔,4 ℃包被过夜,次日取出包被好的ELISA板弃尽板中的液体,加入PBST溶液洗涤孔板,200 μL/孔,洗涤3次;每孔加入含5%脱脂乳的PBST溶液200 μL,37 ℃孵育封闭1 h,同样的洗涤方法PBST溶液洗板3次;加入含有5%脱脂乳的PBST 稀释后的纯化的BRSV病毒液加入反应孔内,阴性对照为未感染BRSV病毒的Vero细胞培养液,100 μL/孔,37 ℃孵育1 h,洗板3次;加入稀释后的多克隆抗体,100 μL/孔,37 ℃孵育1 h,洗板3次;加入HRP标记的羊抗兔IgG,100 μL/孔,37 ℃孵育1 h,洗板3次;加入TMB底物显色液,100 μL/孔,室温避光显色15 min;之后加入2 mol/L硫酸终止反应,50 μL/孔,测定OD450值,并计算P/N值。
1.4.2 单抗、多抗浓度筛选 按照方阵滴定法,分别将单克隆抗体稀释至20 μg/mL、10 μg/mL、 5 μg/mL、 2.5 μg/mL、1.25 μg/mL,多克隆抗体稀释至20 μg/mL、10 μg/mL、 5 μg/mL、 2.5 μg/mL,按照上述DAS-ELISA方法操作程序进行检测纯化BRSV病毒液,酶标仪读取OD450值,计算P/N值。
1.4.3 反应条件的优化和包被条件的优化 在下列5种条件下用单克隆抗体包被酶标板:37 ℃封闭1 h、37 ℃封闭2 h 4 ℃过夜、37 ℃封闭1 h 4 ℃过夜、37 ℃封闭2 h 4 ℃过夜,分别进行DAS-ELISA反应,确定最适包被条件。
封闭液种类的优化 分别选择5%脱脂奶粉、10%脱脂奶粉、5%BSA、10%犊牛血清、1%明胶作为封闭液,进行DAS-ELISA反应,计算P/N值,选择最佳封闭液种类。
酶标二抗稀释度的优化 将酶标二抗分别按照1∶1 000、 1∶2 500、1∶5 000、1∶10 000比例进行稀释,按照上述DAS-ELISA方法进行操作,通过分析结果确定最适酶标二抗稀释度。
显色时间的优化 将显色时间分别设为5 min、10 min、15 min、20 min、25 min、30 min,分别进行显色测定OD450值,以确定最佳显色时间。

1.4.5 DAS-ELISA特异性试验 采用优化的DAS-ELISA方法检测本实验室保存的BRSV、BPIV3、IBRV和BCV 4种病毒,同时设BRSV标准阴、阳性对照及细胞培养液空白对照,检测建立的DAS-ELISA方法的特异性。
1.4.6 DAS-ELISA重复性试验 批内重复性试验 以优化的DAS-ELISA方法在同一块酶标板内检测5份BRSV阳性样品,每份重复3孔,计算批内重复性变异系数。
批间重复性试验 用不同批次的单抗分别包被5块酶标板,以同样的方法在5块酶标板上分别检测上述5份BRSV阳性样品,每份重复3孔,计算批间重复性变异系数。
1.4.7 灵敏性试验 将纯化的BRSV病毒定量后,按照1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000倍比稀释,进行DAS-ELISA检测,计算最低病毒检出量。
1.4.8 DAS-ELISA与RT-PCR符合率试验 将本实验室保存的45份牛鼻拭子样品,反复冻融3次,10 000 r/min离心5 min,取上清液,同时采用优化的DAS-ELISA检测方法和RT-PCR对样品进行检测,比较2种方法的检测结果,确定建立的DAS-ELISA与RT-PCR的符合率。
2 结 果
2.1 目的蛋白的表达及纯化 将构建的pET30a-G重组质粒转化至大肠杆菌BL21感受态细胞,对不同的诱导时间进行SDS-PAGE分析,可见最佳诱导时间为4 h,目的蛋白大小约为36 kD (图1),与预期大小相符。用His-Binding-resin对表达产物进行纯化,BCA试剂盒检测纯化后的蛋白浓度为2 mg/mL左右。

1:未诱导的 2:诱导的pET-30a;3~8:经IPTG 诱导后1~6 h表达产物; M:低分子量蛋白Marker1: pET-30a-G without inducing by IPTG; 2: pET-30a;3-8: Expressed products induced by IPTG from 1 to 6 h respectively; M: Protein molecular weight marker.图1 不同诱导时间表达产物SDS-PAGE鉴定结果Fig.1 SDS-PAGE analysis of the expression products of different induction time

1:裂解物上清;2:纯化后的表达产物;M:低分子量蛋白Marker1: Supernatant of lysis; 2: The protein after purification; M: Protein molecular weight marker图2 表达产物纯化结果Fig.2 Purification of the expressed protein
2.2 抗体的纯化鉴定 用rProteinG亲和层析柱对采集的兔血清进行纯化,并测定纯化后的浓度,SDS-PAGE电泳分析可见在55 kD和24 kD有特异性条带(图3),因多克隆抗体为针对不同抗原表位的混合抗体,所以24 kD左右条带呈现均匀弥散状,纯化后浓度为1.3 mg/mL。
小鼠腹腔注射阳性杂交瘤细胞诱生腹水,用rProteinG亲和层析柱进行纯化,进行SDS-PAGE分析,55 kD和24 kD处出现两条特异性条带(图4),分别为重链和轻链。BCA试剂盒测定纯化单克隆抗体浓度,5株单克隆抗体浓度分别为2.1 mg/mL、1.9 mg/mL、 1.7 mg/mL、2.0 mg/mL、1.6 mg/mL。
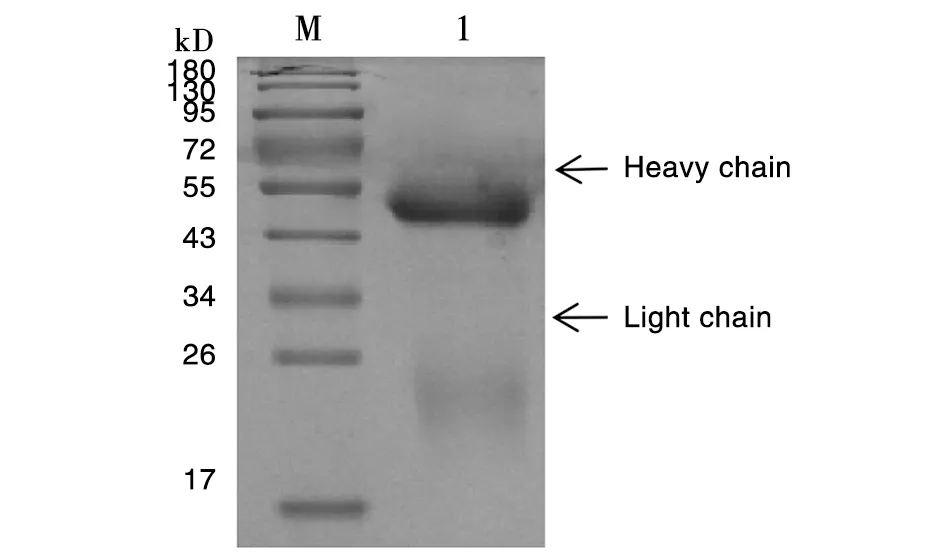
1:纯化的多克隆抗体;M:低分子量蛋白Marker 1: Purified PcAb; M: Protein Molecular Weight Maker 图3 多克隆抗体纯化结果Fig.3 Results of the PcAb after purification

1-5:分别为1E3、2B4、3F6、4B8、5F7腹水纯化SDS-PAGE结果; M:低分子量蛋白Marker 1-5:The results of 1E3,2B4,3F6,4B8,5F7 SDS-PAGE analysis of purified ascites; M: Protein molecular maker 图4 单克隆抗体纯化结果Fig.4 Results of the mAb after purification
2.3 抗体Western blot检测 将纯化的重组G蛋白经SDS-PAGE电泳转膜后,以制备的多克隆抗体作为一抗,与酶标二抗结合,DAB显色。可见36 kD处有特异性条带(图5),与阴性血清无反应,表明抗原和抗体能够很好地结合。
Western blot对5株单抗的特异性进行鉴定,结果显示,在36 kD处出现特异性条带(图6),而SP2/0细胞上清不能与目的蛋白发生特异性结合。

1,2:多克隆抗体;3:阴性对照;M:低分子量蛋白Marker 1,2: PcAb serum; 3: Negative control; M: Protein molecular Maker图5 多克隆抗体Western blot鉴定结果Fig.5 Results of the PcAb of Western blot

1~5:分别为1E3、2B4、3F6、4B8、5F7 杂交瘤细胞培养上清;6:SP2/0细胞培养上清;M:低分子量蛋白Marker 1-5: 1E3,2B4,3F6,4B8,5F7; 6: AP2/0; M: Protein molecular marker图6 单克隆抗体Western blot鉴定结果Fig.6 Results of the mAb of Western blot
2.4 间接免疫荧光检测 分别将多克隆抗体和5株单克隆抗体进行间接免疫荧光检测,检测结果显示多克隆抗体和5株单克隆抗体均与感染BRSV的Vero细胞发生特异性反应,阴性对照无荧光反应(图7)。

A:多克隆抗体;B~F.1E3、2B4、3F6、4B8、5F7;G:阴性兔血清;H:SP2/0细胞培养上清A: PcAb; B-F: 1E3,2B4,3F6,4B8,5F7; G: Negative rabbits serum; H: SP2/0.图7 单克隆抗体、多克隆抗体间接免疫荧光鉴定结果Fig.7 IFA identification of MAbs and PcAb reacted with BRSV
2.5 单抗、多抗最佳工作条件的确定 通过方阵滴定试验测定结果,可见当单抗最佳包被浓度为2.5 μg/mL,多抗最佳工作浓度为5 μg/mL时P/N值最大(表1)。
表1 单抗多抗最适工作浓度的确定
Tab.1 Determination of the optimal concentration of MAb and PAb

多抗工作浓度(μg/mL)ConcentrationofPcAb单抗包被浓度(μg/mL)ConcentrationofmAb201052.51.2520+2.8492.7822.7212.6032.402-0.3530.2980.2560.2350.203P/N8.0719.33610.62911.07711.83310+2.7962.6972.6442.5672.464-0.3400.2810.2050.2020.192P/N8.2249.59812.89812.70612.8315+2.6082.5672.5262.4452.133-0.3150.2630.1910.1760.165P/N7.9629.76013.22513.89212.922.5+2.5632.4792.4572.1421.928-0.2910.2560.1880.1640.153P/N8.8089.68413.06913.06112.601
注: + :阳性;- :阴性
Note:“+”means positive; “-”means negative
分别对包被条件、封闭液种类、酶标二抗浓度、及显色时间等条件进行优化。结果显示,最佳包被条件为4 ℃过夜,最佳封闭液为5%脱脂乳,最佳酶标二抗稀释度为1∶5 000,最佳显色时间为20 min(图8~图11)。

图8 最佳包被条件的选择Fig.8 Optimization temperature and time of coating antibody

图10 最佳酶标二抗稀释度的选择Fig.10 Optimization dilution of enzyme-labeled antibody

图9 最佳封闭液的选择Fig.9 Selection for optimal blocking reagents

图11 最佳显色时间的选择Fig.11 Determination of substrate optimal reaction time

2.8 特异性试验 试验结果表明,建立的DAS-ELISA方法与BCV、BRV、IBRV以及BPIV3均无交叉反应(表2),表明该方法特异性良好。
2.9 重复性试验 对5份阳性样品分别进行批内重复性试验和批间重复性试验,试验结果表明批内重复性试验变异系数为3.79%~4.12%,批间重复性试验变异系数为2.96%~6.55%,变异系数均小于10%(表3),表明建立的DAS-ELISA方法重复性良好。
2.10 灵敏性试验 用建立的DAS-ELISA法检测倍比稀释后的病毒液,结果表明随着稀释度的增大其OD450值呈线性下降,当稀释度为1∶32 000(病毒含量1.43 μg/mL)时,结果为阳性,而当稀释度为1∶64 000(病毒含量0.71 μg/mL)时,结果为阴性(表4)。表明建立的DAS-ELISA法最低检测量为1.43 μg/mL,具有较高的灵敏度。
表2 双抗体夹心ELISA方法特异性试验
Tab.2 Result of specific test for DAS-ELISA

待测样品SamplesBRSVBCVBRVIBRVBPIV3OD4502.3980.1640.1820.1920.127P/N13.5711.3151.2451.3021.073S0.0180.0210.0230.0190.022结果判定Result+----
注: + :阳性;- :阴性
Note:“+”means positive; “-”means negative
表3 DAS-ELISA方法重复性试验
Tab.3 Repeatability assay for DAS-ELISA

样品Sampleno.批间重复Introbatch批内重复Interbatchx±SCVx±SCV12.431±0.0214.052.397±0.0203.9322.423±0.0223.932.413±0.0224.0732.392±0.0173.862.425±0.0196.5542.386±0.0194.122.419±0.0233.7452.296±0.0153.792.422±0.0172.96
表4 DAS-ELISA法灵敏性试验结果
Tab.4 Sensitivity test results of DAS-ELISA

BRSV稀释倍数DilutionofBRSV病毒含量(μg/mL)ConcentrationsofthevirusOD450ValueofOD450P/N值ValueofP/N标准差S结果Result1∶100045.762.57714.150.020+1∶200022.882.32512.770.021+1∶400011.442.10411.560.019+1∶80005.721.5278.3900.015+1∶160002.861.0315.6640.018+1∶320001.430.4932.7080.016+1∶640000.710.2011.1040.014-空白对照0.000.182-
注: + :阳性;- :阴性
Note:“+”means positive; “-”means negative
2.11 符合率试验 45份疑似BRSV感染的牛鼻拭子同时使用DAS-ELISA检测方法和RT-PCR检测方法进行检测,结果见表5。在DAS-ELISA中,23份样品被确定为阳性,在RT-PCR中,25份样品被确定为阳性,两种方法的敏感性、特异性、符合率分别为92.0%、100%、95.6%。
表5 DAS-ELISA方法与RT-PCR方法符合率结果
Tab.5 The coincidence rate of DAS-ELISA method and RT-PCR method

RT⁃PCR检测结果RT⁃PCRtestresultsDAS⁃ELISA检测结果DAS⁃ELISAtestresults阳性阴性总数阳性23225阴性02020总数232245
3 讨 论
近年来,随着我国养牛业的不断发展,需不断地从国外引进优质奶牛,而我国未将BRSV列入检疫范围,市场上也无商品化疫苗,因此及时检测出BRSV病毒,尽早淘汰BRSV阳性牛,对我国养牛业的发展意义重大。目前国内外报道的牛呼吸道合胞体病毒的诊断方法主要有病毒的分离鉴定、血清中和实验、补体结合实验、免疫荧光检测、RT-PCR方法等,而病毒的分离鉴定作为病毒检测的“黄金标准”,但病毒分离周期长,成本高,因此不适合临床样品大批量的检测,上述其他检测方法均需专业设备、特殊试剂、专业人员,因此基层大规模检测难以普及。有研究表明BRSV暴发后会出现很高的血清转换可达22%~53%[12],因此只检测BRSV抗体会出现假阳性结果,因此抗原的检测对于确定是否感染BRSV是必要的。而DAS-ELISA检测方法是测定抗原的一种常用的方法,与普通ELISA不同之处为多加了一层抗体,因此提高了检测的特异性[13]。
双抗体夹心ELISA(DAS-ELISA)方法在基层临床大规模检测中使用比较普及[14],近年来我国学者分别对牛传染性鼻气管炎病毒[15-16]、牛疱疹病毒[17]、牛病毒性腹泻病毒[18]建立了DAS-ELISA检测方法,用该方法同IDEXX公司抗原检测试剂盒和RT-PCR检测同一批临床样品,符合率均很高,可用于临床样品的检测。本实验室曾成功建立了牛轮状病毒DAS-ELISA检测方法[19]和牛副流感病毒3型DAS-ELISA检测方法[13],经临床样品检测该方法与RT-PCR试验相比符合率分别为95%和94.6%,为临床的检测和开展病原学研究奠定了一定的基础。而有关BRSV的DAS-ELISA检测方法还未见报道,因此本研究在冯军科等对BRSV G基因截短表达的基础上选用具有抗原性的G1段基因进行表达,原核表达的蛋白制备的抗体滴度较高且具有较好的反应原性[19],因此利用原核表达的G蛋白作为抗原制备兔抗G蛋白高免多克隆抗体和鼠抗G蛋白单克隆抗体,获得5株分泌抗体亚类均为IgG1型κ链的单克隆细胞株,利用获得的抗体进行建立检测BRSV的DAS-ELISA检测方法,因该方法具有较高的敏感性,选用同动物源的抗体会产生非特异性,因此选用1株单克隆抗体和多克隆抗体分别作为捕获抗体和检测抗体,大大的降低了非特异性,经不断传代和细胞冻存复苏,间接ELISA检测1E3杂交瘤细胞分泌抗体最为稳定,因此选择1E3为捕获抗体,多克隆抗体为检测抗体。通过方阵滴定试验对抗体的浓度进行摸索,确定单抗浓度2.5 μg/mL,多抗5 μg/mL时效果最好,并对包被条件、封闭液种类、酶标二抗稀释度、显色时间等进行了进一步的优化,提高了其敏感性,建立的DAS-ELISA方法与牛轮状病毒、牛冠状病毒、牛传染性鼻气管炎病毒、牛副流感病毒3型无交叉反应,特异性良好,最低可检出1.43 μg/mL BRSV病毒。用建立好的DAS-ELISA检测方法检测45份样品,与RT-PCR方法的敏感性、特异性、符合率分别为92.0%、100%、95.6%。本研究建立的DAS-ELISA检测方法准确度高、重复性好、敏感度高,能在短时间内直接检测样品中BRSV抗原,较其他检测方法更为省时省力,适用于兽医基层大批量样本的检测,为BRSV的流行病学调查和诊断提供了有效的技术手段。
[1] Taylor G,Wyld S,Valarcher JF,et al. Recombinant bovine respiratory syncytial virus with deletion of the SH gene induces increased apoptosis and pro-inflammatory cytokinesinvitro,and is attenuated and induces protective immunity in calves[J]. J General Virol,2014,95(6): 1244-1254. DOI: 10.1099/vir.0.064931-0
[2] Sarmiento-Silva RE,Nakamura-Lopez Y,Vaughan G. Epidemiology,molecular epidemiology and evolution of bovine respiratory syncytial virus[J]. Viruses,2012,4(12): 3452-3467. DOI: 10.3390/v4123452
[3] Wang H,Hou XL,Piao FZ. Isolation and identification of bovine respiratory syncytial virus[J]. Acta Veterinaria et Zootechnica Sinica,2009,40(9): 1414-1419. (in Chinese)
王红,侯喜林,朴范泽. 牛呼吸道合胞体病毒的分离鉴定[J]. 畜牧兽医学报,2009,40(9): 1414-1419.
[4] Shi HF,Zhu YM,Gao YR,et al. Detection of bovine respiratory syncytial virus by a reverse transcriptase-nested-polymerase chain reaction in bovine clinical samples[J]. Chin J Pre Vet Med,2010,32(3): 238-240. (in Chinese)
史鸿飞,朱远茂,高欲燃,等. 套式RT-PCR检测牛呼吸道合胞体病毒的研究[J]. 中国预防兽医学报,2010,32(3): 238-240.
[5] Ma L. Preparation of monoclonal antibody against nucleoprotein of bovine respiratory syncytial virus,and experimental infection of guinea pig with the virus[D]. Beijing: CAAS,2013. (in Chinese)
马磊.牛呼吸道合胞体病毒单抗的制备和实验感染豚鼠的研究[D].北京:中国农业科学院,2013.
[6] Ma L,Zhu YM,Cai H,et al. Prokaryotic expression and preparation of monoclonal antibody of the nucleoprotein of bovine respiratory syncytial virus (BRSV)[J]. J Chin Biotechnol,2012,32(12): 20-24. DOI: 10.13523/j.cb.20121204 (in Chinese)
马磊,朱远茂,蔡红,等.牛呼吸道合胞体病毒核蛋白的表达及其单克隆抗体的制备[J].中国生物工程杂志,2012,32(12): 20-24.
[7] Hägglund S,Hu K,Blodörn K,et al. Characterization of an experimental vaccine for bovine respiratory syncytial virus[J]. Clin Vaccine Immunol,2014,21(7): 997-1004. DOI: 10.1128/CVI.00162-14
[8] Brady RP,Topliff CL,Kelling CL.Invitroexpression of full-length and truncated bovine respiratory syncytial virus G proteins and their antibody responses in BALB/c mice[J]. Vaccine,2004,22(27/28): 3762-3768. DOI:10.1016/j.vaccine.2004.03.020
[9] Feng JK,Xue F,Li J. Expression and identification truncated glycoprote in G of bovine respiratory syncytial virus inEscherichiacoli[J]. J Chin Biotechnol,2008,28(12): 24-29. DOI: 10.13523/j.cb.20081205 (in Chinese)
冯军科,薛飞,李娇.牛呼吸道合胞体病毒G蛋白的截短表达与鉴定[J].中国生物工程杂志,2008,28(12): 24-29.
[10] Chen H,Ou Q,Tang Y,et al. Development and evaluation of a DAS-ELISA for rapid detection ofTembusuvirus using monoclonal antibodies against the envelope protein[J]. PLoS One,2014,9(5): e96366. DOI: 10.1371/journal.pone.0096366
[11] Yang Q,Zhang Q,Tang J,et al. Lipid rafts both in cellular membrane and viral envelope are critical for PRRSV efficient infection[J]. Virology,2015,484: 170-180. DOI: 10.1016/j.virol.2015.06.005
[12] Weng SG. Epidemic and diagnosis of bovine respiratory syncytial virus (BRSV)[J]. China Dairy Cattle,2013,8: 45-47. (in Chinese)
翁善钢. 牛呼吸道合胞体病毒的流行与诊断[J]. 中国奶牛,2013,8: 45-47.
[13] Li LY,Li YT,Yu LY,et al. Establishment and evaluation of a double antibody sandwich ELISA for detecting bovine parainfluenza virus type 3[J]. Chin J Pre Vet Med,2016,38(2): 122-136.DOI: 10.3969/j.issn.1008-0589.2016.02.11(in Chinese)
李丽阳,李艳婷,余丽芸,等.牛副流感病毒3型双抗体夹心ELISA检测方法的建立[J]. 中国预防兽医学报,2016,38(2): 122-136.
[14] Niu HM,Huang XM,Han KK,et al. Development of double antibody sandwich ELISA for detection of duck or goose Flavivirus[J]. JIA,2013,12(9): 1638-1643.
[15] Zhou YH. Identification of an antigen epitope on the glycoprotein with monoclonal antibody and establishment of a double antibody sandwich ELISA for detection for infectious bovine rhinotracheitis viru[D].Beijing: CAAS,2015. (in Chinese)
周跃辉.牛传染性鼻气管炎病毒糖蛋白gD单抗制备及其抗原表位鉴定与双抗夹心ELISA的建立[D].北京:中国农业科学院,2015.
[16] Ma H,Bian CZ,Wang YF,et al. Development and preliminary application of monoclonal antibody against IBRV gC and identification of its biological characteristic[J]. Acta Veterinaria et Zootechnica Sinica,2013,44(10): 1637-1644. DOI: 10.11843/j.issn.0336-6964.2013.10.018 (in Chinese)
马辉,边传周,王永芬,等. 牛传染性鼻气管炎病毒gC蛋白单克隆抗体的制备与初步应用[J]. 畜牧兽医学报,2013,44(10): 1637-1644.
[17] Li YL. Development of monoclonal antibodies against BHV-1 gB and establishment of double-antibody sandwich ELISA method[D]. Yangzhou: Yangzhou University,2013. (in Chinese)
李艳莉.牛疱疹病毒Ⅰ型gB基因的单克隆抗体制备及双抗体夹心ELISA检测方法的建立[D]. 扬州:扬州大学,2013.
[18] Li Z,Ma SQ,Chen WF,et al. Establishment and preliminary application of the sandwich ELISA method for quick detection of bovine viral diarrhea virus[J]. J Gansu Agr Univ,2012,47(3): 13-19. DOI: 10.13432/j.cnki.jgsau.2012.03.028 (in Chinese)
李倬,马省强,陈文芳,等. 牛病毒性腹泻病毒夹心ELISA快速检测方法的建立与初步应用[J]. 甘肃农业大学学报,2012,47(3): 13-19.
[19] Hou MR. Isolation and identification of bovine rotavirus and establishment of double antibody sandwich ELISA[D]. Daqing: Heilongjiang Bayi Agricultural University,2011. (in Chinese)
侯美如. 牛轮状病毒的分离鉴定及其双抗体夹心ELISA方法建立[D]. 大庆:黑龙江八一农垦大学,2011.
[20] Cai L,Zhang H,Gao LD,et al. Cloning and expression of hantavirus nucleoprotein gene of Hunan03 and its immunogenicity[J]. Chin J Zoonoses,2016,32(08): 711-716. DOI: 10.3969/j.issn.1002-2694.2016.08.006 (in Chinese)
蔡亮,张红,高立冬,等. 汉坦病毒Hunan03株S基因克隆、表达及核蛋白免疫原性分析[J]. 中国人兽共患病学报,2016,32(08): 711-716.
Establishment and evaluation of DAS-ELISA for detecting bovine respiratory syncytial virus
LI Yan-ting,HOU Xi-lin
(CollegeofAnimalScienceandVeterinaryMedicine,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China)
In order to develop a double antibody sandwich assay (DAS-ELISA) for detecting bovine respiratory syncytial virus (BRSV),New Zealand white rabbits and BALB/c mice were immunized with the purified G protein as an antigen to prepare anti-G protein polyclonal and monoclonal antibodies. The antibody concentration and reaction conditions of DAS-ELISA were optimized by square titration,and its sensitivity,specificity,and coincidence rate were validated. Five hybridoma were stably secreting MAb which subclass belonged to IgG1κ. Western blot and IFA test showed that PcAb and MAb could react specifically with G protein and BRSV. The PcAb and MAb as the capture antibody and detection antibody respectively,and their optimal working concentrations were determined to be 2.5 μg/mL and 10 μg/mL,the critical value 0.22 and the detection limit of 1.43 μg/mL,batch,inter-assay coefficient of variation less than 10%. The DAS-ELISA had no cross-reaction with several pathogens which often caused bovine respiratory disease. When 45 nasal swabs of clinical samples were simultaneously detected by the DAS-ELISA and RT-PCR,the sensitivity,specificity and coincidence rate were 92.0%,100%,95.6%,respectively. It’s indicated that the established DAS-ELISA detection method can be used to detect a large number of clinical samples. It was the foundation of monitoring and quick diagnosis for BRSV.
bovine respiratory syncytial virus; G protein; polyclonal antibody; monoclonal antibody; DAS-ELISA
Hou Xi-lin,Email: xly_hou@163.com
黑龙江八一农垦大学研究生创新科研项目(No. YJSCX2016-Y18)和黑龙江省教育厅资助项目(No. 12521372)联合资助
侯喜林,Email:xly_hou@163.com
黑龙江八一农垦大学动物科技学院,大庆 163319
10.3969/j.issn.1002-2694.2017.07.011
R373.1
A
1002-2694(2017)07-0628-09
2016-12-21 编辑:张智芳
Supported by the Graduate Student Innovation Research Project in Heilongjiang Bayi Agricultural University (No. YJSCX2016-Y18) and the Funded Projects by Department of Education in Heilongjiang Province (No. 12521372)
