基于HPLC分析柴胡黄芩配伍的主要化学成分研究
2017-07-31戴培慧马瑞莲高佳丽刘天龙
戴培慧 马瑞莲 高佳丽 刘天龙
(内蒙古医科大学附属医院药剂部,呼和浩特,010050)
基于HPLC分析柴胡黄芩配伍的主要化学成分研究
戴培慧 马瑞莲 高佳丽 刘天龙
(内蒙古医科大学附属医院药剂部,呼和浩特,010050)
目的:基于高效液相色谱法(High Performance Liquid Chromatography,HPLC)分析柴胡黄芩配伍的主要化学成分,阐释中药合理配伍的科学内涵。方法:采用HPLC指纹图谱分析进行精密度试验测试HPLC仪器的精密度;重复性试验测试HPLC指纹图谱方法的重复性;稳定性试验测试样品的稳定性。HPLC指纹图谱:取10批柴胡黄芩,精密吸取5 μL按照供试品溶液制备方法制备供试品溶液,根据色谱条件依次测定并记录10批柴胡黄芩配伍的色谱图。结果:1)柴胡黄芩精密度试验中峰面积大于总峰面积5%的峰有22、30、36和47号峰。2)重复试验和稳定性试验中各主要色峰的相似度均大于0.99,显示良好的重复性和稳定性。3)10批柴胡黄芩HPLC指纹图谱中大于总峰面积5%的共有峰面积为22、30、36、47号色谱峰,且10批柴胡黄芩配伍的药液相似度均>0.99,显示相似度良好。4)柴胡黄芩配伍的水煎液中,大多数物质归属柴胡,45 min以后的色谱峰是柴胡的特征峰,而15~45 min多集中了黄芩的特征峰;主要化学成分为柴胡皂苷a和黄芩苷。结论:柴胡黄芩配伍的水煎液中主要化学成分为柴胡皂苷a和黄芩苷。
HPLC;柴胡;黄芩;配伍;化学成分
化学研究药物的成分及药代动力学是药物配伍(包括药对)在不同层面及角度的的研究手段,是研究方剂的突破口[1-4]。药对是人类反复临床实践的结晶,是病患相应症候的真实反映,亦是中药复方的关键之所在,因此对药对的探索是研究中药复方的基础,利用现代技术手段研究药对配伍及其化学成分的变化规律是继“拆解古方”及“组合新方”后又一研究中药复方的新重点[5-8]。
柴胡-黄芩药对首载于医圣张仲景名著《伤寒论》中小柴胡汤方中,是和解少阳的经典名方,目前仍被广泛运用。张仲景认为柴胡-黄芩是和解少阳的基本结构,二药合用可“透泄半表之邪、清散半里之热”,后世医家更是在此配伍特点的启发下开发大量相关中成药,并通过临床或者动物实验证实柴胡、黄芩药对的疗效[9-13]。今我们化学研究手段对柴胡-黄芩进行化学成分变化规律进行分析,以期进一步探讨改药对药效作用的最佳配伍关系,现将结果报道如下。
1 仪器与试药
1.1 仪器 高效液相(HPLC)(Agilent 1100型高效液相色谱仪)。
1.2 试剂 乙腈,0.1%磷酸。
2 方法与结果
2.1 色谱条件 精密量取20 μL的样品进样量或对照品溶液,采用250 mm×4.6 mm,4 μm的色谱柱(Synergi Hydro-RP C18柱),在乙腈和0.1%磷酸的流动相中,流速为1 mL/min,柱温为25 ℃,根据高效液相色谱仪指纹图谱的梯度洗脱程序进行试验。见表1。
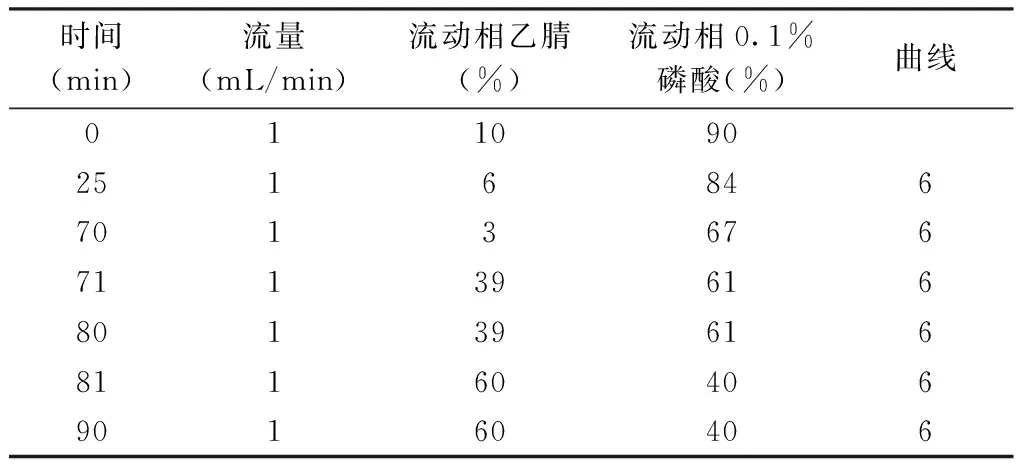
表1 HPLC指纹图谱梯度洗脱程序(检测波长未315 nm)
2.2 供试品溶液制备 柴胡药用部位为伞形科植物柴胡或狭叶柴胡的干燥根,黄芩药用部分为唇形科黄芩属多年生草本植物的干燥根,柴胡黄芩采用1∶1配伍,采用回流法煎煮,于敞口药盆中称取20 g柴胡加200 mL水,浸泡30 min,煮沸后文火45 min再加入等量黄芩,煮沸后文火15 min,取100 mL药液,在60 ℃下减压浓缩,定容至50 mL,折合柴胡黄芩药物水煎液浓度未0.2 g/mL。取5 mL柴胡黄芩浓缩液用100%甲醇定容10 mL,混合均匀,取2 mL离心取上清液在0.45 μm超微膜滤过即可。见图1。
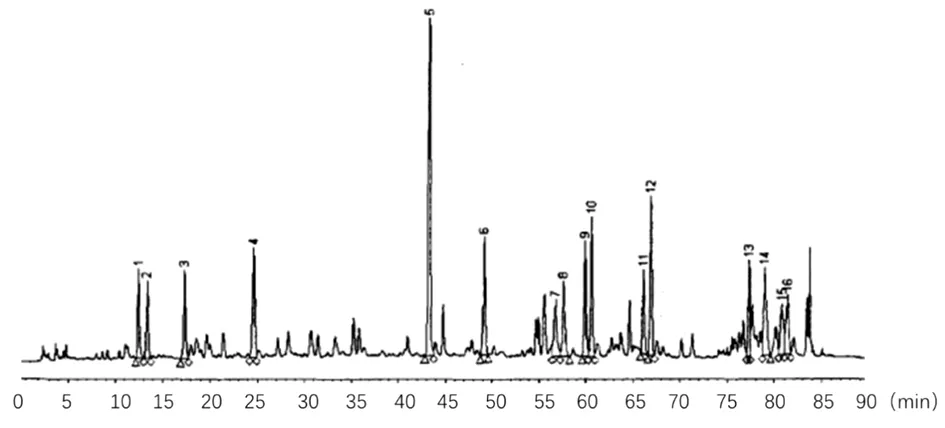
图1 柴胡黄芩配伍水煎液HPLC图谱主要色谱峰
2.3 内参峰S峰的选择 目前供柴胡和黄芩HPLC测定用的对照品有柴胡皂苷a和黄芩苷,但由于柴胡皂苷a和黄芩苷在水煎液中的含量较低,故不宜做本研究的内参峰S,因此根据图1中吸收峰面积最大,保留时间最长的43 min左右的5号峰作为本研究的内参峰S。
2.4 高效液相(HPLC)指纹图谱分析
2.4.1 精密度试验 取同一供试品溶液根据2.2制备的供试品溶液,依照2.1的色谱条件,连续5次进样,测试HPLC仪器的精密度。
2.4.2 重复性试验 取同一供试品溶液根据2.2制备的供试品溶液,依照2.1的色谱条件,连续5次进样,测试HPLC指纹图谱方法的重复性。
2.4.3 稳定性试验 取同一供试品溶液根据2.2制备的供试品溶液,依照2.1的色谱条件,连续5次进样,测试样品的稳定性。
2.4.4 指纹图谱 取10批柴胡黄芩,精密吸取5 μL按照供试品溶液制备方法制备供试品溶液,根据色谱条件依次测定并记录10批柴胡黄芩配伍的色谱图。为了分析柴胡黄芩配伍的主要化学成分,根据2.2供试品溶液制备方法,分别单独制区远志水煎液(0.2 g/mL)和厚朴水煎液(0.2 g/mL)。
2.5 数据处理 根据国家药典委员会提出的中药指纹图谱相似度评价系统2004A进行相似度分析,采用MATLAB软件进行数据处理和统计。
2.6 样品测定结果
2.6.1 精密度考察结果 柴胡黄芩精密度试验中各色谱峰相对保留时间和峰面积见图2,其中峰面积大于总峰面积5%的峰有22、30、36和47号峰。见表2。
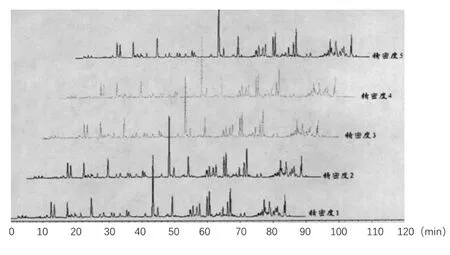
图2 精密度试验各色谱图
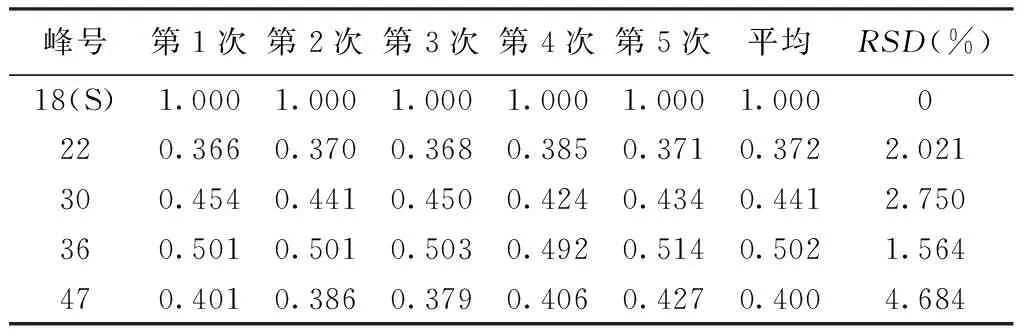
峰号第1次第2次第3次第4次第5次平均RSD(%)18(S)1.0001.0001.0001.0001.0001.0000220.3660.3700.3680.3850.3710.3722.021300.4540.4410.4500.4240.4340.4412.750360.5010.5010.5030.4920.5140.5021.564470.4010.3860.3790.4060.4270.4004.684
2.6.2 重复试验考察结果 由图3和表3可知,重复试验中各主要色峰的相似度均大于0.99,显示良好的重复性。
2.6.3 稳定性考察结果 由图3和表3可知,稳定性试验中各主要色峰的相似度均大于0.99,显示良好的稳定性。

图3 重复试验考察结果
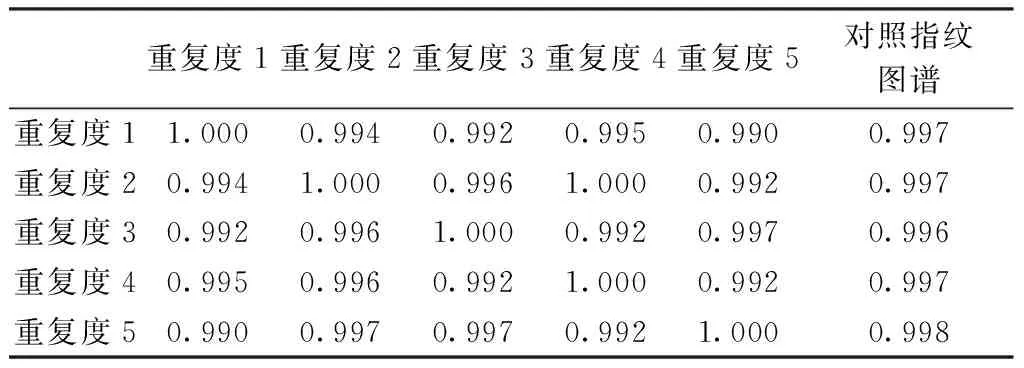
重复度1重复度2重复度3重复度4重复度5对照指纹图谱重复度11.0000.9940.9920.9950.9900.997重复度20.9941.0000.9961.0000.9920.997重复度30.9920.9961.0000.9920.9970.996重复度40.9950.9960.9921.0000.9920.997重复度50.9900.9970.9970.9921.0000.998
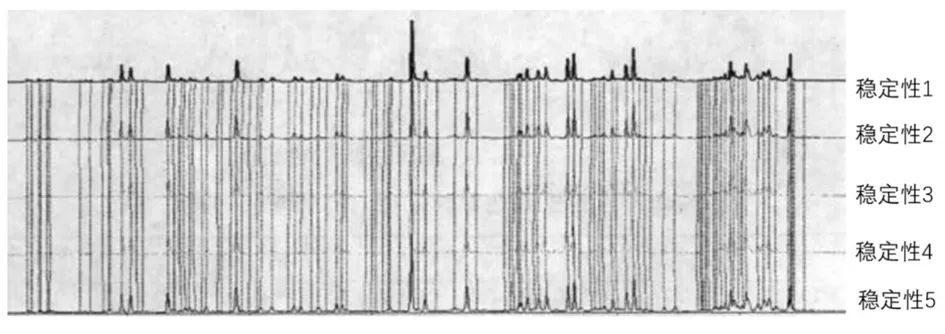
图4 稳定性考察结果
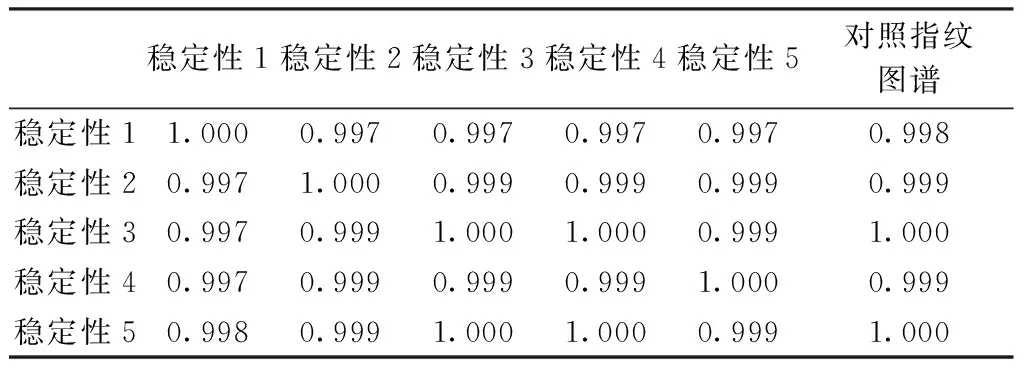
稳定性1稳定性2稳定性3稳定性4稳定性5对照指纹图谱稳定性11.0000.9970.9970.9970.9970.998稳定性20.9971.0000.9990.9990.9990.999稳定性30.9970.9991.0001.0000.9991.000稳定性40.9970.9990.9990.9991.0000.999稳定性50.9980.9991.0001.0000.9991.000

图5 10批柴胡黄芩HPLC指纹图谱
2.6.4 10批柴胡黄芩水煎液的指纹图谱 10批柴胡黄芩水煎液HPLC指纹图谱详见图5、表5、表6,10批柴胡黄芩HPLC指纹图谱中大于总峰面积5%的共有峰面积为22、30、36、47号色谱峰,且10批柴胡黄芩配伍的药液相似度均>0.99,显示相似度良好。
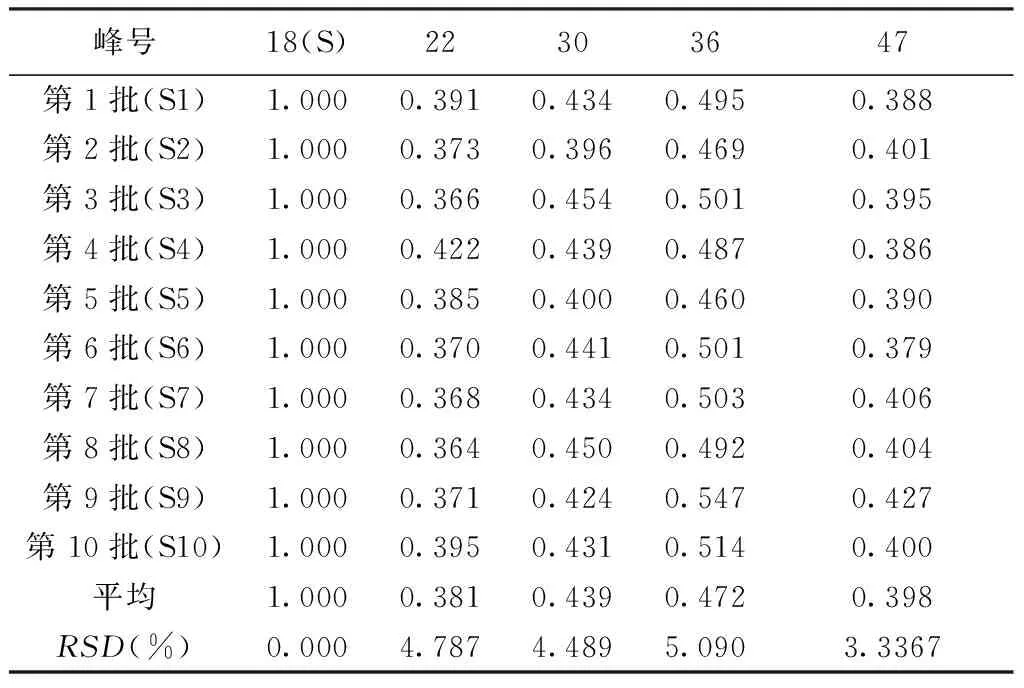
表5 10批柴胡黄芩HPLC指纹图谱中大于 总峰面积5%的共有峰面积
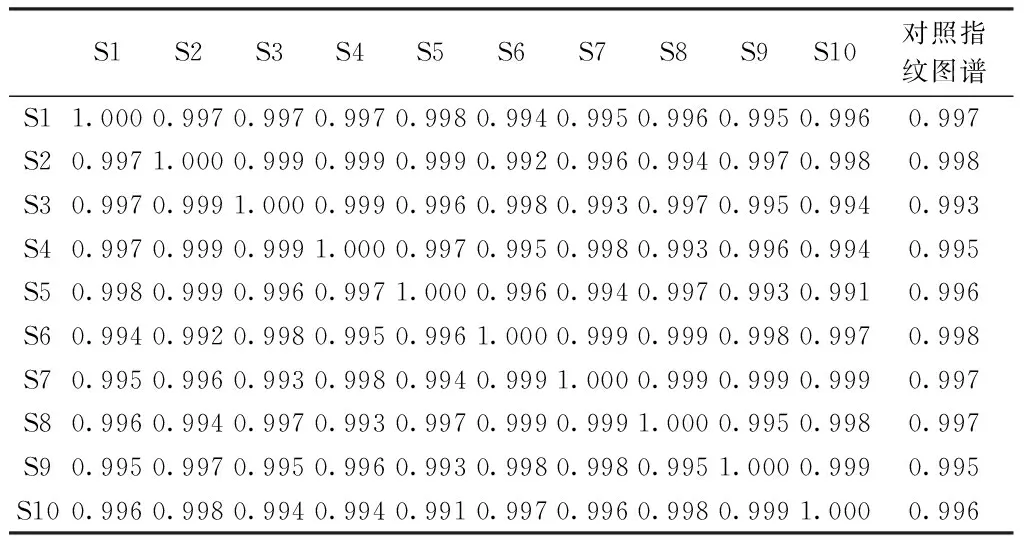
表6 10批柴胡黄芩药液相似度结果
2.6.5 柴胡黄芩配伍HPLC指纹图谱各主要化学成分分析 由图6、7可得,柴胡黄芩配伍的水煎液中,大多数物质归属柴胡,45 min以后的色谱峰是柴胡的特征峰,而15~45 min多集中了黄芩的特征峰,主要化学成分为柴胡皂苷a和黄芩苷。
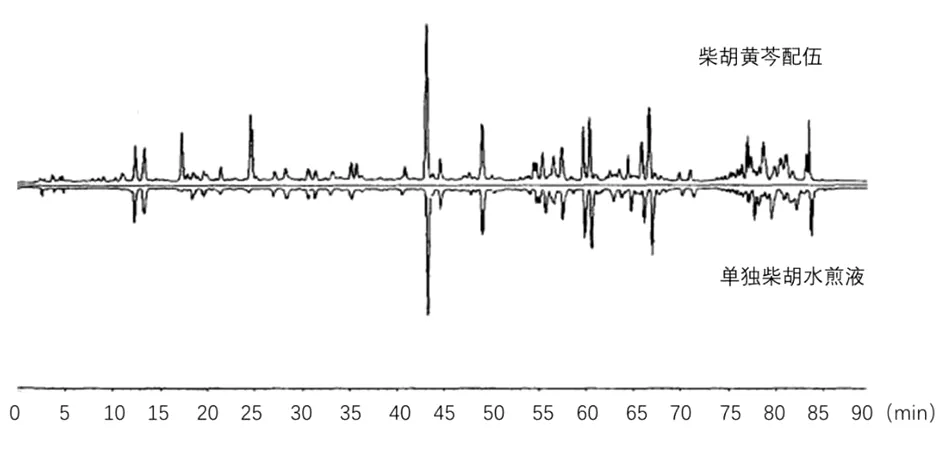
图6 柴胡黄芩配伍中归属于柴胡所含化学成分的指纹图谱
3 讨论
药对配伍是复方发挥临床疗效的核心,大量临床文献已证实柴胡、黄芩药对配伍有协同增强疗效的作用[14-15],本研究对该药对的化学成分物质变化情况进行探析。基于HPLC技术测定柴胡、黄芩配伍前后柴胡的主要有效成分柴胡皂苷a和黄芩主要有效物质是黄芩苷的含量。本研究利用乙腈和0.1%磷酸进行梯度洗脱,结果显示分离效果理想,保留时间适中。在所选择的色谱柱条件下我们发现柴胡及黄芩各成分分离度高,色谱峰尖锐,分离时间亦理想,实验结果充分可靠。该研究采用各地的10批柴胡及黄芩进行指纹图谱检查分析,结果显示不同批次的图谱结果基本一致,在相似度检测中各批药材的相似度尚可,这说明经过国家药物质量监督部分的努力,现中药药材市场上的柴胡及黄芩质量较前明显改善。
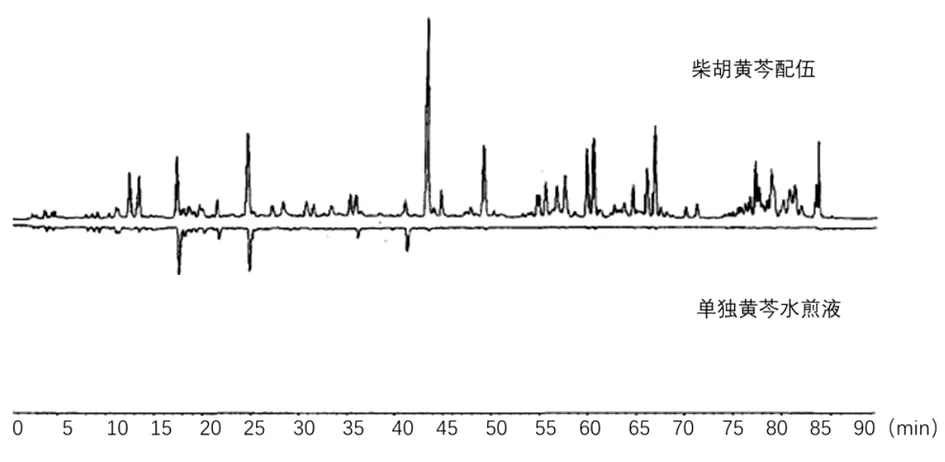
图7 柴胡黄芩配伍中归属于黄芩所含化学
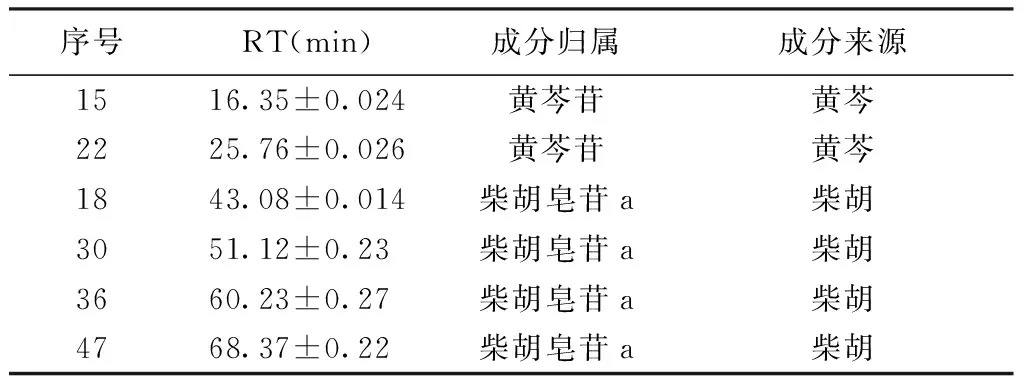
序号RT(min)成分归属成分来源1516.35±0.024黄芩苷黄芩2225.76±0.026黄芩苷黄芩1843.08±0.014柴胡皂苷a柴胡3051.12±0.23柴胡皂苷a柴胡3660.23±0.27柴胡皂苷a柴胡4768.37±0.22柴胡皂苷a柴胡
本研究在获取的色谱的条件下快速、准确的分析柴胡、黄芩及其同煎液的化学成分,实验结果体现了该方法具有理想的精密度、可重复性及稳定性,在药液煎煮过程中并无产生新的化学成分,10批柴胡的主要成分均是柴胡皂苷a,而黄芩的主要成分也只是黄芩苷,这说明此次研究的柴胡及黄芩药材稳定均一,在有效化学成分分析中我们发现柴胡黄芩配伍的水煎液中,大多数物质归属柴胡,45 min以后的色谱峰是柴胡的特征峰,而15~45 min多集中了黄芩的特征峰,因此我们认为该要对的理想煎煮时间应集中于15~45 min,才可充分体现柴胡、黄芩的最大药效。
HPLC完整体现了柴胡、黄芩的组成特征,同时验证了该药对产生最大药物效价的时间,以期指导临床运用。
[1]罗国安,梁琼麟,王义明.中药指纹图谱质量评价质量控制与新药研发[M].北京:化学工业出版社,2009.
[2]顾英,冯怡,李玉敏.指纹图谱在中药物质基础研究中的应用[J].中成药,2007,29(7):1048-1051.
[3]李绍平,赵静,钱正明,等.色谱技术在中药有效成分辨识中的应用进展[J].中国科学:化学,2010,40(6):651-667.
[4]戴岳,张聪,林已笼,等.黄芩总苷对大鼠急慢性前列腺炎影响的实验研究[J].中医药学刊,2003,21(3):386-387.
[5]孙世君.柴胡的药理学分析以及临床应用[J].中国医药指南,2010,8(29):210-211.
[6]Li W,Guo J,Tang Y,Wang H,et a1.Phannacokinetic Compison of Femlic Acid in Normal and Blood Deficiency Rats after Oral Administration of Angelica sinensis,Ligusticum chuanxiong and Their Combination[J].Int J Mol Sci,2012,13(3):3583-3597.
[7]Xiong YH,Hu K,Wang M.Analysis of essential oil in herbal pair Artemisia annua——Agastache rugosa by GC-MS and chemometric resolution method[J].Acta Pharmaceutica Sinica,2009,44(11):1267-1272.
[8]Shi XQ,Shang EX,Tang YP,et a1Interaction of nourishing and tonifying blood efects of the combination ofAngelicae sinensis Radix and Astragali Radix studied by response surface method[J].Acta Pharmaceutica Sinica,2012,47(10):1375-1383.
[9]张智华.柴胡黄芩药对古今运用比较[C].中华中医药学会中医方证基础研究与临床应用学术研讨会论文集,北京:中华中医药学会,2008.
[10]刘琳娜,戚志华,郭志伟,等.小柴胡汤滴丸质量标准研究[J].实用药物与临床,2012,15(11):742-743.
[11]李敏,王斌,侯建平,等.柴胡、黄芩及其配伍抗大鼠肝纤维化作用研究[J].天津中医药,2012,29(6):576-578.
[12]王宪龄,周志.试探柴胡黄芩药对清泄肝胆的配伍作用[J].中医研究,2009,22(6):6-9.
[13]王宪龄,李连珍,牛万强.柴胡与黄芩不同剂量比例配伍对扑热息痛所致小鼠急性肝损伤的保护作用[J].河南中医,2004,24(8):15-17.
[14]刘博,杨向东,史自东.HPLC法测定大柴胡颗粒中黄芩苷含量[J].湖北中医杂志,2007,29(5):51-52.
[15]王一飞,王广基,佟玲,等.北柴胡药材的HPLC指纹图谱研究[J].安徽农业科学,2012,40(23):11558-11559.
(2017-03-31收稿 责任编辑:张文婷)
Study on Main Chemical Components from Compatibility of Chaihu and Huangqin by HPLC
Dai Peihui, Ma Ruilian, Gao Jiali, Liu Tianlong
(Pharmacydepartment,AffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohehot010050,China)
Objective:To analyze the main chemical components from compatibility of Chaihu and Huangqin by HPLC and to explain the scientific connotation of rational compatibility. Methods:High performance liquid chromatography (HPLC) fingerprint was used for test precision of HPLC instrument. Repeatability of HPLC fingerprint method was test and sample stability was also tested. HPLC fingerprint:Ten batches of Chaihu and Huangqin were taken and 5 μL solution was prepared according to the conditions of chromatography and the chromatogram. Fingerprint of compatibility of Chaihu and Huangqin was determined and recorded. Results:1) The peak areas in the precision test over 5% of the total peak area were No. 22, 30, 36 and 47. 2) The similarity of the main color peaks in the repeatability test and the stability test was greater than 0.99, which showed good repeatability and stability. 3) The total peak areas of the HPLC fingerprint of the ten batches of Chaihu and Huangqin greater than the total peak area were No. 22, 30, 36, and 47 and the similarity of the chemical compatibility of the ten batches of Chaihu and Huangqin was above 0.99, showing a good similarity. 4) Most substances in the decoction of Chaihu with Huangqin came from Chaihu and chromatographic peak after 45 min was the characteristic peak of Chaihu, while characteristic peak of Huangqin mainly appeared during 15~45 min. The main chemical components were saikosaponin a and baicalin. Conclusion:The main components in decoction of Chaihu and Huangqin were saikosaponin a and baicalin.
HPLC; Chaihu; Huangqin; Compatibility; Chemical composition
内蒙古教育厅课题(NJZY4157)
戴培慧(1971.06—),女,大学本科,研究方向:中西医药学,E-mail:925873412@qq.com
R284.1
A
10.3969/j.issn.1673-7202.2017.07.046
