磁共振T2Flair像下扩大切除脑胶质母细胞瘤
2017-07-31贺小军赖名耀邓星海卢建侃
周 辉,鲁 明,贺小军,赖名耀,邓星海,卢建侃
广东三九脑科医院1神经外五科,2肿瘤综合治疗中心,广东 广州 510510
磁共振T2Flair像下扩大切除脑胶质母细胞瘤
周 辉1,鲁 明1,贺小军1,赖名耀2,邓星海1,卢建侃1
广东三九脑科医院1神经外五科,2肿瘤综合治疗中心,广东 广州 510510
目的探究在磁共振T2Flair序列范围下扩大切除脑胶质母细胞瘤并辅助放化疗对患者预后的影响。方法回顾性分析2010年9月~2016年1月我科41例在唤醒麻醉下进行颅内胶质母细胞瘤患者,其中17例MRI T2Flair序列范围下扩大切除的脑胶质母细胞瘤的患者,剩余24例作对照组为T1增强像下切除的脑胶质母细胞瘤的患者。所有病例手术过程中应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助手段,术后病理均确诊为胶质母细胞瘤(GBM)。采用德国Brainlab放疗计划系统分别勾画出术前、术后MRI T1增强病灶及T2Flair范围,进行图像融合,比较术前术后体积,明确肿瘤T1增强切除范围及T2Flair切除范围,所有患者随访至2017年1月,术后病人均行同步放疗及辅助化疗。结果对照组24例病例T1增强病灶均全部切除,术后无患者出现神经功能障碍。另外17例T2Flair像扩大切除患者中,7例T2Flair切除0~10%,4例T2Flair切除10%~25%,6例T2Flair切除25%以上;所有病人随访至2017年1月,17例T2Flair切除GBM患者,中位生存时间为30.45月,对照组24例病例切除GBM患者,中位生存时间为15.37月,两组有统计学差异(χ2=6.16,P=0.013)。T2Flair切除范围0~10%组,10%~25%组,25%以上组,各组中位生存时间分别20.16月,45月,33月,组间无明显统计学差异。结论唤醒麻醉下应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助手段有效保障了颅内GBM患者的手术安全性,提高了T1增强像的病灶全切率,可以最大安全范围完成了T2Flair的扩大切除;T2Flair的扩大全切除可明显延长GBM患者的生存期,但并非T2Flair像切除越多越好,切除程度之间无明显生存差异。
胶质母细胞瘤;T2Flair;扩大切除;唤醒麻醉
胶质母细胞瘤(GBM)是颅内最常见的原发恶性肿瘤,恶性胶质瘤约占原发性恶性脑肿瘤的70%[1-2]。因其高侵袭性、浸润性生长特性,且复发率高,治疗效果及预后总是差强人意[3]。多年来,国内外学者开展了大量针对GBM的临床探索和基础研究,希望对GBM的治疗获得突破性的进展,改善患者的预后。然而,手术治疗依然是胶质瘤的首选治疗策略,且手术切除范围与胶质瘤的生存预后密切相关,少数研究提示T2Flair残留体积预后相关[4-6],全切可延长新诊断GBM中位生存期[7]。本研究收集了2010年9月~2016年1月广东三九脑科医院神经外五科符合研究条件的41例GBM,在唤醒麻醉下多种技术前提下,保证患者神经功能前提下,尽可能的在MRI的T2Flair像下扩大切除病灶,并对相关数据结果进行了分析总结,为提高患者的生存期及治疗GBM提供一种治疗策略。
1 资料与方法
1.1 一般资料
回顾性总结广东三九脑科医院神经外五科2010年9月~2016年1月共手术治疗GBM 80例,其中采用唤醒麻醉手术65例,纳入本次分析41例。纳入分析标准:(1)年龄大于15岁,术前生活状态、语言、利手、认知、运动等评估能配合者;(2)术前检查均无手术禁忌症者;(3)术后病理明确诊断为GBM;(4)手术采用唤醒麻醉,术中应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助技术;(5)术前术后患者行KPS评分评价生活状态;(6)术后24~48 h复查MRI均T1增强切除;(7)术后按照标准Stupp方案进行治疗;(8)术后随访均能成功的患者。其中男性28例,女性13例,年龄15~67岁,平均46.56岁。病灶位于额叶6例,颞叶10例,枕叶3例,额顶叶3例,额颞叶3例,颞岛叶5例,颞枕叶3例,丘脑基底节区3例,多脑叶5例。
1.2 分组
41例患者分为两组:一组为17例MRI T2Flair像下扩大切除的GBM患者,对照组为剩余24例T1增强像下切除的GBM的患者。
1.3 手术方法
(1)术前1 d告知患者术中唤醒麻醉的目的和意义,使患者做好充分的心理准备;(2)先插管喉罩麻醉,全身麻醉后开颅;(3)唤醒患者成功后后,应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助手段做到T1增强病灶全切除,部分病例在多技术手段辅助下,保证患者功能下,近一步T2Flair范围内扩大切除;(4)关颅:恢复麻醉药及重新置入喉罩全麻关颅;(5)术后病理学检测,确诊为GBM;(6)术后病情稳定后尽早按照标准Stupp方案进行治疗;(7)治疗后随访及临床数据收集分析。
1.3 结果评估
根据采用Aspect-Vista型脑电活动监测仪测定并记录脑电双频谱指数(BIS)进行意识监测,判断患者清醒度。术中判定语言、运动、感觉区的位置。术前术后所有患者均行KPS评分评价生活状态。术后48 h内复查头颅MRI评估T1增强像切除程度。
1.4 T2Flair切除范围计算方法
采用德国Brainlab放疗计划系统对术前及术后MRI进行图像融合,计算T2Flair切除体积比例。分别勾画术前T1增强(T1)、T2Flair范围(T2)、术后T2FLAIR范围(T3)及术后切除范围(T4),软件三维重建并计算T1、T2、T3及T4体积,T2Flair切除范围比=1-(T3-T4)÷(T2-T1)。计算方法如图1所示。
红色部分为术前T1增强体积(T1),深黄色部分为术前T2Flair范围体积(T2),蓝色部分为术后T2Flair范围体积(T3),淡黄色部分为术后切除范围(T4),T2Flair切除范围比=1-(T3-T4)÷(T2-T1)。
1.5 统计学方法
应用统计分析软件SPSS20.0进行统计学分析,对收集的数据做独立样本t检验、Kaplan-Meier单因素生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 总体数据及术中术后情况
两组患者在性别和年龄方面无明显差异(P>0.05),术中均能配合术者指令,BIS意识监测数值均在80分以上(图2A),术中应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助手段保留患者语言、运动等神经功能,术中可以监测到运动功能区(图2B),导航结合DTI、术中肿瘤荧光可以清楚定位病灶大小与范围(图2C、D)。两组患者术前KPS评分分别为平均92.93分,术后平均88.29分,17例T2Flair像扩大切除患者术后KPS评分与对照组无明显差异(P>0.05),说明手术扩大切除不影响患者神经功能及术后生活质量,尽管41例其中10例患者术后KPS评分下降,经过治疗后基本恢复至术前。术后41例患者复查MRI均达T1增强像全切病灶(图3A、B),17例患者做到T2Flair像扩大切除(图3C、D)。
2.2 患者生存时间
随访的病例中,24例T1增强像切除的患者中位生存时间为15.37个月。17例T2Flair像扩大切除的GBM患者中位生存时间为30.45个月(图4),两组生存时间有统计学差异(χ2=6.16,P=0.013);其中T2Flair像不同扩大切除范围0~10% 7例,10%~25% 4例,25%以上6例,3组术后中位生存时间分别为20.16月,45月,33月,差异无统计学意义(P>0.05,图5)。

图1 T2Flair切除范围计算方法示意图
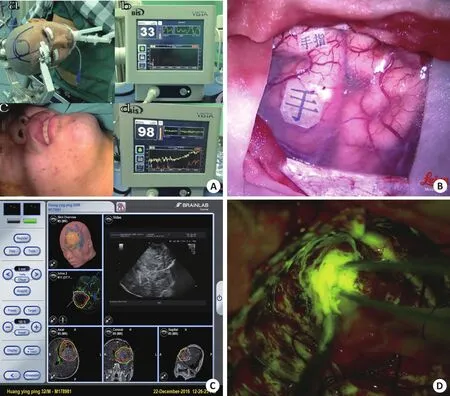
图2 患者术中唤醒及功能定位情况

图3 脑胶质瘤病灶患者术前术后病灶情况

图4 两组GBM总体生存分析结果

图5 两组患者生存期对比及T2Flair不同切除范围的生存时间
3 讨论
胶质细胞瘤是颅内最好发的恶性肿瘤之一,其发病率虽然不高,约为6.61/10万,但致残、致死率非常高[8]。GBM作为高级别胶质细胞留,因其高侵袭性、浸润性生长,手术全切困难,术后易复发,预后不佳。故如何取得GBM的治疗突破,改善胶GBM患者的预后成为当前临床研究的难点与热点。
目前胶质瘤的主要治疗原则是在保证患者神经功能前提下,尽可能手术切除病灶并辅助以放化疗等综合治疗。手术切除通常包括全切、次全切及部分切除等,因此最大限度地安全切除肿瘤成为GBM手术治疗的共识[9]。虽然影响GBM预后的因素是多方面的,但术后肿瘤的残瘤量仍然是影响GBM预后的重要原因[10-12],GBM的全切除率直接影响到肿瘤的复发时间及生存期,甚至有部分学者认为GBM肿瘤的手术切除程度是其他后续治疗的基础[7,13-14],因而如何在尽可能地保留患者感觉、言语、运动等重要神经功能的前提下,最大程度地切除肿瘤便成为了许多神经外科大夫所追求的目标,GBM的扩大全切除也在伴随的争议中,越来越多地运用在临床[15]。早前部分学者认为,扩大再切除能明显增加神经功能损伤的风险,降低患者的预后生活质量,且对GBM患者的预后生存期的延长无明显改善[16]。然而,得益于科技的进步,越来越多的技术手段被用来保障GBM手术切除的安全性、有效性,尤其是唤醒麻醉技术的应用,结合术中DTI神经导航、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助手段,极大的解放了神经外科手术在脑功能区开展的局限性,肿瘤扩大切除的安全性进一步得到了保障[17-19]。故而在肿瘤的病理性质确定的条件下,如何尽可能把胶质瘤潜在的复发根源在首次手术治疗中予以切除便成为了提高GBM治疗疗效的关键。有研究表明,在多技术手段保障下,安全切除T1增强病灶后,神经导航T2Flair序列引导下的手术扩大切除能进一步延长GBM的生存期[20]。
本研究中的所有病例均在唤醒麻醉下运用了神经导航、术中电生理监测、术中直接皮层电刺激、术中超声及术中荧光等技术手段,41例GBM患者均获得了T1增强病灶的全切除,其中17例病例获得了不同程度的T2Flair范围的扩大全切除。所有的全切除及扩大全切除病例,虽有10例患者术后出现KPS评分下降,但经过治疗均恢复至术前,虽然本次研究的病例数有限,但也在一定程度上证实了唤醒麻醉技术结合多技术手段对患者术中神经功能保护的有效性。所研究的41例GBM患者中,中位生存期为18.57个月,明显高于国内外研究GBM患者的中位生存期[7,12,21],一定程度上进一步证实了手术全切除及扩大切除对GBM预后生存期的改善。本研究结果显示T2Flair切除范围0~10%组 ,10%~25%组,25%以上组中位生存时间分别20.16、45、33月,尽管T2flair范围的扩大切除能够延长GBM患者的预后生存期,经卡方检验后这一增多的差异并无明确的统计学意义,说明不同切除范围组别的中位生存期数值并不能随着扩大切除范围的增多而增加,但笔者推测这或许与研究的病例数不足以及因根据T2flair切除范围百分比分组的划分层次不够理想有关,但这一推测仍需要进一步的研究来加以佐证,T2flair范围的最适切除百分比亦需要进一步的研究数据。另外,本研究中患者术后均采用了标准Stupp方案进行放化疗,毫无疑问,对延长GBM患者的生存期是十分必要的,放化疗治疗是为手术切除肿瘤病灶后治疗GBM的重要补充手段。
综上所述,唤醒麻醉下应用术中神经导航结合DTI、皮层电刺激、术中超声、术中肿瘤荧光造影等多种辅助技术手段,能在保证患者神经功能的前提,提高颅内GBM病灶的切除率。T2flair范围的扩大切除,同时GBM患者术后还应接受足疗程的放化疗等综合治疗能够延长GBM患者的生存期,为我们治疗GBM提供一种新的手术策略,但T2flair范围的最适切除区间仍需进一步研究。
[1]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32.
[2]Ostrom QT, Gittleman H, Liao P, et al. CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2007-2011[J]. Neuro Oncol, 2014, 16(Suppl 4):iv1-63.
[3]Schwartzbaum JA, Fisher JL, Aldape KD. Epidemiology and molecular pathology of glioma[J]. Nat Clin Pract Neurol, 2006,2(9): 494-503.
[4]Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome[J]. Neurosurgery, 2008, 62(4): 753-66.
[5]Gorlia T, van den Bent MJ, Hegi ME, et al. Nomograms for predicting survival of patients with newly diagnosed glioblastoma:prognostic factor analysis of EORTC and NCIC trial 26981-22981/CE.3[J]. Lancet Oncol, 2008, 9(1): 29-38.
[6]王永志, 杨 帆, 季玉陈, 等. 手术切除程度对胶质母细胞瘤预后预测因素的影响[J]. 中国微侵袭神经外科杂志, 2015, (07):289-92.
[7]Pan I W FS, treatment factors associated with survival among adult glioblastoma patients: A USA population-based study from 2000-2010[J]. J Clin Neurosci, 2015, 22(10): 1575-81.
[8]Ostrom QT, Gittleman H, Fulop J, et al. CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in theUnited States in 2008-2012[J]. Neuro Oncol, 2015, 17(4): 1-62.
[9]张 忠, 江 涛, 王忠诚. 功能区胶质瘤的手术治疗进展[J]. 中国微侵袭神经外科杂志, 2006, (02): 88-90.
[10]Mcgirt MJ, Chaichana KL, Gathinji MA, et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma[J]. J Neurosurg, 2009, 110(1): 156-62.
[11]Hardesty DA, Sanai N. The value of glioma extent of resection in the modern neurosurgical era[J]. Front Neurol, 2012, 3(6): 140-2.
[12]马翔宇, 李新钢, 刘 佳, 等. 影响胶质母细胞瘤切除术后的预后因素分析[J]. 中华神经外科杂志, 2008, 24(6): 464-7.
[13]Laws ER, Parney IF, Huang W, et al. Survival following surgery and prognostic factors for recently diagnosed malignant glioma:data from the glioma outcomes project[J]. J Neurosurg, 2003,99(3): 467-73.
[14]Almeida JP, Chaichana KL, Rincon-Torroella J, et al. The value of extent of resection of glioblastomas: clinical evidence and current approach[J]. Curr Neurol Neurosci Rep, 2014, 15(2): 517.
[15]杨伯捷, 吴劲松, 姚成军, 等. 术中MRI监测下行胶质母细胞瘤扩大全切除术的临床研究[J]. 中国临床神经科学, 2010, (04):381-4.
[16]De Witte O, Levivier M, Violon P, et al. Quantitative imaging study of extent of surgical resection and prognosis of malignant astrocytomas[J]. Neurosurgery, 1998, 43(2): 398-9.
[17]Feng C, Yang Y, DM Xiao, et al. Optimizing the extent of resection and minimizing the morbidity in insular high-grade glioma surgery by high-field intraoperative MRI guidance[J]. Turk Neurosurg,2016, 25(7): 45-7.
[18]张 忠, 江 涛, 谢 坚, 等. 唤醒麻醉和术中功能定位切除语言区胶质瘤[J]. 中华神经外科杂志, 2007, 23(9): 643-5.
[19]周 辉, 鲁 明, 邓心情, 等. 术中唤醒麻醉结合定位技术切除脑深部病灶的临床研究[J]. 中华神经医学杂志, 2015, 14(8): 835-8.
[20]Grabowski MM, Recinos PF, Nowacki AS, et al. Residual tumor volume versus extent of resection: predictors of survival after surgery for glioblastoma[J]. J Neurosurg, 2014, 121(5): 1115-23.
[21]梁进华, 刘湘衡, 白红民, 等. 多形性胶质母细胞瘤的预后影响因素分析[J]. 中华神经外科杂志, 2016, 32(8): 831-5.
Expand resection in glioblastoma under magnetic resonance T2Flair
ZHOU Hui1, LU Ming1, HE Xiaojun1, LAI Mingyao2, DENG Xinghai1, LU Jiankan1
1Unit Five, Department of Neurosurgery;2Department of Medical Oncology, Guangdong 999 Brain Hospital, Guangzhou 510510, China
ObjectiveTo explore the effect of extensive resection induced by MRI T2Flair sequence on the prognosis of glioblastoma.MethodsForty-one cases of anesthesia in patients with intracranial glioblastoma between September 2010 and January 2016 in our Hospital were retrospectively analyzed. Seventeen cases were performed with MRI T2Flair sequence under extended resection of brain glioblastoma patients, 24 cases of control group with T1 enhancement were performed with the remaining resection of brain glioblastoma patients. All cases were applied with intraoperative neural navigation application in the process of surgery combined with electrical stimulation DTI, cortex, intraoperative ultrasound, intraoperative tumor fluorescence imaging. Postoperative pathology were diagnosed with glioblastoma (GBM). The preoperative and postoperative MRI T1 enhanced lesions and T2Flair scope were outlined by German making radiotherapy plan system. Image fusion was conducted. The preoperative and postoperative volume were compared. T1 enhance tumor resection range and T2Flair excision scope were definited. The patients were followed up to January 2017. The patient underwent postoperative radiotherapy and chemotherapy.ResultsT1 enhanced lesions of 24 cases in Control group were excised. No patient had neurological dysfunction after operation. Another 17 cases of T2Flair patients as extended resection, 7 cases T2Flair had a excision of 0%~10%, 4 cases of T2Flair had a resection of 10%~25%, 6 T2Flair removed more than 25%. All patients were followed up to January 2017, 17 patients with GBM T2Flair excision had a median survival time of 30.45 months. In the control group of 24 cases with GBM patients, median survival time was 15.37 months. Difference between two groups was significantly (P=0.013). T2Flair resection were divided into group of 0%~10%, 10%~25% and more than 25%. The median survival time of each group was 20.16, 45, 33 months, respectively, with no significant differences .ConclusionApplication of awaken anesthesia combined with intraoperative neural navigation, electrical stimulation DTI, cortex, intraoperative ultrasound, intraoperative tumor fluorescence imaging can effectively guarantee the operation safety of the intracranial GBM patients. It improves the T1 enhanced the rate of total resection of lesions like, promotes the maximum safe range to complete the T2Flair extended resection. T2Flair total excision of the expansion can obviously prolong the survival time of GBM patients,but not T2Flair like to remove the more the better. The difference between the survival degree of resection is not significant.
glioblastoma; T2Flair; extended resection; awake anesthesia
2017-02-19
广东省医学科研基金(B2015106)
周 辉,硕士,E-mail: yjzhouhui@126.com
鲁 明,硕士,E-mail: 40756036@qq.com
