乳腺型肌纤维母细胞瘤3例临床病理观察
2017-07-31杜晓华罗碧怡杨海峰
阳 宇,杜晓华,赵 敏,罗碧怡,杨海峰
乳腺型肌纤维母细胞瘤3例临床病理观察
阳 宇,杜晓华,赵 敏,罗碧怡,杨海峰
目的 探讨乳腺型肌纤维母细胞瘤(mammary-type myofibroblastoma, MTMF)的临床病理学特征、诊断及鉴别诊断。方法 回顾性分析3例MTMF的临床病理学及免疫表型特征,并复习相关文献。结果 3例均为老年男性,临床表现为单发的无痛性实性肿物。3例均行肿块局部切除术,术后病理示温和的梭形细胞呈束状排列于玻璃样变的胶原化间质中,并混有不等的脂肪组织。免疫表型:desmin、CD34均呈阳性。患者预后较好,随访至今未见复发。结论 MTMF有典型的组织学形态及免疫表型特征,MTMF应与梭形细胞脂肪瘤、富细胞性血管纤维瘤、血管肌纤维母细胞瘤、孤立性纤维瘤及非典型脂肪瘤鉴别,并可通过免疫组化染色及基因检测协助确诊。
软组织肿瘤;乳腺型肌纤维母细胞瘤;病理;诊断
乳腺型肌纤维母细胞瘤(mammary-type myofibroblastoma, MTMF)是一种良性间叶源性肿瘤,于2001年由McMenamin等[1]定义为发生于乳腺外的、与乳腺肌纤维母细胞瘤形态和免疫表型均一致的肿瘤。MTMF临床罕见,国内仅13例报道[2-3],外文文献综合报道143例[4]。本文现收集3例MTMF,并复习相关文献,探讨其临床病理学特征及鉴别诊断,以提高对该病的诊断水平。
1 材料与方法
1.1 临床资料 检索2010~2016年广东省中医院院病理活检组织检查资料库,收集3例MTMF病例(占同期活检病例的1.8/10万)。收集患者的临床资料,包括性别、年龄、病变部位、病灶大小、临床治疗以及复发情况等,并进行随访(表1)。
1.2 方法 3例MTMF患者的常规病理切片,均经两名外院软组织病理专家复核原HE与免疫组化切片确诊。3例MTMF组织蜡块,5 μm厚切片,行免疫组化EnVision两步法染色。抗体desmin、S-100购自福州迈新公司,CD34、CK、AR、ER购自珠海泉晖公司,二抗为罗氏公司产品。每种抗体均设阴阳性对照。
2 结果
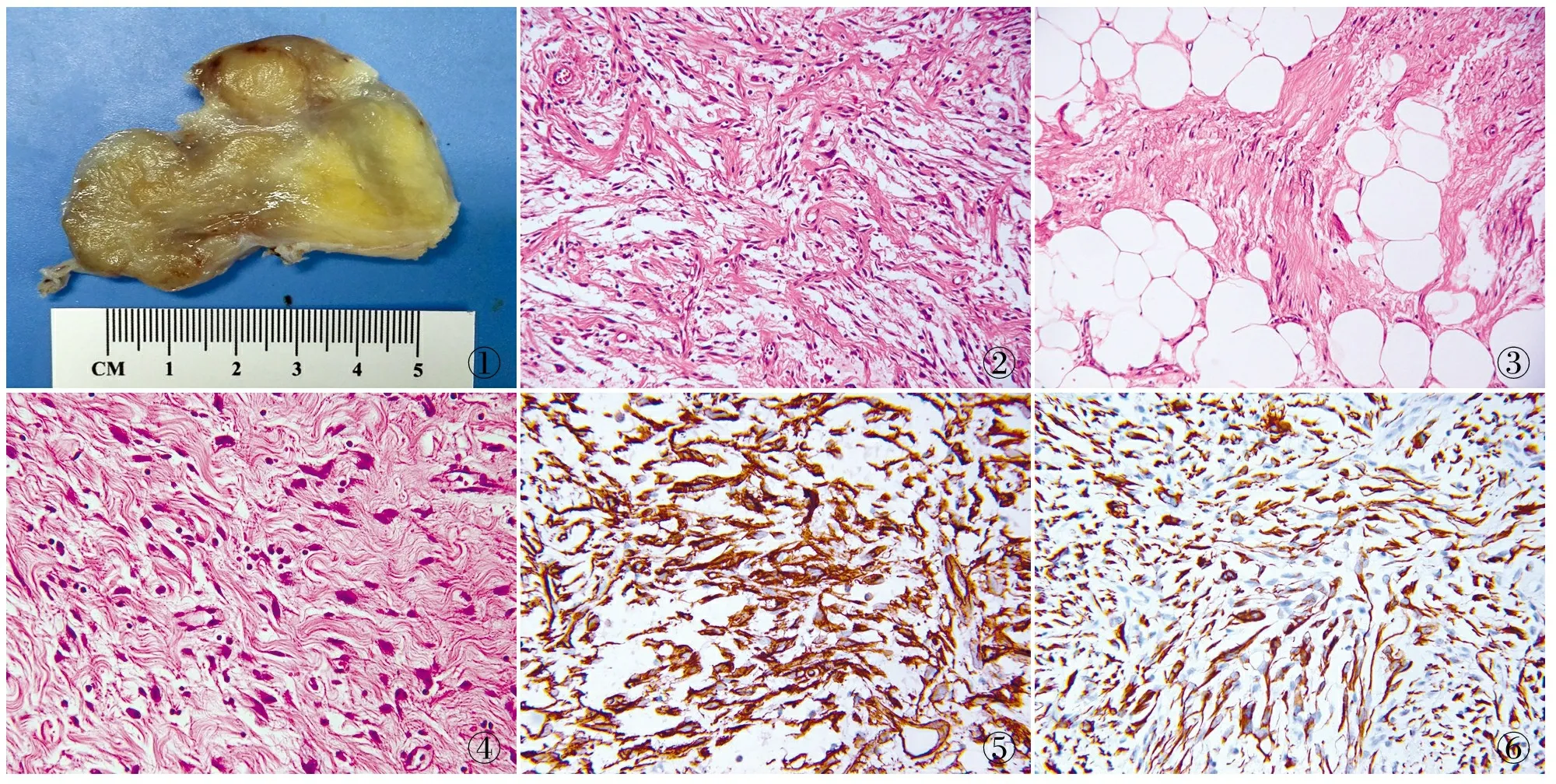
2.1 眼观 3例肿物表面均光滑、有纤维包膜,切面呈灰黄、棕黄色,胶冻状(图1)。
2.2 镜检 镜下见肿物边界清楚,具有纤维样包膜。肿瘤细胞形态温和,梭形或卵圆形,呈束状排列于玻璃样变胶原间质中(图2),部分胶原纤维条索状穿插于肿瘤细胞束中呈束状或“Z”字形。瘤细胞大小一致,细胞质嗜酸或淡染,核长或点状、空泡样,核仁不明显,核分裂象少见,局灶细胞有轻度异型。周边区域可见多少不等的成熟脂肪组织(图3),间质血管以中小血管为主散在分布,血管周围有淋巴细胞浸润,部分区域有黏液样变性,肿瘤细胞间可见散在肥大细胞(图4)。
2.3 免疫表型 送检3例标本免疫表型表达一致。镜下见梭形肿瘤细胞CD34胞膜和胞质弥漫阳性(图5),desmin胞质弥漫阳性(图6),ER及AR核阳性,S-100、CK均阴性。
2.4 病理诊断 3例均确诊为MTMF。
2.5 随访 所有患者均行手术切除,随访2~8个月,未见复发。
3 讨论
3.1 临床特点 MTMF可见于任何年龄,发病年龄4~96岁,但大多发生在50~60岁。男性患者多于女性(男女比约2 ∶1)。发病部位广泛,尤其腹股沟好发(50%左右),其他发病部位包括下肢、躯干、阴道、臀部、腹腔、腹膜后及上肢等。临床常表现为缓慢生长的无痛性质硬肿块,或轻微疼痛伴膨胀感。本组MTMF均为中老年男性患者,分别发生于腹股沟和臀部,自觉肿物就诊,与国内外临床特征一致。文献显示手术后随访平均28.8个月,即使在切缘阳性的患者中,也未见肿瘤复发和转移。
3.2 病理特征 手术切除后送检肿物一般界限清楚,具有纤维样包膜,平均直径6.6 cm(1~22 cm),切面呈黄白色或褐色胶冻样。镜下肿瘤由核短粗的梭形细胞构成,细胞界限不清,核分裂象罕见。肿瘤含有数量不等的脂肪成分,经常可见玻璃样变和黏液样变间质。部分间质血管管壁玻璃样变,血管周围有淋巴细胞浸润,肿瘤细胞间有丰富的肥大细胞。少见的特征包括细胞核的异型、上皮样细胞形态及神经鞘瘤栅栏样特征。肿瘤可分为纤维型、上皮型、富于细胞型、侵袭型和黏液型等[5-6]。免疫组化标记CD34、desmin弥漫阳性。

表1 3例MTMF临床病理资料
①②③④⑤⑥
图1 肿瘤大体界限清楚,切面呈灰黄至棕黄色脂肪样 图2 MTMF肿瘤细胞梭形排列于明显玻璃样变的胶原化间质中 图3 条索状排列,其间可见成熟脂肪成分 图4 间质可见较多肥大细胞 图5 肿瘤细胞CD34弥漫阳性,EnVision两步法 图6 肿瘤细胞desmin阳性,EnVision两步法
MTMF是间叶组织来源的良性肿瘤,免疫组化和电镜证实是肌纤维母细胞来源。2001年McMenamin等[1]报道9例发生于乳腺外的肌纤维母细胞瘤,命名为MTMF。肿瘤细胞具有典型乳腺肌纤维母细胞瘤的特点。即肿瘤细胞梭形或卵圆形,呈束状排列于胶原化的间质中,玻璃样变的胶原条索状穿插于梭形细胞束中,肿瘤细胞质嗜酸及淡染,核仁不明显,核分裂象罕见,局灶细胞有异型性。另外,肿瘤同时表达ER和AR,提示肿瘤与性激素有一定的关系。在细胞遗传学方面,MTMF与梭形细胞脂肪瘤、富于细胞的血管纤维瘤均具有染色体13q的部分缺失,该基因可抑制Rb蛋白的表达,在免疫表型上特征性的表现为抑癌基因Rb蛋白的表达缺失[7-12]。有学者认为这些肿瘤有共同的基因学异常,同时又有组织学的相似性,提示它们可能属于“13q/Rb肿瘤家族”谱系,均来源于间质细胞,只是向肌纤维母或脂肪方向分化造成的形态学和免疫组化不同[9-10]。考虑到病例数量的限制,有学者认为它们有基因和形态学的相似性,是否是独立的个体或来源于基因相关肿瘤谱系还需进一步证实。尽管从学术上还无精确的术语来描述该类肿瘤之间的关系,临床认为其属于良性肿瘤,即使存在一些肉瘤样的成分,转移和复发风险依然非常小[4,13]。
3.3 鉴别诊断 (1)梭形细胞脂肪瘤:细胞遗传学证实其与MTMF有部分重叠,但梭形细胞脂肪瘤常伴染色体16q的重排[8]。在形态学上与MTMF相似,均有梭形细胞增生并含有脂肪成分,可见肥大细胞、较多胶原束及CD34阳性的梭形细胞。但梭形细胞脂肪瘤大部分发生在后肩、颈部或背部上方区域,有多少不等的双折光性绳索样胶原纤维,免疫组化标记desmin阴性,而S-100常阳性,可资鉴别[4]。(2)富于细胞性血管纤维瘤[9-10,14]:是一种少见的良性肿瘤,常发生于外阴,骨盆、腹股沟也可发生。肿瘤边界清楚,由丰富的梭形细胞组成,具有纤细的嗜酸性胶原束,间质内中小血管丰富、均匀分布伴管壁玻璃样变,局部可有脂肪组织。肿瘤细胞vimentin阳性,CD34部分阳性,SMA、desmin和S-100均阴性,提示为纤维母细胞来源。肿瘤无复发和转移。本组2例MTMF虽然也有血管增生,但以薄壁小血管为主且散在分布,管壁玻璃样变不明显,间质胶原纤维粗、呈穿插排列,desmin弥漫阳性等特征均支持MTMF。(3)血管肌纤维母细胞瘤[15]:多发于中青年女性外阴,少数可发生于男性会阴、腹股沟及阴囊等。肿瘤周界清晰,瘤细胞圆形或梭形,呈巢或束状围绕血管周围排列,间质含有大量扩张的小至中等大薄壁血管,其间可见交替分布的细胞丰富区和细胞稀疏区。免疫组化标记vimentin、desmin均阳性,SMA部分阴性,CD34常阴性。(4)孤立性纤维瘤[6,9]:肿瘤边界清楚,为短梭形细胞伴玻璃样变的胶原增生,形成交替分布的细胞丰富区和稀疏区,形态无明显模式,常有血管外皮瘤样图像,脂肪成分罕见。瘤细胞表达CD34、vimentin、BCL-2及STAT6,desmin常阴性。尽管在孤立性纤维瘤中检测到13q染色体丢失,但是在细胞遗传学未发现基因学异常[16]。(5)非典型脂肪瘤性肿瘤:由近似成熟脂肪细胞组成的肿瘤,可见核深染的梭形细胞和脂肪母细胞。细胞遗传学显示肿瘤染色体含有扩增的12q13-15区域,该区域导致MDM2及CDK4高表达[17]。免疫组化标记MDM2、CDK4及S-100阳性,Rb亦未见表达缺失,与MTMF可资鉴别。
综上所述,MTMF临床罕见,临床表现为良性过程,诊断常需结合常规病理和免疫组化结果。因其生物学行为良好,治疗上采用单纯肿块切除即可,预后较好,未见复发和转移。该肿瘤临床工作中的关键在于对该肿瘤的鉴别诊断,避免误诊。
[1] McMenamin M E, Fletcher C D. Mammary-type myofibroblastoma of soft tissue: a tumor closely related to spindle cell lipoma[J]. Am J Surg Pathol, 2001,25(8):1022-1029.
[2] 朱延波,金晓龙. 外阴乳腺型肌纤维母细胞瘤伴小汗腺癌1例报道及文献复习[J]. 诊断病理学杂志, 2003,10(4):245-247.
[3] 邵 畅, 齐广伟, 过华蕾. 乳腺型肌纤维母细胞瘤临床病理分析[J]. 浙江实用医学, 2016,21(4):293-295.
[4] Howitt B E, Fletcher C D. Mammary-type myofibroblastoma clinicopathologic characterization in a series of 143 cases[J]. Am J Surg Pathol, 2016,40(3):361-367.
[5] Magro G. Mammary myofibroblastoma: a tumor with a wide morphologic spectrum[J]. Arch Pathol Lab Med, 2008,132(11):1813-1820.
[6] Magro G, Foschini M P, Eusebi V. Palisaded myofibroblastoma of the breast: a tumor closely mimicking schwannoma: report of 2 cases[J]. Hum Pathol, 2013,44(9):1941-1946.
[7] Maggiani F, Debiec-Rychter M, Verbeeck G,etal. Extramammary myofibroblastoma is genetically related to spindle cell lipoma[J]. Virchows Arch, 2006,449(2):244-247.
[8] Chen B J, Marino-Enriquez A, Fletcher C D,etal. Loss of retinoblastoma protein expression in spindle cell/pleomorphic lipomas and cytogenetically related tumors: an immunohistochemical study with diagnostic implications[J]. Am J Surg Pathol, 2012,36(8):1119-1128.
[9] Flucke U, van Krieken J H, Mentzel T. Cellular angiofibroma: analysis of 25 cases emphasizing its relationship to spindle cell lipoma and mammary-type myofibroblastoma[J]. Mod Pathol, 2011,24(1):82-89.
[10] Maggiani F, Debiec-Rychter M, Vanbockrijck M,etal. Cellular angiofibroma: another mesenchymal tumour with 13q14 involvement, suggesting a link with spindle cell lipoma and (extra) mammary myofibroblastoma[J]. Histopathology, 2007,51(3):410-412.
[11] Dahlen A, Debiec-Rychter M, Pedeutour F,etal. Clustering of deletions on chromosome 13 in benign and low-malignant lipomatous tumors[J]. Int J Cancer, 2003,103(5):616-623.
[12] Bartuma H, Nord K H, Macchia G,etal. Gene expression and single nucleotide polymorphism array analyses of spindle cell lipomas and conventional lipomas with 13q14 deletion[J]. Genes Chromosomes Cancer, 2011,50(8):619-632.
[13] Chen E, Fletcher C D. Cellular angiofibroma with atypia or sarcomatous transformation: clinicopathologic analysis of 13 cases[J]. Am J Surg Pathol, 2010,34:707-714.
[14] Iwasa Y, Fletcher C D. Cellular angiofibroma: clinicopathologic and immunhistochemical analysis of 51 cases[J]. Am J Surg Pathol, 2004,28:1426-1435.
[15] 张 蒿, 齐 跃, 刘水策, 等. 血管肌纤维母细胞瘤的临床病理特点[J]. 现代肿瘤医学, 2015,23(8):1121-1125.
[16] Park M S, Araujo D M. New insights into the hemangiopericytoma/solitary fibrous tumor spectrum of tumors[J]. Curr Opin Oncol, 2009,21(4):327-331.
[17] Italiano A, Bianchini L, Gjernes E,etal. Clinical and biological significance of CDK4 amplification in well-differentiated and dedifferentiated liposarcomas[J]. Clin Cancer Res, 2009,15(18):5696-5703.
☆ ☆ ☆ ☆ ☆ ☆
本刊网站投稿:http://www.cjcep.com
电子邮箱投稿:lcsybl@163.com
广东省中医院病理科,广州 510120
阳 宇,男,硕士,医师。Tel: (020)81887233,E-mail: 116808316@qq.com 杨海峰,男,硕士,副主任医师,通讯作者。E-mail: yang_hf@126.com
时间:2017-6-20 11:18 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.022.html
R 738.6
A
1001-7399(2017)06-0683-03
10.13315/j.cnki.cjcep.2017.06.022
接受日期:2017-04-12
