胃肠间质瘤合并消化道癌9例临床病理分析
2017-07-31林文生李德昌郑吉春朱建平
林文生,张 芳,任 力,李德昌,郑吉春,朱建平
胃肠间质瘤合并消化道癌9例临床病理分析
林文生1,张 芳2,任 力2,李德昌2,郑吉春2,朱建平2
目的 探讨胃肠间质瘤(gastrointestinal stromal tumour, GIST)合并消化道癌的临床病理学特征、诊断及鉴别诊断。方法 回顾性分析9例GIST合并消化道癌的临床病理学及免疫表型特征,并复习相关文献。结果 4例食管癌中,大部分肿瘤细胞可见角化珠,为高分化鳞状细胞,少部分分布在癌巢边缘的小基底细胞样细胞。在另外5例中(4例合并胃癌,1例合并直肠癌),肿瘤由腺样结构的异型腺体组成,呈中~低分化改变。GIST与平滑肌瘤很相似,由梭形细胞构成,核旁空泡常见,形态各异,花边状、栅栏状、古钱币状、漩涡状等多种结构常可见。免疫表型:4例食管鳞状细胞癌:CK5/6、CK14、p53(+),S-100、CK7(-)。另外,4例合并胃癌,1例合并直肠癌:CK7、CK20、CEA、HER-2(+),S-100(-)。9例GIST中,CD34、CD117、DOG1、SMA(+),S-100、desmin(-)。结论 GIST合并消化道癌时,GIST多数无特殊临床症状,多因癌手术后大体检查发现,其增殖活性显著低于未并发癌的GIST,多数不需要针对性治疗,当肿瘤具有恶性指征时采用恶性GIST治疗规范。
胃肠间质瘤;食管癌;胃癌; 直肠癌;临床病理特征;诊断
胃肠间质瘤(gastrointestinal stromal tumour, GIST)是最常见的胃肠道间叶性肿瘤,其独立起源于胃肠道原始间质干细胞,并呈非定向分化的间叶组织肿瘤,其占消化道恶性肿瘤的2.2%,好发于中老年人,较少发生于儿童和青年,发病无性别优势[1]。患者可有腹痛、腹胀、消化道出血等非特异性症状和体征。GIST可合并其他肿瘤的发生,特别是与其他消化道肿瘤并发比较少见,国内外仅有个别的文献报道[2-4]。本文收集9例比较典型的病例,通过形态学及免疫表型对其进行分析,结合相关文献的复习,探讨其发生原因、临床病理学特点、诊断、鉴别诊断、治疗及预后,以提高对这些并发症的认识。
1 材料与方法
1.1 材料 收集中国人民解放军空军总医院病理科2012~2016年间诊断的GIST 209例,其中合并消化道癌者9例(4例合并食管癌,4例合并胃癌,1例合并直肠癌),男性8例,女性1例,年龄56~76岁,平均66岁。其中1例术前检查发现消化道癌合并GIST,余下术中探查或术后病理检查发现。
1.2 方法 用10%中性福尔马林固定活检标本组织,常规脱水、浸蜡、石蜡包埋、3~4 μm厚切片,HE染色,光镜观察。免疫组化染色采用SP法,DAB显色,苏木精复染。一抗Ki-67、S-100、CD163、CD34和vimentin为Dako公司产品,余下抗体为北京中杉金桥公司产品。
2 结果
2.1 眼观 9例GIST中4例合并食管癌,3例为溃疡型高~中分化鳞状细胞癌,1例为隆起型鳞状细胞癌(表1)。肿物位于食管中、下1/3处,大小4.5 cm×2.5 cm×2.0 cm~2.6 cm×0.8 cm×0.7 cm,呈环状,伴溃疡形成,边缘清楚,切面灰白色,部分或完全浸润肌壁。另外4例合并胃癌,其中3例为腺癌,1例为印戒细胞癌。肿物呈溃疡隆起形,大小9.0 cm×9.0 cm×1.5 cm~2.0 cm×2.0 cm×0.2 cm,切面灰白色、实性、质稍硬。1例合并直肠癌,呈溃疡隆起型,大小4.0 cm×3.5 cm×0.7 cm,边缘高出黏膜0.8 cm,切面灰白、灰黄色,实性,质硬。9例GIST中8例发生在胃,1例发生在小肠,为浆膜、黏膜下或胃壁内以及浆膜外结节,呈结节状或分叶状,大小不一,大小2.8 cm×2.8 cm×2.0 cm~0.3 cm×0.5 cm×0.5 cm,切面灰白、灰红色,质地从硬韧到软,可伴出血、坏死及囊性变。
2.2 镜检 合并食管癌4例,大部分位于中央的肿瘤细胞为大的、分化较好、角化细胞样的鳞状细胞和角化珠,少部分分布在癌巢边缘的小基底细胞样细胞(图1)。另外4例合并胃癌,其中2例为中~低分化管状腺癌,肿瘤由分支状和明显扩张或裂隙样的管状结构组成,管腔大小不一,形态各异,部分腺体难以辨认,或单个细胞孤立排列,或多个细胞形成大小不一的实性条索,可见有黏液分泌(图2)。肿瘤细胞常呈柱状、扁平状或立方状,透明细胞亦可见到。1例为黏液样癌,其腺体由柱状黏液分泌上皮构成,间质腔隙内可见黏液;细胞呈不规则状或串珠状漂浮于黏液池中。1例为印戒细胞癌,表现为肿瘤细胞弥漫分布,淡蓝色黏液充满于胞质内,将细胞核挤压至一旁。1例合并直肠癌,肿瘤细胞呈密集的腺管状结构排列,形态较规则,异型性较小。
GIST与平滑肌瘤很相似,由梭形细胞、上皮样细胞或两种细胞混合构成。大部分肿瘤细胞由梭形细胞构成,核旁空泡常见,形态各异,花边状、栅栏状、古钱币状、漩涡状等多种结构常可见(图3)。
2.3 免疫表型 4例食管鳞状细胞癌:CK5/6(图4)、CK14、p53(+),其中2例EGFR和VEGF(+),Ki-67增殖指数高(分别为30%和40%),S-100、CK7(-)。另外4例胃癌:CK7(图5)、CK20、CEA(+),其中2例EGFR、VEGF、HER-2(+),Ki-67增殖指数非常高(分别为50%和80%),S-100(-)。9例GIST合并癌中,GIST免疫组化指标:7例CD34(+)(图6)、8例CD117(+)(图7),6例DOG1(+)(图8),6例SMA(+),S-100、desmin均(-)(表2)。
3 讨论
近年来,随着GIST与其他肿瘤并发的报道越来越多,也引起大家越来越多的关注。据报道GIST并发的肿瘤包括胃肠道癌、女性生殖系统癌、肺癌、肾癌、前列腺癌以及造血系统肿瘤等[5-7]。伴发的肿瘤可先后发生,亦可同时发生。最常见的是GIST与胃肠道癌的并发[8],文献报道,与癌并发的GIST常见于食管(1.13%),其次是胃(0.53%),少见于结直肠(0.03%)[9]。在本组所选209例GIST中9例并发胃肠道癌(4.3%),其中有4例并发食管癌(1.9%),4例并发胃癌(1.91%),1例并发直肠癌(0.053%)。GIST除了与癌并发外,还与一些非上皮来源的肿瘤并发,如脂肪瘤、Burkitt淋巴瘤、慢性淋巴细胞白血病、生长抑素瘤等,发生率为4.5%~33%[10]。
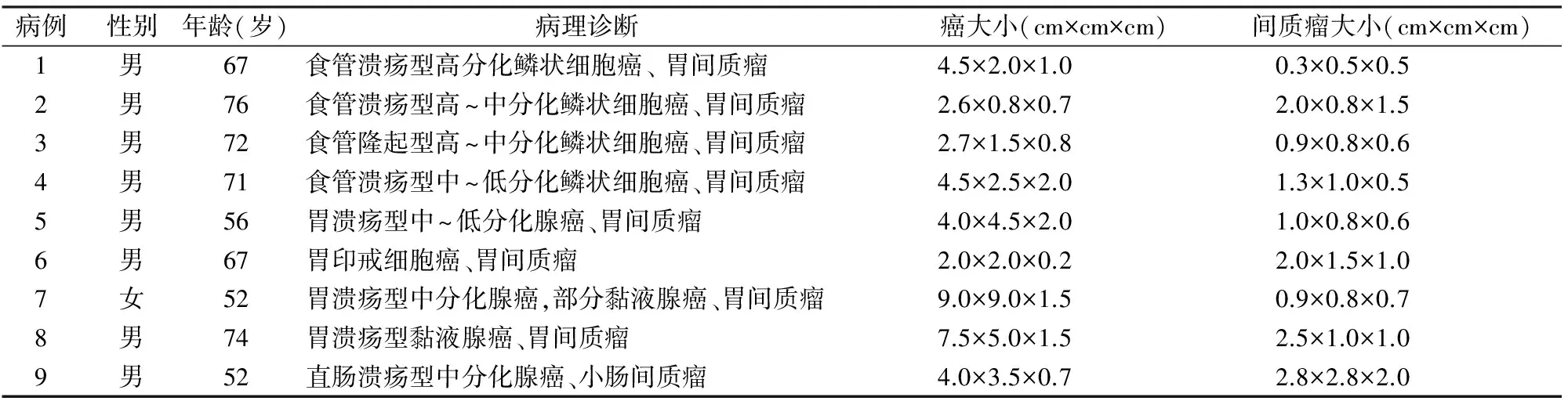
表1 9例胃肠间质瘤合并消化道癌的临床病理资料

表2 癌与胃肠间质瘤免疫表型对比

①②③④⑤⑥⑦⑧图1 食管高分化鳞状细胞癌:癌细胞癌巢中央可见分化较好的角化珠形成,少部分分布在癌巢边缘的小基底细胞样细胞 图2 胃腺癌由分支状和明显扩张或裂隙样的管状腺样结构组成,脉腔的大小不一 图3 间质瘤由梭形细胞组成,瘤细胞呈栅栏状,胞质红染,胞膜界限清楚;染色质稀疏,核仁明显 图4 食管鳞状细胞癌细胞胞质CK5/6(+),SP法 图5 胃腺癌细胞胞质CK7(+),SP法 图6 间质瘤细
胞胞膜CD34(+),SP法 图7 间质瘤细胞胞质/膜CD117(+),SP法 图8 间质瘤细胞胞质/膜DOG1(+),SP法
3.1 发病机制 目前为止,与癌并发的GIST发病机制尚未清楚。在胃肠道肿瘤的高发区,GIST的并发率并不高,从流行病学上很难说明,两者发病机制的共同点。或许GIST本身(尤其是恶性的GIST)与癌的发生互为诱因;或许有共同的致病因素,如电离辐射暴露、基因突变以及幽门螺旋杆菌感染等,但这些均缺乏证据。尽管国外有学者提出患者基因改变或相同癌基因对邻近胃组织的影响等假说,并用实验证明同一器官能够被诱导出不同类型的肿瘤,如N-甲基-N'-硝基-N-亚硝基胍能诱导大鼠胃腺癌,同样该化合物在胃黏膜屏障被破坏后,也可诱发出平滑肌肉瘤[11-12],但这些假说用来解释GIST与癌并发的机制仍然不具备说服力,具体机制仍有待进一步探究。
3.2 临床病理学特征 GIST是最常见的胃肠道间叶肿瘤,可发生于胃肠道的各级导管中,在胃中最常见(60%~70%),其次是小肠(20%~30%)、结肠直肠和食管(<10%)[13]。本组GIST并发胃肠道癌9例,4例并发食管癌,4例并发胃癌,1例并发直肠癌。GIST并发消化道癌缺乏特异临床症状,一般是以癌发生部位的症状为主,如进行性吞咽、呕血、咯血、大便性状改变来就诊的。临床影像学的检查也往往检查出较大、较明显的消化道肿瘤,其他较小的结节往往会被误以为癌的转移而忽略了合并GIST的可能。本组9例GIST合并癌中,8例GIST位于胃,分别位于黏膜下或浆膜下,1例位于小肠浆膜内。术前检查查出GIST者仅1例,其余8例在术中探查或术后病理检查意外发现。基于上述情况,临床医师应予以足够的关注,需充分考虑肿瘤发生的多样性和GIST的特殊性。术中探查时需要对可疑病灶进行必要的术中快速冷冻病理检查,以利于确定手术范围。如在切除消化道肿瘤时忽略了并发的GIST,就有可能引起消化道的梗阻或出血,并有可能发展成侵袭性病变,造成治疗不当;或是把并发的GIST当成消化道癌的转移灶而过度治疗。对于直径>3 cm的GIST应该扩大切除,术后除行常规病理检查外,还应行免疫组化检查,以便进一步明确诊断。如果并发的肿瘤体积比较大,具有较多恶性指征,能归入高危险度肿瘤,则应该按照恶性GIST的治疗规范进行治疗。GIST合并胃肠道癌的生物学行为大多数为低风险或极低风险,只有极少数是高风险,其症状晚于胃肠道癌。国内已报道的19例GIST合并癌者无因GIST而死亡的病例,这可能与GIST合并癌极低度恶性或低度恶性相关[14]。
3.3 GIST侵袭危险性标准 参照国家卫生研究所的GIST共识指南中的Fletcher分级标准,根据间质瘤大小及核分裂数进行术后侵袭危险度分级[15]。
3.4 诊断及鉴别诊断 9例GIST合并消化道癌中GIST具有下列病理特点:(1)眼观:GIST为浆膜、黏膜下或胃壁内以及浆膜外结节,呈结节状或分叶状,大小不一,大小0.3 cm×0.5 cm×0.5 cm~4.0 cm×3.5 cm×0.7 cm,切面灰白、灰红色,质地从硬韧到软,可伴有出血、坏死及囊性变。(2)镜检:GIST由梭形细胞、上皮样细胞组成,瘤细胞呈编织状排列,胞质红染,胞膜界限清楚;核呈香烟卷或火腿肠样,染色质稀疏,核仁明显,常可见核旁空泡改变。肿瘤中胶原丰富,细胞稀疏,血管玻璃样变,伴有黏液样变。GIST主要与平滑肌肿瘤、神经鞘瘤鉴别。(3)免疫表型:平滑肌肿瘤表达SMA、desmin等肌源性蛋白标志物,不表达CD117、CD34、DOG1;神经鞘瘤S-100阳性,CD117、CD34、DOG1阴性;GIST则表达CD34、CD117、DOG1。
3.5 治疗及预后 (1)手术治疗:对于手术指征明确,无手术禁忌症、能够耐受手术的患者首选手术联合、同期、完整切除。根治切除胃肠癌是手术的首要目的,如术中探查合并GIST应完整切除。原因:① GIST无论大小均有恶性潜能。②如若遗漏了GIST可能会导致胃肠道梗阻、出血,需再次手术,增加患者无谓的负担。③如未切除GIST有可能诱发消化道癌的复发。(2)放、化疗:对于不能手术的患者,首先考虑胃肠癌的放、化疗,随着各类放、化疗药物在临床上的应用,可予以患者正规、个体化的放、化疗。然而,用于胃肠癌的放、化疗药物对于GIST治疗的效果均不理想。(3)靶向治疗:对于胃肠癌患者特别是结直肠癌患者进行K-ras基因检测,对于检测突变为野生型的患者,应用靶向治疗药物西妥昔单抗,可改善预后、提高生存率。在临床上,伊马替尼和舒尼替尼作为一二线药物,可以明显改善恶性GIST的预后,提高生存率。然而,却没有同时能治疗GIST合并胃肠道癌的靶向药物。两者之间的机制仍有待研究、阐明。GIST的预后与肿瘤发生部位、大小、核分裂数、术中是否完整切除肿瘤、肿瘤组织学亚型、免疫类型、细胞核增殖指数、突变类型均有关系,特别是肿瘤的生物学侵袭性、肿瘤的最大直径以及核分裂数,肿瘤发生部位已成为预测GIST预后的独立因素。资料显示,与胃癌并发的GIST 比其他部位的GIST预后要好。
综上所述,GIST与胃肠道癌是两种不同的实体瘤,并发的机制尚不清楚,是两者存在相似的易感因素还是两者肿瘤存在着内在的尚不为人所知的基因突变,这一切有待进一步研究。这对我们的日常工作提出了要求,面对有可能合并GIST的患者,应考虑全面,细致检查,明确病理学检查,治疗得当。
[1] 王 坚, 朱雄增. 软组织肿瘤病理学[M]. 北京: 人民卫生出版社, 2008:263-276.
[2] Maiorana A, Fante R, Maria Cesinaro A,etal. Synchronous occurrence of epithelial and stromal tumors in the stomach: a report of 6 cases[J]. Arch Pathol Lab Med, 2000,124(5):682-686.
[3] Liu S W, Chen G H, Hsieh P P. Collision tumor of the stomach: a case report of mixed gastrointestinal stromal tumor and adenocarcinoma[J]. J Clin Gastroenterol, 2002,35(4):332-334.
[4] Bircan S, Candir O, Aydin S,etal. Synchronous primary adenocarcinoma and gastrointestinal stromal tumor in the stomach: a report of two cases[J]. Turk J Gastroenterol, 2004,15(3):187-191.
[5] 丁洪基, 姜希宏, 徐登科, 等. 胰尾原发性胃肠外间质瘤1 例并文献复习[J]. 临床与实验病理学杂志, 2014,30(4):453-454.
[6] Dasanu C A, Jethava A, Ali S,etal. Gastrointestinal stromal tumor of small intestine and synchronous bilateral papillary renal cell carcinoma[J]. Conn Med, 2013,77(7): 405-407.
[7] 李杜娟, 赵跃武, 付芳芳, 等. 外阴及直肠阴道隔胃肠道外间质瘤3例临床病理分析[J]. 临床与实验病理学杂志, 2015,31(4):376-379.
[8] Seshadri R A, Singh S S, Ratnagiri R. Synchronous jejunal gastrointestinal stromal tumor and primary adenocarcinoma of the colon[J]. Indian J Surg, 2012,74(2):196-198.
[9] Liu Y J, Yang Z, Hao L S,etal. Synchronous incidental gastrointestinal stromal and epithelial malignant tumors[J]. World J Gastroenterol, 2009,15(16):2027-2031.
[10] Agaimy A, Wfinsch P H, Sobin L H,etal. Occurrence of other malignancies in patients with gastrointestinal stromal tumors[J]. Semin Diagn Pathol, 2006,23(2):120-129.
[11] Sugimura T, Fujimura S, Baba T. Tumor production in the glandular stomach and alimentary tract of the rat by N-methyl-N′-nitro-N-nitrosoguanidine[J]. Cancer Res, 1970,30(2):455-465.
[12] Cohen A, Geller S A, Horowitz I,etal. Experimental models for gastric leiomyosarcoma. The effects of N-methyl-N′-nitro-N-nitrosoguanidine in combination with stress, aspirin, or sodium taurocholate[J]. Cancer, 1984,53(5):1088-1092.
[13] Corless C L, Fletcher J A, Heinrich M C. Biology of gastrointestinal stromal tumors[J]. Clin Oncol, 2004,22(18):3813-3825.
[14] 孙希印, 吴起嵩, 耿振宏, 等. 与癌并发的胃肠道间质瘤临床病理观察[J]. 中华病理学杂志, 2013,42(11):739-743.
[15] Fletcher C D, Berman J J, Codess C,etal. Diagnosisofgastrointestinal stromal tumors: a confleusus approach[J]. Int J Surg Pathol, 2002,10(2):81-89.
Gastrointestinal stromal tumor with synchronous carcinoma features: a clinicopathologic analysis of 9 cases
LIN Wen-sheng1, ZHANG Fang2, REN Li2, LI De-chang2, ZHENG Ji-chun2, ZHU Jian-ping2
(1HebeiNorthUniversity,Zhangjiakou075000,China;2DepartmentofPathology,AirForceGeneralHospital,Beijing100142,China)
Purpose To explore the differentiation of gastrointestinal stromal tumor(GIST) with synchronous carcinoma clinical and pathological features, diagnosis and differential diagnosis. Methods Clinical characteristics, pathological morphology and immunohistochemical staining were observed in 9 cases of GIST with synchronous carcinoma, with review of the relevant literature. Results Microscopically, in 4 cases GIST with esophageal carcinoma, most of tumor cells in central focus were squamous cells and keratin pearls which were well differentiated and the rest of tumor cells are basal like cells on the edge. In the other 5 cases (4 of them with gastric carcinoma and 1 with rectal cancer). Microscopically, the tumors were composed of dysplastic glands which presented as adenoid structures and poorly differentiated. The majority of gastric GIST were spindle cell tumors, which resembled smooth muscle tumors histologically and showed a variety of histological pattern, such as lace like pattern, palisading pattern, antique coins like pattern and eddy pattern. And a perinuclear vacuolization pattern was common. Immunohistochemistry showed that the tumor cells were positive for CK5/6, CK14 and p53, but negative for S-100, CK7 of the 4 cases GIST with esophageal carcinoma. In the other 5 cases (4 of them with gastric carcinoma and 1 with colorectal cancer), showed that CK7, CK20, CEA and HER-2 were positive and negative for S-100. In all the 9 case of GIST, the tumor cells were positive for CD34, CD117(+), DOG1 and SMA, but negative for S-100, desmin, etc. Conclusion There are no special clinical symptoms in most of GIST with synchronous carcinoma, because these GISTs are generally incidental findings. The proliferative index of GIST with synchronous carcinoma is observably lower than that of GIST without synchronous carcinoma. Most GISTs with synchronous carcinoma can be treated by the standard treatment for the accompanying carcinoma, and do not need specific additional treatments.
gastrointestinal stromal tumor; esophageal carcinoma; gastric carcinoma; rectal cancer; pathological features; diagnosis
1河北北方学院,张家口 0750002中国人民解放军空军总医院病理科,北京 100142
林文生,男,硕士,医师。E-mail: l87987464@126.com 任 力,男,硕士,主任医师,通讯作者。E-mail: renlifei2000@sina.com
时间:2017-6-20 11:18 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.005.html
R 735
A
1001-7399(2017)06-0613-05
10.13315/j.cnki.cjcep.2017.06.005
接受日期:2017-03-23
