特殊部位原发性肝癌经皮微波消融临床观察
2017-07-31荀运浩刘德林孙希希孔梓祥
黄 斌 荀运浩 刘德林 孙希希 刘 芳 孔梓祥
特殊部位原发性肝癌经皮微波消融临床观察
黄 斌 荀运浩 刘德林 孙希希 刘 芳 孔梓祥
目的 探讨经皮微波消融技术在特殊部位原发性肝癌中的临床应用价值。方法 纳入自2015年1月至2016年3月期间特殊部位(位置紧邻大血管、胆囊或临近重要脏器)原发性肝癌31例。超声引导下经皮微波消融治疗,消融气化范围控制在大于病灶边缘1.0cm,术中严密观察生命体征,记录消融及全程操作时间;术后即刻及术后1、3、6、12个月超声造影评估,每6个月肝脏MRI复查,详细记录并发症及病灶复发情况。结果 术后即刻超声造影提示31个病灶完全灭活,但操作难度增大,整个手术操作周期较普通部位病灶延长平均25min。消融术后综合症发生率74%(23/31):剧烈呕吐1例;上腹隐痛11例,其中9例1个月内消失,2例持续3个月;术后发热22例,体温均<39°,持续2~9d;均未出现出血等严重并发症。9.6%(3/31)术后6个月发生消融灶边缘肿瘤复发,其中2例在术后6个月复发,1例在术后1个月复发,余28例12个月内均未见明显复发。31例经皮微波消融均未出现出血等严重并发症。结论 特殊部位原发性肝癌经皮微波消融操作难度增大,手术时间延长,消融术后综合症常见,但微波消融创伤小、疗效确切,仍是不能手术切除病例的主要治疗手段。
微波消融 特殊部位 原发性肝癌 超声造影
原发性肝癌为起源于肝细胞或胆管细胞的癌肿,是我国常见的恶性肿瘤之一,病死率位居恶性肿瘤第二位,其中90%原发性肝癌有病毒性肝炎、肝硬化基础。手术切除是其主要治疗手段,但临床上大部分肝癌发现已晚期,有手术切除机会的肝癌<20%[1]。近年来,在超声引导下热消融治疗肝癌技术发展迅速,综合疗效确切[2],<3cm肝癌经微波消融治疗后生存率可与外科手术相媲美[3]。但原发性肝癌由于肝硬化基础的影响,肝脏形态和结构产生变化,部分病灶位于胆囊或大血管旁等特殊部位,导致消融操作难度加大,本研究旨在探讨肝脏特殊部位肿瘤经皮微波消融的临床应用价值。
1 临床资料
1.1 一般资料 31例特殊部位原发性肝癌病例(31个病灶)来自2015年1月至2016年3月期间本院住院患者,其中男28例,女3 例,年龄29~66岁,均有乙肝肝硬化病史,影像学检查肝脏均有不同程度缩小,其中19例伴有肝周侧支循环建立,29例甲胎蛋白(AFP)增高。31个病灶均超声可见,位置紧邻大血管、胆囊或肝外重要脏器,病灶最大切面1.6×1.4cm~4.3×3.9cm,胆囊受压凹陷3 例,血管受压改变 6例,位于左侧膈下紧邻心脏4 例,突向肝包膜外4例,紧贴胃肠道 6例,靠近第一、二肝门部 8例。
1.2 方法 超声设备采用百胜MyLab Class-C,CA541探头,频率1~8MHz;消融设备为国产频率2450MHz带水循环冷却系统17G微波消融电极,在全身麻醉后选择合适体位,取16G前极1.1微波消融电极,在超声引导下进针至肿瘤深部,消融功率设定为55~85 W,启动消融后至气化范围完全覆盖瘤体并持续加热120~180s。术中及术后严密观察并发症,术后即刻、1、3、6、12个月超声造影评估,每6个月MRI复查,详细记录病灶存活情况及并发症发生情况。
1.3 评估标准 以超声造影(或MRI)作为消融疗效评估方法:(1)完全消融:病灶完全丧失活性,病灶内动脉期、门脉期及延迟期均无造影剂增强信号,呈“空洞”征。(2)不完全消融:病灶部分存活,病灶内可见部分异常增强信号伴随局部“空洞”征。(3)消融失败:可见病灶一半以上有增强信号。(4)肿瘤复发:在原消融灶“空洞”区域内部或边缘出现异常增强信号。
2 结果
2.1 手术情况 31个病灶术后即刻超声造影均提示完全灭活呈“空洞”征(图1~3),因进针点位置和进针路径选择局限,操作难度明显增大,布针及整个手术操作周期延长,较常规消融比较,平均手术周期延长25min。所有病灶消融气化范围均完全覆盖肿瘤面积,术中均未出现出血等严重并发症。
2.2 术后并发症 消融术后综合症发生率74%(23/31),22例术后出现低热,体温<39°,持续时间2~9d;1例出现激烈呕吐,肌肉注射胃复安10mg,30min后症状减轻并消失;11例术后上腹部隐痛,其中9例1个月内痛感消失,2例位于左肝包膜下病灶自诉隐痛持续3个月,单个病例可出现多个症状。
2.3 术后复发 术后6个月内9.6%(3/31)病例消融灶边缘肿瘤复发,超声造影可见消融灶“空洞”边缘弧形异常增强信号(图4),其中2例术后6个月复发,1例术后1个月复发,复发肿瘤均包绕消融灶边缘生长;余28例12个月内均未见明显复发征象。
3 讨论
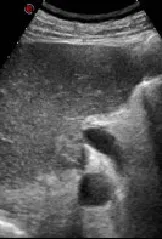
图1 肿瘤向肝门部突出突出,向门静脉压迫,后方邻近下腔静脉
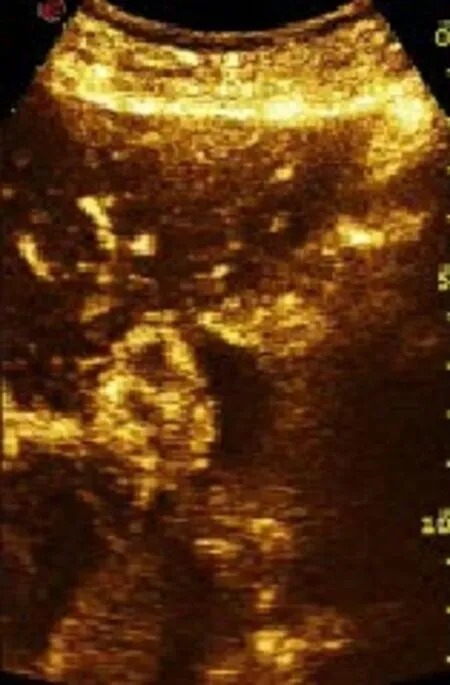
图2 消融前超声造影(动脉期肿瘤快速增强)
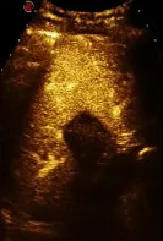
图3 消融后超声造影(肿瘤完全消融呈“空洞”征)
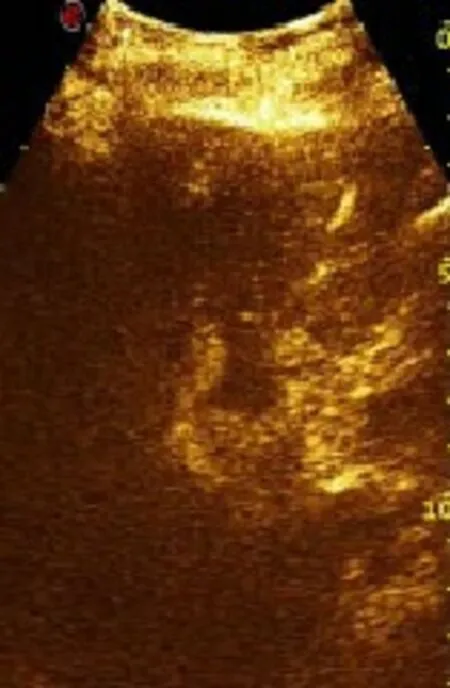
图4 肿瘤复发[超声造影(第6个月)动脉期消融灶边缘弧形增强]
近年来,超声引导下热消融治疗肝癌技术迅速发展,为临床提供了微创的局部治疗方法,实现了肝脏肿瘤“原位整体灭活”的根治性疗效[4]。多数研究表明[5],射频与微波消融对于小肝癌的疗效确切,远期疗效达到与手术切除相媲美,梁萍等[6]认为无法行手术切除的肝癌患者也可使用该技术进行根治性治疗或控制肿瘤发展。
随着热消融应用深入,多数学者认为在超声引导下经皮对高危部位的原发性肝癌行微波消融治疗存在较大风险。Wong等[7]报道消融治疗非特殊部位肝癌未发现严重的并发症,而所有严重并发症都是发生在特殊部位的肝癌。目前,特殊部位肝癌临床尚无确切定义,国内外学者看法也不完全相同。Kelogrigoris等[8]认为肿瘤临近心脏、肺、胆囊、右肾、胃肠道等重要脏器为特殊部位。Teratani等[9]定义更加明确,认为靠近肝门静脉一、二级分支5 mm 以内;或肝静脉、下腔静脉主干旁;或靠近心脏、胆囊、肺、右肾、胃肠道5 mm 以内为特殊部位。本组31个病灶所处部位符合 Kelogrigoris 等所指特殊位置,因我国原发性肝癌约75%具有肝硬化基础,肝脏形态改变、体积缩小,致使肝内肿瘤所处位置更贴近大血管、胆囊或胃肠道等特殊部位,形成原发性肝癌患者中特殊部位肝癌比例显著增高。综合本组研究,作者认为,特殊部位肝癌为靠近大血管或者邻近肝外重要脏器的肝癌,临床操作难度大,布针路径局限,较易误伤这些邻近脏器并易引起严重并发症。
特殊部位的原发性肝癌因患者肝脏基础条件差、病灶位置风险,手术切除难度及风险成倍增加,尤其对于部分不能手术切除病例应用消融治疗具有重要意义;超声引导下经皮微波消融虽然布针困难,但疗效显著,且患者创伤相对小。本组31个病灶由于其位置的特殊性,操作难度明显增大,肝脏缩小,超声扫查声窗明显变窄,经皮消融路径受限,进针点位置和进针路径选择局限,布针及手术时间明显延长,手术全程操作时间平均延长25min。因原发性肝癌患者身体条件较差,受呼吸干扰,手术时间延长将增加各类手术风险,全身麻醉下消融治疗将能够达到更满意的操作。因病灶紧邻胃壁,1例左肝下缘包膜下病灶术后出现激烈呕吐,肌肉注射胃复安10mg,30min后症状减轻并消失;11例肝包膜下病灶术后上腹部隐痛,可忍受;本组病例消融术后综合症常见,主要表现为术后全身不适、局部疼痛、发热、恶心呕吐等症候群,并发症持续时间明显长于非特殊部位肝肿瘤消融术,术后综合症发生率74%。
微波消融升温快,消融时间短,消融范围相对较大,能快速使消融区发生凝固性坏死,超声造影及MRI可见消融后病灶呈“空洞”征表现,消融后的坏死组织吸收并刺激机体免疫反应引起吸收热;本组70.1%(22/31)术后出现低热,体温<39°,持续时间2~9d,为热消融后肿瘤坏死引起的吸收热。9.6%(3/31)病例12个月内出现消融灶边缘复发,2例发现于术后6个月,1例发现于术后1个月,复发病灶呈弧形包绕消融灶;考虑为病灶紧邻危险脏器,消融范围和消融时长不足,或紧邻较大血管,血流带走热能引起热降效应,从而对周边肿瘤组织起到了保护作用,而术后即刻超声造影显示完全灭活,可能为肿瘤组织在相对高温下未引起凝固性坏死,仅为热休克现象。本组31个病灶术后均未出现出血等严重并发症。
综上所述,特殊部位原发性肝癌经皮微波消融治疗操作难度增大,布针及手术时间延长,术后复发率相对较高,但微波消融升温快,疗效确切,虽然操作难度较大,但作为不能手术切除病例,仍是主要的治疗手段。
[1] Ansari D,Andersson R.Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors.World J Gastroe nterol,2012,18(10):1003-1008.
[2] Itoh S,Ikeda Y,Kawanaka H,et al.Efficacy of surgical microwave therapy in patients with unresectable hepatocellular carcinoma.Ann Surg Oncol,2011,18(13):3650-3660.
[3] Li L,Zhang J,Liu X,et al.Clinical outcomes of radiofrequency ablation and surgical resection for small hepatocellular carcinoma:a meta-analysis.J Gastroenterol Hepatol,2012,27(1):51-58.
[4] 梁萍,董宝玮.肝癌微波消融合理选择与评价.中国实用外科杂志,2008,28(8):615-617.
[5] Livraghi T,Meloni F,Di Stasi M,et al.Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis:Is resection still the treatment of choice? Hepatology,2008,47(1):82-89.
[6] Liang P,Yu J,Yu XL,et al.Percutaneous cooled-tip microwave ablation under ultrasound guidance for primary liver cancer:a multicentre analysis of 1363 treatment-naive lesions in 1007 patients in China.Gut,2012,61(7):1100-1101.
[7] Wong SN, Lin CJ, Lin CC, et al. Combined percutaneous radiofrequency ablation and ethanol injection for hepatocellular carcinoma in high- risk locations.Am J Roentgenol, 2008, 190(3): W187-W195.
[8] Kelogrigoris M, Laspas F, Kyrkou K, et al. Percutaneous radiofrequency ablation for malignant liver tumours in challenging locations. J Med Imaging Radiat Oncol,2012,56(1):48-54.
[9] Teratani T, Yoshida H, Shiina S, et al. Radiofrequency ablation for hepatocellular carcinoma in so-called high-risk locations. Hepatology, 2006,43(5):1101-1108.
Objective To investigate the clinical value of ultrasound-guided percutaneous microwave ablation for difficult-to-ablate primary liver cancer(PLC). Methods A total of 31 eligible patients with PLC were enrolled from Jan 2015 to Mar 2016. Ultrasound-guided percutaneous microwave ablation was performed to destroy the lesions,and gasif i cation area was controlled 1.0 cm away from rim of the lesion. The vital signs were observed during the operation,and the operation time was recorded. Contrast enhanced ultrasound(CEUS)was performed alone immediately and one week after treatment,then together with MRI one and three months after ablation,to assess the therapeutic eff i cacy. Conditions of residual lesion and post-operation complications were analyzed. Results As evidenced by CEUS immediately after treatment,all the lesions were ablated completely. Compared with percutaneous microwave ablation in regular locations,lesions in the present study were treated very diff i cult,with a 25 min longer time. Post-ablation syndrome was observed in 77% of patients,including 1 case with severe vomiting,11 with blur epigastric pain and 22 with fever. Nonetheless,severe complications,such as bleeding,occurred to none. Marginal tumor recurrence occurred to 3 patients by the end of 6 months after ablation. Conclusion Percutaneous microwave ablation for diff i cult-to-ablate PLC is a great challenge by the prolonged time for operation and a relatively high incidence of post-ablation syndrome. However,microwave ablation remains a favorable choice for patients with unresectable lesions,gives the def i nite eff i cacy and less invasiveness nature.
Microwave ablation Diff i cult-to-ablate Primary liver cancer Contrast enhanced ultrasound
310023 杭州市西溪医院
