深圳湾红树林根际富油酵母的筛选与鉴定
2017-07-25安娜杨渊沈兰琳朱卓郭馨杰薛智权
安娜+杨渊+沈兰琳+朱卓+郭馨杰+薛智权
摘 要:从深圳湾红树林根际土壤和海水样品中筛选到一株富油酵母,对其基本形态、油脂积累情况和生物学地位进行研究,旨在为开发其应用潜力提供理论指导。利用松花粉垂钓法筛选得到富油酵母,用显微镜观察其基本形态,采用尼罗红染色法观察油脂积累情况,扩增18S rRNA序列对该富油酵母进行分子鉴定,并用GC-MS分析菌株的油脂含量和组成情况。结果显示,筛选得到一株富油酵母菌,在低氮培养基中72 h油脂积累即达到平台期。18S rRNA序列鉴定其属于Cyberlindnerasaturnus sp.。脂肪酸含量達到细胞干质量的55%,主要成分为C15∶0、C16∶0和C17∶0的饱和脂肪酸,含量达到总脂肪酸的90%以上。该酵母菌适合用于生物柴油的生产。
关键词:红树林;富油酵母;筛选;18S rRNA;GC-MS
中图分类号:TE667 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.07.002
Screening and Identification of Oil-rich Yeast from Mangrove Rhizosphere of Shenzhen Bay
AN Na, YANG Yuan, SHEN Lanlin, ZHU Zhuo, GUO Xinjie, XUE Zhiquan
(College of Life Science, Shanxi Agricultural University, Jinzhong, Shanxi 080301, China)
Abstract:Anoil-rich yeast strain was screened from mangrove rhizosphere soil and seawater samples of Shenzhen bay, and its morphology, oil accumulation and taxonomy were studied. The pine pollen fishing method was used for screening and its morphology was observed by microscope, Nile red staining was used to observe the oil content, the molecular identification of the oil rich yeast was conducted by enhancing 18S rRNA gene sequence, and GC-MS was used to analyze the oil content and composition. The result showed that the strains of the yeast identified by 18S rRNA gene belonged to Cyberlindnerasaturnus sp., and the strains had the genus of rich oil. It is concluded that the yeast is suitable to producing biological diesel oil.
Key words:mangrove; oil-rich yeast; screening; 18S rRNA; GC-MS
近年来,随着石油能源枯竭、全球资源短缺及环境污染等问题的日益严重,生物柴油因其原料的可再生性、易生物降解、清洁无污染等特性,被认为是传统石油的最佳代替品之一,已成为国际研究热点[1-3]。
深圳红树林位于陆地和海洋环境的动态交界面,为热带亚热带海洋潮间带独特的生态系统。因周期性的海水侵袭、河口有机质的沉积和落叶的腐败作用使其中富含有机质和腐殖质,并形成了特殊的生态环境,其中生活着众多生物,也蕴含了极其丰富的微生物资源[4]。对盐胁迫和富营养化环境的长期适应,使得红树林微生物在形成特殊群落的同时,也可产生大量活性代谢产物。红树林土壤中的微生物不但在环境修复和城市污水处理中扮演着重要的角色[5-6],同时也是多种重要工业和医药产业中间产物的生产者[7]。其中的多种微生物能够合成和积累大量的多不饱和脂肪酸和中长链饱和脂肪酸,在食品、保健品和生物新能源等行业中具有巨大的潜在应用价值[8-10]。
本研究从深圳红树林根际土壤和海水样品中筛选到一株富油酵母菌株,研究了其基本形态、油脂积累情况,并用18S rRNA基因序列对其进行鉴定,可为菌种工业化高产脂肪酸提供理论指导。
1 材料和方法
1.1 培养基
筛选培养基:葡萄糖30 g·L-1,胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,海水晶15 g·L-1,蒸馏水配制。固体培养基加20 g·L-1的琼脂。
低氮培养基:葡萄糖30 g·L-1,胰蛋白胨1.5 g·L-1,酵母提取物1 g·L-1,海水晶1.5 g·L-1,KH2PO4 0.25 g·L-1,蒸馏水配制。
1.2 方 法
1.2.1 样品采集与分离 从深圳湾红树林保护区采集红树林根际土壤和海水样品,放入灭菌的密封离心管中带回实验室,立即进行菌株分离。分离采用松花粉垂钓法:在无菌平板中加入 2 mL 海水样品和 10 mL 海水培养基,并加入少量松花粉(95 ℃烘箱处理1 h)作为诱饵,在室温条件下培养1周。分别在接种土壤和海水的培养基中挑选菌种转接到新鲜的海水(含有松花粉、0.075%链霉素和0.05%氨苄西林)平板中进行数字标记培养。培养1周后,取适量培养液涂布到含有链霉素和氨苄西林的固体培养基中,室温培养1周后,取单克隆涂布到新鲜的固体培养基中,重复纯化 2~3 次。
1.2.2 菌株鉴定 采用PCR法扩增18S rDNA序列的方法进行菌种鉴定。总基因组的提取采用酵母基因组DNA 提取试剂盒(Solarbio,北京)。18S rDNA基因的 PCR (Polymerase chain reaction)扩增使用的特异性引物为:18SF,5-AACCTGGTTGATCCTGCCAGTA-3;18SR,5-CCTTGTTACGACTTCACCTTCCTCT -3。PCR反应用20 μL 反应体系,其中菌液加2 μL,引物含量分别为1 μL,2*Mix 10 μL,ddH2O 6 μL。扩增条件:95 ℃ 4 min; 94 ℃45 s,52 ℃ 30 s,72 ℃ 45 s,30 个循环;72 ℃10 min。PCR 产物跑琼脂糖凝胶电泳后,切胶分离纯化。挑取阳性克隆送到百迈克生物科技有限公司(北京)进行测序。
将测序得到的18S rDNA序列在GenBank中进行比对,确定该酵母菌的分子学分类。
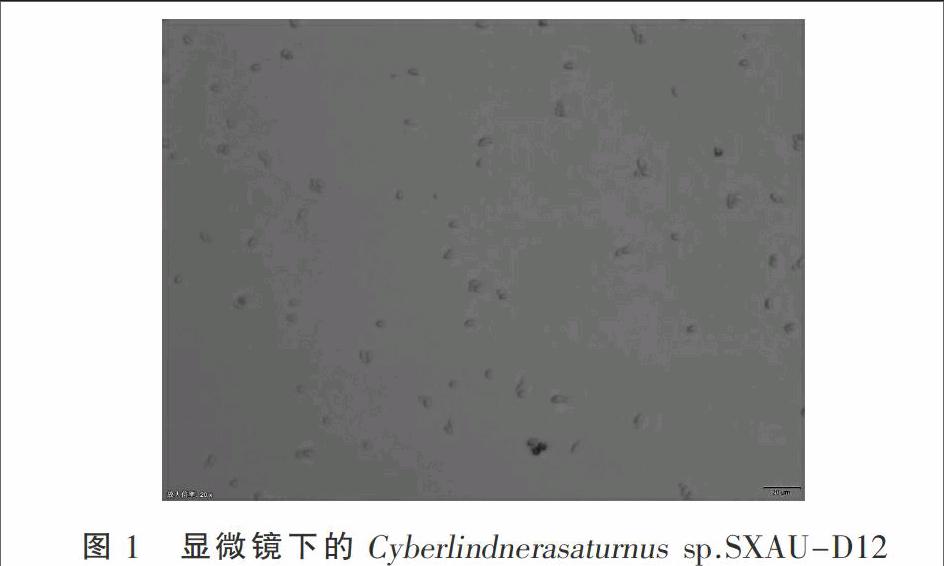
1.2.3 富油酵母菌的形态及生活史观察 观察富油酵母菌的生活形态时,直接取30 μL富油酵母菌培养液,用95%乙醇稀释的美蓝溶液79 μL染色5 min。染色完成后,取一滴滴在载玻片上,盖上盖玻片,风干后在 Olympus显微镜下观察,目镜10×,物镜 40×。观察时可先找到单个的酵母菌。油镜(100×)下可清晰观察到菌体形态。
定期取不同培养时期(6,12,24,36,48,60,
72,84,96 h)的酵母菌培养液在显微镜下观察酵母菌生长变化及其生活史的一般过程。
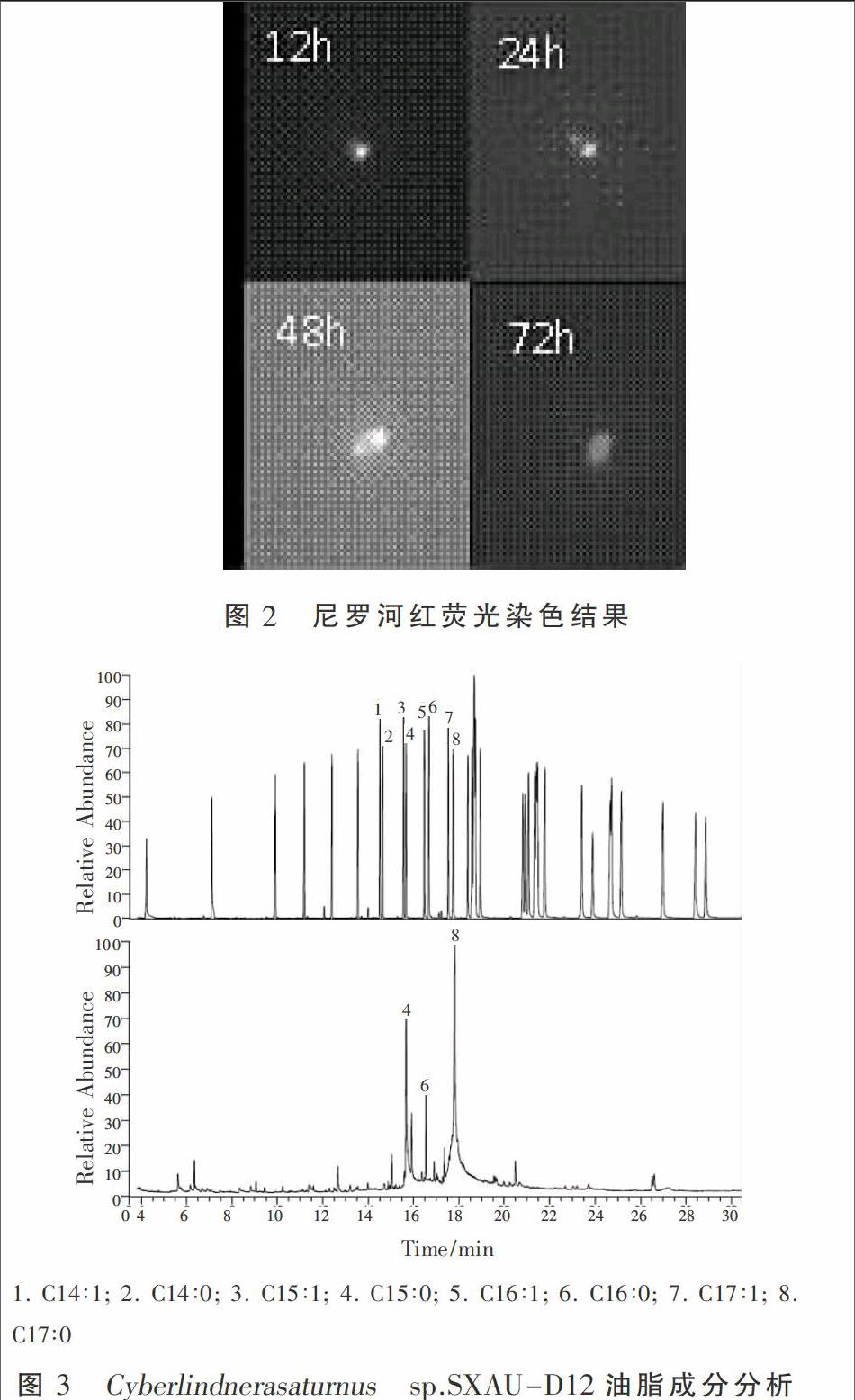
1.2.4 尼罗红(Nile Red)荧光染色 尼罗红是一类苯吩哑嗪酮类化合物,能够与脂类物质结合并在≤570 nm 波长的激发光下发出荧光,快速地将类脂类物质与其它储藏物分离开来。尼罗红是一类脂溶性染料,难溶于水,需要借助丙酮、乙醇等有机溶剂,故尼罗红染色液配制成 0.01% (质量体积比)丙酮溶液。
取100 μL不同生长时间的酵母菌培养液于96孔板中,加入10 μL尼罗红染色液于暗处染色20 min,然后用蓝光激发,在暗场下观察,以发出红色荧光为阳性。
1.2.5 细胞油脂的提取与脂肪酸甲酯的制备 收集200 mL处于平台期的菌体培养液,6 000 r·min-1离心10 min收集菌体,冷冻干燥后用于油脂提取。菌体油脂的提取与转酯化采用一步法[6]:称取200 mg冷冻干燥后的菌体,加入2 mL 4%硫酸甲醇溶液,振荡混匀20 s,在80 ℃水浴1 h。待溶液冷却至室温后,加入水和正己烷各1 mL,混匀后离心,脂肪酸甲酯即溶于上层正己烷中。取上层有机相用于气相色谱分析。
1.2.6 油脂成分分析 取0.5 mL过滤后的脂肪酸甲酯,置于气相色谱样品管中,采用气相色谱-质谱联合分析仪(气相色谱仪为Trace1300,质谱仪为Trace ISQ,Thermo Fisher,USA)进行分析。色谱柱为DB-5 ms毛细管柱(35 m× 250 μm×0.25 μm),扫描荷质比范围为40~500。载气为He,流速1 mL·min-1,进样量1 μL;进样口温度280 ℃,检测器温度 290 ℃,升温程序:70 ℃保持2 min,接着以10 ℃·min-1升温至 220 ℃,再以3 ℃·min-1升温至 260 ℃,然后以10 ℃·min-1升温到280 ℃,保持5 min。以37 种混合脂肪酸甲酯标准品(NU-CHEKPREP,INC., USA)为参照。通过对比标准样品并计算峰面积来确定各组分的含量。
2 结果与分析
2.1 富油酵母菌的形态特征及分子生物学鉴定
显微镜下可清晰地观察到单个酵母菌,菌体的大小一般在2~10 μm 之間,菌体形态多呈椭圆形(图1)。年轻的菌体其长轴一般在5 μm 左右,成熟的菌体长轴可达10 μm,且菌体形态被拉长,细胞核被挤向细胞边缘,可清晰地看到成熟的大液泡。在固体培养基上,单克隆为乳白色圆球,直径约为1~5 mm,边缘清晰,表面光滑湿润。
该酵母菌主要以出芽的形式繁殖,成熟细胞表面生出一个小芽孢,然后逐渐变大,至与母体大小相近时,两细胞壁分离,成为完整的两个细胞,此为第一种方式。也可能在母体细胞核内部先进行有丝分裂,随着染色体被拉向细胞两极,细胞膜、细胞壁发生缢缩,后分裂为两个子细胞,此为第二种二分裂的方式。这两种方式都是酵母菌比较常见的繁殖方式。在营养条件较丰富的培养基中,酵母菌主要以出芽生殖为主,而在后期产物积累的过程中,会出现部分二分裂生殖。二分裂生殖中,细胞壁缢缩发生在一瞬间,显微镜下很难捕捉到。在此次观察中,还观察到了少许呈两端出芽生殖的细胞。
对18S rDNA序列测序后比对,该序列跟Cyberlindnerasaturnusstrain SBPN 27(GenBank No.:KY419100.1)的序列具有99%的相似度,根据微生物分类方法,将其归类为Cyberlindnerasaturnus sp.,命名为SXAU-D12。
2.2 尼罗红染色法检测破囊壶菌生长过程中的油脂积累情况
使用尼罗红荧光染色的方法对酵母菌生长过程中油脂积累情况进行定性检测,所得结果见图2。接种后12 h,酵母菌仍处于对数生长期,细胞以分裂生长为主,油脂的积累量较少。尼罗红染色显示荧光较弱,细胞内的油脂粒呈现微弱的黄色荧光,数量较少,细胞壁呈现红色荧光,边缘较厚且清晰可见。24 h后,细胞开始逐渐进入平台期,细胞开始积累油脂,尼罗红染色可见细胞内油脂粒的数量明显增多,细胞内黄色荧光强度增加,细胞壁的红色荧光减弱。第2天细胞中油脂粒的荧光强度继续增强,至第3天,细胞中的油脂积累量达到最大,整个细胞都呈现亮黄色,细胞内不可见单个的脂肪粒,不可见明显的细胞壁。
2.3 脂肪酸含量与成分分析
本试验筛选得到的酵母菌脂肪酸含量占细胞干质量的55%以上。GC-MS结果显示(图3),脂肪酸成分主要包括C15∶0(棕榈酸)、C16∶0(硬脂酸)和C17∶0,三者占到总油脂含量的90.5%。
3 结论与讨论
本试验从红树林根际土壤和海水中筛选得到的富油酵母菌,具有生长繁殖快,易于研究的特性。在低氮培养基中培养96 h左右,其脂肪酸堆积量大,可达干菌体质量的55%。脂肪酸主要为15碳、16碳和17碳的饱和脂肪酸,非常适合于生产生物柴油。在后续试验中,拟通过优化培养条件,并对该菌株进行遗传改造,以进一步提高脂肪酸产量,实现脂肪酸的大量生产,为其在工业上大规模应用奠定理论基础。
参考文献:
[1]SOYDEMIR G,KERIS-SEN U D, SEN U,et al. Biodiesel production potential of mixed microalgal culture grown in domestic wastewater[J]. Bioprocess and biosystems engineering, 2016,39(1): 45-51.
[2]薛智权, 吕蕊, 李宏, 等. 一株富油微藻的鉴定及其脂肪酸成分分析[J]. 天津农业科学, 2016,22 (8): 1-5.
[3]SALVI B L, PANWAR N L. Biodiesel resources and production technologies :a review[J].Renewable and sustainable energy reviews,2012,16(6): 3680-3689.
[4]孟昊, 薛智权, 唐杰, 等. 深圳福田红树林土壤可培养微生物和土壤酶活性研究[J]. 广东农业科学, 2013(1): 53-56.
[5]LI C H, WONG Y S, TANG N F. Anaerobic biodegradation ofpolycyclic aromatic hydrocarbons with amendment of iron(Ⅲ) inmangrove sediment slurry[J].Bioresource technology, 2010, 101(21):8083-8092.
[6]MIAO S, CHEN G, DELAUNE R D, et al. Partitioning and removalof Cd and Mn using a simulated mangrove wastewater treatment system[J].J environ sci health atox hazard subst environ eng,2007,42(4):405-411.
[7]张柳红, 王嘉健, 洪葵,等. 红树林内生真菌Aspergillus sp. 085035次級代谢产物研究[J]. 中药材, 2017, 40(2): 342-346.
[8]李晶晶, 刘瑛, 马炯. 破囊壶菌生产DHA的应用前景[J]. 食品工业科技, 2013, 34(16): 367-371.
[9]梁园梅, 刘瑛, 李晶晶, 等. 高产DHA 破囊壶菌Aurantiochytrium sp. PKU#SW7诱变株的筛选[J]. 微生物学通报, 2016, 43(2): 457-464.
[10]姜剑锋,赵丽芹,陈涛,等.DHA的来源及寇氏隐甲藻生产DHA的研究[J].内蒙古农业科技,2011(3):109-112.
