光学相干断层扫描与视觉电生理检查分析糖尿病黄斑水肿患者黄斑部形态学及视功能改变
2017-07-25桂玉敏彭建军李双
桂玉敏,彭建军,李双
(1.武汉市普仁医院眼科,湖北武汉430081;2.武汉市中心医院眼科,湖北武汉430014)
光学相干断层扫描与视觉电生理检查分析糖尿病黄斑水肿患者黄斑部形态学及视功能改变
桂玉敏1,彭建军1,李双2
(1.武汉市普仁医院眼科,湖北武汉430081;2.武汉市中心医院眼科,湖北武汉430014)
目的利用光学相干断层扫描(OCT)与视觉电生理检测,分析糖尿病黄斑水肿(DME)患者黄斑部形态学及视功能改变的关系,为临床治疗提供相关依据。方法选取2014年12月至2016年12月在武汉市普仁医院确诊为糖尿病黄斑水肿的患者190例(320眼)为观察组,同时选取无黄斑水肿及视网膜病变的同期糖尿病患者180例(301眼)为对照组。检测患者的最佳矫正视力,并对患者进行光学相干断层扫描及视觉电生理检查。结果观察组190例患者(320眼)最佳矫正视力为0.02~0.6,对照组180例患者(301眼)最佳矫正视力为0.7~1.5,差异具有统计学意义(P<0.05);观察组的黄斑中心凹视网膜神经上皮层平均厚度为(330.17±87.3)μm,比对照组的(150.39±22.9)μm增加了98%,差异有统计学意义(P<0.05)。结论发生黄斑水肿及视网膜病变的糖尿病患者与未发生黄斑水肿及视网膜病变的糖尿病患者,在黄斑形态学及视功能改变方面差异显著,光学相干断层扫描与视觉电生理对临床检查具有重要的作用。
光学相干断层扫描;视觉电生理检测;糖尿病黄斑水肿;视功能改变
糖尿病是人体血脂代谢紊乱引起的一种慢性疾病,可引起全身各种器官出现并发症,严重影响患者的生命健康[1]。随着人们生活条件的改善,糖尿病发病率逐年升高,出现各种并发症的人数也不断增加,而糖尿病视网膜病变就是发生在患者眼部的病变,典型特征是患者视网膜出血和出现微血管瘤[2]。出现患者糖尿病视网膜病变、视力下降的原因之一是糖尿病黄疸水肿,在视网膜病患者的膜内血管会变薄,血管内的液体渗透到视网膜上聚集,导致视网膜增厚,引起患者视力的下降。因此,早期的检测对糖尿病黄斑水肿及视功能改变的诊断和治疗就显得尤为重要。传统临床检测主要使用眼底血管荧光造影技术,但这种方法会对患者造成创口,特殊情况下影像不清晰,效果不佳[3]。随着医学的发展,光学相干断层扫描与视觉电生理检测在临床中得到广泛运用,它们具有无创性,能清晰反映病变组织的影像的特点。本文旨在比较以上两种方法对视网膜及视功能检测的数据,探讨其临床应用的价值。
1 资料与方法
1.1 一般资料选取2014年12月至2016年12月在武汉市普仁医院确诊并治疗的糖尿病黄斑水肿患者190例(320眼),纳入观察组,其中男性112例(200眼),女性78例(120眼),双眼屈光范围均在±3.00 D之间;同时选取同一时期在本院确诊并治疗的无黄斑水肿及视功能改变的糖尿病患者180例(301眼),纳入对照组,其中男性104例(180眼)、女性76例(121眼),双眼屈光范围均在±3.00 D之间。
1.2 纳入标准根据ETDRS对糖尿病黄斑水肿的定义,纳入标准为:视网膜水肿增厚在距黄斑中心500 μm区域,或小于500 μm;硬性渗出位于距黄斑中心500 μm区域,或小于500 μm,并伴有邻近视网膜增厚;视网膜增厚至少有1个视盘直径(disk diameter,DD)范围,其任何部位病变皆距黄斑中心1 DD范围之内[4]。
1.3 研究方法
1.3.1 最佳矫正视力测试对所有患者利用国际标准对数视力表测试裸眼视力,随后进行电脑验光,结合两项数据对患者进行插片试镜矫正视力,登记收集患者的最佳矫正视力[5]。
1.3.2 光学相干断层扫描检查采用美国OPTOVUE公司生产的RTVue傅立叶型频域型光学相干断层扫描对患者视网膜进行检查,以黄斑凹点为中心,在半径5 mm范围内扫描[6]。记录获得的影像,测量黄斑中心凹视网膜神经上皮层的厚度。
1.3.3 视觉电生理检查对患者进行视觉电生理检查,记录P100、a波、b波的潜伏期及振幅。
1.4 统计学方法采用SPSS20.0对数据进行统计学分析,两组患者的最佳矫正视力是非正态的分布数据,采用秩和检验,计量数据以均数±标准差()表示,组间比较采用t检验,两组患者光学相干断层扫描检查结果对比采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的一般资料比较两组患者的年龄、病程比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的一般资料比较()
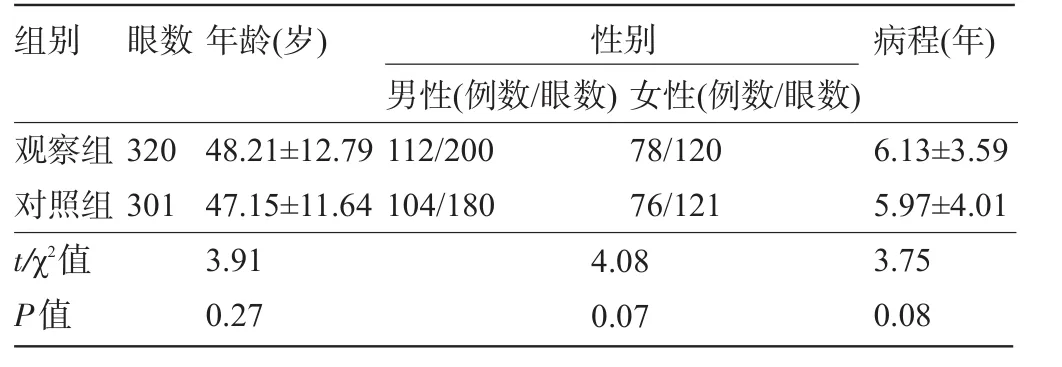
表1 两组患者的一般资料比较()
组别眼数年龄(岁)性别病程(年)男性(例数/眼数)女性(例数/眼数)观察组对照组t/χ2值P值320 301 48.21±12.79 47.15±11.64 3.91 0.27 112/200 104/180 78/120 76/121 4.08 0.07 6.13±3.59 5.97±4.01 3.75 0.08
2.2 两组患者的最佳矫正视力比较通过对患者进行插片试镜,收集患者的最佳矫正视力,其中观察组视力范围为0.02~0.6,平均视力为0.53;对照组最佳矫正视力范围为0.7~1.5,平均视力为1.35,两组数据间比较差异有统计学意义(P<0.05),见表2。
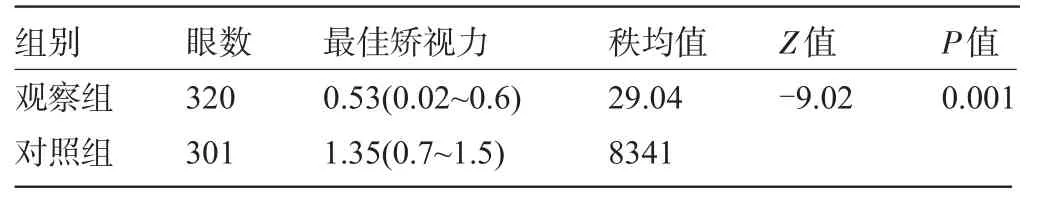
表2 两组患者的最佳矫正视力比较
2.3 两组患者的光学相干断层扫描结果比较对两组患者进行光学相干断层扫描,结果显示观察组患者黄斑中心凹视网膜厚度最薄的为154.8 μm,最厚的达到520.1 μm,平均厚度为(330.17±87.3)μm,其中黄斑囊性水肿80眼、视网膜出血58眼、黄斑裂孔52眼;对照组患者光学相干断层扫描结果显示中心凹厚度范围为127.4~219.9 μm,平均厚度为(150.39±22.9)μm,未发现其他病变组织。对比分析两组患者的检查数据,对照组相比观察组患者,中心凹视网膜厚度增加了98%,差异有统计学意义(P<0.05),见表3。

表3 两组患者的光学相干断层扫描结果比较(眼)
2.4 两组患者的视觉电生理检查结果比较对两组患者进行P-VEP、F-ERG两项视觉电生理检查,对比分析其潜伏期和振幅,通过分析波段图,采集数据分析,观察组患者对比对照组患者,P-VEP潜伏期延长,振幅下降;F-ERG的a、b波段潜伏期延长、振幅下降,两组差异均有统计学意义(P<0.05),见表4。
表4 两组患者视觉电生理检查结果比较()
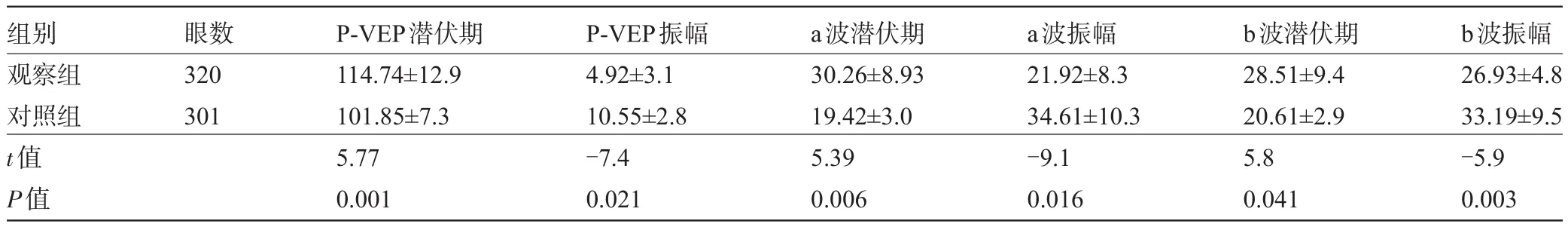
表4 两组患者视觉电生理检查结果比较()
组别观察组对照组t值P值眼数320 301 P-VEP潜伏期114.74±12.9 101.85±7.3 5.77 0.001 P-VEP振幅4.92±3.1 10.55±2.8 -7.4 0.021 a波潜伏期30.26±8.93 19.42±3.0 5.39 0.006 a波振幅21.92±8.3 34.61±10.3 -9.1 0.016 b波潜伏期28.51±9.4 20.61±2.9 5.8 0.041 b波振幅26.93±4.8 33.19±9.5 -5.9 0.003
3 讨论
黄斑水肿是引起视力减退的重要原因之一。目前对引起黄斑水肿的病理机制还不明确,有研究认为是糖尿病患者较高的血糖影响所致[7-10],也有研究认为随着糖尿病患者病程的增加,出现黄斑水肿的概率也随之升高,从而导致患者视功能的改变,视力下降,严重威胁患者的健康,影响患者的生活能力[11]。临床对糖尿病黄斑水肿的检查主要有几种方法,如眼底血管荧光造影技术、光学相干断层扫描与视觉电生理检查。眼底血管荧光造影技术是利用荧光素钠作为制影剂从前臂静脉快速注入,当荧光素钠随血流进入眼底血管时,通过一组滤色片的眼底摄影机,持续拍摄眼底血管外染料轮回时接收激发光线发射出的荧光形态,以察看视网膜动态轮回的过程,从而得到眼底血管的微细结构和微小的变化数据[12-14]。这种技术在前几年使用较为广泛,但有一定的不足,一是在中心凹厚度较厚时,造影不能清晰反映病变组织,不能够做到定量分析;二是这种技术是有创口的手术,会对患者身心造成一定的损害。随着技术的发展,光学相干断层扫描与视觉电生理检查在临床中得到了广泛的应用,光学相干断层扫描可进行活体眼组织显微镜结构的非接触式、非侵入性断层成像,能够做到清晰定量分析。视觉电生理检查能用客观无损的方法测量患者的视觉功能[15]。
本研究中,利用光学相干断层扫描仪对患者进行了黄斑检查,其中观察组190例(320眼)患者中,有160眼出现了黄斑囊性水肿,75眼出现视网膜出血,85眼出现黄斑裂孔,而对照组患者无一例视网膜病变。在中心凹厚度方面,观察组患者中心凹平均厚度为(330.17± 87.3)μm,远高于对照组的(150.39±22.9)μm,两组差异具有统计学意义,可见光学相干断层扫描技术可以清晰地对病灶进行定量分析。对患者视功能的测试主要利用视觉电生理检测,重点检查P-VEP潜伏期、振幅,F-ERG中a波、b波潜伏期及振幅,因为P-VEP数据能反映视功能的完好度,a波反映视网膜内感受器的完整度,b波反映视网膜神经的传递。潜伏期延长及振幅下降均说明患者视功能的改变及下降。在研究中,观察组患者的P-VEP潜伏期、F-ERG潜伏期比对照组患者有明显延长,P-VEP振幅,F-ERG中a波、b波振幅比对照组下降,两组数据间差异有统计学意义。
综上所述,发生糖尿病黄斑水肿及视网膜病变的患者与未发生水肿及视网膜病变的患者对比差异明显,光学相干断层扫描与视觉电生理可以对病灶及视功能进行精确的定量分析和客观评价,具有重要的临床诊断意义。
[1]Chiu SJ,Allingham MJ,Mettu PS,et al.Kernel regression based segmentation of optical coherence tomography images w ith diabetic macular edema[J].Biomed Opt Express,2015,6(4):1172-1194.
[2]Ichiyama Y,Sawada O,Mori T,et al.The effectiveness of vitrectomy for diffuse diabetic macular edema may depend on its preoperative optical coherence tomography pattern[J].Graefes Arch Clin Exp Ophthalmol,2016,254(8):1545-1551.
[3]Turgut B,Yildirim H.The causes of hyperreflective dots in optical coherence tomography excluding diabetic macular edema and retinal venous occlusion[J].Open Ophthalmol J,2015,9:36-40.
[4]Tehrani NM,Riaziesfahani H,Jafarzadehpur E,et al.multifocal electroretinogram in diabetic macular edema;correlation w ith visual acuity and optical coherence tomography[J].J Ophthalm ic Vis Res, 2015,10(2):165-171.
[5]Shen Y,Liu K,Xun X.Correlation between visual function and photoreceptor integrity in diabetic macular edema:spectral-domain optical coherence tomography[J].Curr Eye Res,2016,41(3):391-399.
[6]Nagesh BN,Takkar B,Azad S,et al.Optical coherence tomography and multifocal electroretinography in diabetic macular edema:a neurovascular relation w ith vision[J].Ophthalmic Surg Lasers Imaging Retina,2016,47(7):626-631.
[7]Islam F.Retinal thickness and visual acuity in diabetic macular edema:an optical coherence tomography-based study[J].J Coll Physicians Surg Pak,2016,26(7):598-601.
[8]Ghosh S,Bansal P,Shejao H,et al.Correlation of morphological pattern of optical coherence tomography in diabetic macular edema w ith system ic risk factors in m iddle aged males[J].Int Ophthalmol,2015, 35(1):3-10.
[9]Bonnin S,Tadayoni R,Erginay A,et al.Correlation between ganglion cell layer thinning and poor visual function after resolution of diabetic macular edema[J].Invest Ophthalmol Vis Sci,2015,56(2):978-982.
[10]Fang IM,Hsu CC,Chen LL.Correlation between visual acuity changes and optical coherence tomography morphological findings in idiopathic epiretinal membranes[J].Graefes Arch Clin Exp Ophthalmol, 2016,254(3):437-444.
[11]Fiore T,Lupidi M,Androudi S,et al.Repeatability of retinal macular thickness measurements in patients w ith cinically significant macular edema using two different scanning protocols of spectralis optical coherence tomography[J].Ophthalmologica,2015,234(3):167-171.
[12]de Freytas A,Gallego Pinazo R,Cisneros Lanuza Á.Subfoveal choroidal thickness in eyes w ith diabetic macular oedema using swept source optical coherence tomography[J].Arch Soc Esp Oftalmol, 2016,91(5):228-231.
[13]Itoh Y,Petkovsek D,Kaiser PK,et al.Optical coherence tomography features in diabetic macular edema and the impact on anti-VEGF response[J].Ophthalmic Surg Lasers Imaging Retina,2016,47(10):908-913.
[14]Ruia S,Saxena S,Gemmy Cheung CM,et al.Spectral domain optical coherence tomography features and classification systems for diabetic macular edema:a review[J].Asia Pac J Ophthalmol(Phila), 2016,5(5):360-367.
[15]Kim Y,Yu SY,Kwak HW.En Face spectral-domain optical coherence tomography imaging of outer retinal hard exudates in diabetic macular edema based on optical coherence tomography patterns[J]. Ophthalmic Surg Lasers Imaging Retina,2016,47(4):313-321.
Correlation between macular morphology and visual function change in patients with diabetic macular edemadetected by optical coherence tomography and visual electrophysiology.
GUI Yu-min1,PENG Jian-jun1,LI Shuang2. 1.Department of Ophthalmology,Wuhan Puren Hospital,Wuhan 430081,Hubei,CHINA;2.Department of Ophthalmology, the Central Hospital of Wuhan,Wuhan 430014,Hubei,CHINA
Objective To analyze the correlation between macular morphology and visual function change by optical coherence tomography and visual electrophysiological exam ination so as to provide the basis for the clinical treatment of diabetic macular edema.M ethods The 190 patients(320 eyes)w ith diabetic macular edema from December 2014 to December 2016 in Wuhan Puren Hospital were selected as the observation group.180 diabetic patients w ithout macular edema and retinopathy(301 eyes)were selected as the control group.The best corrected visual acuity were detected,and optimum coherence tomography and visual electrophysiological examination were performed on the patients w ith diabetic macular edema.Results The best corrected visual acuity in the 190 patients(320 eyes)in the observation group was 0.02~0.6 and the best corrected visual acuity in the 180 diabetic patients(301 eyes)of the control group was 0.7~1.5,which showed the significant difference between the two groups(P<0.05).The average thickness of retinal neuroepithelium layer at the fovea in 190 patients in the observation group(330.17±87.3)μm increased by 98%compared w ith that in the control group(150.39±22.9)μm(P<0.05).Conclusion There were significant differences in macular morphology and visual function between the diabetic patients w ith macular edema and retinopathy and those w ithout macular edema and diabetic retinopathy.Optical coherence tomography and visual electrophysiology play an important role in clinical exam ination.
Optical coherence tomography;Visual electrophysiological exam ination;Diabetic macular edema; Visual function change
R587.2
A
1003—6350(2017)13—2110—03
10.3969/j.issn.1003-6350.2017.13.014
2017-01-17)
国家自然科学基金(编号:81300761)
桂玉敏。E-mail:1967571726@qq.com
