哺乳期干预甘油三酯型和磷脂型DHA对仔鼠体组织DHA水平的影响
2017-07-25王丹丹王静凤薛长湖王玉明
王丹丹,吴 芳,温 敏,王静凤,薛长湖,王玉明
(中国海洋大学 食品科学与工程学院,山东 青岛 266003)
油脂营养
哺乳期干预甘油三酯型和磷脂型DHA对仔鼠体组织DHA水平的影响
王丹丹,吴 芳,温 敏,王静凤,薛长湖,王玉明
(中国海洋大学 食品科学与工程学院,山东 青岛 266003)
研究哺乳期母鼠干预甘油三酯型DHA(DHA-TG)和磷脂型DHA(DHA-PL)对仔鼠体组织脂肪酸组成及二十二碳六烯酸(DHA)水平的影响。母鼠妊娠期给予n-3多不饱和脂肪酸(n-3 PUFAs)缺乏饲料,产仔后分别给予n-3 PUFAs缺乏饲料(缺乏组)、含DHA-TG饲料(DHA-TG组)和含DHA-PL饲料(DHA-PL组),饲喂至仔鼠3周龄断乳。测定仔鼠脑皮质、肝脏、血清和红细胞总脂中脂肪酸组成和DHA含量。与缺乏组相比,哺乳期干预DHA-TG和DHA-PL后仔鼠各组织中DHA和n-3 PUFAs含量均显著升高,二十二碳五烯酸(DPA)、花生四烯酸(AA)、∑n-6 PUFAs与∑n-3 PUFAs比值均显著降低。其中DHA-PL组仔鼠脑皮质和红细胞总脂中DHA水平显著高于DHA-TG组,而肝脏和血清中DHA水平两组之间无显著性差异。总之,哺乳期母鼠补充DHA-TG和DHA-PL均可显著提高仔鼠各组织中DHA水平,其中DHA-PL对脑皮质和红细胞中DHA的补充效果更佳。
二十二碳六烯酸(DHA);n-3 PUFAs缺乏;仔鼠;哺乳期
二十二碳六烯酸(DHA)是典型的n-3多不饱和脂肪酸(n-3 PUFAs),对婴幼儿大脑的发育和功能十分重要[1]。n-3 PUFAs缺乏不仅影响发育期的脑结构,引发学习、认知行为障碍,还会增加子代成年期焦虑、抑郁症等精神类疾病的风险[2]。大脑发育的高峰期集中在妊娠期第三阶段以及哺乳期,需要蓄积足量DHA以满足神经系统的正常发育[3]。大脑本身合成DHA的能力微弱,远远不能满足发育的需求,因此需要通过血液从肝脏和膳食中补充DHA。然而,婴幼儿的肝脏利用n-3脂肪酸前体物质ALA 合成 DHA的效率低下[4-5],所以哺乳期婴幼儿体内DHA主要来源于母乳。据报道[6],哺乳期母体补充DHA能够显著提高母乳中DHA含量以及总n-3 PUFAs与n-6 PUFAs比例,且与甘油三酯型DHA(DHA-TG)相比,磷脂型DHA(DHA-PL)具有更高的生物利用率[7]。近年来,发现DHA-PL具有多种生物学功效,但通过母乳对哺乳期子代体组织DHA的补充效果鲜有报道,而有关DHA-TG的相关研究较多。因此,本文通过对n-3 PUFAs 缺乏背景下的哺乳期母鼠干预DHA-TG和DHA-PL,比较二者对仔鼠体组织中脂肪酸组成及DHA水平的影响。
1 材料与方法
1.1 实验材料
鸢乌贼(Sthenoteuthisoualaniensis)卵,由威海博宇食品有限公司提供;甘油酯型鱼油(DHA-TG,纯度>90%),由宜宾汇海源生物科技有限公司提供;SPF级ICR小鼠,8周龄,20~25 g,购自北京维通利华实验动物技术有限公司。氯仿、甲醇、正己烷、石油醚等均为分析纯。
AB135-S型精密电子分析天平,瑞士梅特勒-托利多公司;IKA MS 3 Digital旋涡混匀器,德国IKA集团;HD-200p型加热器及氮吹设备,瑞士Blue Marlin公司;Agilent 7820型气相色谱仪,美国Agilent科技公司。
1.2 实验方法
1.2.1 DHA-PL的制备
将冷冻鸢乌贼卵室温下解冻后匀浆、冻干,获得卵粉,按照Folch法[8]从鸢乌贼卵中提取总脂,用冷丙酮洗涤数次获得粗DHA-PL。粗DHA-PL经硅胶柱层析法[9]纯化后,得DHA-PL,纯度达90%以上,脂肪酸组成中DHA占32%、EPA占13%。
1.2.2 动物分组及饲料配制
ICR小鼠适应性喂养1周后,雌雄合笼交配,以查到母鼠阴栓脱落为妊娠期开始的标志。自妊娠之日起,饲喂n-3 PUFAs缺乏饲料,直至产仔。产仔后,母鼠随机分为3组,分别饲喂n-3 PUFAs缺乏饲料(缺乏组)、含DHA-TG饲料(DHA-TG组)和含DHA-PL饲料(DHA-PL组),饲喂至仔鼠3周龄断乳。另设阳性对照组,即在妊娠期和哺乳期均饲喂n-3 PUFAs充足饲料(充足组)。采用气相色谱法[10]测定各组饲料总脂中脂肪酸组成。饲料配方及总脂中脂肪酸组成如表1、表2所示。

表1 饲料配方组成 g/kg

表2 饲料总脂中脂肪酸组成
注:各饲料配方均建立在AIN93G基础上,DHA-TG和DHA-PL两组饲料中DHA+EPA添加量均按照饲料5 g/kg配制。SFA,饱和脂肪酸;MUFA,单不饱和脂肪酸;PUFA,多不饱和脂肪酸。ND表示未检出。下同。
1.2.3 动物实验
ICR母鼠在室温(23±2)℃、相对湿度50%~60%、12 h∶12 h明暗交替的条件下,采用自由饮水和定量摄食的方式饲养,待母鼠产仔后,继续饲养至仔鼠3周龄断乳。仔鼠摘眼球取血,脱颈椎处死,分离肝脏、脑皮质等组织,称重并经液氮速冻后,于-80℃保存备用。血液室温静置30 min,离心(4℃,7 500 r/min,15 min),分离上层血清和下层红细胞。
1.2.4 小鼠各组织中脂肪酸分析
按照Folch法[10]从脑皮质、肝脏、红细胞、血清中提取总脂,经皂化后室温下用盐酸-甲醇(体积比1∶5)试剂进行甲酯化处理,利用气相色谱仪分析各组织中脂肪酸组成。
气相色谱条件:色谱柱为HP-INNOWax石英毛细管柱(30 m×320 μm×0.25 μm),载气为高纯度氮气,模式为恒定压力(62.47 kPa),流速为1.19 mL/min,分流比为20∶1;检测器为火焰离子化检测器(FID),进样口温度为240℃,检测器温度为250℃;升温程序为170℃(5 min)→3℃/min→210℃(30 min),平衡时间3 min。各脂肪酸含量以其占总脂肪酸含量的百分比表示。
1.2.5 数据处理及统计分析
2 结果与讨论
2.1 哺乳期补充DHA-TG和DHA-PL对仔鼠脑皮质总脂中脂肪酸组成的影响
仔鼠脑皮质总脂中主要脂肪酸组成如表3所示。哺乳期是小鼠脑发育的高峰期,脑内DHA主要来源于母体(母乳),母体DHA水平直接决定了仔鼠脑内DHA水平[11]。据报道[12],饮食中n-3 PUFAs 不足而n-6 PUFAs相对丰富的情况下,脑皮质内DPA(22∶5n-6)水平会上升,所以DPA可以作为n-3 PUFAs相对缺乏的一个指标。由表3可知,与缺乏组相比,DHA-TG和DHA-PL两组仔鼠脑皮质内DHA水平分别升高了32.50%(P<0.01)和50.65%(P<0.01);AA和DPA水平均显著降低,其中AA分别降低了17.05%(P<0.05)和26.94%(P<0.01),DPA分别降低了40.00%(P<0.01)和47.42%(P<0.01)。此外,总n-3 PUFAs水平显著高于缺乏组(P<0.05),∑n-6 PUFAs与∑n-3 PUFAs比值显著低于缺乏组(P<0.05)。

表3 仔鼠脑皮质总脂中主要脂肪酸组成
注:缺乏组与充足组相比*P<0.05;**P<0.01。缺乏组与DHA-TG、DHA-PL组相比,不同字母表示存在显著性差异,P<0.05。
本研究结果显示,妊娠期及哺乳期缺乏n-3 PUFAs会导致仔鼠脑皮质内DHA含量显著降低,DPA含量明显升高,这与付慧聪[13]的研究结果相一致。在哺乳期给予母鼠DHA-TG和DHA-PL均可显著提高仔鼠脑皮质中DHA水平,且DHA-PL比DHA-TG作用效果更佳,这种差异可能是由于DHA-TG和DHA-PL在体内的代谢途径不同导致的[14]。同时,哺乳期补充DHA-TG和DHA-PL可显著降低仔鼠脑皮质内AA和DPA等n-6 PUFAs水平。由此可知,哺乳期补充DHA对仔鼠脑皮质内DHA的蓄积以及脂肪酸组成具有重要意义。
2.2 哺乳期补充DHA-TG和DHA-PL对仔鼠肝脏总脂中脂肪酸组成的影响
仔鼠肝脏总脂中主要脂肪酸组成如表4所示。肝脏作为脂肪酸代谢的主要场所,膳食脂肪酸中DHA水平会影响肝脏中DHA的蓄积[15]。由表4可知,与缺乏组相比,哺乳期干预DHA-TG和DHA-PL后,仔鼠肝脏总脂中DHA水平显著升高,且高于充足组;肝脏AA水平显著低于缺乏组(6.27%±0.74%),分别降低了21.21%和23.60%;此外,∑MUFAs水平显著降低,∑n-3 PUFAs水平显著升高(P<0.05);∑n-6 PUFAs与∑n-3 PUFAs比值显著低于缺乏组(P<0.01)。

表4 仔鼠肝脏总脂中主要脂肪酸组成
我们前期的研究表明[16],在低脂和高脂饮食条件下,成年期小鼠短期补充DHA-TG和DHA-PL能够同等程度地增加肝脏总脂中DHA水平和降低AA水平。同样地,本研究发现,在n-3 PUFAs缺乏的基础上,哺乳期母鼠补充DHA-TG和DHA-PL均会显著提高仔鼠肝脏总脂中DHA水平,并下调AA水平,且两种形式的DHA对肝脏的作用效果无显著性差异,这与我们前期的研究结果相一致。
2.3 哺乳期补充DHA-TG和DHA-PL对仔鼠血清总脂中脂肪酸组成的影响
仔鼠血清总脂中主要脂肪酸组成如表5所示。据报道[6],婴儿血清中脂肪酸组成与作为膳食来源的母乳有较大关系。婴儿早期血清中n-3 PUFAs水平可能对婴儿晚期生长具有显著影响,早期血清中n-3 PUFAs(主要是其中的DHA)水平越高,则其在婴儿晚期可以得到更为理想的体重指数(BMI)。由表5可知,缺乏组血清中DHA水平(1.29%±0.06%)显著低于其他3组(P<0.01);哺乳期干预DHA-TG和DHA-PL能够显著提高小鼠血清中DHA(11.54%±0.51%,11.05%±1.36%)和∑n-3 PUFAs水平;同时,AA水平分别降低了29.50%和60.21%。研究结果表明,在先天n-3 PUFAs缺乏的背景下,后天膳食补充DHA-TG或DHA-PL对婴幼儿的生长发育具有重要作用。

表5 仔鼠血清总脂中主要脂肪酸组成
续表5

脂肪酸 充足组 缺乏组DHA-TG组DHA-PL组C20∶4n-6(AA)/%5.57±0.4813.12±0.84**a9.25±0.11b5.22±0.36cC20∶5n-3(EPA)/%4.18±0.202.19±0.07**2.51±0.121.66±0.03C22∶5n-6(DPA)/%2.23±0.111.69±0.04*2.43±0.702.00±0.42C22∶6n-3(DHA)/%7.30±0.541.29±0.06**a11.54±0.51b11.05±1.36b∑SFAs/%59.4352.4954.5255.32∑MUFAs/%7.7714.59**a6.01b8.10b∑PUFAs/%32.8032.9239.4736.58∑n-3PUFAs/%12.563.49**a18.13b13.74b∑n-6PUFAs/%20.2429.43*a21.34b22.84b∑n-6PUFAs与∑n-3PUFAs比值1.618.44**a1.18b1.66b
2.4 哺乳期补充DHA-TG和DHA-PL对仔鼠红细胞总脂中脂肪酸组成的影响
仔鼠红细胞总脂中主要脂肪酸组成如表6所示。红细胞DHA水平往往被用作指示组织器官(如大脑)DHA状态的指标,目前许多研究将婴幼儿红细胞中脂肪酸组成作为评价孕产妇膳食结构合理性的指标[17]。由表6可知,妊娠期和哺乳期母体膳食中缺乏n-3 PUFAs能够显著降低仔鼠红细胞中DHA水平(2.56%±0.05%,P<0.01);DHA-TG和DHA-PL两组仔鼠红细胞中AA、∑MUFAs水平显著低于缺乏组(P<0.05),DHA和∑n-3 PUFAs水平显著高于缺乏组,且DHA-PL组红细胞中DHA水平是DHA-TG组的1.9倍,说明妊娠期和哺乳期母体补充DHA-PL能够更加显著地增加婴幼儿红细胞中DHA水平,有利于婴幼儿大脑和其他组织的正常发育和成熟。此外,本研究还发现,DHA蓄积存在组织差异,肝脏DHA水平显著高于脑皮质、血清和红细胞中DHA水平。
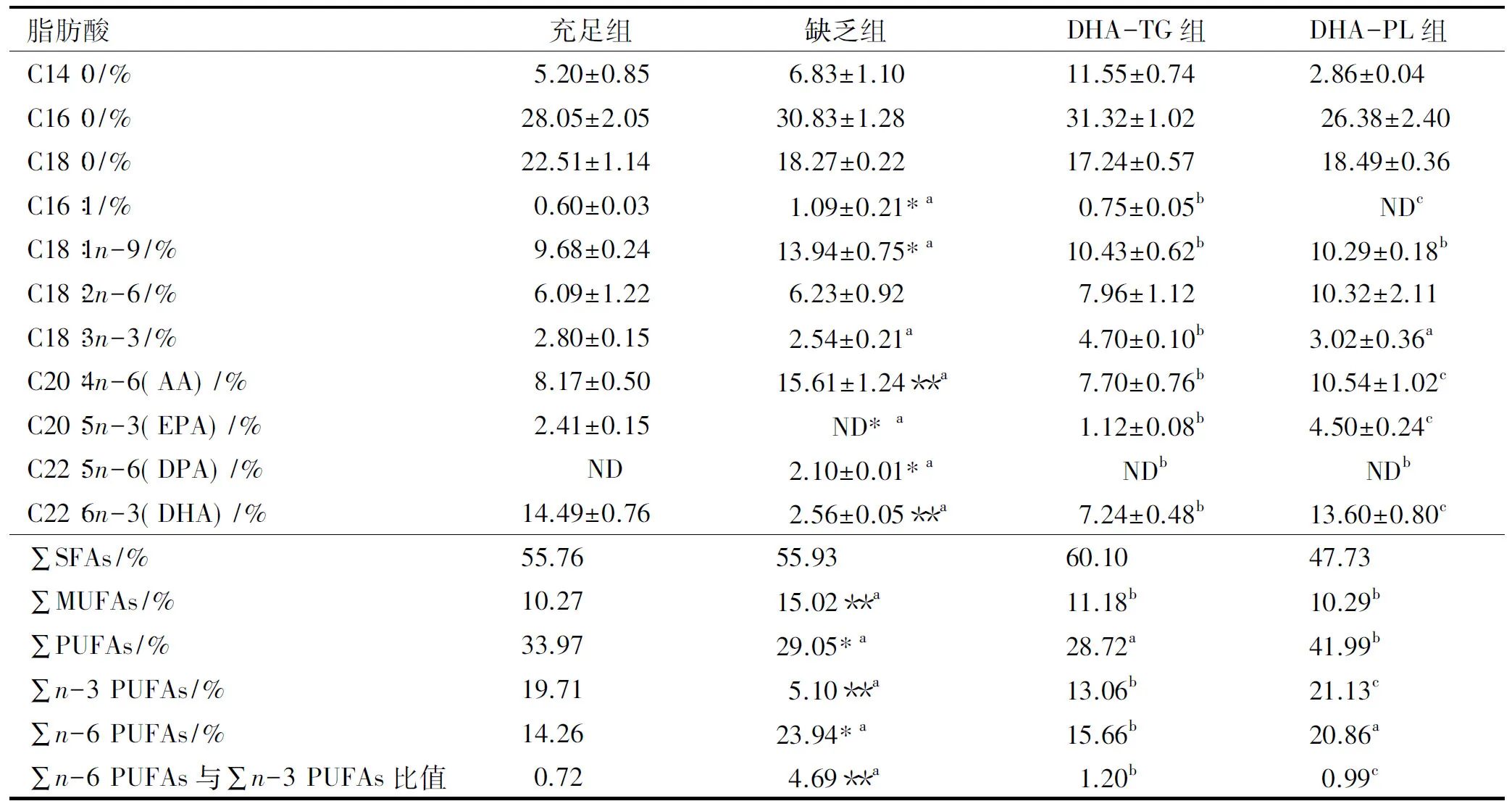
表6 仔鼠红细胞总脂中主要脂肪酸组成
3 结 论
本实验通过对妊娠期母鼠饲喂n-3 PUFAs缺乏饲料,构建出n-3 PUFAs缺乏小鼠模型,比较研究了DHA-TG和DHA-PL对仔鼠各组织中DHA的补充效果及其脂肪酸组成的影响。研究结果表明,哺乳期给予母鼠DHA-TG和DHA-PL均能够显著提高断乳时仔鼠各组织中DHA水平,降低AA和DPA等n-6 PUFAs水平。与DHA-TG相比,DHA-PL对脑皮质和红细胞中DHA的补充效果更佳。本研究为孕产妇的膳食结构和婴幼儿配方奶粉中DHA的添加形式提供了有力的理论依据。
[1] 马琴. 二十二碳六烯酸-磷脂生物活性的研究[D]. 山东 青岛: 中国海洋大学, 2009.
[2] STONEHOUSE W. Does consumption of LComega-3 PUFA enhance cognitive performance in healthy school-aged children and throughout adulthood? evidence from clinical trials[J]. Nutrients, 2014, 6(7): 2730-2758.
[3] MULDER K A, KING D J, INNIS S M.omega-3 fatty acid deficiency in infants before birth identified using a randomized trial of maternal DHA supplementation in pregnancy[J].Plos One, 2014, 9(1): e83764.
[4] WARENSJO E, RISERUS U, GUSTAFSSON I B, et al. Effects of saturated and unsaturated fatty acids onestimated desaturase activities during a controlled dietary intervention[J]. Nutr Metab Cardiovas Dis, 2008, 18(10): 683-690.
[5] EDER K, SLOMMA N, BECKER K, et al. Effect of linseed oil supplementation on concentrations of (n-3) polyunsaturated fatty acids in liver phospholipids of rats fed diets containing either an oil rich in conjugatedlinoleic acids, sunflower oil or high-oleic acid sunflower oil[J]. J Anim Physiol A Anim Nutr, 2005, 89(1/2): 45-54.
[6] 周婷婷. 孕哺期膳食脂肪酸水平对母乳与子代血脂肪酸组成及生长发育的影响[D]. 上海: 复旦大学, 2008.
[7] 刘磊. 仔猪补充甘油三酯DHA或磷脂DHA效能的比较及初步分析[D]. 长春: 吉林大学, 2014.
[8] FOLCH J, LEES M,SLOANE STANLEY G H. A simple method for the isolation and purification of totallipides peptides from animal tissues[J]. J Biol Chem, 1957, 226: 497-509.
[9] 李金章. 甘油酯型鱼油的制备及活性研究[D]. 山东 青岛: 中国海洋大学, 2011.
[10] 刘艳青, 李兆杰, 楼乔明,等. 皱纹盘鲍内脏脂质分析[J]. 水产学报, 2012, 36(6): 989-992.
[11] 樊超男, 田春雨, 夏露露,等. 不同年龄阶段小鼠脑聚集二十二碳六烯酸及脂肪酸去饱和酶的变化[J]. 中国儿童保健杂志, 2012, 20(8): 709-712.
[12] BABA R. Biochemical and functional effects of prenatal and postnatalomega3 fatty acid deficiency on retina and brain in rhesus monkeys[J]. Proc Nat Acad Sci, 1986, 83(83): 4021-4025.
[13] 付慧聪. 母孕期和哺乳期n-3多不饱和脂肪酸缺乏对子代成年期小鼠脑神经发生及凋亡的影响[D]. 北京: 首都医科大学, 2016.
[14] KITSON A P,METHEREL A H, CHEN C T, et al.Effect of dietary docosahexaenoic acid (DHA) in phospholipids or triglycerides on brain DHA uptake and accretion[J]. J Nutr Biochem, 2016, 33: 91-102.
[15] MILLER L R,JORGENSEN M J, KAPLAN J R, et al. Alterations in levels and ratios ofn-3 andn-6 polyunsaturated fatty acids in the temporal cortex and liver of vervet monkeys from birth to early adulthood[J]. Physiol Behav, 2015,156: 71-78.
[16] TANG X. Short term effects of differentomega-3 fatty acid formulation on lipid metabolism in mice fed high or low fat diet[J]. Lipids Health Dis, 2012, 11(1): 1-8.
[17] MINDA H,MOLNAR S, BUMS I, et al. Effect of different types of feeding on fatty acid composition of erythrocyte membrane lipids in full-term infants[J]. Acta Paediatr, 2002, 91(8): 874-881.
Effect of dietary docosahexaenoic acid (DHA) in phospholipids and triglycerides on DHA level in body tissues of infant mice
WANG Dandan, WU Fang, WEN Min, WANG Jingfeng,XUE Changhu, WANG Yuming
(College of Food Science and Engineering, Ocean University of China,Qingdao 266003, Shandong, China)
The effect of dietary docosahexaenoic acid (DHA) in phospholipids and triglycerides during lactation on fatty acid composition and DHA level in body tissues of infant mice was investigated. Then-3 polyunsaturated fatty acids (n-3 PUFAs) deficient feeds were given to pregnant mice during the gestation period, after delivery the feeds would be changed inton-3 deficient (deficient group), DHA-TG (DHA-TG group) and DHA-PL (DHA-PL group) for 3 weeks until weaning. The fatty acid composition and DHA levels in total lipid of cerebral cortex, liver, serum and erythrocytes of infant mice were measured. Compared with the deficient group, the DHA andn-3 PUFAs contents in the DHA-TG and DHA-PL groups were significantly increased, docosahexaenoic acid (DPA), arachidonic acid (AA) and the ratio ofn-6 PUFAs ton-3 PUFAs were obviously decreased. The levels of DHA in total lipid of cerebral cortex and erythrocytes of infant mice in DHA-PL group were significantly higher than those in DHA-TG group, but there was no significant difference in the levels of DHA in total lipid of liver and serum. Given DHA-TG and DHA-PL during lactation could significantly improve DHA levels in infant’s body tissues, in which DHA-PL had a better effect on cerebral cortex and erythrocytes.
docosahexaenoic acid (DHA);n-3 PUFAs deficiency; infant mice; lactation
2016-10-13;
2017-03-03
国家自然科学基金(31371757)
王丹丹(1989),女,硕士研究生,研究方向为海洋活性脂质的分子营养学(E-mail)2279371693@qq.com。
王玉明,教授(E-mail)wangyuming@ouc.edu.cn。
R151.2; Q547
A
1003-7969(2017)06-0065-06
