HPCE法测定金银花药材中木犀草苷、槲皮素和金丝桃苷的含量Δ
2017-07-25曾雪杨元娟陈竹唐倩石磊重庆医药高等专科学校重庆4033重庆市食品药品检验检测研究院重庆40
曾雪,杨元娟,陈竹,唐倩,石磊(.重庆医药高等专科学校,重庆4033;.重庆市食品药品检验检测研究院,重庆40)
HPCE法测定金银花药材中木犀草苷、槲皮素和金丝桃苷的含量Δ
曾雪1*,杨元娟1#,陈竹2,唐倩1,石磊1(1.重庆医药高等专科学校,重庆401331;2.重庆市食品药品检验检测研究院,重庆401121)
目的:建立同时测定金银花药材中木犀草苷、槲皮素和金丝桃苷含量的方法。方法:采用高效毛细管电泳法。毛细管柱为石英毛细管柱,检测波长为360 nm,分离电压为20 kV,进样方式为电动进样,进样电压为15 kV,进样时间为5 s,操作温度为25℃,缓冲溶液为60mmol/L四硼酸钠-50mmol/L碳酸钠-50mmol/L丙羟基-β-环糊精(pH 9.2)。结果:木犀草苷、槲皮素和金丝桃苷检测质量浓度线性范围分别为0.06~0.56mg/m L(r=0.988 1)、0.08~0.56mg/m L(r=0.989 2)、0.06~0.49mg/m L(r=0.979 6);精密度、稳定性、重复性的RSD<2.0%;加样回收率分别为96.12%~99.77%(RSD=1.29%,n=6)、95.90%~98.35%(RSD=0.89%,n=6)、94.07%~97.45%(RSD=1.33%,n=6)。结论:该方法操作简便,精密度、稳定性、重复性好,可用于金银花药材中木犀草苷、槲皮素和金丝桃苷含量的同时测定。
高效毛细管电泳法;木犀草苷;槲皮素;金丝桃苷;金银花
金银花Lonicera japonica flos是一种较常见的中药,又称忍冬花,其味甘,性寒,具有凉散风热、清热解毒、抗炎抑菌的作用[1-2]。金银花中药用有效成分以有机酸和黄酮类化合物为主。其中,黄酮类化合物主要包括木犀草苷、槲皮素和金丝桃苷,三者均能抑制肠道的致病菌、抗肿瘤以及抗呼吸道病毒感染[3-4]。目前常用于金银花有效成分的检测方法是高效液相色谱法(HPLC)[5-6],但缺点为操作复杂、试剂消耗量较大。毛细管电泳作为一种高效分离技术手段,相对于HPLC具有流动相配制简单、试剂消耗量少、分析速度快等优点,常用于有效成分的检测[7-8]。因此,笔者采用高效毛细管电泳法(HPCE)建立测定金银花药材中黄酮类化合物木犀草苷、槲皮素和金丝桃苷含量的方法,旨在为金银花的质量控制提供参考。
1 材料
1.1 仪器
CL1020型HPCE仪,包括紫外检测器(北京彩陆仪器有限公司);SK-1型涡旋混合器(常州市国旺仪器制造有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司,功率:200W,频率:40 kHz);AUX220型电子分析天平(日本Shimadzu公司)。
1.2 试剂
木犀草苷对照品(批号:A0121,纯度:99.0%)、槲皮素对照品(批号:A0114,纯度:98.0%)、金丝桃苷对照品(批号:Q0134,纯度:98.0%)均购自美仑生物科技有限公司;试验所用试剂均为分析纯,水为纯化水。
1.3 药材
金银花药材(重庆太极集团重庆中药二厂,批号:110912201606、110912201607、110912201608、110912201609、110912201611)经笔者鉴定为真品。
2 方法与结果
2.1 电泳条件
毛细管柱:石英毛细管柱(51 cm×67.4 cm×75μm);检测波长:360 nm,分离电压:20 kV;进样方式:电动进样;进样电压:15 kV;进样时间:5 s;操作温度:25℃;缓冲溶液:60 mmol/L四硼酸钠-50 mmol/L碳酸钠-50 mmol/L丙羟基-β-环糊精(pH 9.2)。
2.2 毛细管预处理
毛细管分别用0.1mol/L氢氧化钠冲洗活化10min,水洗5min,再用缓冲溶液冲洗5m in。每次进样前都分别用0.1mol/L氢氧化钠冲洗3min,水洗1m in,再用缓冲溶液冲洗2min,以保证迁移时间和峰面积的重现性。
2.3 溶液的制备
2.3.1 对照品溶液分别精密称取待测成分对照品10 mg,各置于1.5m L离心管中,加缓冲溶液1m L,涡旋振荡混匀,40℃下水浴加热使溶解,制成木犀草苷、金丝桃苷和槲皮素质量浓度均为10mg/m L的单一对照品贮备液。临用前,分别量取上述单一对照品贮备液各20μL,分别置于100μL PCR管中,加缓冲溶液80μL,制成木犀草苷、金丝桃苷和槲皮素质量浓度均为2mg/m L的单一对照品溶液[9-10]。
2.3.2 供试品溶液将干燥药材样品粉碎,精密称取药材样品粉末约1 g,置于锥形瓶中,加70%甲醇溶液50 m L,称定质量,超声处理1.5 h,取出,放冷;再次称定质量,用70%甲醇溶液补充减失的质量,滤过;精密吸取滤液1m L,置于10m L量瓶中,加70%甲醇溶液定容,摇匀;经0.45μm微孔滤膜滤过,取续滤液,既得。
2.4 系统适用性试验
取“2.3”项下对照品溶液、供试品溶液各适量,按“2.1”项下电泳条件进样测定,记录电泳图,详见图1。结果,木犀草苷、金丝桃苷和槲皮素均能实现完全分离,且在供试品中上述成分均无干扰组分存在,证明本方法适用于金银花提取物的含量测定。
2.5 线性关系考察
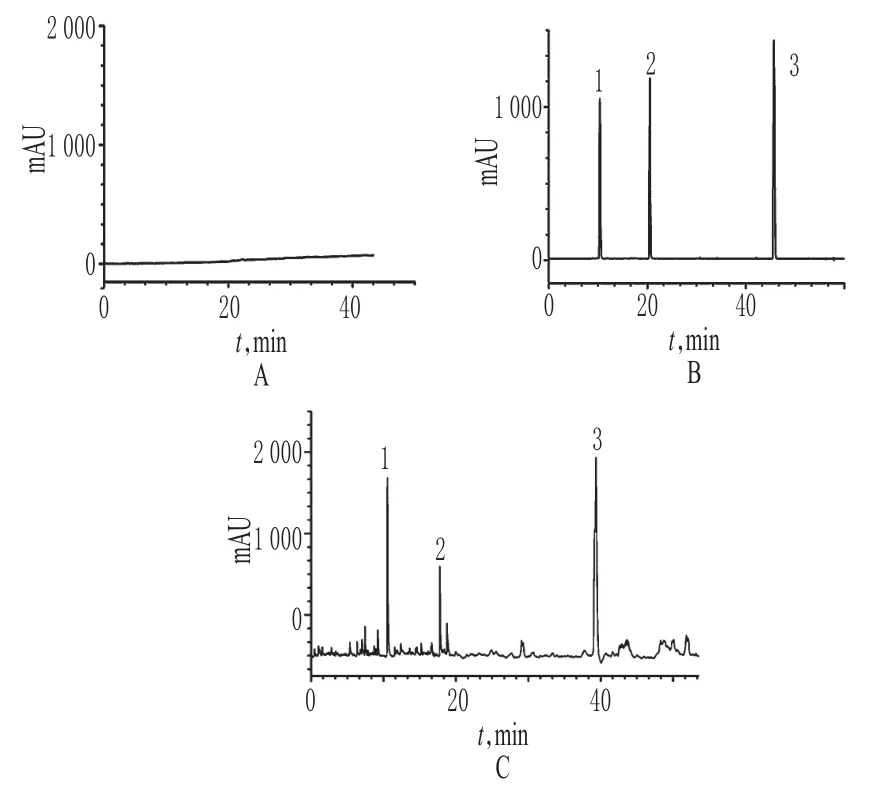
图1 高效液相色谱图Fig 1 HPLC chromatogram s
分别精密量取“2.3.1”项下待测成分对照品溶液各1m L,各置于10m L量瓶中,加70%甲醇溶液定容,制成木犀草苷、金丝桃苷和槲皮素质量浓度均为0.2mg/ m L的混合对照品溶液。精密量取上述混合对照品溶液0.3、0.8、1.3、1.8、2.3、2.8m L,分别置于10m L量瓶中,加70%甲醇溶液定容,制成系列对照品溶液。精密量取上述系列对照品溶液各10μL,按“2.1”项下电泳条件进样测定,记录峰面积。以木犀草苷、金丝桃苷和槲皮素质量浓度(x,mg/m L)为横坐标、峰面积(y)为纵坐标进行线性回归,得木犀草苷、金丝桃苷和槲皮素回归方程分别为y=0.074 11x-0.028 1(r=0.988 1)、y=0.082 14x-0.064 3(r=0.989 2)、y=0.062 14x-0.014 1(r=0.979 6)。结果表明,木犀草苷、金丝桃苷和槲皮素检测质量浓度线性范围分别为0.06~0.56、0.08~0.56、0.06~0.49 mg/m L。
2.6 精密度试验
取“2.3.1”项下待测成分对照品溶液各适量,按“2.1”项下电泳条件连续进样测定6次,记录峰面积。结果,木犀草苷、金丝桃苷和槲皮素峰面积的RSD分别为1.67%、1.91%、1.84%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.3.2”项下供试品溶液(批号:110912201608)适量,分别于室温下放置0、2、4、8、12 h时按“2.1”项下电泳条件进样测定,记录峰面积。结果,木犀草苷、金丝桃苷和槲皮素峰面积的RSD分别为1.23%、1.41%、1.19%(n=5),表明供试品溶液室温放置12 h内基本稳定。
2.8 重复性试验
精密称取同一批样品(批号:110912201608)适量,按“2.3.2”项下方法制备供试品溶液,共6份,再按“2.1”项下电泳条件进样测定,记录峰面积并计算样品含量。结果,木犀草苷、金丝桃苷和槲皮素含量的平均值分别为0.381%、0.272%、0.312%,RSD分别为1.39%、1.88%、1.73%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取已知含量样品(批号:110912201608)适量,共6份,分别加一定质量的待测成分对照品,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下电泳条件进样测定,记录峰面积并计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=6)Tab 1 Resultsof recovery tests(n=6)
2.10 药材样品含量测定
取5批药材样品各适量,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下电泳条件进样测定,记录峰面积并计算药材样品含量,结果见表2。
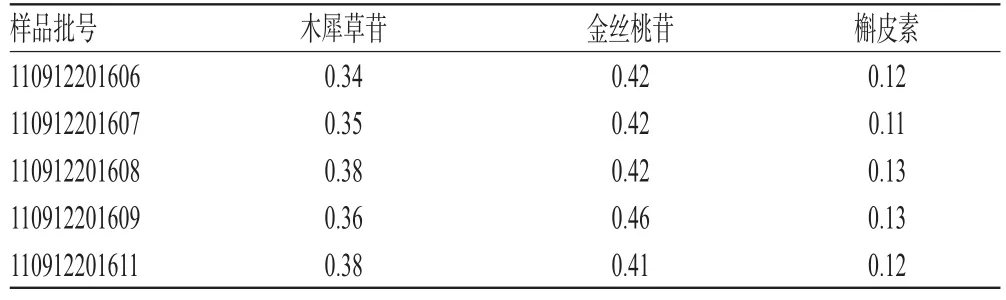
表2 药材样品含量测定结果(n=3,%)Tab 2 Results of content determ ination of sam p les(n=3,%)
3 讨论
根据文献[9-10],金丝桃苷和槲皮素在360 nm处均有最大吸收,木犀草苷的最大吸收波长在350 nm处,由于本试验采用的是单紫外检查器,因此选定360 nm作为系统检查波长。
在重复性试验和加样回收率试验中笔者发现,长时间连续性试验会导致含量检测值下降,分析可能是由于连续的进样降低了毛细管柱的分离效率,在后期研究中可对毛细管柱进行惰性处理,以保持色谱柱的分离效率。
在加样回收率试验和含量测定试验中,其RSD高于文献[9]采用的HPLC法,分析原因可能是由于电动进样方式还不够准确造成。因为进样电压和驱动电压采用同一电源,操作中首先需设定进样电压,再改为分离电压,多样品操作中,不同样品的转换时间难以保持一致,导致样品进样量可能存在差异,以致RSD相对偏高。
综上所述,本方法操作简便,精密度、稳定性、重复性好,可用于金银花药材中木犀草苷、槲皮素和金丝桃苷含量的同时测定。
[1]张丽媛,李遇伯,李利新,等.RRLC-Q-TOF/MS分析金银花的化学成分[J].中南药学,2012,10(3):204-208.
[2]沈玲玲,胡志军,王志良,等.金银花中总黄酮的提取及其消除自由基的研究[J].时珍国医国药,2011,22(5):1169-1171.
[3]Lin L,Wang P,Du Z,etal.Structuralelucidation of a pectin from flowers of Lonicera japonica and its antipancreatic cancer activity[J].Int JBiolMacromol,2016,88(3),130-137.
[4]梁萱,赵建军,梁永锋,等.金银花中黄酮提取工艺研究及野生与人工种植金银花中黄酮含量的比较[J].中南药学,2013,11(3):173-175.
[5]熊艳,朱晶晶,王智民,等.金银花与山银花HPLC指纹图谱比较研究[J].湖南中医药大学学报,2010,30(9):99-101.
[6]王慧慧,周凤琴,郭庆梅,等.金银花化学指纹图谱与质量相关性研究进展[J].山东中医杂志,2011,30(10):757-759.
[7]张百霞,周凤琴,郭庆梅.金银花中黄酮类化合物的研究进展[J].中国实验方剂学杂志,2012,18(23):349-352.
[8]周春晖,李俊.多一环糊精辅助提取金银花中总黄酮的工艺研究[J].中成药,2010,32(10):1796-1798.
[9]王荣梅,徐丽华,林永强.HPLC法同时测定银黄含片中6个咖唏酰奎宁酸类成分的含量[J].药物分析杂志,2012,32(1):57-60.
[10]欧水平,张文志,陈灵.金银花与山银花抗病毒酚酸类和黄酮类成分的差异性研究[J].中国药房,2015,26(33):4750-4752.
ContentsDetermination of Luteoloside,Quercetin and Hyperoside in the Extract of Lonicera japonica by HPCE
ZENG Xue1,YANG Yuanjuan1,CHEN Zhu2,TANG Qian1,SHI Lei1(1.Chongqing Medical and Pharmaceutical College,Chongqing 401331,China;2.Chongqing Institute for Food and Drug Control,Chongqing 401121,China)
OBJECTIVE:To establish amethod for contents determination of luteoloside,quercetin and hyperoside in Lonicera japonica.METHODS:HPCE was performed silica capillary column w ith detection wavelength of 360 nm and separation voltage of 20 kV,electrokinetic sampling,sampling voltage of 15 kV,sampling time of 5 s,operation temperature of 25℃.The buffer was consisted of 60 mmol/L sodium tetraborate-50 mmol/L natrium carbonicum-50 mmol/L hydroxypropyl-β-cyclodextrin(pH 9.2). RESULTS:The linear rangesof luteoloside,quercetin and hyperosidewere 0.06-0.56mg/m L(r=0.988 1),0.08-0.56mg/m L(r=0.989 2),0.06-0.49 mg/m L(r=0.979 6),respectively.RSDs of precision,stability and reproducibility tests were all lower than 2.0%.The recoverieswere 96.12%-99.77%(RSD=1.29%,n=6),95.90%-98.35%(RSD=0.89%,n=6),94.07%-97.45%(RSD=1.33%,n=6),respectively.CONCLUSIONS:The method is simple,accurate,stable and reproducible,and can be used for simultaneous determ ination of luteoloside,quercetin and hyperoside in L.japonica.
HPCE;Luteoloside;Quercetin;Hyperoside;Lonicera japonica
R927
A
1001-0408(2017)18-2543-03 DOI 10.6039/j.issn.1001-0408.2017.18.27
2016-12-24
2017-01-20)
(编辑:张静)
重庆市基础与前沿研究计划项目(No.cstc2014jcyjA10125);重庆医学检验试剂研究所科技创新项目(No.CQYJS1502);重庆市卫计委中医药科技项目(No.2012-2-17);重庆市教委科学技术研究项目(No.KJ132501)
*讲师,博士。研究方向:中药提取及药物分析。E-mail:13108918885@163.com
#通信作者:教授,硕士。研究方向:药物分析。E-mail:1210719517@qq.com
