两种无孔强阳离子交换色谱固定相的制备及色谱性能比较
2017-07-24卜春苗龚波林
卜春苗,龚波林
(1.宁夏大学化学化工学院,宁夏银川750021;2.北方民族大学,宁夏银川750021)
两种无孔强阳离子交换色谱固定相的制备及色谱性能比较
卜春苗1,龚波林2
(1.宁夏大学化学化工学院,宁夏银川750021;2.北方民族大学,宁夏银川750021)
针对基质表面的化学修饰是分离材料性能的直接决定因素。本文对3.0 μm无孔单分散亲水性交联聚甲基丙烯酸环氧丙酯树脂(PGMA/EDMA)进行不同的化学方法改性,制备得到两种强阳离子交换色谱填料(SCX-I和SCX-II),并对填料表面的磺酸基含量进行测定。在相同的色谱条件下,详细考察了这两种填料对碱性蛋白的分离性能,亲水性能考察,以及对溶菌酶的动力学吸附容量。SCX-I和SCX-II填料的各项性能对比结果表明,SCX-I填料上磺酸基键合量高,分离碱性蛋白具有较好的选择性,亲水性好,能够用于对鸡蛋清中溶菌酶的快速分离纯化。
无孔单分散亲水性聚合物微球;强阳离子交换色谱;对比;蛋白分离
Key words:non-porous monodiperse polymer beads;strong cation-exchange stationary phase;comparison;protein separation
高效液相色谱(high performance liquid chromatography,HPLC)已成为发展生命科学,材料科学和环境科学等重要学科研究必不可少的手段和工具[1,2]。色谱固定相是HPLC系统的核心,也是分离科学研究的重要课题[3]。目前离子交换色谱固定相在活性生物大分子的分离和纯化中被广泛应用,但一般要分离的目标产物常处于稀的水溶液或发酵液中,易使蛋白质失活和构型发生变化,因此减少分离和纯化时间以保持蛋白的生物活性是非常必要的[4],无孔类型的快速离子交换色谱固定相应运而生。与多孔填料相比,其最主要的特点是,被分离的生物大分子只在表面进行传质交换,消除了停滞流动相传质带来的峰加宽,故可用于蛋白质和多肽等生物大分子的快速分离分析[5]。
相关离子交换色谱固定相的报道较多,但大多为硅胶基质,大大限制了固定相在分离中的pH应用范围。本文采用自制的3.0 μm无孔单分散亲水性的交联聚甲基丙烯酸环氧丙酯(PGMA/EDMA)树脂[6],同时解决多孔填料分离纯化时间长和硅胶pH应用范围窄的弊端。另外,对基质进行表面修饰是提高固定相分离性能和选择性的决定因素,这也是研究者都致力于开发新型制备方法和合成路线用于提高分离材料色谱性能的主要原因。基于以上原因,开发两种改性方法,对(PGMA/EDMA)树脂进行修饰用于制备强阳离子交换色谱(SCX)固定相,详细研究不同合成方法对离子交换色谱性能的影响。
1 实验部分
1.1 仪器与试剂
(1)仪器:高效液相色谱仪(Agilent 1100),CGY-100型高压气动泵,2003型电动搅拌器,超声波细胞破碎仪(宁波新芝生物科技股份有限公司)。
(2)试剂:肌红蛋白(Myo,马心);核糖核酸酶(RNase-A,牛红细胞);α-糜蛋白酶原-A(α-Chy-A,牛胰脏);细胞色素-C(Cyt-C,马心);溶菌酶(Lys)均购自美国Sigma公司。
1.2 强阳离子交换填料的合成
1.2.1 SCX-I型填料的合成100 mL三颈瓶中加入4.0 g水解PGMA/EDMA树脂(II),再加入一定量的二氧六环和三氟化硼乙醚后,超声分散5 min,在搅拌下滴加一定量环氧氯丙烷,80℃恒温水浴反应2.5 h,产物依次用水和丙酮洗涤后真空干燥。再取树脂(III)3.0 g加入到250 mL的单口烧瓶中,加入16 mL无水乙醇和一定量NaHSO3水溶液,超声分散5 min,90℃水浴反应24 h。产物用水反复洗涤。抽滤,干燥,得SCX-I型填料。合成反应(其中P代表聚合物)(见图1)。
1.2.2 SCX-II型填料的合成将3.0 g无孔PGMA/EDMA(I)树脂加入一定量的稀盐酸中,在30℃水浴中反应2.5 h。产物用水,乙醇,丙酮反复洗涤数次,真空干燥,即得微球(II)。再加入一定量NaHSO3水溶液,超生分散后80℃水浴中反应24 h,再用水,乙醇和丙酮反复洗涤即得到强阳离子交换色谱填料(SCX-Ⅱ)。合成路线(见图2)。
1.3 色谱填料的装填
将自制的SCX-I和SCX-II填料,以蒸馏水为匀浆液和顶替液,在30 MPa压力下以匀浆法装柱,不锈钢柱管:5.0×0.46 cm I.D。
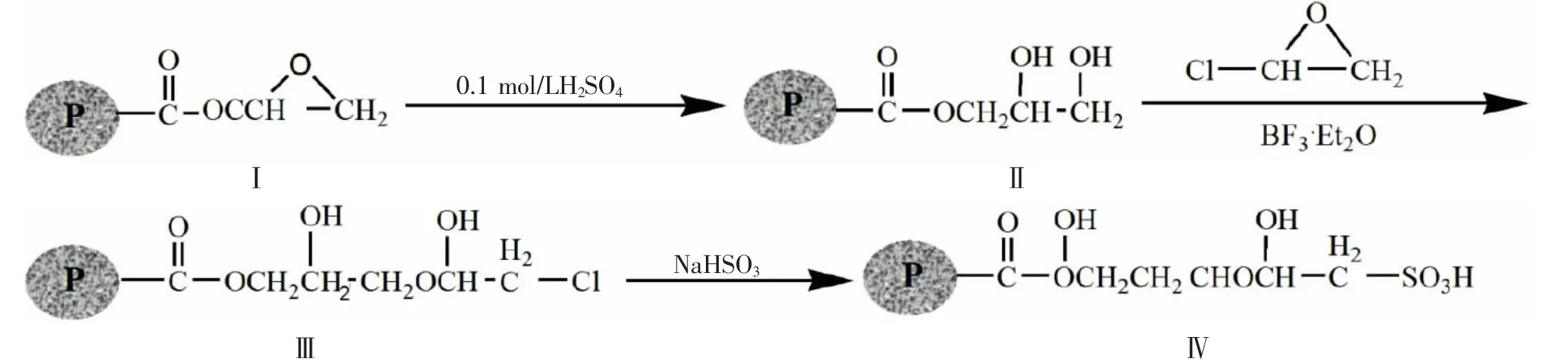
图1 SCX-I型填料合成路线

图2 SCX-II型填料的合成路线
1.4 磺酸基含量的测定
按照文献[7]报道的方法测定填料表面磺酸基的含量。
1.5 动态吸附容量测定
动态吸附容量的测定采用迎头分析法[8],含有2 mg/mL Lys的PBS的缓冲溶液测定其穿透曲线,根据下式计算动态吸附容量:

式中:q5-达到5%穿透时的动态吸附容量(mg/mL);c-入口Lys的浓度;F-Lys的体积流速(mL/min);t5-出口浓度达到5%的保留时间(min);t0-死时间(min);V-柱体积(mL)。
1.6 应用研究
鸡蛋清样品的处理:取新鲜的蛋清液20 mL,向其中加入80 mL 0.02 mol/L磷酸盐缓冲液(pH=8.5),超声15 min后加入一定量的NaCl使其浓度为1.0 mol/L,离心除去杂质,得到的上清液用所制备的SCX柱进一步分离纯化溶菌酶。
2 结果及讨论
2.1 SCX填料的合成及评价
同苯乙烯微球相比,PGMA/EDMA微球表面的疏水性弱,但此微球制备时以聚苯乙烯(PSt)为种子,采用一步溶胀聚合法得到,其疏水性主要来源于碳氢主链和抽提不完全的PSt种子,所以将该树脂作为生物大分子的分离材料,对其进行表面亲水性改性是非常必要的。本实验中,设计合成两种改性方法用于制备SCX填料。SCX-I填料制备(见图1),首先将PGMA/EDMA微球水解为具有一定亲水性的邻二醇,再进一步与环氧氯丙烷反应,后与含有氯的树脂与NaHSO3反应得到带有磺酸基的阳离子填料。改性方法大大增加了PGMA/EDMA树脂表面的亲水性,测定其磺酸基含量为0.37 mmol/g。SCXII填料的改性方法相对简单(见图2),将PGMA/EDMA微球先与稀盐酸反应,后与NaHSO3反应即可得到,此方法简单,但其亲水性不如SCX-I填料,测定其磺酸基含量仅为0.19 mmol/g。
2.2 SCX柱对标准蛋白的分离性能
标准蛋白在两种SCX柱上的分离图(见图3)。

图3 标准蛋白在两种SCX柱上的分离图
2.3 SCX填料表面亲水性能考察
无孔PGMA/EDMA树脂的疏水性主要源于聚合物的碳氢主链,因此,应对改性后的SCX-I和SCX-II填料表面的亲水性进行考察。采用在流动相中加入5%(v/v)的异丙醇(IPA)溶液,与不加入IPA时的结果相比较(见表1)。

表1 SCX-I和SCX-II柱上未加IPA和加5%IPA对蛋白保留的影响
从表1中可以看出,加入异丙醇后四种蛋白在SCX-I和SCX-II柱的保留时间都有不同程度地减小,但SCX-I柱减小量较小。实验结果进一步表明SCX-I柱上仅存在弱的疏水性,蛋白质的保留行为主要取决于与固定相之间的静电相互作用,这也说明了SCX-I柱的改性方法优良,增强了固定相表面的亲水性,大大抑制了蛋白与微球间的非特异性吸附。
2.4SCX填料动力学吸附容量的测定
动态吸附曲线能够为分离介质的动力学键合量提供有价值的信息。在本工作中,分别测定了SCX-I和SCX-II柱对溶菌酶(Lys)的动力学吸附容量,测试流动相组成为20 mmol/LPBS+1.0 mol/LNaCl+0.5 mg/mLLys,流速为0.5 mL/min条件下获得的前沿突破曲线。根据公式(1)得到SCX-I和SCX-II的动力学吸附容量分别为:20.5 mg/g和15.6 mg/g。磺酸基含量较高的SCX-I柱具有较高的吸附容量,进一步表明,SCX-I填料的改性方法更适用于分离纯化碱性蛋白。

图4 鸡蛋清样品中溶菌酶与标准样品中溶菌酶对比
2.5 SCX柱应用于分离纯化鸡蛋清中溶菌酶
目前,离子交换色谱是制备高纯度溶菌酶最常用的方法。本文采用合成的SCX-I柱对所处理的鸡蛋清样品进行分离,与标准溶菌酶样品进行对照(见图4),在2 mL/min的流速下,6 min内可对鸡蛋清中的Lys进行快速分离纯化。图4中的第一个峰为杂蛋白,标*的峰为Lys。由图4可以看出,Lys与其他杂蛋白得到了较好的分离,收集Lys组分,测定其纯度大于92%。这表明所合成的无孔SCX-Ⅰ柱具有较高的选择性,具备实际分离纯化能力。
3 结论
本文主要针对不同的表面修饰方法直接决定分离材料的色谱行为。以3.0 μm无孔单分散亲水性交联聚甲基丙烯酸环氧丙酯树脂为基质,采用两种不同改性方法,制备得到两种强阳离子交换色谱填料:SCX-I和SCX-II,首先测定SCX填料表面的磺酸基键合量,结果显示SCX-I填料上的磺酸基含量大大高于SCX-II。进一步验证两柱的色谱行为,结果显示,SCX-I柱对碱性蛋白的分离表现出更好的选择性,具有优良的亲水性能和较高的动态吸附容量,最后应用于鸡蛋清中溶菌酶的分离纯化中取得了满意的效果。
[1]Qiu H,Liang X,Sun M,Jiang S.Development of silica-based stationary phases for high-performance liquid chromatography[J].Analytical and Bioanalytical Chemistry,2011,399:3307-3322.
[2]Zhang M,Chen J,Mallik A,et al.Preparation and chromatographic evaluation of new branch-type diamide-embedded octadecyl stationary phase with enhanced shape selectivity[J].Analytical Chimica Acta,2014,833:48-55.
[3]Lu J,Zhang W,Zhang Y,et al.A new stationary phase for high performance liquid chromatography,Calix arene derivatized chitosan bonded silica gel[J].Journal of Chromatography A,2014,1350:61-67.
[4]Sugrue E,Pavel N,Nesterenko,et al.Fast ion chromatography of inorganic anion and cations on a lysinebonded porous silica monolith[J].Journal of Chromatogr aphy A,2005,1075:167-175.
[5]Twohill E,Paull B.Zwitterionic ion chromatography using a dynamically coated column and mobile phase recycling[J].Journal of Chromatography A,2002,973:103-113.
[6]Zhu Jinxia,Bo Chunmiao,Gong Bolin.Preparation of strong cation exchange packings based on monodisperse hydrophilic non-porous resins and their application for fast separation of proteins[J].Chinese Journal of Chromatography,2006,24(2):129-134.
[7]复旦大学高分子科学,高分子实验技术[M].上海:复旦大学出版社,1996:219-221.
[8]Sun G,Shi Q,Sun Y.Novel biporous polymeric stationary phase for high-speed protein chromatography[J].Journal of chromatography A,2004,1061:159-165.
Preparation of two types of non-porous strong cation-exchange stationary phases and comparison with their performance
BO Chunmiao1,GONG Bolin2
(1.College of Chemistry and Chemical Engineering,Ningxia University,Yinchuan Ningxia 750021,China;2.Beifang University of Nationalities,Yinchuan Ningxia 750021,China)
The chemical modification on the surface of substrate is the critical factor on the performance of separation material.In this work,two kinds of strong cation-exchange(SCXI and SCX-II)stationary phases have been synthesized by the different chemical modification of the 3.0 μm non-porous monodiperse poly(glycidymethacrylate-co-ethylenedimethacrylate)(PGMA/EDMA)resin,and determined the percent of sulfonate groups on the two prepared SCX materials.Under the same chromatographic conditions,the performance for the separation of basic proteins,hydrophilicity,dynamicn loading capacity of the two SCX columns were investigated in detail.In comparison with the performance of SCX-I and SCX-II packings,the results indicated that the higher bonded content of sulfonate groups,the better selectivity on the separation of basic proteins and hydrophilicity were all achieved on SCX-I stationary phase.Finally,the application in rapid separation and purification of Lys from egg white by SCX-I column obtained satisfactory results.
O657.75
A
1673-5285(2017)06-0137-04
10.3969/j.issn.1673-5285.2017.06.030
2017-05-12
卜春苗,女(1980-),中级,硕士,主要从事色谱固定相的制备及应用研究的工作。
