小麦HMW-1Bx17基因启动子的功能验证
2017-07-24王亚红刘缙王玉国
王亚红,刘缙,王玉国
(1.运城学院 机电工程系,山西 运城 044000;2.运城学院 生命科学系, 山西 运城 044000;3.山西农业大学 农学院,山西 太谷 030801)
小麦HMW-1Bx17基因启动子的功能验证
王亚红1,3,刘缙2*,王玉国3*
(1.运城学院 机电工程系,山西 运城 044000;2.运城学院 生命科学系, 山西 运城 044000;3.山西农业大学 农学院,山西 太谷 030801)
[目的]小麦HMW-1Bx17基因是在小麦胚乳中特异高表达的基因,该基因启动子的获得可为进一步研究小麦高分子量麦谷蛋白种子特异表达的调控模式提供基础材料,并为小麦品质改良的基因工程研究奠定基础。[方法]本文以改良的CTAB法提取小麦“舜麦1718”基因组DNA为模板,根据已知序列设计引物,利用嵌套PCR扩增1Bx17基因启动子片段。构建1Bx17基因启动子启动下的GUS(β-葡糖苷酸酶) 基因表达载体,用基因枪法分别导入小麦根、茎、叶、胚乳及胚中进行瞬时表达,同时构建了1Bx17基因启动子驱动的抗菌蛋白Gnk2-1基因表达载体用于小麦幼胚稳定转化。[结果]X-gluc染色检测表明,GUS基因在该启动子的驱动下能在小麦胚乳中特异表达。通过对再生抗性植株的RT-PCR鉴定,初步表明已获得转基因植株,并进一步证明了启动子的驱动功能。[结论]本文所获得小麦1Bx17基因的启动子在小麦基因工程遗传改良等方面具有一定的利用潜力。
小麦; 1Bx17基因; 启动子;Gnk2-1基因; 瞬时表达
小麦是全球种植面积最大,也是我国主要栽培的粮食作物之一[1]。随着人民生活水平的提升,高品质小麦育种已经成为小麦育种研究者的重要目标之一。研究表明,高分子量麦谷蛋白亚基(HMW-GS)和低分子量麦谷蛋白亚基(LMW-GS)通过分子间二硫键的聚合作用,共同影响着面筋强度和面团弹性[2,3]。其中HMW-GS虽然只占小麦贮藏蛋白的10%,但其数量、类型、结构和含量却对面筋强度和面团黏弹性等加工性状起决定性作用[4,5]。为改善小麦品质,近年来诸如1Ax、Bx7、Dx5、Dy10、Bx14、Bx20、By20等越来越多的高分子量麦谷蛋白优质亚基基因被克隆和转化[6~9]。在此过程中,为了避免组成型表达增加植物的代谢负担和能量浪费,分离和鉴定能够在胚乳中高效特异表达的启动子,并应用于转基因实践显得尤为重要[10]。
已有研究表明,小麦HMW-1Bx17基因是在小麦种子中高效表达的优质亚基基因[11,12]。因此,本研究利用嵌套PCR从山西本地优质品种“舜麦1718”小麦基因组中克隆了1Bx17基因启动子片段[13]。并构建1Bx17基因启动子驱动的GUS报告基因真核表达载体,利用基因枪法分别导入小麦根、茎、叶、胚乳及胚中,以验证启动子的胚乳特异性驱动功能。在此基础上,进一步构建了1Bx17基因启动子驱动的包含银杏种仁抗真菌蛋白Gnk2-1的表达载体,用于小麦幼胚转化[14,15]。初步鉴定表明已获得转基因植株,试验结果进一步验证了启动子的胚乳表达活性。本文同时也为进一步研究抗真菌蛋白Gnk2-1在小麦中的抗病作用奠定了基础。
1 材料与方法
1.1 材料和试剂
本研究以山西本地栽培品种“舜麦1718”为植物材料,抽提基因组DNA。植物真核表达载体pAHC25,包含Gnk2-1基因的质粒均由本试验保存。质粒提取试剂盒和DNA凝胶回收试剂盒购自美国AXYGEN公司;限制性内切酶、T4DNA连接酶等皆购自大连TaKaRa有限公司;pGM-T克隆试剂盒购自北京天根公司;引物合成和序列测定均由上海生工完成,其他常规试剂均为国产分析纯药品。
1.2 试验方法
1.2.1 小麦基因组DNA提取
取20~30粒小麦“舜麦1718”成熟种子,经过夜浸泡露白后,24 ℃暗培养3 d,剪取适量幼嫩叶片用于抽提基因组DNA。
抽提液的配置:溶液I(0.35 mol·L-1山梨醇,0.1 mol·L-1Tris,5 mmol·L-1EDTA-Na2,pH调至7.5);溶液II(0.2 mol·L-1Tris,50 mmol·L-1EDTA-Na2, 2.0 mol·L-1NaCl,2%CTAB,pH调至7.5);溶液III(5% N-月桂酰肌氨基钠盐),按照1∶1∶0.4体积比混和,加入亚硫酸氢钠(3.8 g·L-1),65 ℃预热,既为抽提液。
取0.15 g小麦幼嫩叶片,经过液氮研磨后放入盛有700 μL抽提液(65 ℃预热)的1.5 mL离心管中,充分混匀,65 ℃水浴裂解40 min。加入700 μL氯仿:异戊醇(24∶1),猛烈混匀,离心(12 000×g离心10 min)。取上清于新离心管中,加入0.8倍预冷异丙醇并混匀,在-20 ℃冰箱中静置30 min。随后离心(12 000×g,10 min), 弃上清,将沉淀用1 mL 70% 乙醇清洗一次,离心干燥,溶于50 μL含有RNase A的无菌水中。1.2.2HMW-GS1Bx17基因启动子的克隆
根据已知1Bx17基因启动子序列(GenBank accession number: KC254854)设计嵌套引物:
引物1:5′-ACCAAGCCAAATACTCCA
引物2:5′-GCTCGTGCTCACATTGTAG-3’
引物3:5′-GACTACTGCCGCAAAGAG-3’
PCR扩增体系为:gDNA 1 μL,引物1 (10 mmol·L-1) 1 μL,引物2 (10 mmol·L-1) 1 μL,5×HS PCR bufer(Mg2+Plus) 10 μL,dNTP Mixture (10 mmol each) 0.5 μL,Prime STARTMHS DNA聚合酶(5 U·μL-1)) 0.25 μL,ddH2O补足50 μL;PCR反应条件为:94 ℃预变性5 min,94 ℃、30 s,55 ℃、40 s,72 ℃、2.5 min, 30个循环;72 ℃充分延伸7 min。第一轮PCR产物稀释100倍后作为下一轮PCR模板,用引物1和引物3再进行一次PCR反应,反应条件同上。PCR产物1%的琼脂糖凝胶电泳检测后回收,回收产物与pGEM-T载体16 ℃连接过夜,连接产物转化大肠杆菌感受态DH5α;随机各挑取10个单克隆,抽提质粒后进行酶切鉴定,并送上海生工进行测序分析。
1.2.3 pBx17-GUS和pBx17-GNK载体的构建
利用PCR法在1Bx17启动子片段上下游引物上分别引入HindIII和SamI酶切位点(下划线):
引物4:5’-CCCAAGCTTGGGACCAAGCC AAATACTCCA-3’
引物5:5’-TCCCCCGGGGGACTCAGTGA ACTGTCAGTGAA-3’
用HindIII和SamI两种内切酶对pAHC25质粒进行部分酶切,回收7 684 bp的片段,与引入酶切位点的1Bx17启动子片段,按照摩尔比1∶3,16 ℃过夜连接。次日将重组质粒转化大肠杆菌DH5a,从转化平板随机挑取5个单克隆,提取质粒,并做酶切鉴定。正确的克隆命名为pBx17-GUS。
pBx17-GNK的构建:以来自银杏种仁抗真菌蛋白基因为模板,设计引物6及引物7(粗体为起始密码子和双终止密码子,下划线为酶切位点)。分别在引物上引入SamI和SacI酶切位点(下划线表示)。
引物6:5’-TCCCCCGGGGGAATGAAGACTATGAGAATG-3’
引物7:5’-CGAGCTCGTTATTAGAAGCTCCTCTGCTC-3’
pBx17-GUS经过SamI和SacI双酶切,再与引入双酶切位点的Gnk2-1基因ORF片段混合,16 ℃过夜连接。并对重组质粒进行酶切鉴定,阳性克隆通过进一步测序选择读码框正确的克隆,命名pBx17-GNK,用于小麦幼胚转化。
1.2.4 基因枪瞬时转化
选取开花后12~14 d的小麦品种“舜麦1718”幼嫩种子、经表面消毒后,去除种皮,将胚和胚乳分离后,正面向上与幼嫩的小麦根、茎、叶摆放在高渗MS培养基(含有0.4 mol·L-1甘露醇)中央直径3 cm的范围内,暗培养4 h预处理。
用构建好的表达质粒DNA包裹金粉粒。将2.5 mg直径1.0 μm金粉置于离心管中,加无水乙醇200 μL,用超声波粉碎机分散至手感温度略发烫。离心(10 000×g,5 min),去上清。加200 μL 70%乙醇,涡旋振荡30 s。静置1 min。再次离心(16 000×g,5 min),去上清(重复3次)。加入50 μL无菌水,涡旋振荡,离心沉淀,弃上清。在沉淀的金粉中加入50%甘油100 μL,振荡。取50 μL悬液边振荡边迅速依次加入5 μL质粒DNA(1 g·L-1),50 μL氯化钙溶液(2.5 mol·L-1),20 μL亚精胺(0.1 mol·L-1),涡旋振荡30 s,然后冰上静置10 min,10 000×g离心6 min,弃上清。加入150 μL 70%乙醇,10 000×g离心3 min,弃上清(重复2次)。加入200 μL无水乙醇10 000×g离心3 min,弃上清。加入50 μL无水乙醇振荡成悬浮液,置于冰上备用。采用PDS 1 000/He Biolistic Particle Delivery System (Bio-Rad) 进行轰击,压力为1 350 Pa,轰击距离为6 cm,轰击1枪。轰击后继续在高渗培养基上暗培养16 h。
1.2.5 组织化学染色
将轰击后的小麦胚、胚乳、根、茎、叶分别置于一定量的X-gluc底物溶液中,37 ℃过夜恒温培养,当胚乳GUS蓝斑较为明显时取出小麦各组织,并于无水乙醇和乙酸按 3∶1配置的固定液中固定处理。染色后选择有代表性的个体在解剖显微镜下照相。
1.2.6 基因枪幼胚转化
转基因材料选取开花后12~14 d的小麦品种“舜麦1718”未成熟胚,预处理以及基因枪微粒子弹制备方法同1.2.3,轰击参数:压力为1 100 Pa,轰击距离为6 cm,轰击1枪,轰击后继续在高渗培养基上暗培养16 h。然后将幼胚转移至含有2 mg·L-12,4-D和5 mg·L-1PPT的MS固体培养基上,进行16 h光照,8 h暗培养,诱导幼胚愈伤组织。3周后,将愈伤组织转移至含有5 mg·L-1PPT的分化培养基上进行分化。转移大约3 cm高的绿苗至含有5 mg·L-1PPT 1/2 MS固体生根培养基上,进行幼苗壮根培养。待长出3~5条根后,经锻炼后移栽温室。
1.2.7 转基因植株的PT-PCR鉴定
经过早期PCR筛选,共筛选获得11株T0代转基因抗性植株,其中有4株正常结实。在开花14 d左右参照文献中的方法提取小麦胚乳总RNA,进行RT-PCR检测Gnk2-1基因表达情况[16]。引物序列如下:
引物8:5′-TGAATTCGGCCTTCAT-3’
引物9:5′-CCTCTGCTCGTATTGGAT -3’
PCR扩增体系为:cDNA 0.5 μL,10×PCR bufer(Mg2+Plus) 2.5 μL,dNTP Mixture (10 mmol each)0.5 μL,rTaq DNA聚合酶(5 U·μL-1) 0.25 μL,ddH2O补足25 μL;PCR反应条件为:94 ℃预变性5 min,94 ℃、30 s,50 ℃、30 s,72 ℃、40 s,30个循环; 72 ℃充分延伸5 min。反应产物进行1%的琼脂糖凝胶电泳检测。
2 试验结果
2.1 小麦基因组DNA提取和HMW-GS1Bx17基因启动子克隆
“舜麦1718”幼嫩叶片用于抽提基因组DNA,经过电泳检测如图1(A)所示,泳道1~2可见清晰条带,大小与基因组理论值接近,无弥散拖尾,说明基因组质量较好。对PCR扩增产物进行琼脂糖凝胶检测,如图1(B)所示,泳道1在约1 600 bp处出现单一条带,与理论大小1 676 bp基本一致,初步表明该条带可能是目标启动子序列。测序结果表明,该序列与已知序列(GenBank accession number: KC254854)一致性达到99%,表明成功获得了小麦1Bx17基因启动子序列。

图1 小麦基因组gDNA电泳图(A)和小麦1Bx17启动子PCR扩增结果(B)Fig.1 Agrose gel electrophoresis of wheat gDNA (A) and 1Bx17 promoter(B) 注:M,DL2000 分子量标准;(A):1~2,小麦基因组DNA,箭头所指为目标条带; (B):1, 1Bx17启动子片段Note:M, DL2000 DNA marker;(A):1~2, Genomic DNA of wheat, Arrows point to the target band.(B):1, 1Bx17 promoter
2.2 pBx17-GUS和pBx17-GNK载体的构建
pBx17-GUS的构建:对重组质粒做酶切鉴定,结果如图2(A)所示。重组质粒酶切产物经过琼脂糖凝胶电泳检测,观察到3条明显的条带,其大小分别与酶切片段理论值5 531 bp、2 153 bp、1 676 bp大小一致。表明载体构建成功。
pBx17-GUS经过SamI和SacI双酶切,回收大片段,再与引入酶切位点的Gnk2-1基因阅读框连接。对重组质粒进行酶切鉴定,结果如图2(B)所示,泳道1可以观察到两条电泳条带,大小与载体片段(7 454 bp)和Gnk2-1基因片段(418 bp)大小一致。初步表明载体构建成功。进一步通过测序选择读码框正确的克隆,命名为pBx17-GNK,用于后续小麦转化。
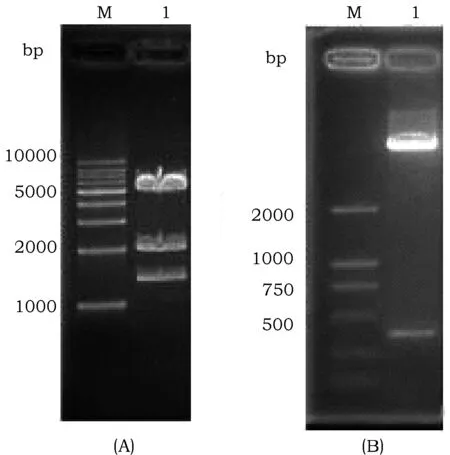
图2 pBx17-GUS(A)和pBx17-GNK(B)载体的酶切鉴定结果Fig.2 Enzyme analysis of plasmid pBx17-GUS and pBx17-GNK 注:(A):M, DL 10 000 分子量标准;(A):1,pBx17-GUS表达载体经过Hind III 和Sam I酶切后的电泳结果。(B):M, DL 2 000 分子量标准;(B):1,pBx17-GNK经过Sam I和Sac I双酶切后的电泳结果Note:(A):M, DL 10 000 DNA marker;1, Restriction enzyme analysis of pBx17-GUS by Hind III and Sam I.(B): M, DL 2 000 DNA marker;1, Restriction enzyme analysis of pBx17-GUS by Sam I and Sac I
2.3 1Bx17基因启动子的瞬时表达
将质粒pBx17-GUS通过基因枪法瞬时转化小麦不同组织,染色结果显示,转化后的胚乳表面有明显的蓝色斑点(图3(E)),说明GUS基因已经导入了小麦胚乳细胞并获得表达。与胚乳相比,小麦幼嫩根(图3(A))、茎(图3(B))、叶(图3(C))、幼胚(图3(D))、均没有观察到检测到GUS的表达活性。表明小麦1Bx17基因启动子具有胚乳表达特异性,可以驱动异源基因在小麦胚乳中专一表达。因此,若将小麦品质相关的目标基因或者种仁抗菌蛋白基因融合在该启动子下游,也将会在小麦种子中获得特异性表达,这可能会进一步提高小麦的品质或贮藏特性。
2.4 转基因植株的RT-PCR鉴定
对4株能够正常结实的再生抗性植株进行RT-PCR检测。结果如图4所示,3~6泳道可观察到大小约为400 bp左右的电泳条带,这与2泳道内以质粒pBx17-GNK为模板扩增得到的条带大小一致。而未转基因的野生型植株,检测结果为阴性,说明目标基因Gnk2-1已整合入这4株植株基因组中并被转录。试验结果初步表明我们已经获得转基因植株。同时,也进一步验证了1Bx17启动子的胚乳表达活性。

图3 1Bx17 promoter驱动下β-葡糖苷酸酶 (GUS)在小麦各组织中的瞬时表达结果Fig.3 The transient expression of the β-glucuronidase(GUS)gene in wheat endosperm 注:(A):根,(B):茎,(C):叶,(D):幼胚,(E):胚乳Note:(A):Root; (B):Stem; (C):Leaf; (D):Immature embryo; (E):Endosperm
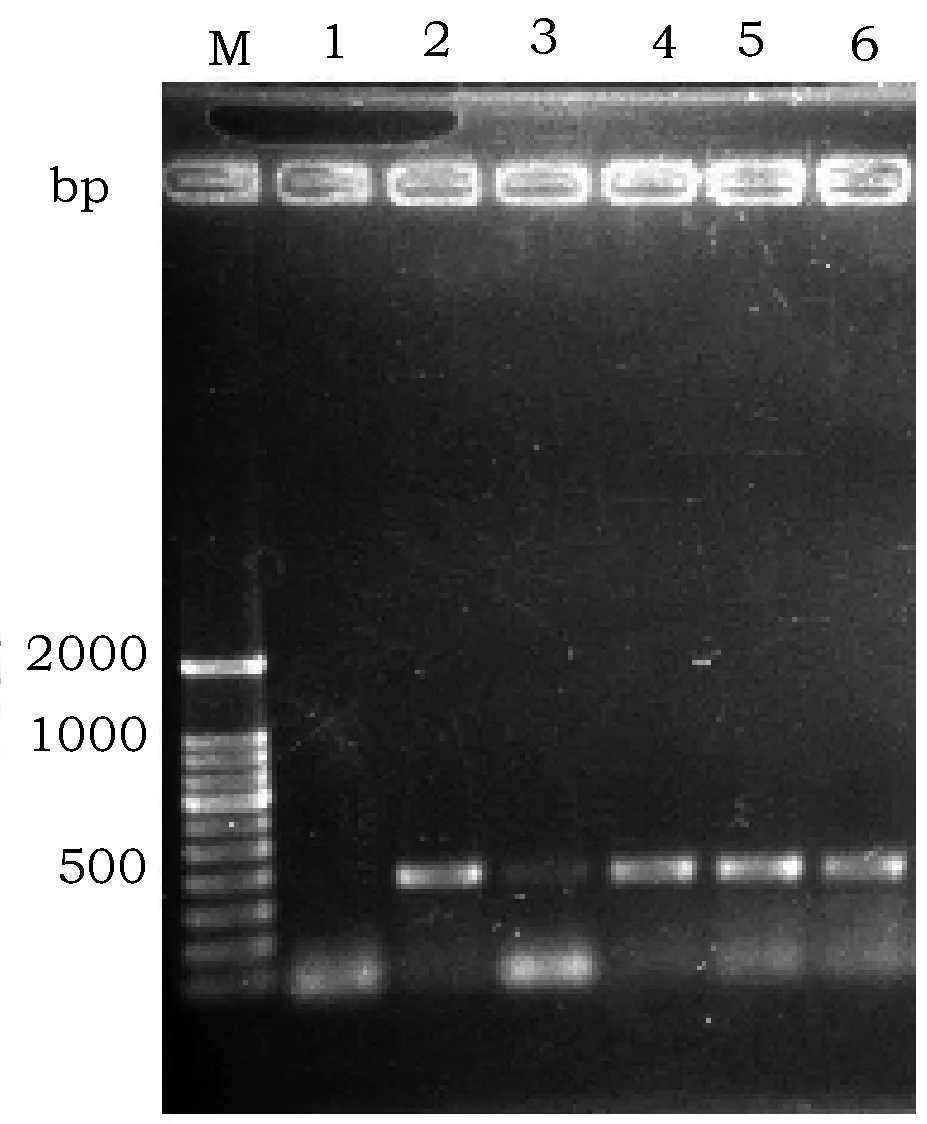
图4 转基因抗性植株的RT-PCR鉴定Fig.4 RT-PCR analysis of transformed resistant plants 注:M,100 bp Ladder分子量标准;1,为负对照:未进行基因转化的野生型植株;2,为正对照:pBx17-GNK质粒;3-6,转基因抗性再生植株Note:M: 100 bp Ladder marker; 1,Non-transformed control plant (negative control); 2, Plasmid pBx17-GNK (positive control); 3-6, RT-PCR analysis of transgenic plants
3 讨论与结论
β-葡萄糖甘酶(GUS)因其组织染色检测的便利性和在植物中表达的广谱性,使其在启动子结构与功能研究和转基因标记等方面得到广泛应用[17,18]。外源基因在受体中转录效率关键取决于启动子的特性,适宜的启动子对于外源基因的高效表达起重要作用。由于组织特异性启动子和诱导型启动子只在特定的环境或条件下启动外源基因的转录,可有效避免外源基因的组成型表达对植物本身造成的能量浪费和潜在伤害。因此,组织特异性启动子或诱导型启动子的开发和应用研究日益受到科研人员的重视[19]。
已有研究表明,HMW-GS1Bx17蛋白基因是在小麦胚乳中高表达的优质亚基基因,其表达特性很大程度上取决于启动子[12,20]。因此,本试验从小麦基因组DNA中分离和克隆了大小为1 627 bp的1Bx17基因启动子序列。并将其与GUS基因融合,构建基因枪表达载体,分别导入小麦根、茎、叶、胚及胚乳组织中以验证该启动子的功能。试验结果表明,GUS基因在胚乳中专一性表达,这说明该启动子具有小麦胚乳组织表达特异性,可以驱动外源基因在小麦种子中表达。因此,1Bx17基因的启动子在改良小麦品质、贮藏特性等方面的基因工程研究中具有一定的应用潜力。
本文将实验室之前获得的银杏种仁抗菌蛋白Gnk2-1基因与1Bx17胚乳特异启动子融合,对小麦幼胚进行了遗传转化,通过对有4株正常结实的再生抗性植株进行RT-PCR检测,初步表明目的基因已整合进入小麦基因组中并得到表达,同时也进一步证明了1Bx17启动子的胚乳表达活性。文中转基因植株的获得也为进一步研究抗真菌蛋白Gnk2-1在小麦贮藏特性中的作用奠定了基础。
[1]王华记.加快优质专用小麦产业化进程[J]. 小麦研究,2003,24(2):24-26.
[2]李式昭,郑建敏,伍玲,等. 四川小麦品种高、低分子量麦谷蛋白基因和1B/1R易位的分子标记鉴定[J]. 麦类作物学报,2014,34(12):1619-1626.
[3]陈东升,刘丽,董建力等. HMW-GS和LMW-GS组成及1BL/1RS易位对春小麦品质性状的影响[J]. 作物学报,2005,31(4):414-419.
[4]Liu Shuwei.Genetic variation of HighMoleculaWeight glutenin subunits associated with processing quality improvements in Wheat[J].Plant Physiology Journal, 2011, 47(6): 531-539.
[5]Singh J, Sheikh I, Sharma P, et al. Transfer of HMW glutenin subunits from Aegilops kotschyi to wheat through radiation hybridization[J]. Journal of Food science and Technology, 2016,53(9):1-7.
[6]Li Y, Wang Q, Li X, et al. Coexpression of the high molecular weight glutenin subunit 1Ax1 and puroindoline improves dough mixing properties in durum wheat (TriticumturgidumL.ssp.durum) [J]. Plos One, 2012, 7(11):50057.
[7]Beckles D M, Tananuwong K, Shoemaker C F. Starch characteristics of transgenic wheat (TriticumaestivumL.) overexpressing the Dx5 high molecular weight glutenin subunit are substantially equivalent to those in nonmodified wheat[J]. Journal of Food Science. 2012,77(4): 437-C442.
[8]Liu X, Jin W, Liu J, et al. Transformation of Wheat with the HMW-GS 1Bx14 Gene without Markers[J]. Russian Journal of Genetics, 2011, 47(2): 182-188.
[9]Santagati V D, Sestili F, Lafiandra D, et al. Characterization of durum wheat high molecular weight glutenin subunits Bx20 and By20 sequences by a molecular and proteomic approach[J]. Journal of Mass Spectrometry Jms, 2016,51(7):512-517.
[10]杨随庄,尚勋武,叶春雷. 小麦高分子量谷蛋白亚基基因分子育种研究进展[J]. 麦类作物学报,2007,27(2):358-363.
[11]Li X, Liu T, Song L, et al. Influence of high-molecular-weight glutenin subunit composition at Glu-B1 locus on secondary and micro structures of gluten in wheat (Triticum aestivum L.)[J]. Food Chemistry. 2016,197:1184-1190.
[12]万映秀,张晓科,夏先春,等. 多重PCR的建立及黄淮麦区主要品种品质相关基因的鉴定[J]. 中国农业科学,2008,41(3):643-653.
[13]刘婷婷,赵颖红,杨珍平,等. ‘舜麦1718’和‘中麦175’在晋中晚熟冬麦区的生育表现[J]. 中国农学通报,2014,30(15):56-61.
[14]刘缙,田花丽,王亚红,等. 黄瓜转新型抗菌蛋白基因GNK2-1及其抗枯萎病的研究[J]. 植物学报, 2010,45(4):411-418.
[15]刘缙,王亚红,王强,等. 银杏果仁抗菌蛋白的分离纯化及其基因克隆和原核表达初步研究[J]. 农业生物技术学报, 2010,18(2):246-253.
[16]王亚红,刘缙,王玉国. 高质量提取银杏种仁总RNA的改良方法[J]. 中国农学通报, 2010,26(15):48-52.
[17]王银晓, 赵军. 玉米bHLH 类转录因子ABP7 的启动子克隆及其活性分析[J]. 生物技术进展,2015,5(5):359-365,406.
[18]崔喜艳,陈众峰,范贝,等. 大豆rbcS基因启动子的克隆及在转基因烟草中的功能缺失分析[J]. 西北农林科技大学学报(自然科学版),2015,43(5):114-121,128.
[19]Geng Y, Pang B, Hao C, et al. Expression of wheat high molecular weight glutenin subunit 1Bx is affected by large insertions and deletions located in the upstream flanking sequences[J]. PloS One. 2013;9(8):105363.
[20]郭庆瑞,郭凤琴. 春小麦麦谷蛋白优质亚基的引进与应用研究[J].内蒙古农业科技, 2011,3: 64,67.
(编辑:韩志强)
Characterization of the promoter ofHMW-1Bx17 gene from wheat
Wang Yahong1,3, Liu Jin2*, Wang Yuguo3*
(1.DepartmentofMechanicalandElectricalEngineering,YunchengUniversity,Yuncheng044000,China; 2.DepartmentofLifeSciences,YunchengUniversity,Yuncheng044000,China; 3.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]HMW-1Bx17 protein gene is one of the highly expressed genes in wheat endosperm. Promoter of 1Bx17 gene can provide the basic materials for further studying regulation model of wheat high molecular weight glutenin gene, and lay a foundation for genetic engineering research in wheat quality improvement.[Methods]The wheat “ShunMai 1718” genomic DNA was extracted based on the improved CTABmethod , and 1Bx17 promoter fragment was obtained by nested PCRmethod with genomic DNA as a template and the primers designed according to the known sequence. The expression plasmid containing GUS reporter gene driven by 1Bx17 promoter was successfully constructed, and used for transient expression assay in different tissues of wheat by particle bombardmentmethod . The expression vector containing antibacterial proteinGnk2-1 gene driven by 1Bx17 promoter was also constructed to stablely transform immature embryo of wheat for detecting the expression activity of the promoter further.[Result]X-gluc dying assay showed that the GUS gene driven by 1Bx17 promoter could be specifically expressed in wheat endosperm. The transgenic resistant plants obtained from experiment was detected by RT-PCR, theresult not only showed that we have obtained the transgenic plants, but also verify the function of the promoter further.[Conclusion]1Bx17 promoter has application potential in improvement of quality by plant genetic engineering.
Wheat, 1Bx17 gene, Promoter,Gnk2-1 gene, Transient expression
2017-04-19
2017-05-09
王亚红(1981-),女(汉),陕西西安人,助教,硕士,研究方向:生物化学与分子生物学
*通信作者:王玉国,教授,博士生导师,Tel:13835462639;E-mail: tgwygn@126.com;刘缙,讲师,博士,Tel:15536274037;E-mail:liugene@163.com
运城学院博士启动项目 (YQ-2011040);运城学院产学研项目(XK-2015030)
S512.103.53; Q78
A
1671-8151(2017)07-0487-06
