饲料浮萍水平对黄金锦鲤生长性能、消化酶活力及抗氧化能力的影响
2017-07-24张植元范泽李静辉杨天毅魏东乔秀亭白东清
张植元,范泽,李静辉,杨天毅,魏东,乔秀亭,白东清
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津300384)
饲料浮萍水平对黄金锦鲤生长性能、消化酶活力及抗氧化能力的影响
张植元,范泽,李静辉,杨天毅,魏东,乔秀亭,白东清
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津300384)
为研究浮萍Lemna minor对黄金锦鲤Cyprinus carpio生长性能、抗氧化和消化能力的影响,以初始体质量为(52.99±1.95)g的黄金锦鲤为研究对象,在饲料中分别添加0、3%、6%、9%、13%、14%的浮萍,相应替代同等水平的菜粕,制成6组等氮(粗蛋白质为38.5%~38.6%)、等能(12.2 MJ/kg)的饲料,分别记为D1(对照)、D2、D3、D4、D5、D6饲料组,将540尾健康的黄金锦鲤随机分成6组,每组设3个重复,每个重复放30尾鱼,养殖时间为8周。结果表明:D6饲料组增重率(WGR)、蛋白质效率(PER)、特定生长率(SGR)和肥满度(CF)均显著高于对照组及添加水平为3%的饲料组(P<0.05),而其饲料系数(FCR)显著低于上述两组(P<0.05);D6饲料组蛋白酶活力与脂肪酶活力显著高于其他饲料组(P<0.05),各饲料组间淀粉酶活力则无显著性差异(P>0.05);D4与D6饲料组肝胰脏、脾脏、肾脏和血清中的超氧化物歧化酶(SOD)与过氧化氢酶(CAT)活力显著高于其他饲料组(P<0.05),且D6饲料组丙二醛(MDA)活力显著最低(P<0.05)。研究表明:本试验条件下,饲料中浮萍的添加水平在14%时,有利于黄金锦鲤的生长,并能提高鱼体抗氧化能力与消化酶活力。
浮萍;黄金锦鲤;生长性能;消化酶活力;抗氧化能力
浮萍Lemna minor又称青萍、田萍、浮萍草、水浮萍、水萍草,是浮萍科水面浮生植物,其分布范围广泛,常见于河流、湖泊和稻田。浮萍的经济价值主要有两种,一是可以入药,二是可以作为饲料成分。浮萍既可作为淡水鱼的饲料,又可作为水源的清洁剂[1]。因此,将其加入饲料中不仅可以带来一定的经济价值,还可以解决一定的污染问题。然而,鲜浮萍含水量较高(89%~91%),且生长于污水中,可能含有寄生虫和细菌,因此,不能直接饲喂禽畜[2]。以往研究者多注重浮萍的药用价值,而忽略了其饲用价值[3-4]。研究发现, 35%~50%蛋白含量和种类丰富的维生素使得浮萍作为动物饲料原料成为现实[2,5]。目前,将浮萍作为饲料饲养猪、鸭等畜禽及草鱼等水产动物的研究已有报道[6],将浮萍作为补充饲料混养银鲤、罗非鱼、鲤时能够有效促进鱼的生长[7]。
锦鲤Cyprinus carpio食性杂、繁殖快、体格健美、色彩艳丽,其对水质要求不高、易饲养的特性使其备受大众喜爱[8]。黄金锦鲤又以其独特的色彩从诸多锦鲤品种中脱颖而出。黄金锦鲤通体金黄,鱼鳞排列整齐有序,身体发出的光恰如黄金一样璀璨夺目,其极高的观赏价值赋予了其广阔的市场前景。目前,中国对锦鲤已有较多研究,但主要集中在生物学特性、人工繁殖技术、养殖技术和病害防治检测等方面[9],关于饲料原料对其影响的研究较少,而将浮萍作为一种原料添加到观赏鱼饲料中的研究尚未见报道。为此,本试验中研究了浮萍对黄金锦鲤的生长性能、抗氧化能力和消化酶活力的影响,以期为浮萍在锦鲤饲料中的应用提供理论依据。
1 材料与方法
1.1 材料
黄金锦鲤取自天津市蓝科水产有限公司,试验在天津农学院循环水实验室进行。
1.2 方法
1.2.1 试验设计与饲养管理 试验分6组,每组设3个重复,共用18个循环水族箱,每个水族箱放养30尾鱼。试验鱼驯化1周后,选取体格健壮、规格为(52.99±1.95)g的锦鲤,随机分入18个水族箱中,水温为(29.0±1.1)℃,pH为7.8± 0.2,投饵量为鱼体质量的3%,每日9:00、15:30进行投喂,持续养殖8周。
1.2.2 试验饲料 从天津农学院正门对面河沟中采集鲜浮萍,清理晒干后用粉碎机粉碎制成浮萍粉(粗蛋白质为34.6%,粗脂肪为6.7%,粗纤维为5.0%),以鱼粉、全虾粉、豆粕和棉粕作为蛋白源,配制浮萍(干品)替代菜粕水平分别为0、20%、40%、60%、80%、100%的6种等蛋白(38.6%)饲料,分别记为D1(对照)、D2、D3、D4、D5、D6饲料组,其原饲料组成及营养水平见表1。各饲料原料经粉碎机粉碎后过60目网筛,混合均匀后,使用江苏牧羊集团牧羊MUZLM V4型饲料制粒机制成直径为1.00 mm的沉性颗粒饲料保存备用。

表1 试验饲料组成及营养水平(风干基础)Tab.1 Ingredient and nutrient levels of the experimental diets(air dry basis)w/%
1.2.3 样本的采集 饲养结束后,将各试验组锦鲤禁食2 d,之后从每个重复组随机取20尾鱼作为样品,测量其体质量、体长、体高,并立即用不含有抗凝剂的针管从尾静脉取血,离心(12 000 r/min,5 min,4℃),分离上清并于超低温冰箱(-80℃)中保存备用。然后将其解剖,取其肝胰脏、脾脏、肾脏及前、中、后肠立即速冻,然后转至冰箱(-80℃)中保存待测。
1.2.4 全鱼生长指标的测定 生长指标及饲料系数、蛋白质效率计算公式分别为
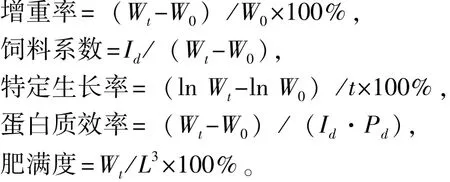
其中:Wt为试验终末鱼体质量(g);W0为初始鱼体质量(g);t为试验时间(d);L为试验末鱼体长(cm);Id为摄食量干质量(g);Pd为饲料中蛋白质含量(%)。
1.2.5 生化指标的测定 将组织样品解冻后,用预冷的生理盐水冲洗干净,并用滤纸吸干后称量其质量。在预冷的生理盐水中漂洗,除去血液,用滤纸拭干,用移液管加入9倍组织块质量的预冷匀浆介质(0.85%的氯化钠注射液),在匀浆器中进行匀浆,于4℃下以4500 r/min离心15 min,取上清液备用。
组织中蛋白质含量、淀粉酶和脂肪酶活力测定试剂盒以及各抗氧化指标测定试剂盒均由南京建成生物工程研究所提供。采用福林酚法[10]测定组织中蛋白酶活力。
1.3 数据处理
试验数据均以平均值±标准误表示,采用SPSS 18.0软件对所得数据进行单因素方差分析(Oneway ANOVA),采用Duncan氏法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲料浮萍水平对黄金锦鲤生长性能的影响
由表2可知:随饲料中浮萍水平的升高,锦鲤增重率、特定生长率、蛋白质效率、肥满度均呈升高的趋势,而饲料系数则呈降低趋势;D6组试验鱼的增重率、特定生长率、蛋白质效率、肥满度最高,均显著高于对照组与D2组(P<0.05),D6组试验鱼的饲料系数最低,且显著低于对照组与D2组(P<0.05),其他处理组间无显著性差异(P>0.05)。
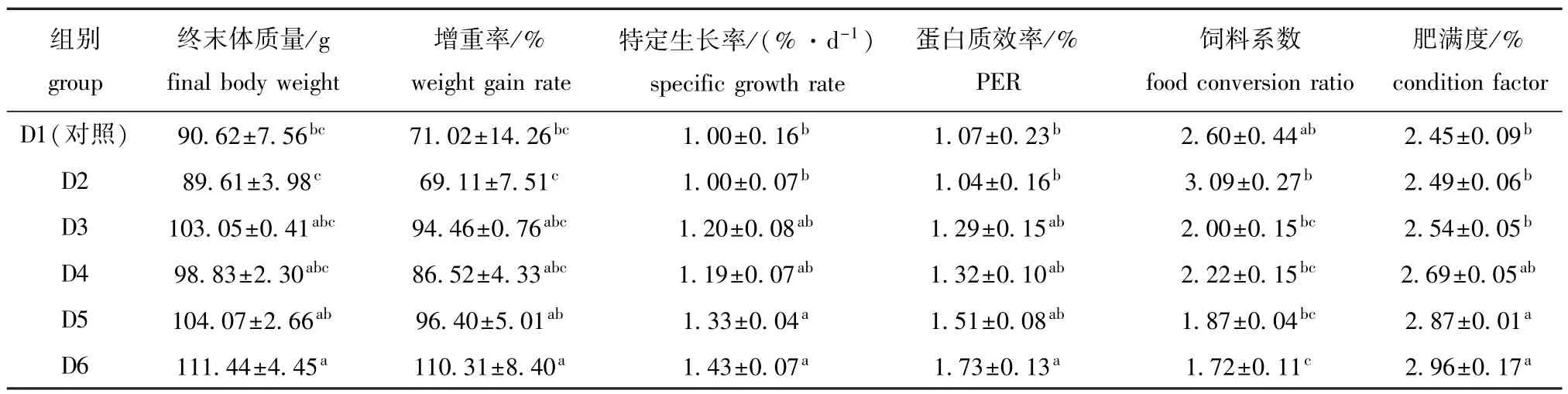
表2 饲料浮萍水平对黄金锦鲤生长性能的影响Tab.2 Effects of dietary duckweed meal levels on growth performance in koi carp
2.2 饲料浮萍水平对黄金锦鲤消化酶活力的影响
2.2.1 饲料浮萍水平对黄金锦鲤蛋白酶活力的影响 由表3可知:随饲料浮萍水平的升高,各组织、血清中蛋白酶活力均呈上升趋势;各组织、血清中各试验组酶活力均高于对照组(血清中D2组除外),D6组蛋白酶活力最高,且显著高于对照组及D2组(P<0.05)。
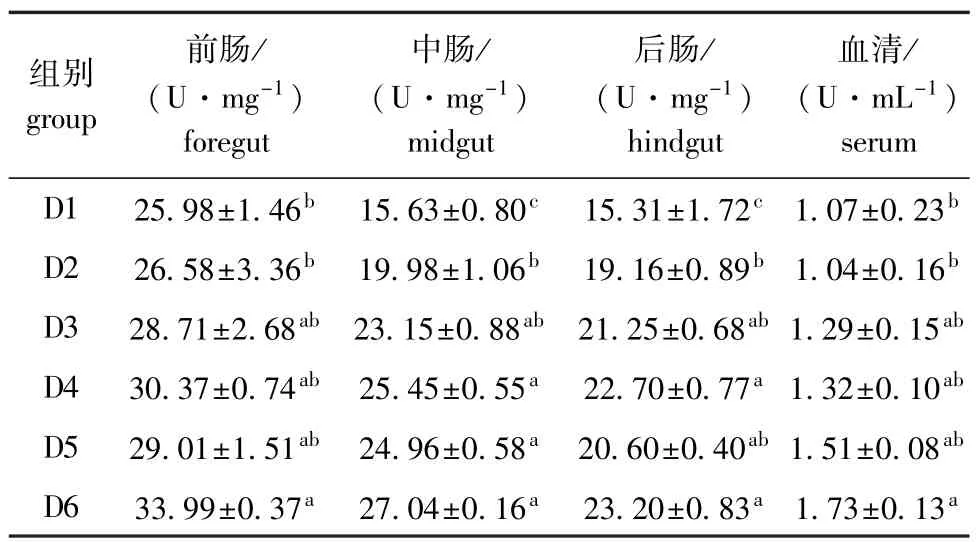
表3 饲料浮萍水平对黄金锦鲤蛋白酶活力的影响Tab.3 Effects of dietary duckweed meal levels on protease activity in koi carp
2.2.2 饲料浮萍水平对黄金锦鲤淀粉酶活力的影响 由表4可知:随饲料浮萍水平的升高,前肠中锦鲤淀粉酶呈先升高后降低的趋势;各组织、血清中,D4、D5、D6组淀粉酶活力均高于对照组;前肠中D4组和后肠中D6组的淀粉酶活力最高,且显著高于对照组(P<0.05),中肠与血清中各组淀粉酶活力均无显著性差异(P>0.05)。
2.2.3 饲料浮萍水平对黄金锦鲤脂肪酶活力的影响 由表5可知:随饲料浮萍水平的升高,各组织中脂肪酶活力均呈上升趋势,血清中脂肪酶活力则呈先下降后上升的趋势;各组织中试验组脂肪酶活力均高于对照组,血清中除D2、D3组低于对照组外,其余试验组均高于对照组;各组织、血清中D4~D6组脂肪酶活力均较高,且显著高于对照组(血清中各组除外)(P<0.05)。
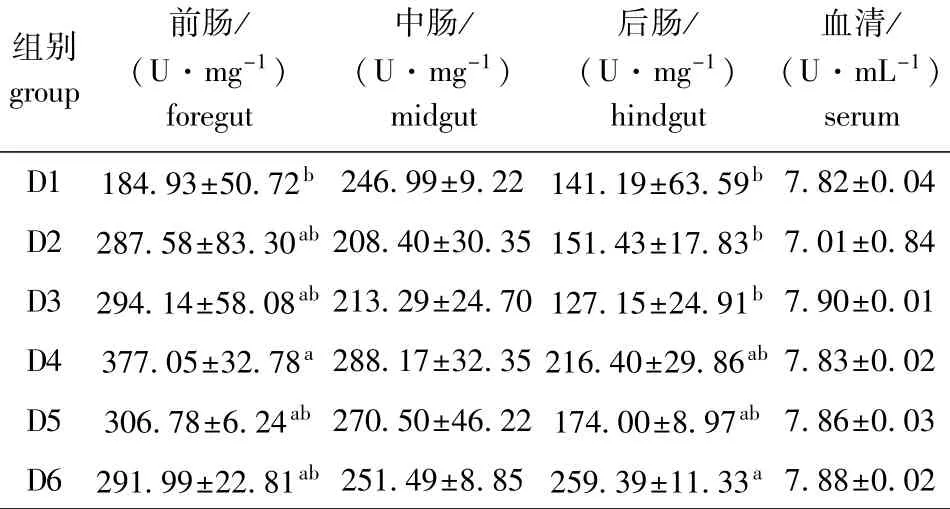
表4 饲料浮萍水平对黄金锦鲤淀粉酶活力的影响Tab.4 Effects of dietary duckweed meal levels on amylase activity in koi carp
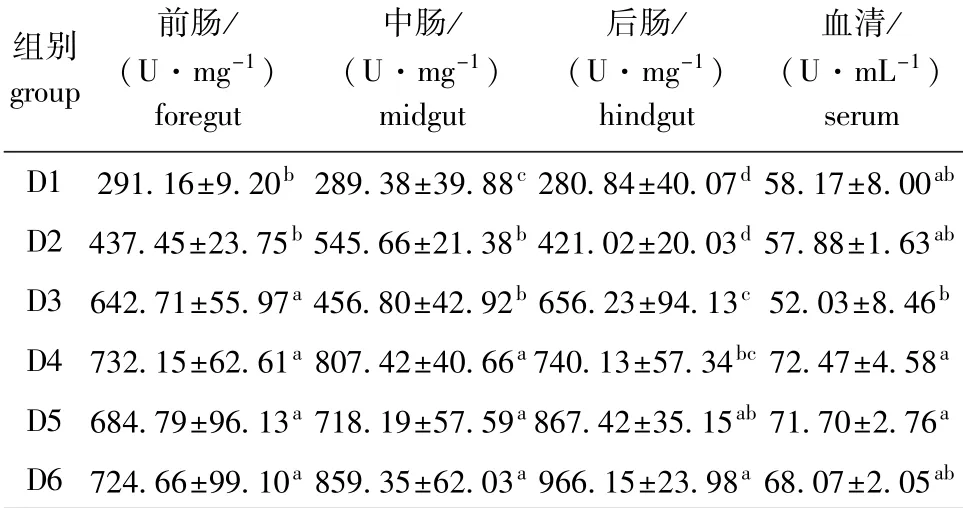
表5 饲料浮萍水平对黄金锦鲤脂肪酶活力的影响Tab.5 Effects of dietary duckweed meal levels on lipase activity in koi carp
2.3 饲料浮萍水平对黄金锦鲤抗氧化能力的影响
2.3.1 饲料浮萍水平对黄金锦鲤超氧化物气化酶(SOD)活力的影响 由表6可知:随饲料浮萍水平的升高,肝胰脏和脾脏组织中SOD活力均呈上升趋势,中肾组织中SOD活力呈先降低后升高的趋势,血清SOD活力则呈下降趋势;肝胰脏组织中各试验组SOD活力均显著高于对照组(P<0.05),脾脏组织中各试验组SOD活力均高于对照组,中肾组织中D4~D6组SOD活力高于对照组,血清中各试验组SOD活力均低于对照组;各组织中D6组SOD活力最高,且显著高于对照组及D2、D3组(P<0.05),血清中D4、D5组SOD活力显著低于对照组及其他各试验组(P<0.05)。
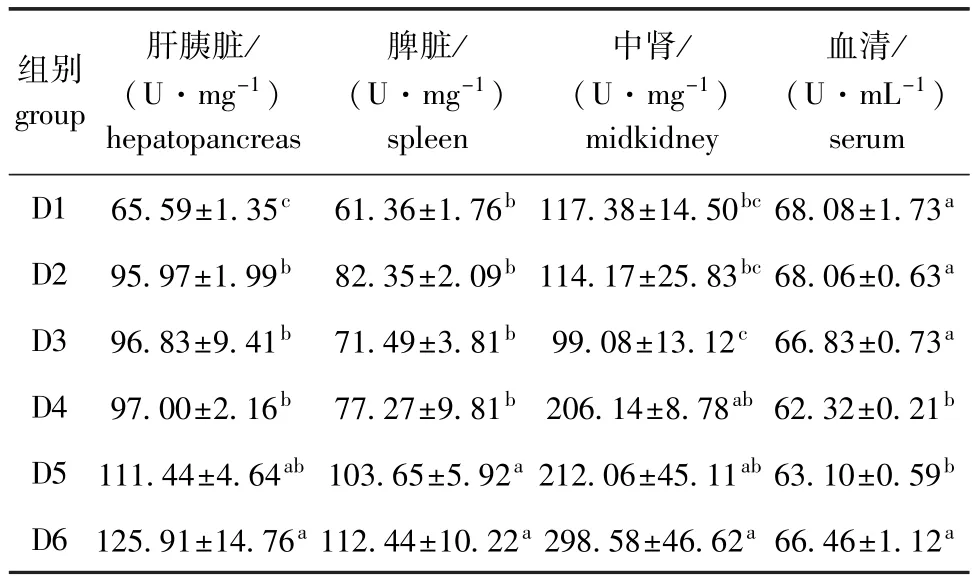
表6 饲料浮萍水平对黄金锦鲤SOD活力的影响Tab.6 Effects of dietary duckweed meal levels on superoxide dismutase(SOD)activity in koi carp
2.3.2 饲料浮萍水平对黄金锦鲤丙二醛(MDA)含量的影响 由表7可知:随饲料浮萍水平的升高,肝胰脏组织中MDA含量呈下降趋势,脾脏和中肾组织中MDA含量呈先升高后降低的趋势;肝胰脏和血清中各试验组MDA含量均显著低于对照组(血清中D3组除外),脾脏中D4~D6组MDA含量均显著低于对照组(P<0.05),中肾组织中各组间MDA含量无显著性差异(P>0.05)。
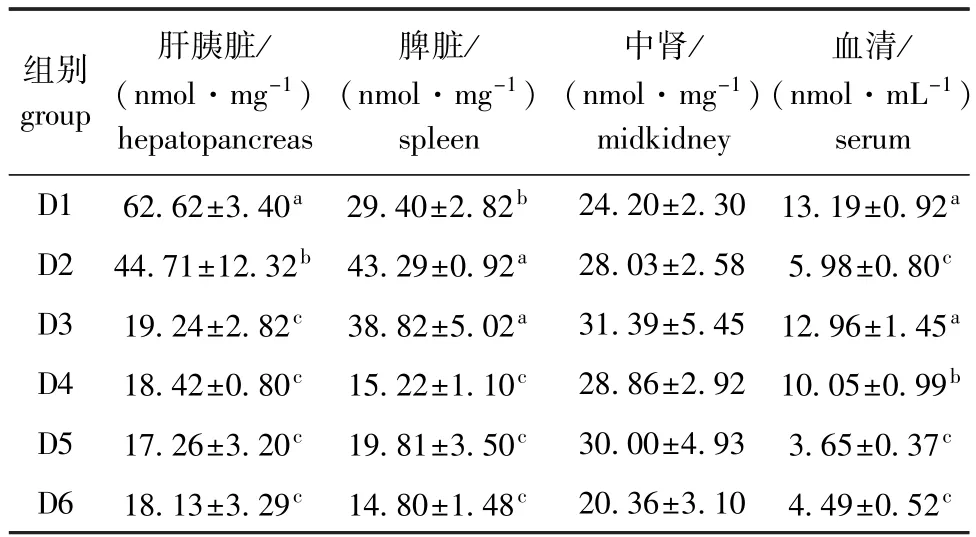
表7 饲料浮萍水平对黄金锦鲤MDA含量的影响Tab.7 Effects of dietary duckweed meal levels on malondialdehyde(MDA)content in koi carp
2.3.3 饲料浮萍水平对黄金锦鲤过氧化氢酶(CAT)活力的影响 由表8可知:随饲料浮萍水平的升高,各组织和血清中CAT活力均呈先下降后升高的趋势;肝胰脏、脾脏中各试验组CAT活力均低于对照组(脾脏中D6组除外),中肾组织中D4~D6组CAT活力高于对照组,血清中各试验组均高于对照组(D4组除外);各组织和血清中D6组的CAT活力均最高(肝胰脏除外)。
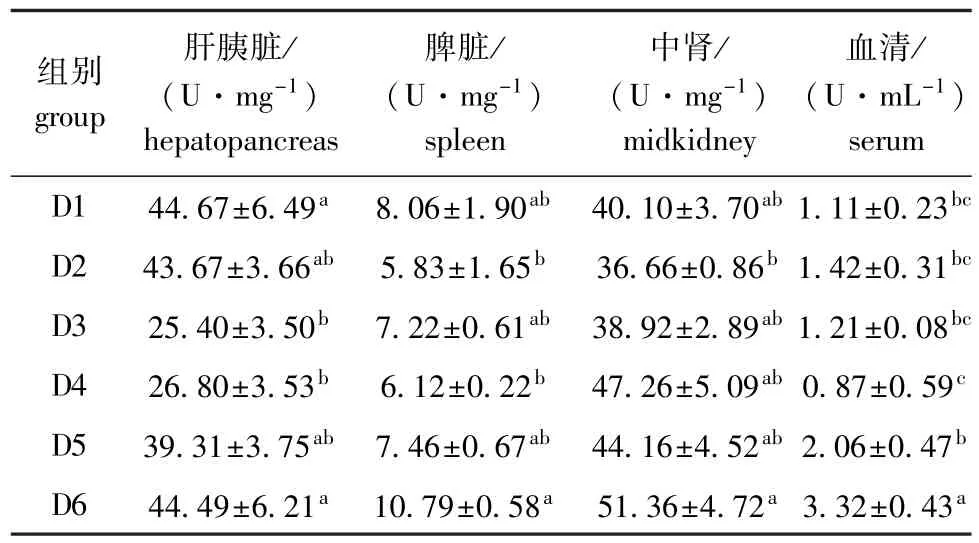
表8 饲料浮萍水平对黄金锦鲤CAT活力的影响Tab.8 Effects of dietary duckweed meal levels on catalase (CAT)activity in koi carp
3 讨论
3.1 饲料浮萍水平对黄金锦鲤生长性能的影响
浮萍蛋白质的氨基酸模式非常理想,较接近动物蛋白质,可被动物高效利用,浮萍蛋白质的氨基酸模式与大豆饼非常相似,第一限制性氨基酸(赖氨酸)含量较高,且明显优于玉米和高粱等植物,这使浮萍成为可替代大豆饼的饲料蛋白源[6]。而本试验中使用浮萍粉的粗蛋白含量在34%左右,与菜粕粗蛋白质含量相近,均为植物性蛋白原料,且粕类中会含有抗胰蛋白酶等有毒物质,影响适口性,会使饲料蛋白利用率降低[11],因此,浮萍作为植物蛋白源替代菜粕可能会促进黄金锦鲤的生长。本试验中,黄金锦鲤生长性能结果综合显示,随着浮萍替代水平的升高黄金锦鲤的生长性能呈上升的趋势,且肥满度的升高表明,该试验饲料对锦鲤的体形可能有一定的影响,这与黄斌等[12]在日粮中添加芜萍对红色草金鱼生长影响的研究结果相似。黄斌[13]研究表明,在芜萍水平对泥鳅生长性能的影响中,30%芜萍水平组泥鳅各项生长指标均优于其他水平组,当添加量超过40%时,蛋白质效率开始降低,饲料系数增大。该结果与本试验结果存有差异,可能是由于浮萍添加机制与本试验不同,也可能是试验对象种间差异太大所致。
3.2 饲料浮萍水平对黄金锦鲤消化酶活力的影响
锦鲤属于无胃鱼,前肠的前端通常存在膨大部,作用相当于有胃鱼的胃部,因此,肠道是锦鲤主要的消化场所,其中,前肠和后肠是锦鲤的主要消化位置,所以最易受到影响[14]。锦鲤自身能分泌一定量的消化酶,饲料进入鱼体消化道后,其成分就成为各种消化酶的底物,消化酶的分泌和活力会因此受其影响[14-15]。本试验结果综合显示,D6组(14%浮萍水平)蛋白酶活力最高,已有试验表明,蛋白酶的活力随着蛋白质含量的升高而增大[16-17],但本试验中的6组饲料均为等蛋白饲料,可能是由于浮萍氨基酸组成理性[6],利于鱼体消化利用。由于脂类不溶于水,必须与胆汁充分混合,经胆汁酸盐的乳化并分散成细小的乳糜微粒后才能被脂肪酶消化[18-19]。当水产动物处于饥饿状态越冬,或者处于洄游期间等需要能量时,储存于体内的脂肪才被脂肪酶水解成甘油和游离的脂肪酸,并释放入血液,被运送到全身各组织中氧化利用[20-21]。淀粉酶是水解淀粉和糖原的酶类总称,能水解淀粉、糖原和有关多糖糖苷键[22-23]。有研究表明,转氨酶的增强有利于蛋白质代谢效率的提高[24],而浮萍中丰富的类胡萝卜素含量能够提高鱼体内转氨酶活力[25-26]。本试验中,各试验组蛋白酶活力较对照组均有提高,说明饲料中浮萍的添加在促进锦鲤转氨酶提高的同时,加强了对蛋白质的代谢效率,从而提高了体内蛋白酶及脂肪酶活力,但对淀粉酶活力影响不显著,还有待进一步研究。因此,浮萍添加量在14%时,黄金锦鲤的蛋白质代谢能力及消化酶活力达到最佳。
3.3 饲料浮萍水平对黄金锦鲤抗氧化能力的影响
鱼体的综合抗氧化能力可以通过测定SOD、CAT活力和MDA含量体现。SOD是一种清除超氧阴离子自由基的酶,是反映鱼体内自由基代谢状态的重要指标,对鱼体内的氧化与抗氧化平衡起着至关重要的作用[27]。MDA含量的测定通常又与SOD相互配合,其高低能反映鱼体受自由基的攻击程度[28]。CAT活力越高,氧化应激反应越强烈。抗氧化剂的抗氧化作用主要通过抑制自由基的产生、直接清除自由基,以及提高内源性抗氧化物质的水平来实现。浮萍的类胡萝卜素含量丰富,且叶黄素含量极高[29],而类胡萝卜素具有较强的抗氧化活性和极强的清除自由基能力[30]。本试验中,综合各项抗氧化指标结果得到,各试验组抗氧化能力相对于对照组均有提高,这表明,在锦鲤饲料油脂中浮萍替代菜粕,具有提高SOD和CAT活力、抑制MDA含量的作用,而浮萍添加量在14%时,饲料对于提高锦鲤的抗氧化能力达到最佳状态。李建光等[31]的研究表明,4种增色剂对锦鲤抗氧化能力有一定的负面影响,与本试验结果不一致,可能是因为直接以添加剂形式添加类胡萝卜素与本试验中基于蛋白源水平添加浮萍的机制不同。浮萍中类胡萝卜素所具有的抗氧化性,有效提高了黄金锦鲤内源性抗氧化物质的水平,不仅使锦鲤体色鲜艳,鱼体品质得到提高,同时提高了鱼体的抗氧化能力。因此,本试验饲料可能对黄金锦鲤体色也有一定的影响。
4 结论
综合各项指标结果表明:在生长性能方面,浮萍作为植物蛋白源替代菜粕能促进黄金锦鲤的生长,且14%浮萍组效果最好;在消化酶活力方面,由于浮萍的添加提高了转氨酶的活力,促进了体内蛋白质的代谢,从而提高了各消化酶的活性;在抗氧化指标方面,饲料浮萍水平在14%时,锦鲤SOD、CAT活力均显著高于对照组,MDA含量则显著低于对照组。综合分析说明,浮萍添加量在14%时,黄金锦鲤各项指标均达到最佳效果,因此,建议在饲料中添加14%的浮萍替代菜粕。
[1] 侯文华,宋关玲,汪群慧.浮萍在水体污染治理中的应用[J].环境科学研究,2004,17(1):70-73.
[2] 姚茂桂.浮萍的营养成分及其在草鱼养殖中的应用[D].武汉:华中农业大学,2007.
[3] 朱晔荣,马荣,刘清岱,等.浮萍相关研究的几方面重要进展[J].生物学通报,2010,45(4):4-6.
[4] Perniel M,Ruan R,Martinez B.Nutrient removal from a stormwater detention pond using duckweed[J].Applied Engineering in Agriculture,1998,14(6):605-609.
[5] Gijzen H J.Anaerobes,aerobes and phototrophs.A winning team for wastewater management[J].Water Science and Technology, 2001,44(8):123-132.
[6] 李新波,蔡发国,邓岳松.浮萍饲用价值研究进展[J].饲料研究,2011(10):3-6.
[7] Kabir A N M A,Hossain M A,Rahman M S.Use of duckweed as feed for fishes in polyculture[J].Journal of Agriculture&Rural Development,2009,7(1-2):157-160.
[8] 刘飞,汪小将,陈万光.锦鲤的营养需求[J].水产科技情报, 2007,34(4):180-183.
[9] 胡民强.我国锦鲤营养需要研究进展[J].佛山科学技术学院学报:自然科学版,2010,28(6):36-39.
[10] 桂远明.水产动物机能学实验[M].北京:中国农业出版社, 2004:113-116,119-124.
[11] 彭福峰.饼粕类饲料鱼用七注意[J].农家致富顾问,1998 (10):35.
[12] 黄斌,黄勇,汪利.日粮添加芜萍对红色草金鱼生长及体色的影响[J].水产科学,2011,30(10):617-620.
[13] 黄斌.日粮添加芜萍对泥鳅生长性能的影响[J].饲料研究, 2011(3):37-39.
[14] 赖红娥.Glycinin对鲤稚鱼和幼鱼生长、消化酶活力及肠道组织的影响[D].长春:吉林农业大学,2013.
[15] 杨代勤,严安生,陈芳,等.不同饲料对黄鳝消化酶活性的影响[J].水产学报,2003,27(6):558-563.
[16] 黄峰,严安生,张桂蓉,等.不同蛋白含量饲料对南方鲇胃蛋白酶和淀粉酶活性的影响[J].水生生物学报,2003,27(5):451-456.
[17] 黄耀桐,刘永坚.草鱼肠道肝胰脏蛋白酶活性初步研究[J].水生生物学报,1988,12(4):328-333.
[18] 赖铭勇.鲤鱼的营养需要与饲料配制[J].内陆水产,2004,29 (7):31-32.
[19] Alam M S,Teshima S,Ishikawa M,et al.Effects of ursodeoxycholic acid on growth and digestive enzyme activities of Japanese flounder Paralichthys olivaceus(Temminck&Schlegel)[J].Aquaculture Research,2001,32(S1):235-243.
[20] Eusebio P S,Coloso R M.Proteolytic enzyme activity of juvenile Asian sea bass,Lates calcarifer(Bloch),is increased with protein intake[J].Aquaculture Research,2002,33(8):569-574.
[21] Shepherd C J,Bromage N R.Intensive Fish Farming[M].London,First Publishing Billing&Sons,1988:154-197.
[22] 桂远明,吴垠,刘焕亮,等.温度对草鱼、鲤、鲢、鳙主要消化酶活性的影响[J].大连水产学院学报,1992,7(4):1-8.
[23] Muir J F,Roberts R J.Recent Advances in Aquaculture[M]. London:Croom Helm,1988:216-263.
[24] 孙红梅.饥饿对黄颡鱼血液指标及免疫机能的影响[D].长春:吉林农业大学,2004.
[25] 王吉桥,樊莹莹,徐振祥,等.饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响[J].大连海洋大学学报,2012,27(3):215-220.
[26] 崔培,刘芳,杨广,等.虾青素对锦鲤血液及抗氧化指标的影响[J].东北农业大学学报,2013,44(3):89-94.
[27] 许治冲,刘辉,徐奇友,等.温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响[J].大连海洋大学学报,2012,27 (5):429-435.
[28] 吴志刚,沈洪艳,高吉喜,等.青土霉素废水出水对锦鲤肝脏抗氧化酶活性和丙二醛含量的影响[J].江西农业大学学报, 2013,35(3):587-592.
[29] 于斌.浮萍对污水中氮、磷去除作用的初步研究[D].扬州:扬州大学,2010.
[30] Ganji V,Kafai M R.Population determinants of serum lycopene concentrations in the United State:data from the Third National Health and Nutrition Examination Survey,1989-1994[J].The Journal of Nutrition,2005,135(3):567-572.
[31] 李建光,胡世然,刘霆,等.四种增色剂对锦鲤的生长、形体、体色和抗氧化能力的影响[J].中国饲料,2009(16):33-36, 40.
Effects of dietary duckweed levels on growth performance,digestive ability,and antioxidant ability in koi carp Cyprinus carpio
ZHANG Zhi-yuan,FAN Ze,LI Jing-hui,YANG Tian-yi,WEI Dong,QIAO Xiu-ting,BAI Dong-qing
(College of Fisheries,Tianjin Agricultural University,Tianjin 300384,China)
Koi carp Cyprinus carpio with initial body weight of(52.99±1.95)g was reared in net cages at a density of 30 fish per cage and fed six isonitrogenous(38.5%-38.6%,crude protein)and isocaloric(12.2 MJ/kg)diets containing 0(control,D1),3%(D2),6%(D3),9%(D4),13%(D5),and 14%(D6)dry duckweed meal replacing corresponding rapeseed meal at water temperature of(29.0±1.1)℃or 8 weeks with triplication to evaluate the effects of dietary duckweed levels on growth,antioxidant ability,and digestive ability of koi carp.The results showed that there were significantly higher weight gain rate(WGR),specific growth rate(SGR),protein efficient ratio(PER)and condition factor(CF)and significantly lower food conversion ratio(FCR)in the fish in group D6 than those in the control group and in group D2(P<0.05).The koi carp fed the diet containing 14%duckweed had significantly higher activities of protease and lipase than the fish in other groups did(P<0.05),without significant differences in amylase activity(P>0.05).There were significantly higher activities of superoxide dismutase(SOD)and catalase(CAT)in hepatopancreas,kidney,spleen and serum in the fish fed the diets containing 9%and 14%duckweed meal than those in the other groups(P<0.05),with significantly lower contents of malondialdehyde(MDA)in the fish fed the diets containing 14%duckweed(P<0.05).The findings indicate that supplementation of 14%duckweed replacing corresponding rapeseed meal can improve the growth,and meet requirements for antioxidant ability and digestive capacity of koi carp.
duckweed;koi carp;growth;digestion ability;antioxidant ability
S963.71
A
10.16535/j.cnki.dlhyxb.2017.04.007
2095-1388(2017)04-0416-06
2016-11-24
天津市科技重大专项与工程计划项目(15ZXBFNC00340)
张植元(1992—),男,硕士研究生。E-mail:382402187@qq.com
魏东(1970—),男,副教授。E-mail:wd0528@126.com
