生长调节剂处理对马铃薯贮藏期萌发及氧化酶活性的影响
2017-07-21钟蕾邓俊才王良俊郑顺林豆攀王兴龙袁继超
钟蕾,邓俊才,王良俊,郑顺林,豆攀,王兴龙,袁继超*
(1.农业部西南作物生理生态与耕作重点实验室,四川农业大学农学院,四川 成都 611130;2.四川省眉山市东坡区农业技术推广站,四川 眉山620000)
生长调节剂处理对马铃薯贮藏期萌发及氧化酶活性的影响
钟蕾1,邓俊才1,王良俊2,郑顺林1,豆攀1,王兴龙1,袁继超1*
(1.农业部西南作物生理生态与耕作重点实验室,四川农业大学农学院,四川 成都 611130;2.四川省眉山市东坡区农业技术推广站,四川 眉山620000)
探究生长调节剂对马铃薯贮藏期休眠的调控效果及其生理作用机制,对保障马铃薯安全贮藏和研究马铃薯休眠机制都具有重要意义。本研究以马铃薯中长休眠期品种“川芋117”和短休眠期品种“费乌瑞它”为供试材料,赤霉素(gibberellin A3, GA3)、氯苯胺灵(chlorpropham, CIPC)和脱落酸(abscisic acid, ABA)为供试试剂,研究不同作用类型生长调节剂处理对不同马铃薯品种贮藏期块茎萌发动态及不同部位氧化酶活性的影响。结果表明,GA3促进马铃薯的萌发主要表现在缩短块茎的萌发期上,“川芋117”和“费乌瑞它”较对照(control, CK)分别缩短10.42%和26.92%。而ABA和CIPC抑制马铃薯的萌发表现在延长其萌发期上,在“川芋117”上分别较CK延长10.42%和106.25%,在“费乌瑞它”上ABA处理延长23.08%,CIPC处理块茎未发芽。且ABA处理能显著降低休眠幅度,“川芋117”和“费乌瑞它”休眠幅度分别降低17.95%和29.41%,块茎萌发较整齐。马铃薯块茎在贮藏期芽周和薯肉部位的多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性均呈先升高后降低的变化趋势,其峰值出现的时间与其开始大量发芽的时期基本一致,表明PPO和POD活性的升高是块茎解除休眠开始萌芽的生理基础之一。GA3、ABA和CIPC处理显著影响块茎芽周和薯肉PPO和POD活性,其中GA3主要提高块茎芽周部位的PPO和POD活性,CIPC和ABA有降低未发芽块茎芽周和薯肉PPO活性的趋势,但ABA处理在块茎休眠解除过程中氧化酶活性上升,特别是“川芋117”,这可能是GA3打破休眠促进萌发、CIPC和ABA延长休眠的生理机制之一。
生长调节剂;马铃薯;贮藏期;萌发;氧化酶活性
马铃薯(Solanumtuberosum)块茎作为繁殖器官和营养器官,其贮藏是马铃薯产业链中的重要环节,不适当的贮藏会导致块茎变青、发芽、腐烂、缩水等,严重影响其经济价值。发芽是马铃薯贮藏中最常见的问题之一,抑制马铃薯的萌发对马铃薯的安全贮藏具有重要意义[1]。然而,在生产中为满足不同播期的需要,又要求适时适度的打破或延长马铃薯的休眠,因此马铃薯的休眠调控对马铃薯产业具有重要意义[2]。生长调节剂是一类在较低浓度下即可对植物的生长发育表现出促进或抑制作用的有机物质,将其处理贮藏期的马铃薯能直接作用于块茎,调控块茎在贮藏过程中的系列生理活动,进而调控块茎的休眠和萌发,其处理具有高效、直接与节约成本的特点[3-4]。赤霉素(gibberellin A3, GA3)是有效的马铃薯促芽剂,研究表明0~100 mg/L浓度处理马铃薯整薯均能促进马铃薯休眠的解除并刺激芽的生长,但不同块茎对处理浓度的响应不一[5-7]。氯苯胺灵(chlorpropham, CIPC)是高效抑芽剂,其对马铃薯的抑芽率可高达95%以上[8],由于其抑制幼芽细胞的有丝分裂,使萌动的芽很难发芽生长,因此不利于种薯的贮藏保鲜[9]。脱落酸(abscisic acid, ABA)是诱导休眠的正调控因子,已有研究表明低浓度的外源ABA处理可以有效推迟洋葱(Alliumcepa)鳞茎、葡萄(Vitisvinifera)和苹果(Maluspumila)枝条芽的萌发[10-11],但将其作为外源的马铃薯抑芽剂却鲜有研究。
活性氧产生和清除的平衡对植物维持正常生长、代谢及应答环境的胁迫有着重要作用,多酚氧化酶(polyphenol oxidase, PPO)和过氧化物酶(peroxidase, POD)均是催化多底物的多功能酶,PPO在高等植物中是良好的活性氧清除剂,POD在植物中与超氧化物歧化酶、过氧化氢酶相互协调配合,通过活化抗氧化系统清除机体内过剩的自由基,对保障正常的生理活动有着重要作用[12-13]。且PPO与POD酶促反应的主要结果是导致褐变与黑化,马铃薯块茎褐变会严重影响产品的营养、风味及外观品质[14-15]。PPO作为呼吸作用的末端氧化酶在生理代谢活动中起重要作用[16]。POD具有氧化分解吲哚乙酸(indoleacetic acid, IAA)的功能,其活性与IAA含量呈反比[17]。分子生物学研究表明,IAA与ABA协同作用促进种子的休眠[18-19]。深入研究马铃薯块茎在贮藏过程中不同部位PPO与POD活性变化规律可揭示其休眠与萌发的部分生理机制,为马铃薯休眠调控提供理论依据。虽然GA3和CIPC打破和延长马铃薯休眠的作用已分别有大量的研究报道,但二者的作用生理机制不同,亦鲜见GA3、CIPC和ABA处理影响马铃薯休眠的比较研究。本研究分别以中长休眠期品种“川芋117”与短休眠期品种“费乌瑞它”为材料,比较研究3种生长调节剂处理对马铃薯块茎的萌芽动态、芽周和薯肉PPO和POD活性动态变化的影响,以期为马铃薯块茎休眠的调控提供技术指导和理论依据。
1 材料与方法
1.1 供试材料与试剂
供试马铃薯材料为西南地区主推中长休眠期品种“川芋117”与短休眠期品种“费乌瑞它”的生产种;供试试剂GA3(有效成分含量≥90.0%)和ABA(有效成分含量≥99.0%)均由成都科龙化工试剂厂生产,氯苯胺灵乳油(有效成分含量为30.0%)为甘肃省农业科学院农产品贮藏加工研究所研制。
1.2 试验方法
两个品种的马铃薯均于2014年12月底播种,于2015年4月底收获,收获后挑选出外观完好、无病害、质量为(50±5) g的块茎,将其清洗干净后平均分成4份平铺置于通风避光处晾干,放置15 d(块茎表皮木栓化后)后分别用15 mg/L的GA3、稀释200倍的CIPC乳油(CIPC浓度为1.5 g/L)、4 mg/L的ABA浸泡处理30 min后取出避光晾干、贮藏,以清水浸泡为对照。每处理6个重复,每重复60个薯块,将处理好的薯块装盒放在阴凉通风处(贮藏温度为18~24 ℃,相对湿度为85%~98%)。固定3个重复在处理后每天观察并记录出芽情况,另外3个重复在处理后每14 d进行一次取样测定PPO和POD活性,直至完全发芽后结束。取样方法为:分别随机取发芽和未发芽的薯块若干,用直径1 cm的打孔器从顶芽处垂直打孔,取顶端向内5 mm为芽周部位,再向内1.5 cm取5 mm为薯肉部位,两个部位的材料分别加液氮研磨至粉末状,-80 ℃冰箱保存备用。
1.3 测定项目与方法
1.3.1 发芽动态相关指标的定义及其计算方法 参考蒲建刚等[20]和刘芳等[21]的方法,测定各处理马铃薯块茎的出芽动态,计算相关指标,具体如下。
1.3.2 PPO活性的测定 取1 g材料加入5 mL预冷的丙酮提取3次,离心去上清液,沉淀物干燥后加入2%聚乙烯吡咯烷酮溶液、 pH=7.3的磷酸缓冲液5 mL,涡旋1 min后在4 ℃、12000 r/min下离心15 min,上清液即为粗酶液。酶活力测定以0.5 mL 50 mol/L的邻苯二酚为底物,将酶液稀释10倍后用紫外分光光度计测定416 nm下的酶促反应液的吸光度变化,酶活力单位定义为单位时间(s)、单位体积(mL)的酶反应液引起的0.01 OD的吸光度变化[22]。
1.3.3 POD活性的测定 取1 g材料加入5 mL预冷的磷酸缓冲液(pH=6.0)涡旋1 min后在4 ℃、4000 r/min下离心10 min,上清液即为粗酶液。取洁净试管2支,于1支中加入3 mL磷酸缓冲液、1 mL愈创木酚溶液和1 mL过氧化氢溶液作为对照,另1支中加入磷酸缓冲液 2.5 mL、愈创木酚溶液1 mL、过氧化氢溶液1 mL和酶液0.5 mL,立即开启秒表记录时间,于分光光度计上测定470 nm下的吸光度值,每隔30 s读数一次,酶活力单位定义如PPO[23]。
1.4 数据处理
用Excel 2007、SPSS 20和Sigma Plot 10.0进行数据分析和作图。
2 结果与分析
2.1 不同生长调节剂对马铃薯休眠程度的影响
不同生长调节剂处理下, 不同休眠期马铃薯品种块茎休眠情况如表1所示。 从表中可看出CK处理长休眠期品种“川芋117”的萌发期、休眠期、休眠强度和休眠幅度分别较短休眠期品种“费乌瑞它”的长84.62%、51.22%、45.00%和14.71%,可见两者在休眠程度上的差异主要体现在萌发期上。促芽剂GA3处理后“川芋117”的萌发期、休眠期、休眠强度和休眠幅度较CK缩短了10.42%、8.06%、9.20%和7.69%,而“费乌瑞它”仅在萌发期上显著减少,较CK缩短26.92%。说明GA3能有效地缩短马铃薯的萌发期,且对短休眠期品种的效果更好,但在对休眠期、休眠强度和休眠幅度的影响上,则对休眠期较长品种的效果更明显。抑芽剂ABA和CIPC都能显著的延长马铃薯块茎的萌发期,在“川芋117”上,ABA和CIPC处理后块茎的萌发期分别较CK长10.42%和106.25%,在“费乌瑞它”上,ABA处理的较CK长23.08%,而CIPC处理的块茎在整个试验阶段均未达到萌发标准。ABA对“川芋117”和“费乌瑞它”块茎的休眠期和休眠强度均无显著影响,但却显著缩短了二者的休眠幅度,“川芋117”和“费乌瑞它”的休眠幅度分别较CK缩短了17.95%和29.41%。CIPC处理下的“费乌瑞它”在整个试验阶段未解除休眠。由上可知,ABA对延长马铃薯休眠期无明显作用,但能显著延长萌发期,且能显著缩短休眠幅度,对短休眠期品种的效果更好,同时也说明其对提高马铃薯萌发整齐度有一定的促进作用;CIPC则能有效地延长马铃薯块茎的休眠期,对块茎的萌发具有极强的抑制作用,适宜于长期贮藏马铃薯块茎。

表1 不同生长调节剂对马铃薯出芽动态的影响Table 1 Effects of different growth regulators on germination dynamics of different potato cultivars d
注:CK:对照;GA3:赤霉素;ABA:脱落酸;CIPC:氯苯胺灵,下同。同列数据后的不同小写字母表示在P<0.05水平差异有统计学意义(邓肯法检测),“-”表示在该时期块茎没有发芽。
Note: CK: Control; GA3: Gibberellin A3; ABA: Abscisic acid; CIPC: Chlorpropham. The same below. Different lowercase letters in a column show significant difference at the 0.05 probability level (Duncan’s test). “-” shows no tuber sprouted at that time point.
3种生长调节剂处理对马铃薯块茎的萌发过程亦有显著影响,从图1可以看出, GA3、CK和ABA处理下“川芋117”块茎萌芽进程为慢-快-慢,符合逻辑斯蒂函数,“川芋117”发芽率(Y)与处理后天数(x,以观察到开始发芽的前一次观察时间为起点)的回归方程分别为YGA3=100.8630/(1+e-0.2039x+8.4347) (R2=0.9989**),YCK=101.4942/(1+e-0.1753x+8.0162) (R2=0.9981**),YABA=98.6918/(1+e-0.2889x+13.4042) (R2=0.9990**)。GA3和ABA处理的“费乌瑞它”在发芽过程中其发芽率呈线性变化趋势,发芽率(Y)与处理后天数(x)的回归方程分别为YGA3=1.69x(R2=0.9656*),YABA=2.0953x-18.913 (R2=0.9927**),而CK处理的块茎萌芽进程为慢-快-慢,符合逻辑斯蒂函数,回归方程为YCK=102.5262/(1+e-0.1214x+3.3045) (R2=0.9816*) 。

图1 不同生长调节剂对马铃薯贮藏期发芽率变化的影响Fig.1 The sprout percentage change of different potato varieties under different plant regulator treatments during storage
2.2 不同生长调节剂处理对马铃薯贮藏期块茎不同部位PPO活性的影响
由表2和表3可知,马铃薯块茎在贮藏期间芽周和薯肉部位的PPO活性总体均先升高后降低,“川芋117”和“费乌瑞它”不同部位PPO活性分别在处理后28和14 d左右达到最高值,与其开始大量发芽的时间(图1)基本一致(短休眠期品种“费乌瑞它”芽周PPO活性的高峰期略迟于开始发芽时间而与大量发芽时间基本一致)。“川芋117”在发芽以后芽周部位的PPO活性还有一个上升过程(这可能与幼芽PPO活性较高有关),之后又下降,其中薯肉到达峰值的时间晚于芽周。各生长调节剂对短休眠期品种“费乌瑞它”贮藏期块茎不同部位PPO活性的影响与长休眠期品种“川芋117”有所不同。“川芋117”芽周各时期的平均PPO活性是薯肉的2.20~2.89倍,而“费乌瑞它”则为3.14~4.40倍,“川芋117”薯肉PPO活性较芽周变化的幅度较“费乌瑞它”小,这可能与其休眠期长短有关。从品种来看,短休眠期品种“费乌瑞它”的PPO活性较长休眠期品种“川芋117”低,特别是薯肉部位,这可能是其基因型效应,抑或也与其休眠期长短有关。
注:S: 发芽;NS: 未发芽。数据为3次重复的平均值±标准差。同行数据后不同字母表示处理间有显著差异(P<0.05),“-”表示在该时期块茎因几乎全部未发芽或发芽,因而没有测定酶活。下同。
Note: S: Sprout; NS: Non-sprout. Data are shown in mean±SD of three replicates. Different letters after values in a row indicate significant differences among treatments atP<0.05. “-” shows no determination of enzyme activity because almost all the tubers sprouted or non-sprouted at that time point. The same below.
在整个贮藏期,GA3处理下不同品种马铃薯未发芽块茎芽周部位平均PPO活性均高于抑芽剂处理。在“川芋117”上,促芽剂GA3处理块茎自处理至28 d后酶活的升高幅度为63.56%,高于ABA处理(42.08%)。抑芽剂CIPC处理块茎芽周部位的PPO活性在贮藏期的活性最低且变化幅度小。各处理发芽块茎芽周部位PPO活性均呈逐渐降低的变化趋势,其中ABA处理活性最高且变化幅度大,至处理结束时,ABA和GA3两处理酶活分别降低31.68%、34.11%。在整个贮藏期,ABA处理块茎薯肉部位的平均PPO活性高于GA3和CIPC处理,但均低于CK。各生长调节剂处理下的“费乌瑞它”未发芽块茎芽周部位酶活性在处理前期(0~28 d)的上升幅度表现为ABA(70.38%)>CIPC(54.00%)>GA3(51.44%)>CK(21.30%)。GA3、CK和CIPC处理未发芽块茎薯肉部位的酶活性均呈先上升后降低的变化趋势,而ABA处理则持续升高,上升幅度表现为ABA(93.70%)>GA3(59.11%)>CK(10.81%)>CIPC(6.46%)。GA3和CK处理下发芽块茎芽周和薯肉部位酶活性均呈先上升后降低的变化趋势,而ABA处理下的酶活性则呈逐渐降低的变化趋势,芽周部位PPO活性的降低幅度表现为ABA(19.04%)>GA3(18.24%)>CK(11.69%),而薯肉部位则表现为CK(26.61%)>ABA(20.97%)>GA3(9.79%)。

表3 生长调节剂处理下“费乌瑞它”贮藏期块茎不同部位多酚氧化酶(PPO)活性Table 3 The polyphenol oxidase (PPO) activity of “Favorita” under different plant regulator treatments at different storage time points 0.01A/(g·s)
2.3 不同生长调节剂处理对马铃薯贮藏期块茎不同部位POD活性的影响
与PPO活性变化一样,在整个贮藏过程中各生长调节剂处理块茎芽周和薯肉部位的POD活性总体均先升后降,但峰值出现的时间较PPO的早(表4和表5)。其中“川芋117”未发芽块茎不同部位的POD活性在萌发期后均有一个上升过程,但“费乌瑞它”则不明显。两品种贮藏各时期薯肉POD活性均低于芽周,“川芋117”芽周各时期的平均POD活性是薯肉的3.40~4.58倍,而“费乌瑞它”则为5.45~9.94倍,差异较PPO活性的大。从品种来看,“费乌瑞它”薯肉的POD活性与“川芋117”差异不大,但其芽周的POD活性则明显高于“川芋117”,平均高88.75%。生长调节剂对两品种芽周和薯肉的POD活性也有一定影响,特别是芽周。
由表4和表5可见,GA3有提高两品种未发芽块茎芽周部位POD活性的作用,“川芋117”和“费乌瑞它”GA3处理块茎芽周部位各测定时期平均POD活性分别较对照提高10.09%和19.69%。GA3处理能提前“川芋117”未发芽块茎薯肉部位POD活性高峰的出现,不同处理下“川芋117”未发芽块茎薯肉部位POD活性[0.01 A/(g·s)]表现为CK(1.26)>ABA(1.18)>CIPC(1.12)=GA3(1.12),而发芽块茎薯肉部位POD活性则表现为ABA(1.53)>CK(1.34)>GA3(1.20)。可见GA3不但未明显提高甚至还有降低薯肉POD活性的趋势,亦未观察到CIPC和ABA明显降低芽周POD活性的作用。各处理下“费乌瑞它”未发芽块茎芽周部位POD活性变化规律与“川芋117”有所不同,其中GA3、CIPC和CK处理下的酶活性呈先升高后降低的变化趋势,在后期并未再次升高,其酶活性的最高值均出现在处理后第14天,而ABA处理则表现为持续上升趋势。各处理发芽块茎芽周部位POD活性均呈逐渐降低的变化趋势,降低幅度表现为CK(58.04%)>GA3(53.51%)>ABA(36.90%)。“费乌瑞它”发芽和未发芽块茎薯肉部位POD活性变化规律同芽周部位,各处理未发芽块茎在整个贮藏过程中平均酶活性[0.01 A/(g·s)]高低表现为CK(1.39)>ABA(1.25)>CIPC(1.11)>GA3(1.07),而各处理发芽块茎薯肉部位的平均酶活性[0.01 A/(g·s)]高低表现为ABA(1.49)>CK(1.45)>GA3(1.12),ABA处理酶活性最高但变化幅度最小。

表4 不同生长调节剂处理下“川芋117”贮藏期块茎不同部位过氧化物酶(POD)活性Table 4 The peroxidase (POD) activity of “Chuanyu 117” under different plant regulator treatments at different storage time points 0.01A/(g·s)
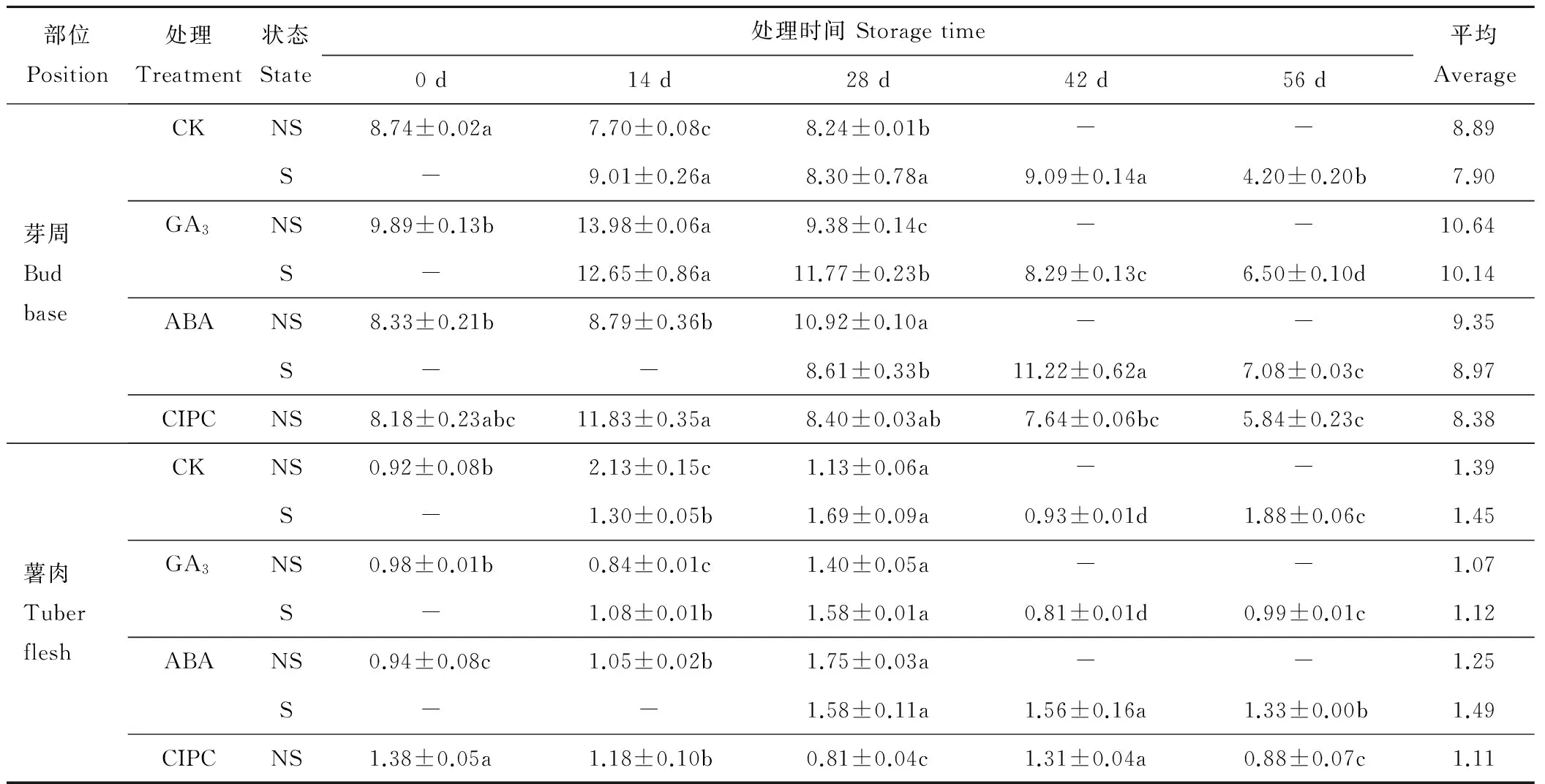
表5 不同生长调节剂处理下“费乌瑞它”贮藏期块茎不同部位过氧化物酶(POD)活性Table 5 The peroxidase (POD) activity of “Favorita” under different plant regulator treatments at different storage time points 0.01A/(g·s)
3 讨论
3.1 生长调节剂对马铃薯休眠动态的影响
马铃薯是以块茎为收获对象的高产作物,植物生长调节剂的应用可以有效降低块茎的贮藏成本,并提高贮藏品质[24]。对马铃薯进行多方位的化学调控研究对马铃薯适应多方面生产加工,提高马铃薯制品的竞争力具有重要意义[25]。不同生长调节剂因其作用机制不同,对块茎休眠生理活性的调节方式不同,最终表现出对贮藏期休眠调控效果的差异[26-28]。GA3广泛用于马铃薯种薯促芽生产方面,已有研究发现GA3有推进碳水化合物代谢及促进细胞分裂素活性的作用,能引起淀粉分解和糖向芽体的转运供能,并促进细胞伸长,促进萌发[29]。CIPC作为高效抑芽剂,通过影响细胞有丝分裂过程中纺锤体的形成干扰细胞分裂的发生从而抑制芽的萌发[30],广泛用于马铃薯商品薯的贮藏保鲜,因此ABA作为新型种薯抑芽剂的研究具有重要意义。在本研究中,GA3处理能有效地提前解除马铃薯的休眠,缩短块茎的休眠幅度。而ABA处理能有效地延长马铃薯的休眠,缩短休眠幅度,提高块茎萌发的整齐度。CIPC处理后“费乌瑞它”的抑芽率高达100%,“川芋117”在处理后70 d才开始迅速萌发。这些结果表明低浓度的促芽剂GA3和抑芽剂ABA、CIPC处理均能有效地调控马铃薯的休眠,且各处理对短休眠期品种的作用强于长休眠期品种,因此在实际生产中,其中GA3可以用于播种前打破休眠,促进种薯快速萌芽出苗;CIPC可用于延长商品薯的休眠期,避免其萌芽而影响品质,但因其作用强烈而不适于种薯;ABA有一定延长休眠的作用,但延长时间有限,休眠期结束后仍能迅速且整齐地发芽,因此可用于种薯延长贮藏期,但其作为外源抑芽剂方面的研究很缺乏,其最佳使用浓度和方法尚有待进一步研究。
3.2 生长调节剂对马铃薯块茎氧化酶活性的影响
收获后的马铃薯块茎在休眠期仍进行着较低水平的生理活动,酶作为生理代谢过程中的催化剂,其活性变化反映着生理代谢活动的强弱。有研究表明马铃薯块茎在休眠解除过程中淀粉酶、淀粉磷酸化酶、蛋白酶等酶活性逐渐升高,为休眠芽萌发的物质转运提供了基础[31-32],但鲜见芽休眠与萌芽过程中PPO和POD活性变化方面的研究报道。PPO是生物体内一种重要的酶,参与到叶绿体和线粒体中的电子传递过程中,可作为判别植株代谢活性强弱的生理指标之一[33-34]。POD是广泛存在于植物中的多功能酶,是调控块茎休眠与萌发生理代谢的关键酶之一。夏宜平等[35]的研究表明POD在百合(Liliumbrowniivar.viridulum)鳞茎休眠解除过程中活性的降低与自由基伤害的减少有关,POD与碳水化合物结合成糖基化蛋白,避免蛋白酶降解以稳定蛋白构象,是植株或器官成熟与衰老的标志[36]。本试验中,贮藏前期块茎不同部位POD和PPO保持较高活性有利于其适应不利环境,减少过氧化物及自由基的积累,保护芽体免于损害,并有可能促进芽体的伸长与萌发[37]。生长调节剂在一定程度上影响马铃薯块茎的PPO和POD活性,不同生长调节剂处理的马铃薯块茎在贮藏期间芽周和薯肉的PPO和POD活性均先升高后降低,在块茎开始大量萌发前后达到峰值,之后出现下降,而POD活性的峰值约早于PPO。其中GA3有提高PPO和POD活性的趋势,特别是芽周部位,GA3处理后块茎芽周部位的PPO活性高且上升幅度大,表明GA3处理能促进块茎在整个贮藏过程中芽周部位的代谢强度,与Alexopoulos等[38]的研究结果相一致。发芽块茎芽周部位POD活性高,薯肉部位PPO及POD活性较CK低且变化幅度小,表明经GA3处理的块茎作种薯用时应在处理后适时播种以保障良好的田间出苗质量。CIPC和ABA有降低未发芽块茎不同部位PPO活性的趋势,表明抑芽剂处理能有效降低处于休眠状态块茎的生理活性,降低能量消耗,提高块茎休眠期的贮藏品质,但ABA处理块茎在休眠解除后萌发迅速,氧化酶活性升高,生理代谢活动加强,具有较强的种薯活力。各处理块茎氧化酶活性变化在长休眠期品种“川芋117”上表现较明显,氧化酶活性变化可能是GA3打破休眠促进萌发、CIPC和ABA延长休眠的生理机制之一。由于本试验取样测定的间隔时期较长(为14 d),只观察到GA3、CIPC和ABA处理后PPO和POD活性高低的变化,未发现其峰出现时期的明显差异,对此还需要作进一步研究,另外PPO和POD活性影响马铃薯块茎休眠与萌芽的生理机制也尚需进一步探讨。
4 结论
不同调控效果的生长调节剂处理木栓化完全的不同休眠期马铃薯品种块茎,对其休眠的影响主要体现在萌发期的延长或缩短上,且对短休眠期品种效果强于长休眠期品种。GA3处理提前解除块茎的休眠并缩短休眠幅度,但该处理主要促进整个贮藏期芽周部位氧化酶活性的升高,薯肉部位酶活性低且变化幅度小。表明GA3处理后能迅速增强芽周部位的代谢活动,主要刺激该部位大分子营养物质的分解与向芽体的转运供能,且GA3能促进细胞伸长,芽体生长速度快但较纤弱,因此GA3处理的种薯解除休眠后应尽快栽种,并适当增加田间底肥用量以培育壮苗。ABA处理显著延长块茎的休眠期,在贮藏前期生理代谢活性较弱,而贮藏后期块茎萌发迅速,芽周和薯肉部位的酶活性均显著增强,表明ABA处理能刺激马铃薯发芽后整薯的生理活性,促进整薯能量物质向芽体的转运,芽体质量高,有望培育壮苗,是优质的种薯抑芽剂。而CIPC抑芽效果强,能有效降低块茎休眠期的生理活性,因此在保鲜商品薯方面具有重要意义。
References:
[1] Rutolo M F, Lliescu D, Clarkson J P. Early identification of potato storage disease using an array of metal-oxide based gas sensors. Postharvest Biology and Technology, 2016, 116: 50-58.
[2] Zhong L, Deng J C, Wang L J,etal. Effect of different growth regulators on germination and main carbon-nitrogen metabolites contents during the storage period of potato tuber. Journal of Zhejiang University: Agriculture and Life Science, 2016, 42(1): 81-88. 钟蕾, 邓俊才, 王良俊, 等. 生长调节剂对马铃薯贮藏期出芽及主要碳氮代谢物质含量的影响. 浙江大学学报: 农业与生命科学版, 2016, 42(1): 81-88.
[3] Duan L S, Tian X L. Crop Chemical Control Principle and Technology[M]. Beijing: China Agriculture University Press, 2005: 1-3. 段留生, 田晓莉. 作物化学控制原理与技术[M]. 北京: 中国农业大学出版社, 2005: 1-3.
[4] Mao J Y, Yan Z L. Plant Growth Regulator Control Principle and Practical Technology[M]. Beijing: China Agriculture Press, 2005. 毛景英, 闫振领. 植物生长调节剂调控原理与实用技术[M]. 北京: 中国农业出版社, 2005.
[5] Salimi K, Afshari R T, Hosseini,etal. Effects of gibberellic acid and carbon disulphide on sprouting of potato minitubers. Scientia Horticulturae, 2010, 124: 14-18.
[6] Guo C H, Sha B C, Yu Y. Effects of gibberellin breaking potato dormancy on potato growth and yield. Chinese Potato Journal, 2003, 17(6): 336-337. 郭华春, 沙本才, 余杨. 赤霉素打破种薯休眠对马铃薯生长及产量的影响. 中国马铃薯, 2003, 17(6): 336-337.
[7] Lascarides D K. Shortening the dormancy of period spring-grown seed potatoes for midsummer planting. Potato Research, 1967, 10: 100-107.
[8] Mary J F, Nora L O. The effect of chlorpropham exposure on field-grown potatoes. American Journal of Potato Research, 2015, 92: 32-37.
[9] Castillo D G, Cruz E, Iguaz A,etal. Effects of essential oils on sprout suppression and quality of potato cultivars. Postharvest Biology and Technology, 2013, 86: 15-21.
[10] Chen Q B, Hou X L, Wang J J,etal. Effect of exogenous abscisic acid on the dormancy of onion (Alliumcepa). Journal of Nanjing Agricultural University, 2007, 30(1): 30-33. 陈沁滨, 侯喜林, 王建军, 等. 外源脱落酸对洋葱鳞茎休眠的影响. 南京农业大学学报, 2007, 30(1): 30-33.
[11] Li S X, Dami I E. Responses ofVitisvinifera‘Pinot gris’ grapevines to exogenous abscisic acid (ABA): yield, fruit quality, dormancy, and freezing tolerance. Journal of Plant Growth Regulation, 2016, 35(1): 245-255.
[12] Xue X, Zhang Q, Wu J X. Research of reactive oxygen species in plants and its application on stress tolerance. Biotechnology Bulletin, 2013, 10: 7-10. 薛鑫, 张芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013, 10: 7-10.
[13] Wang Q G, Cao Y, Zhou L L,etal. Effects of postharvest curing treatment on flesh colour and phenolic metabolism in flesh-cut potato products. Food Chemistry, 2015, 169: 246-254.
[14] Gui F Q, Wu J H, Chen F,etal. Change of polyphenol oxidase activity, color, and browning degree during storage of cloudy apple juice treated by supercritical carbon dioxide. European Food Technology, 2006, 223: 427-432.
[15] Cano M P, Ancos B, Lobo M G,etal. Improvement of frozen banana (Musacavendishiicv. Enana) colour by blanching: relationship between browning, phenols and polyphenol oxidase and peroxidase activities. European Food Research and Technology, 1997, 204(1): 60-65.
[16] Dai L, Gong C R, Shi L,etal. Polyphenol oxidase in plants. Chinese Agricultural Science Bulletin, 2007, 23(6): 312-316. 代丽, 宫长荣, 史霖, 等. 植物多酚氧化酶研究综述. 植物生理科学, 2007, 23(6): 312-316.
[17] Shu K, Liu X D, Xie Q,etal. Two faces of one seed: hormonal regulation of dormancy and germination. Molecular Plant, 2016, 9(1): 34-42.
[18] Shuai H W, Meng Y J, Luo X F,etal. The roles of auxin in seed dormancy and germination. Hereditas (Beijing), 2016, 38(4): 314-322. 帅海威, 孟永杰, 罗晓峰, 等. 生长素调控种子的休眠与萌发. 遗传, 2016, 38(4): 314-322.
[19] Liu F, Li D D, Lian H,etal. Relationship between dormancy breaking and protective enzymes in refrigeratedLiliumpumilumbulbs. Acta Prataculturae Sinica, 2015, 24(12): 180-187. 刘芳, 李丹丹, 廉华, 等. 细叶百合冷藏过程中鳞茎保护酶活性与休眠解除的关系. 草业学报, 2015, 24(12): 180-187.
[20] Pu J G, Sun L X, Pei J W,etal. A preliminary report on the study of the dormancy breaking of the mini-potato’s breeder’s seed of virus-free potato. Gansu Agricultural Sciences and Technology, 1999, 7: 13-14. 蒲建刚, 孙林祥, 裴建文, 等. 脱毒马铃薯微型薯原原种打破休眠试验研究初报. 甘肃农业科技, 1999, 7: 13-14.
[21] Liu F, Yang Y J, Dong D F,etal. Study on dormancy characteristics of potato with different generations and weight. Shandong Agricultural Sciences, 2011, 11: 32-34. 刘芳, 杨元军, 董道峰, 等. 马铃薯不同代数和块茎大小休眠特性的研究. 山东农业科学, 2011, 11: 32-34.
[22] Bi Y F, Jiang R F, Liu W W,etal. Study on a new method for extracting polyphenol oxidase compared with conventional methods. Journal of Anhui Agricultural Science, 2013, 41(22): 9418-9420. 毕云枫, 姜仁凤, 刘薇薇, 等. 一种多酚氧化酶提取新方法与几种常规方法的比较研究. 安徽农业科学, 2013, 41(22): 9418-9420.
[23] Wang S Y, Jiao H J, Miklos F. Changes in the activities of catalase, peroxidase, and polyphenol oxidase in the apple buds during bud break induced by thidiazuron. Journal of Plant Growth Regulation, 1991, 10: 33-39.
[24] Lai G Y, Zhao J R, Yao M S. Effect of four plant growth regulators on the production and quality of potato. Journal of Shanxi Agricultural University, 2003, 23(3): 295-297. 来改英, 赵晋蓉, 姚满生. 四种植物生长调节剂对马铃薯产量和质量的影响. 山西农业大学学报, 2003, 23(3): 295-297.
[25] Zhang X, Wang X. The plant growth regulator research present situation and progress in the potato field’s application. Anhui Agricultural Science Bulletin, 2006, 12(13): 61-63. 张巽, 王鑫. 植物生长调节剂的研究现状及其在马铃薯田的应用进展. 安徽农学通报, 2006, 12(13): 61-63.
[26] Xiang H T. Effects of Three Plant Growth Regulators on Carbon Metabolism Physiology, Yield and Quality of Potato[D]. Daqing: Heilongjiang Bayi Agricultural University, 2013: 1-2. 项洪涛. 三种植物生长调节剂对马铃薯碳代谢生理及产量品质的影响[D]. 大庆: 黑龙江八一农业大学, 2013: 1-2.
[27] Aksenova N P, Sergeeva L I, Konstantinova T N,etal. Regulation of potato tuber dormancy and sprouting. Russian Journal of Plant Physiology, 2013, 60(3): 301-312.
[28] Yang B Y, Lian Y, Zhang M H,etal. Dynamic changes of several endogenous hormones during dormancy of potatoes. Chinese Potato Journal, 2004, 18(6): 321-325. 杨柏云, 连勇, 章敏华, 等. 马铃薯休眠阶段中内源激素变化的研究. 中国马铃薯, 2004, 18(6): 321-325.
[29] Alexopoulos A A, Akoumianakis K A, Vemmos S N,etal. The effect of post-harvest application of gibberellic acid and benzyl adenine on the duration of dormancy of potatoes produced by plants grown from TPS. Postharvest Biological Technology, 2007, 46: 54-62.
[30] Kleinkopf G E, Oberg N A, Olsen N L. Sprout inhibition in storage: current status, new chemistries and natural compounds. American Journal of Potato Research, 2003, 80: 317-327.
[31] Sergeeva L I, Claassens M M, Jamar D C L,etal. Starch-related enzymes during potato tuber dormancy and sprouting. Russian Journal of Plant Physiology, 2012, 59(4): 556-564.
[32] Takahashi M, Hikage T, Yamashita T,etal. Stress-related proteins are specifically expressed under non-stress conditions in the overwinter buds of the gentian plantGentianatriflora. Breeding Science, 2006, 56(1): 39-46.
[33] Cheema S, Sommerhalter M. Characterization of polyphenol oxidase activity in Ataulfo mango. Food Chemistry, 2015, 171: 382-387.
[34] Lei D F, Jiang D Z, Wang Y L. Physiological and biochemical characteristic of tobacco polyphenol oxidase and control way for its activity. Journal of Xi’an Jiaotong University, 2003, 37(12): 1316-1320. 雷东锋, 蒋大宗, 王一理. 烟草中多酚氧化酶的生理生化特征及其活性控制的研究. 西安交通大学学报, 2003, 37(12): 1316-1320.
[35] Xia Y P, Huang C H, He G F,etal. Changes of carbohydrates metabolism and enzymes activities in low temperature storage for buds ofLiliumorientalhybrids. Acta Horticulturae Sinica, 2006, 33(3): 571-576. 夏宜平, 黄春辉, 何桂芳, 等. 东方百合鳞茎冷藏解除休眠的养分代谢和酶活性变化. 园艺学报, 2006, 33(3): 571-576.
[36] Li G, Xu F J, Jiang S S,etal. Effects of aluminum on hydrogen peroxidase content and cell wall-bound peroxidase activity in wheat root tips. Plant Nutrition and Fertilizer Science, 2010, 16(4): 887-892. 李刚, 徐芳杰, 蒋思丝, 等. 铝对小麦根尖细胞壁过氧化物酶活性和过氧化氢含量的影响. 植物营养与肥料学报, 2010, 16(4): 887-892.
[37] Ben Mohamed H, Vadel A M, Geuns J M C,etal. Effects of hydrogen cyanamide on antioxidant enzymes’ activity, proline and polyamine contents during bud dormancy release in superior seedless grapevine buds. Acta Physiologiae Plantarum, 2012, 34(2): 429-437.
[38] Alexopoulos A A, Aivalakis G, Akoumianakis K A,etal. Effect of gibberellin acid on the duration of dormancy of potato tubers produced by plants derived from true potato seed. Postharvest Biology and Technology, 2008, (49): 424-430.
Effect of plant growth regulators on germination and oxidase activity during storage of potato tubers
ZHONG Lei1, DENG Jun-Cai1, WANG Liang-Jun2, ZHENG Shun-Lin1, DOU Pan1, WANG Xing-Long1, YUAN Ji-Chao1*
1.KeyLaboratoryofCropEcophysiologyandFarmingSysteminSouthwestofChina,MinistryofAgriculture,CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu611130,China; 2.AgriculturalExtensionStationofDongpoDistrictofMeishanCityinSichuan,Meishan620000,China
Studies on the effects of plant growth regulators on potato tubers during storage are important both for storing potatoes safely and for understanding the mechanisms of potato dormancy. In this research, the mid-to-longterm dormancy potato cultivar “Chuanyu 117” and the short-term dormancy cultivar “Favorita” were used as the experimental materials. Potato tubers were treated with three plant growth regulators: gibberellin A3(GA3), chlorpropham (CIPC), or abscisic acid (ABA) for 30 min. Then, tuber germination and the oxidase activity in tuber flesh and bud bases were evaluated during storage. The results showed that GA3shortened the germination time of “Chuanyu 117” and “Favorita” by 10.42% and 26.92%, respectively, compared with that in the control (CK). In contrast, ABA and CIPC prolonged the germination time of “Chuanyu 117” by 10.42% and 106.25% respectively, compared with that in the CK. The germination time of “Favorita” treated with ABA was prolonged by 23.08% compared with that in the CK, and the tubers treated with CIPC did not sprout. Moreover, ABA significantly reduced the dormancy amplitude and led to neat tuber sprouting. The polyphenol oxidase (PPO) and peroxidase (POD) activities in tuber flesh and bud bases from cultivars with different degrees of dormancy increased and then decreased during the storage period. The peak activities of PPO and POD occurred during the bud-burst stage of germination, indicating that increased activity of PPO and POD represented physiological processes involved in the breaking of tuber dormancy and sprouting. The three plant growth regulators significantly affected the PPO and POD activities in bud bases and tuber flesh. The activities of PPO and POD in the bud bases were enhanced by GA3. The activities of oxidases in different parts of non-sprouting tubers were reduced by ABA and CIPC. Application of ABA led to increases in PPO and POD activities during dormancy release, especially in “Chuanyu 117”. These findings reveal some of the physiological mechanisms involved in the breaking of dormancy and acceleration of germination by GA3, and in the prolonging of dormancy by ABA and CIPC.
plant growth regulator; potato; storage period; germination; oxidase activities
10.11686/cyxb2016338
2016-09-06;改回日期:2016-12-29
国家科技支撑计划(2012BAD06B0407)和四川省育种攻关配套项目(2011NZ0098-15-5)资助。
钟蕾(1993-),女,四川大邑人,在读硕士。E-mail:zhonglei1205@163.com
*通信作者Corresponding author. E-mail: yuanjichao5@163.com
http://cyxb.lzu.edu.cn
钟蕾, 邓俊才, 王良俊, 郑顺林, 豆攀, 王兴龙, 袁继超. 生长调节剂处理对马铃薯贮藏期萌发及氧化酶活性的影响. 草业学报, 2017, 26(7): 147-157.
ZHONG Lei, DENG Jun-Cai, WANG Liang-Jun, ZHENG Shun-Lin, DOU Pan, WANG Xing-Long, YUAN Ji-Chao. Effect of plant growth regulators on germination and oxidase activity during storage of potato tubers. Acta Prataculturae Sinica, 2017, 26(7): 147-157.
