醒脑静注射液预处理对七氟烷麻醉小鼠认知功能的影响及其潜在机制研究
2017-07-21薛冰心张邓新邱丽颖吴丹玲
薛冰心,张邓新*,邱丽颖,吴丹玲,张 斌
(1.江南大学无锡医学院,江苏 无锡 214122;2.江南大学医学院附属医院麻醉科,江苏 无锡 214062)
醒脑静注射液预处理对七氟烷麻醉小鼠认知功能的影响及其潜在机制研究
薛冰心1,张邓新2*,邱丽颖1,吴丹玲2,张 斌2
(1.江南大学无锡医学院,江苏 无锡 214122;2.江南大学医学院附属医院麻醉科,江苏 无锡 214062)
目的 探讨醒脑静注射液预处理对七氟烷(sevoflurane)麻醉小鼠认知功能的影响及其潜在机制。方法 用3%七氟烷持续麻醉6 h,模拟七氟烷麻醉的小鼠模型将动物随机分为对照组、模型组、醒脑静组,并于麻醉前2 h分别干预。监测麻醉过程中的血氧饱和度(SPO2)和心率;应用Morris水迷宫实验观察小鼠逃避潜伏期的变化;应用RT-PCR法和免疫印迹法检测大脑海马组织中脑源性神经营养因子(brain derived neurotropic factor,BDNF)的表达水平。结果 监测显示:各组麻醉过程中的SPO2及心率均无统计学差异;Morris水迷宫显示:麻醉后模型组逃避潜伏期显著高于对照组(P<0.01),醒脑静组较模型组显著降低(P<0.05);RT-PCR结果显示:模型组BDNF的mRNA表达水平显著低于对照组(P<0.01),醒脑静组的表达水平较模型组显著升高(P<0.01);免疫印迹法结果与PT-PCR法一致。结论 醒脑静预处理可改善七氟烷麻醉小鼠导致的认知功能障碍,且通过调节BDNF的表达发挥作用。
醒脑静;七氟烷;认知功能;脑源性神经营养因子;Morris水迷宫实验
七氟烷作为新型挥发性麻醉药物,广泛应用于麻醉中,特别是小儿麻醉的诱导和维持。但实验研究表明,吸入麻醉药可引起认知功能障碍,甚至诱发神经退行性疾病[1]。醒脑静是在安宫牛黄丸的基础上改制而成的水溶性注射液,在许多神经系统疾病中发挥神经保护作用[2],改善学习记忆功能。目前关于醒脑静对脑损伤患者的保护作用受到国内外广泛关注,但对七氟烷麻醉后认知功能障碍的影响鲜有报道。本文研究醒脑静注射液预处理后对七氟烷麻醉小鼠认知功能的影响并探讨其机制,现报道如下。
1 材料和方法
1.1 实验动物
健康清洁级雄性C57BL/6小鼠(上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002,体质量(22±2)g,鼠龄2月龄。所有动物均维持其生物节律,室温20~25℃,灯光昼夜节律8:00-20:00,自由进食饮水。
1.2 药品及试剂
醒脑静注射液(10 mL/只,无锡济民可信山禾药业有限公司,批号:150502)。吸入用七氟烷(上海恒瑞医药有限公司,批号:14090131)。兔多克隆抗BDNF(英国Abcam公司,ab108319),兔多克隆抗β-Actin(英国Abcam公司,ab6276)。逆转录酶试剂盒(日本 TAKARA 公司,D6110A)。 BDNF、GAPDH引物 (上海生工生物工程股份有限公司)。SYBR Green定量聚合酶链反应PCR反应试剂盒 (美国Invitrogen公司)。
1.3 主要仪器
Morris水迷宫视频分析系统 (北京智鼠多宝生物科技有限责任公司,型号:DB001),多功能监护仪(美国 GE 公司,型号:Datex-Ohmeda S/5),麻醉机(德国Drager公司,型号:Fabius plus),荧光定量PCR 仪(瑞士 Roche公司,型号:Roche480),微量紫外分光光度计(美国Thermo Fisher Scientific公司,型号:NanoDrop 2000),凝胶电泳仪(美国 BIO-RAD公司,型号:PowerPac),凝胶成像系统(美国 BIORAD公司,型号:GelDoxXR),微量移液器(德国Eppendorf公司)。
1.4 分组与干预
24只小鼠按随机数字表法分为对照组、模型组、醒脑静组,每组8只。于每日9:00进行Morris水迷宫定向导航训练,第4天训练结束后实施麻醉,完成造模。对照组:小鼠给予生理盐水10 mL/kg腹腔注射;模型组:小鼠在全麻诱导后给予3%七氟烷持续麻醉6 h,并于麻醉前2 h腹腔注射生理盐水10 mL/kg;醒脑静组:小鼠同模型组麻醉,并于麻醉前2 h腹腔注射醒脑静 10 mL/kg。各组小鼠分别置于自制的有机玻璃麻醉箱(50 cm×40 cm×40 cm)中,麻醉箱一侧孔连接Drager麻醉机对小鼠进行七氟烷吸入麻醉;麻醉机持续通入麻醉箱的O2流量为4 L/min;另一侧孔连接Datex-Ohmeda S/5多功能监护仪,用于测定麻醉箱内七氟烷、O2及CO2浓度。打开挥发罐,待麻醉箱中七氟烷浓度稳定于3.0%后,将模型组、醒脑静组小鼠置入箱中实施麻醉,麻醉时间为6 h。在麻醉箱底布置钙石灰以吸收箱内的CO2。吸入麻醉过程中利用带状脉搏血氧饱和度探头包绕于小鼠尾部上段,同时监测小鼠的血氧饱和度(SPO2)和心率,记录麻醉后5 min时SPO2和心率数据。对照组置于麻醉箱中,不吸入七氟烷,在同一时间点记录SPO2和心率。麻醉过程中通过红外线加热保持小鼠体温。
1.5 空间学习记忆能力的检测
采用Morris水迷宫实验对小鼠空间学习记忆能力进行检测。水池等分为四个象限,在第三象限中央放置平台,并浸没于水平面下1 cm。水池内掺入奶粉,确保平台不可见。每天实验人员将小鼠面向池壁轻放入水中,让其在60 s内寻找平台。若在60 s内未找到平台则逃避潜伏期记为60 s,而后由实验人员引导小鼠上平台并对平台位置进行空间学习记忆30 s,5 min后在新的象限内实施学习检测,每只每日4个象限,共进行5 d[3],记录每天的运动轨迹及逃避潜伏期。
1.6 脑组织标本的处理
各组小鼠于Morris水迷宫空间记忆检测后立即断头取脑,置于预冷的PBS中漂洗后,于冰盘上迅速沿矢状面剖开脑半球,轻轻剥离两侧海马组织,分别装入EP管中,-80℃低温保存。
1.7 脑源性神经营养因子(brain derived neurotropic factor,BDNF)基因的检测
采用逆转录荧光实时定量聚合酶链反应 (RT-PCR)方法测定BDNF的mRNA表达水平。样品处理方法:(1)提取海马组织总 RNA;(2)将 1 μL RNA逆转录获得 cDNA;(3)利用 Primer Ex-press 2.0软件设计引物,由上海生工生物工程股份有限公司合成(见表 1);(4)SYBR-Green 实时荧光定量 PCR(按照SYBR Green Mix 20 μL体系上样:引物1 μL,cDNA 5 μL,ddH2O 4 μL,2 ×SYBR Green Mix 10 μL),设置相应的程序进行反应,得到cp值并进行相对定量处理,计算相关基因的表达倍数。
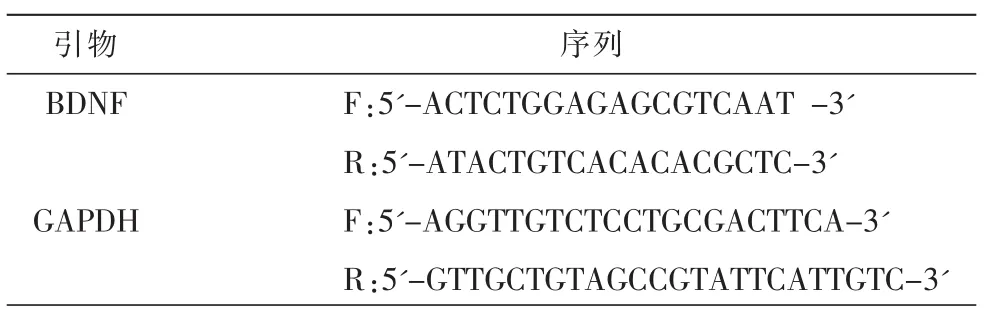
表1待测基因和内参基因引物表
1.8 BDNF蛋白表达水平的检测
采用western blot实验测定BDNF的蛋白表达水平,具体方法:(1)裂解海马组织,离心取上清;(2)变性处理蛋白质样品;(3)经 SDS-聚丙烯酰胺凝胶电泳分离,转移至PVDF膜;(4)经相应的抗体孵育,扫描曝光膜上显色条带并用Image J软件分析处理。
1.9 统计学处理
2 结果
2.1 各组小鼠的SPO2和心率比较
记录模型组和醒脑静组小鼠麻醉后5 min时SPO2和心率数据,以及同一时间点对照组的数据,结果3组小鼠的SPO2和心率差异均无统计学意义(P>0.05),提示七氟烷麻醉不影响小鼠的正常生理机能。见表2。
表2各组小鼠的SOP2和心率的比较 (±s)

表2各组小鼠的SOP2和心率的比较 (±s)
组别对照组模型组醒脑静组n 8 8 8 SOP2/%93.50±4.18 92.37±3.25 93.00±4.96心率/beat·min-1335.10±33.38 346.76±36.31 334.33±38.46
2.2 各组小鼠的逃避潜伏期比较
各组小鼠的潜伏期在第1~4天(麻醉前)均呈逐渐降低的趋势,且每天的结果均无统计学差异(P>0.05),结果见表3。提示造模前各组的空间学习记忆能力无明显差异,其后出现的差异可认为是用药引起。第5天(麻醉后),模型组与对照组相比潜伏期显著增加(P=0.010),醒脑静组与模型组相比潜伏期显著降低 (P=0.034),与对照组相比无统计学差异,结果见图1。提示醒脑静预处理可改善七氟烷麻醉对小鼠空间学习记忆能力的损害。
表3 各组小鼠的逃避潜伏期比较 (±s,s)
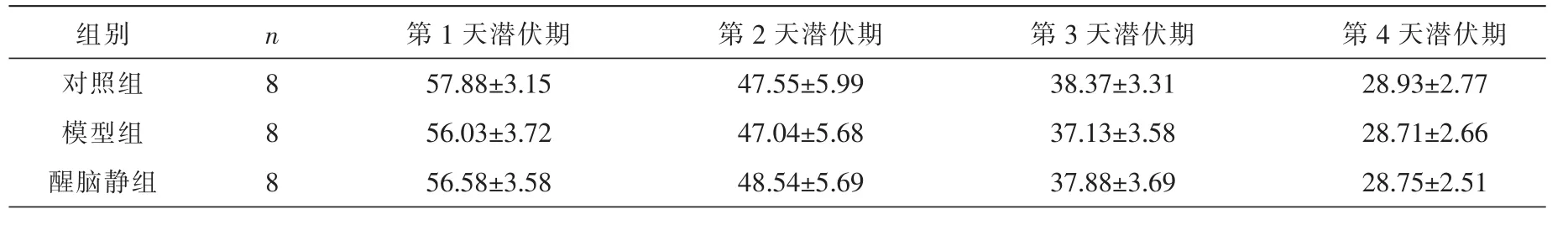
表3 各组小鼠的逃避潜伏期比较 (±s,s)
组别对照组模型组醒脑静组n 88 8第1天潜伏期57.88±3.15 56.03±3.72 56.58±3.58第2天潜伏期47.55±5.99 47.04±5.68 48.54±5.69第3天潜伏期38.37±3.31 37.13±3.58 37.88±3.69第4天潜伏期28.93±2.77 28.71±2.66 28.75±2.51
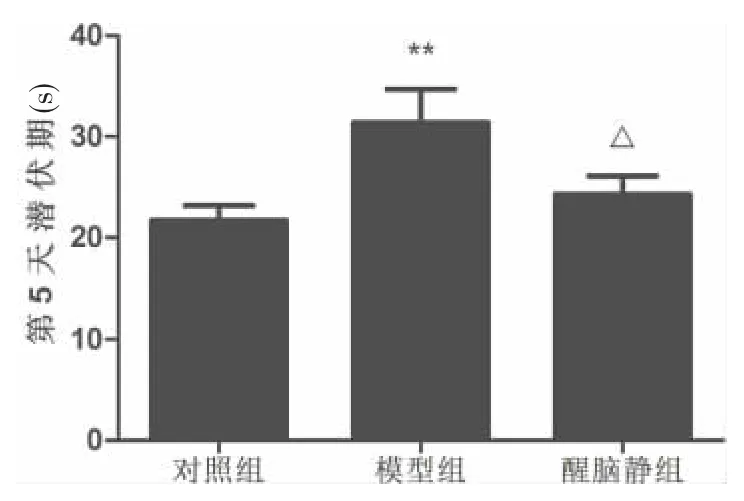
图1各组小鼠麻醉后的逃避潜伏期比较
2.3 各组小鼠海马组织中BDNF表达水平的比较
2.3.1 BDNF的mRNA表达水平 对各组小鼠海马组织进行RT-PCR检测结果分析,发现七氟烷麻醉后BDNF的mRNA表达水平显著下降,醒脑静预处理可改善七氟烷的影响。与对照组相比模型组的表达水平显著降低(P=0.002),与模型组相比醒脑静组的表达水平显著升高(P=0.008),结果见表4。核酸凝胶电泳结果见图2。
表4各组BDNF的mRNA表达水平比较 (±s)

表4各组BDNF的mRNA表达水平比较 (±s)
注:模型组VS对照组,**P<0.01;醒脑静组VS模型组,△△P<0.01。
组别对照组模型组醒脑静组n8 88相对表达量1.03±0.55 0.69±0.79**0.95±0.64△△
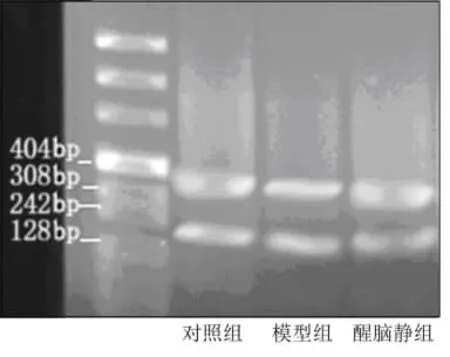
图2各组BDNF的mRNA表达水平比较电泳图
2.3.2 BDNF的蛋白表达水平 对各组小鼠海马组织中BDNF蛋白的表达水平进行组间分析,结果显示七氟烷麻醉后的表达水平出现下降,醒脑静预处理的表达水平升高,恢复正常水平;对结果进行半定量分析,结果表明与对照组相比模型组的灰度值明显降低(P=0.001),与模型组相比醒脑静组的灰度值显著升高(P=0.005),与对照组的表达量无统计学差异(P=0.383),见图 3A-3B。

图3各组BDNF的蛋白表达水平比较
3 讨论
七氟烷作为新型吸入全身麻醉药,具有气道刺激小、诱导和苏醒迅速、体内代谢率低等特点,广泛应用于麻醉的诱导和维持[4]。有关吸入七氟烷导致学习记忆减退的研究已越来越引起人们的重视。学习和记忆是人类和动物赖以生存不可或缺的重要功能[5],多数动物实验结果认为,七氟烷对幼年至老年动物均可造成记忆损伤;发育期大鼠持续暴露于七氟烷6小时可诱导广泛神经退行性疾病,并出现认知功能异常;Wang等[6]报道,幼年大鼠接受2.5%七氟烷麻醉4 h,其成年后海马CA3区树突棘总体密度减少,学习记忆能力降低,认为海马PSD-95蛋白表达降低是其认知功能受损的结构基础。Tian等[7]研究发现,吸入七氟烷可使老年大鼠学习记忆功能减退,其机制与海马β-淀粉样蛋白聚集、激活NF-kappaB信号传导通路有关。
目前,对于麻醉药物引起的认知功能障碍,尚无有效预防和治疗的方法。相关指南侧重于维护围术期内环境的稳定、脑灌注的调节以及阿片类药物的使用时机[8]。醒脑静是在传统中药安宫牛黄丸的基础上改制而成的水溶性注射液,主要含有麝香(7.5 g)、郁金(30 g)、冰片(1 g)、栀子(30 g)。 现代药理研究表明,醒脑静的有效成分易于穿越血脑屏障,直接作用于神经细胞,并能抑制炎症反应和炎症介质的释放,以及清除氧自由基,临床主要用于治疗脑缺血、神经损伤、脑出血、细菌性和病毒性脑膜炎等神经系统疾病[9-10]。药代动力学研究发现,大鼠尾静脉注射醒脑静后,其对大脑的作用迅速 (3~5 min)且相对持久,目前对醒脑静预处理的研究大多是在此基础上进行的[11]。在认知功能方面,有研究证实醒脑静可改善老年大鼠氯胺酮麻醉后的学习记忆能力[12],对麻醉药物诱导的小鼠纹状体神经元凋亡,10 mL/kg的醒脑静可产生较好的保护作用[13]。对于醒脑静是否可以预防七氟烷诱导的认知功能障碍,目前尚无相关报道。本研究探讨醒脑静预处理在七氟烷麻醉中的认知功能的保护作用,并试图阐明这种影响的机制。
BDNF广泛分布于中枢神经系统内,具有防止神经元受损死亡、改善神经元的病理状态、促进受损伤神经元再生及分化等生物效应。研究证实,BDNF是组成某些学习记忆形式的基本要素,其通过调节神经元及突触的结构和功能增强突触可塑性,如诱导长时程增强(LTP),影响依赖海马的认知功能,且空间学习记忆主要通过BDNF介导的信号通路发挥作用。
本研究在Morris水迷宫实验训练阶段 (1~4天),通过剔除差异明显的小鼠保证了七氟烷麻醉前各组小鼠的逃避潜伏期无统计学差异,排除了实验动物自身因素的干扰,故麻醉后逃避潜伏期的不同可以认为是实验用药所引起的。麻醉后模型组逃避潜伏期显著高于对照组,醒脑静组较模型组显著降低并与对照组无统计学差异,表明七氟烷持续吸入可导致小鼠出现空间学习记忆功能障碍,醒脑静预处理可显著改善这一情况,减少小鼠学习记忆功能的缺失,发挥脑保护作用。
本研究中七氟烷麻醉后模型组小鼠海马组织中BDNF的表达水平与对照组相比显著降低,表明七氟烷持续吸入可阻碍BDNF在海马组织中的表达。醒脑静组较模型组显著升高,与对照组相比差异无统计学意义,提示醒脑静预处理可增加BDNF在海马组织中的表达,使其在七氟烷麻醉后达到基本正常的表达水平。同时要注意醒脑静组中BDNF在mRNA表达水平上虽低于对照组,但差异无统计学意义,提示醒脑静并未完全恢复七氟烷诱导的BDNF表达的缺失,可能还存在其他机制作用于BDNF表达的调节。Morris水迷宫检测值与海马组织中BDNF表达水平的测定值变化基本一致,说明两者具有一定相关性。综上所述,醒脑静注射液预处理可通过部分恢复海马组织中BDNF的表达水平,改善七氟烷麻醉对认知功能的影响。
[1]Bin Liu,Yuechao Gu,Hongyan Xiao.et al.Altered metabolomic profiles may be associated with Sevoflurane-induced neurotoxicity in neonatal rats[J].Neurochem Res,2015,40(4):788-799.
[2]Zhoujing Yang,Yingwei Wang,Changlin LI.et al.Pre-treatment with a Xingnaojing preparation ameliorates sevoflurane-in duced neuroapoptosis in the infant rat striatum[J].Molecularmedicine Reports,2015(11):1615-1622.
[3]Patel AD,Gerzanich V,Geng Z,et al.Simard Glibenclamide reduces hippocampal injury and preserves rapid spatial learning in a model of traumatic brain injury[J].J Neuropathol Exp Neurol,2010,69(12):1177-1190.
[4]Paramanik V,Thakur MK.Role of CREB signaling in aging brain[J].Arch Ital Biol,2013,151(1):33-42.
[5]李 状,陈佳雪,罗佳辉,等.饥饿程度对大鼠学习记忆能力影响的实验研究[J].湖南中医药大学学报,2017,37(1):29-32.
[6]Wang SQ,Fang F,Xue ZG,et al.Neonatal sevoflurane anesthesia induces long-term memory impairment and decreases hippocampal PSD-95 expression without neuronal loss[J].Eur Rev Med Pharmacol Sci,2013,17(7):941-950.
[7]Tian Y,Guo S,Wu X,et al.Minocycline alleviates sevoflurane-induced cognitive impairment in aged rats[J].Cell Mol Neurobiol,2015,35(4):585-594.
[8]倪欢欢,何 亮,杨玉玲,等.右美托咪定对小儿七氟醚麻醉术后恶心呕吐及躁动的影响[J].南京医科大学学报,2015,35(9):1308-1310.
[9]Xu P,Du SY,Lu Y,et al.The effect of stroke and other components in Xing-Nao-Jing on the pharmacokinetics of geniposide[J].Ethnopharmacol,2014,152(2):302-307.
[10]Wei G,Chen DF,Lai XP,et al.Muscone exerts neuroprotection in an experimental model of stroke via inhibition of the fas pathway[J].Nat Prod Commun,2012(7):1069-1074.
[11]Lu Y,Du S,Bai J,et al.Bioavailability and brain-targeting of geniposide in gardenia-borneol co-compound by different administration routes in mice[J].Int J Mol Sci,2012,13(11):14127-14135.
[12]温海明,林舜艳,高 巨,等.醒脑静对老年大鼠氯胺酮麻醉后学习记忆的影响及机制[J].广东医学,2012,33(11):1546-1549.
[13]Intlekofer KA,Berchtold NC,Malvaez M,et al.Exercise and sodium butyrate transform a subthreshold learning event into long-term memory via a brain-derived neurotrophic factor-de pendent mechanism[J].Neuropsychopharmacology,2013,38(10):2027-2034.
(本文编辑 杨 瑛)
Effect of Xingnaojing Injection Pretreatment on Cognitive Function and Its Potential Mechanism in Sevoflurane Anesthetized Mouse
XUE Bingxin1,ZHANG Dengxin2*,QIU Liying1,WU Danling2,ZHANG Bin2
(1.Wuxi Medical School,Jiangnan University,Wuxi,Jiangsu 214122,China;2.Department of Anesthesiology,Affiliated Hospital of Wuxi Medical School of Jiangnan University,Wuxi,Jiangsu 214062,China)
ObjectiveTo investigate the effect of Xingnaojing injection pretreatment on cognitive function and its potential mechanism in sevoflurane anesthetized mouse.MethodsMice were anaesthetized with 3%sevoflurane for 6h,and pretreatmented at 2 h before anesthesia.The model mice were randomly divided into the control group,model group and Xingnaojing group.he oxygen saturation (SPO2)and heart rate during anesthesia were monitored.Morris water maze was used to observe the changes of escape latency in mice,RT-PCR and Western blot test were used to detect the expression levels of brain derived neurotrophic factor (BDNF).ResultsThe results showed that there was no significant difference in SPO2and heart rate during anesthesia.After sevoflurane exposure,the escape latency of model group was significantly higher than that of control group(P<0.01),and Xingnaojing group significantly decreased than model group(P<0.05).RT-PCR showed that the mRNA expression level of BDNF in model group was significantly lower than that in control group (P<0.01),and Xingnaojing group was significantly higher than model group(P<0.01).The results of Western blot analysis were in agreement with PT-PCR results.Conclusion Xingnaojing injection pretreatment could improve sevoflurane-induced cognitive impairment in mouse through regulating the expression of BDNF.
Xingnaojing injection;sevoflurane;cognitive function;neurotrophic factor;Morris water maze experiment
R285.5;R338.64
A
doi:10.3969/j.issn.1674-070X.2017.08.004
2016-11-14
无锡市医院管理中心面上项目(YGZXM1502)。
薛冰心,女,在读硕士研究生,研究方向:麻醉药物与认知功能相关性。
* 张邓新,男,副教授,硕士研究生导师,E-mail:zdx095@163.com。
本文引用:薛冰心,张邓新,邱丽颖,吴丹玲,张 斌.醒脑静注射液预处理对七氟烷麻醉小鼠认知功能的影响及其潜在机制研究[J].湖南中医药大学学报,2017,37(8):827-831.
