丛枝菌根真菌的生态分布及其影响因子研究进展
2017-07-20徐天乐陈保冬
向 丹, 徐天乐, 李 欢,陈保冬,*
1 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 2 青岛农业大学资源与环境学院,青岛 266109 3 中国科学院大学, 北京 100049
丛枝菌根真菌的生态分布及其影响因子研究进展
向 丹1,2, 徐天乐1,3, 李 欢2,陈保冬1,3,*
1 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 2 青岛农业大学资源与环境学院,青岛 266109 3 中国科学院大学, 北京 100049
丛枝菌根(arbuscular mycorrhiza, AM)共生体系对于植物适应各种逆境胁迫具有重要积极作用。AM真菌还能够通过根外菌丝网络调节植物群落结构和演替,深刻影响生态系统结构和功能的稳定性。AM真菌生态生理功能的发挥主要取决于其生态适应性,明确AM真菌在不同环境中的多样性、生态适应性以及对各种生态因子的响应机制,是AM真菌资源管理、功能发掘与利用的前提。迄今为止,有关各种生态因子对AM真菌多样性的影响已有不少研究,但是AM真菌生态分布及其形成机制仍缺乏系统的研究和理论分析。综述了生物因子和非生物因子对AM真菌生态分布的影响,结合大型生物空间分布理论探讨了AM真菌生态分布规律和建成机制,分析了当前本研究领域所存在的问题和动向,以期推动相关研究进展。
丛枝菌根真菌;环境因子;驱动因子;生物多样性;生物地理
菌根是由高等植物根系与菌根真菌形成的互惠共生体,而丛枝菌根(AM)是分布最为广泛宿主植物种类最多的菌根类型[1]。AM共生体系对植物生长有诸多有益的生理和生态效应[2- 6],如增强宿主植物对各种逆境胁迫的抵抗力,提高植物的竞争力和成活率;通过根外菌丝网络能够调节植物群落结构和演替,参与生态系统物质循环、能量流动和信息传递,深刻影响生态系统结构和功能的稳定性;促进土壤团聚体形成,提高土壤结构稳定性,有利于水土流失地区的植被恢复。AM真菌生态生理功能的发挥在很大程度上取决于其生态适应性。大量研究表明,AM真菌的种间、生态型之间存在明显的形态、生理和功能差异[7- 10],因此,明确AM真菌在不同生态环境中的多样性、生态适应性以及对各种生态因子的响应机制,是发掘和利用AM真菌资源的前提。迄今为止,关于不同生态因子对AM真菌多样性的影响已有较多研究。本文系统总结了生物因子和非生物因子对AM真菌生态分布的影响,并结合大型生物空间分布理论初步探讨了AM真菌生态分布规律和建成机制,同时分析了当前研究中存在的问题和不足,以期推动相关研究进展。
1 AM真菌物种多样性与生态分布
与植物具有丰富的物种资源相似,由于进化历程和生存环境的差异,AM真菌也具有丰富的物种多样性。Schüßler等[11]通过对广泛真菌类群的18S rRNA序列分析,将AM真菌的分类地位从目提高到门的水平,成立独立的球囊菌门Glomeromycota,包含1纲、4目、7科、9属,建立起了AM真菌的最初分类系统(CABI Bioscience,UK,2004;INVAM,USA,2004)。此后又根据现有AM真菌基因序列(主要为18S rRNA、还包括28s、ITS、β-tubulin基因)更新了分类系统,目前该门已包含11 科18属,共214种(http://www.lrzmuenchen.de/-schuessler/amphylo/amphylo_taxonomy.html). 最近,Redecker 等[12]对 AM真菌的分类系统做了统一划分,形成了1纲4目11科25属的最新分类系统,包括了250个物种。据Borstler等[13]估计,全球范围内AM真菌的种类至少应有1250种。我国迄今已发现 146 种 AM真菌 (约占全球已报道总数的60%),其中包括 13个新种[14]。Öpik等[15]通过数据挖掘和进化分析将公共数据库里的AM真菌SSU序列定义为282个VT (Virtual Taxa,虚拟分类单元),并且稀释曲线分析表明取样强度未达饱和,更多VT有待发掘。Öpik等[16]通过对全球25个位点采集的96种植物的根内AM真菌群落分析,证实了这一推断,发现了 59个新的VT,将全球已记录的AM真菌VT数目推进到341个。
在陆地生态系统中,由于地球陆地表面的气候类型总体呈带状分布,因而与气候类型相对应大型动植物都呈现出明显的地带性和区域性分布特征。土壤也有明显的地带分布特征,但是对于土壤中的微生物而言,其是否具有地带性分布特征仍然存在广泛争议[17- 18]。传统观念认为微生物在世界范围内是随机分布的,群落结构主要受到局域尺度上环境因子的制约[19]。另一种观点则认为,微生物多样性的分布存在生物地理学和宏生态学模式,由局域环境的生态因子、区域的历史过程、生物地理学及进化因子共同控制,即同大型生物一样,存在着大尺度上的地带性分布及局域尺度的非地带性分布[20]。对于AM真菌来说,有关其生态分布格局的研究非常有限。AM真菌与植物形成共生体系,具有紧密的联系,地上植被常可对AM真菌群落产生关键影响, 反之亦然[21- 24]。此外,AM真菌的分布被证明受到各种非生物因子,尤其是土壤环境的影响[25- 26]。
目前关于AM真菌生态分布的研究表明,AM真菌的地理分布十分广泛,几乎遍布于每一陆地板块[27]。迄今为止,几乎所有的纬度地带及生态系统,只要有植被存在,包括北极和受人类严重干扰的地区,都有关于AM真菌的报道[16, 28]。在不同生态系统中,AM真菌多样性表现出明显的差异,Öpik[28]总结了26篇自然生态系统中菌根真菌多样性的文献,发现AM真菌物种数:热带森林>草地>温带森林>人为干扰的环境(农田和污染区)。Treseder[29]的研究表明,温带草原AM真菌丰度是北方针叶林的63倍。刘润进等[30]总结AM真菌多样性相关研究发现,不同生态系统中AM真菌Shannon-Wiener指数存在显著差异,其中污染生态系统中的Shannon-Wiener指数最低(1.67),森林生态系统中最高(2.75)。在全球尺度上,Öpik等[16]通过对6个洲(南极洲除外)的26个样点进行454高通量测序,发现不同大洲和气候带的AM真菌群落组成存在显著差异。Davison[31]等基于1014个植物根部样品对AM真菌在全球尺度下的空间分布格局进行了调查,结果表明虽然在该尺度下AM真菌未形成明显的空间格局,但空间距离对AM真菌的群落组成的产生了重要影响,即扩散限制对AM真菌的地理分布具有重要作用。这一系列的研究结果进一步暗示了AM真菌在全球尺度上可能存在某种特殊的地带性分布特征。然而,想要通过大尺度(比如全球尺度)的野外调查揭示AM真菌地理分布特征是极其艰巨的工作。目前,不同研究者在不同区域和局域尺度研究了AM真菌多样性及其分布特征,为全面揭示AM真菌生态分布规律及其建成机制奠定了一定的基础。
2 影响AM真菌分布的生态因子
目前的研究表明,影响AM真菌生态分布的环境因子可大致可分为非生物因子和生物因子。非生物因子主要分为土壤因子、地理因子和气候因子。土壤因子包括土壤类型、土壤pH值、土壤养分、土壤结构和水分含量等;地理因子包括地理经纬度、海拔;气候因子主要有温度、光照、季节、气候类型等。生物因子如宿主植物及人为干扰(土地利用、放牧等)也会对AM真菌的分布产生明显的影响。值得注意的是各生态因子并不是独立地对AM真菌产生作用,而是作为一个整体综合发挥作用(图1)。
2.1 土壤因子对AM真菌分布的影响
AM真菌主要分布在根系周围的土壤中,因此它与土壤环境的关系十分密切。已有研究表明,土壤的类型、质地、透气性、盐碱度、养分、重金属离子、pH等因素对AM真菌的生长发育、种类组成、分布有重要的影响。另一方面,AM真菌也会改善土壤的理化性状[25, 32- 34]。
土壤类型是影响AM真菌多样性的重要因子之一,不同类型土壤中AM真菌的种类、数量、产孢、侵染及其生理效应都有所不同。Oehl等[35]研究比较欧洲中部不同土壤类型对AM真菌分布的影响,发现球囊霉属均为优势种,在浅层土中球囊霉属所占比例为95%—99%,但在始成土中,其比例只占到55%—82%。其中C.caledonium只是出现在始成土中。
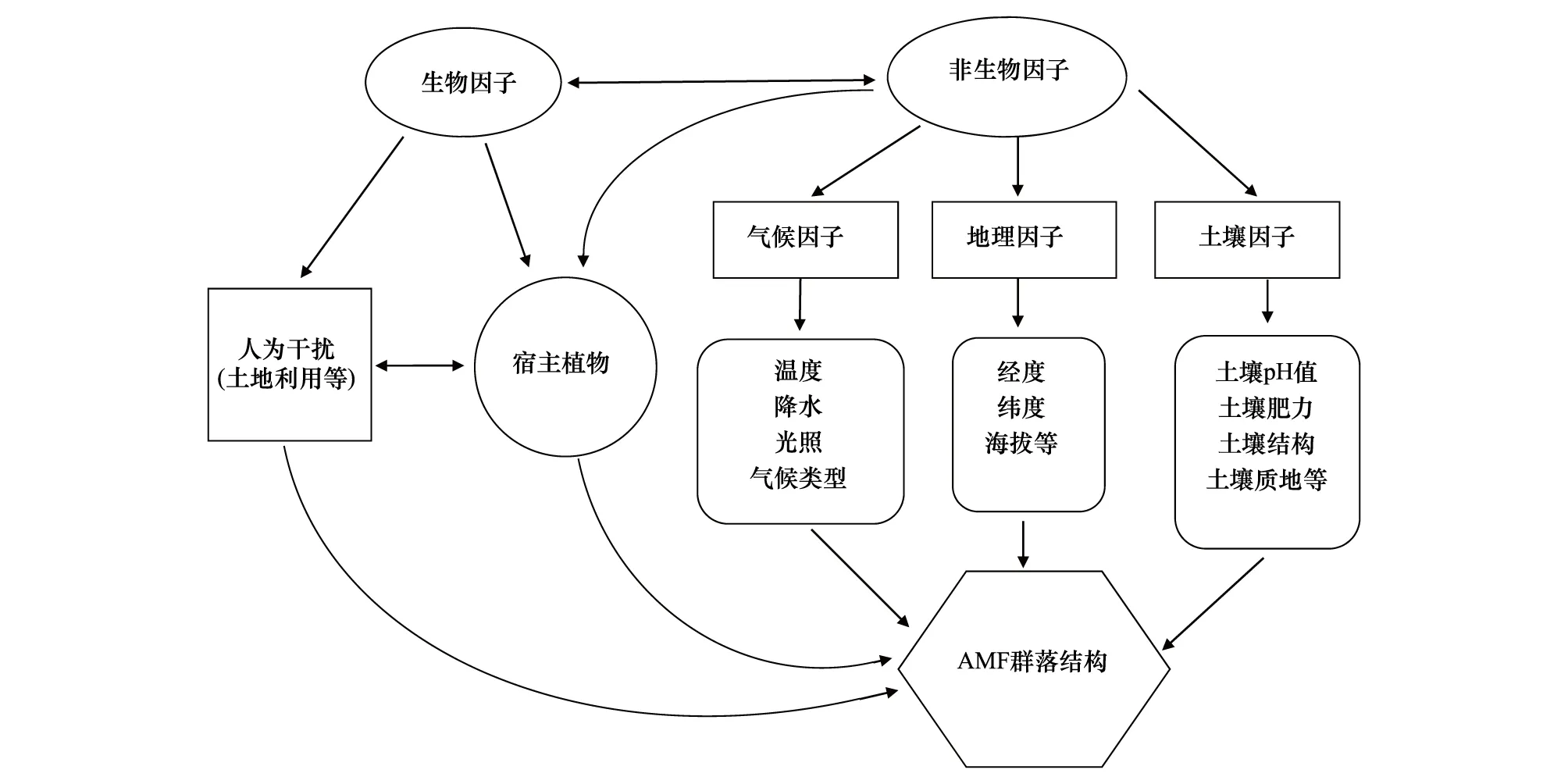
图1 影响AM真菌分布的生态因子Fig.1 Ecological factors influencing AM fungal distribution
土壤养分可直接或间接影响AM真菌侵染、菌根共生体系发育、产孢、分布等。在所有矿质养分中,以磷和AM真菌的关系最为密切[36-39]。土壤速效磷含量过高往往会抑制AM 真菌的生长、发育和功能[37]。张旭红等[38]研究了黑龙江海伦长期定位培肥实验地不同施肥处理下AM真菌群落生态分布特征,发现随着土壤肥力的提升,AM真菌种的丰度和密度均呈增加趋势,而当肥力增高到一定程度后土壤中AM真菌种的丰度和密度转而下降。Sheng等[39]的研究表明,长期(17年)施用磷肥能够显著减少AM真菌物种丰富度,多样性指数和菌丝密度。在我国北方温带草原六年的施肥实验也表明,施加磷肥显著降低了AM真菌的根内侵染率和根外菌丝密度[40]。刘润进等[41]研究发现,在一定范围内AM 真菌孢子数量随有机质含量(1.0%—2.0%)的升高而增多,但超过该含量范围,AM 真菌孢子数量就会下降。
土壤pH直接影响丛枝菌根的形成,也影响AM真菌的产孢和种属分布。大量研究表明不同AM真菌种的最适pH不同,Glomus属能适应较广泛的土壤pH范围,但喜在碱性和中性土壤中生长,而Acaulospora属喜在酸性土壤中生长[42-44]。张美庆等[45]认为能否适应较宽pH范围是影响某个AM真菌种分布范围的重要因素之一,过于酸化或碱化的土壤可能会对部分AM真菌种类的存活和生长产生负作用。An等研究比较了不同pH土壤中AM真菌群落结构差异,提出土壤pH值可能是酸性土壤中AM分布的主驱动因子[46]。
土壤质地也是影响AM真菌孢子密度和种属分布的重要因子。Aliasgharzadeh等[47]研究发现AM真菌孢子密度与土壤沙粒含量呈显著正相关关系。土壤中AM真菌孢子和菌丝只有在一定的通气条件下才能发育良好,所以土壤含氧量及含水量是影响AM真菌发生和分布的重要因子之一。随着淹水深度的增加或者厌氧时间持续,湿地生态系统中AM真菌物种多样性及对宿主植物的侵染显著降低[48]。Garcia等[49]调查发现,淹水缺氧条件下,AM真菌丛枝结构、菌丝密度、孢子数量及物种多样性降低;Wolfe等[50]也证实了随着淹水程度的增加,氧分压降低,导致AM真菌丰度下降。
2.2 气候因子对AM真菌分布的影响
在气候要素中,热量(温度和光照)和水分以及二者的组合是影响陆地生物群落呈带状地理分布的根本原因,水热状况对AM真菌和宿主植物的生长也会产生关键影响。有研究表明,温度明显改变AM真菌的生长发育,在较低温度下AM真菌会产生较多的泡囊,而在较高温度下则产生较多的根外菌丝[51]。此外,在低温胁迫下接种AM真菌显著促进了柑橘幼苗对营养元素吸收及生长[52]。到目前为止,关于温度对AM真菌物种多样性的影响尚少见报道,仅有Yang等[53]在西藏通过长期增温实验研究表明温度对AM真菌物种多样性没有显著影响。然而,以往的研究都明确表明大多数AM真菌都有其生长发育及发挥功效的最适温度范围。如Wu等[52]研究表明在25℃接种AM真菌能够显著促进植物生长,但是在15℃接种菌根真菌则没有任何效应。Antunes等[54]研究表明来自冷热不同气候区的AM真菌对于植物的促生效应有明显的不同。Gavito 等[55]的研究进一步解释了温度效应的原因,其研究表明在温度低于18℃时,宿主植物向AM真菌传递的碳随着温度的升高而增加,但当温度超过18℃后,碳的传递随温度的升高而减少。不同的菌种还表现出了不同的温度适应范围,如G.cerebriforme在温度达到24℃时仍然保持碳传递增加的趋势,这可能与AM真菌长期适应当地的生态环境有关。在我国气候寒冷的青藏高原地区,年平均气温为-3℃到-7℃,仍然存在着较高的AM真菌多样性[56-57],在一定程度上说明了AM真菌总体上对温度的适应范围较广。作为支持气候因子影响AM真菌群落的最新证据,Öpik等[16]在全球尺度下发现不同气候带AM真菌的群落组成存在明显差异,而Xiang[58]等最新研究发现,在我国北方农牧交错带不同AM真菌类群对气候因子有不同的响应,总体上AM真菌多样性对降水量表现出高度依赖性。
2.3 地理因子对AM真菌分布的影响
一般认为,地理距离和环境因子对微生物分布格局的相对贡献具有尺度依赖性:在局域或更小尺度上环境因子对微生物群落的影响较大;中小区域尺度下微生物群落的空间变化则受到环境和地理距离的共同作用;而大区域尺度或全球尺度下地理距离则成为微生物分布格局的主要影响因素[59]。AM真菌产生的孢子相对较大,主要以风和动物为媒介进行中等距离(<2 km)的传播,而菌丝则可以在更小的范围内扩散(<10 m),因而前述因素均会对AM真菌物种的全球或者区域性分布产生限制作用[60- 63]。目前有关空间尺度与AM真菌生物地理分布关系的研究大部分集中在局域或区域尺度。根据已有研究,在大尺度下,空间距离对AM真菌群落结构具有明显影响;随着尺度缩小,地理距离所起到的作用可能被其他环境因子所中和或者屏蔽,各因子之间的相互作用更加复杂。Öpik等[16]对除了南极洲以外的六大洲的调查发现,不同洲的AM真菌物种存在着显著差异,初步表明全球尺度上地理距离可能对AM真菌多样性有一定的影响。Davison等[31]的研究进一步证实了以上结论。此外,Kivlin等[61]通过综合分析已经发表文献中AM真菌分子序列,来探讨全球尺度下AM真菌多样性的影响因子,结果同样揭示在全球尺度下地理分隔对AM真菌群落结构有着显著的影响。在中尺度(景观尺度)的研究结果尚存在不少争议,如Hazard等[25]在全爱尔兰境内的调查显示地理距离对AM真菌群落没有明显影响,而Jansa等[26]的研究则发现空间距离显著影响AM真菌的空间分布格局。笔者在我国北方农牧交错带的调查也未发现地理距离和AM真菌的相关性(尚未发表)。在局域尺度上,一般认为环境因子是AM真菌空间分布的主要驱动因子,但也有个别研究揭示了地理距离对AM真菌群落结构同样可能产生影响[64]。这些研究表明扩散限制对AM真菌空间分布及多样性的作用机制与空间尺度密切相关:即,AM真菌空间分布格局在全球尺度下与地理距离的联系更为紧密;随着空间尺度的缩小,扩散限制的作用可能逐渐减弱。
2.4 宿主植物对AM真菌分布的影响
在影响AM真菌空间分布格局的生物因素中,报道最多的是植物因素。作为专性共生真菌,AM真菌的地理分布与植物群落特征密切相关。早期的研究提出了两种假说:AM真菌群落组成决定植物群落结构或者植物群落组成决定AM真菌群落特征。van der Heijden 等[65]在《Nature》上发表文章指出AM真菌 多样性决定了植物群落物种多样性,该文章奠定了AM真菌与植物多样性关系的基础。该研究发现,植物群落的Simpson 多样性指数随着AM真菌 物种数增加而增加,当AM真菌物种数为14 时,多样性达到最高值。Hiiesalu在加拿大2公顷以内的野外原位调查研究也表明,AM真菌 的物种数与植物群落的物种数存在显著的正相关关系[23]。此外,也有不少研究表明,AM真菌的生物量及群落组成会随着植物区系、植物物种丰度的改变而发生变化,在不同尺度上植物群落的变化均会对AM真菌的空间分布产生影响[21, 29]。AM真菌和植物多样性的关系可能受到以下生态过程的综合影响:(1)对AM真菌而言,较高的植物多样性通常能够保证相对充足的碳源供应,从而缓解处于不同生态位的AM真菌在资源分配过程中的压力,保障其在相同环境下共存[66];(2)宿主植物会倾向于将光合产物输送给对自身生长更为有利的AM真菌,进而影响AM真菌的群落组成[67];(3)非菌根植物或弱菌根植物的存在会对AM真菌的群落组成及多样性产生影响[68]。然而,近年来也有研究表明AM真菌与植物多样性没有明显相关性,它们二者的关系在自然生态系统中由于受到多种环境因子的影响而更加复杂。如Oehl等[35]发现植物物种多样性和AM真菌物种多样性之间没有相关关系,相反土地利用强度和土壤类型对AM真菌多样性却有明显影响。此外,Hazard等[25]考察了爱尔兰境内不同植物种植模式及不同环境条件下的AM真菌多样性,发现地上植被对于AM真菌没有影响,而土壤因子才是制约AM真菌分布的关键因子。在我国北方农牧交错带的野外调查发现,土壤磷和土壤结构是影响AM真菌多样性的关键因子,而植物多样性与AM多样性没有相关性[69]。 这些研究表明,在自然生态系统中地上植被与AM真菌之间的关系可能无法一概而论,宿主植物对AM真菌群落结构的影响除了与植物及AM真菌种类等密切相关外,还受到特定生境的影响。宿主植物作为自然界中影响AM真菌的一个生态因子,必然和其他因子存在复杂的相互作用。因此,在特定生境中如果有其它环境限制因子对AM真菌的生长起到主要作用的话,植物因子的作用就可能被削弱。
2.5 人为干扰对AM真菌分布的影响
AM真菌的数量及群落组成,间接受到土地利用方式、土壤耕作等人为干扰的影响,其作用机制较为复杂[69-76]。大量研究表明,相对于传统耕作方式,有机农业有利于提高AM真菌多样性[64,72-73]。此外,土地利用强度与AM真菌的多样性显著负相关[35,74-77]。如Xiang等[69]研究表明,在生态系统非常脆弱的北方农牧交错带,草地转变为农田导致AM真菌多样性显著下降,同时改变了AM真菌群落结构,而该影响实质上是由于土壤结构及养分状况的改变产生的间接作用。不过,也有研究表明AM真菌物种多样性与土地利用强度没有明显关系[78-81]。例如,Dai等[81]运用454高通量测序技术比较研究了加拿大东部某地农田和草地生态系统间AM真菌群落的差异,发现农田和草地AM真菌多样性相同,农田开垦并未对AM真菌造成负面影响。这种看似矛盾的研究结果,可能与研究地所在的生态系统稳定性有关。越稳定的生态系统,其应对自然胁迫或人为扰动的抵抗力和恢复力越强[82]。在生态系统本身已受到严重破坏,土壤退化的区域,人为干扰会加重土壤退化,包括土壤微生物群落的退化;而在稳定的生态系统中,农田开垦等人为干扰对AM真菌的影响可能仍在自然可恢复的范围内。
3 AM真菌的生态分布规律
纵观AM真菌生态分布及其影响因子相关研究,可发现土壤、植被、地理距离、气候、人为干扰等生物因子和非生物因子都会对AM真菌的物种多样性及群落组成产生影响。目前对于AM真菌分布格局驱动因子的研究,大部分还是集中在较小的尺度下研究一种或者是几种环境因子,能够反映出沿着某一环境梯度AM真菌多样性可能的变化趋势,但无法明确主驱动因子。根据已有的一些综合多环境因子的景观尺度、区域尺度的研究结果来看,土壤因子可能是影响AM真菌群落结构及分布的最重要因子。Hazard等[25]在爱尔兰全国范围内系统研究了土地利用方式、土壤性质及地理距离对AM真菌群落结构的影响,结果发现土壤理化性质是影响AM真菌群落结构的最主要因子,而土地利用方式和地理距离对AM真菌群落多样性影响不明显。Jansa等[26]在瑞士境内开展的类似研究发现土壤因子是影响AM真菌群落最重要的因子,但同时地理距离也有明显的作用。在我国北方农牧交错带草地生态系统中,土壤理化性质同样是决定AM真菌群落结构的最重要因子,同时植物群落结构对AM真菌群落结构也有一定的影响,但是空间地理分隔距离则没有影响(Xiang et al.,Unpublished)。在全球尺度下,土壤因子仍然对AM真菌的空间分布格局具有重要影响,但空间距离的作用则更为重要[31]。
目前的研究也发现许多适用于大型生物的传统生物地理学理论也能在AM真菌生态分布规律中得到较好验证:
(1)物种多度分布格局
根据大型生物的分布理论,物种在地球上的分布并非是均匀的,几乎所有的群落,从海洋生物到亚马逊热带雨林,都呈现出大量的稀有种和少数常见种的模式,并且这种模式重复出现在各种生物类群中[83]。目前的研究表明AM真菌也符合大量稀有种和少数常见种的多度分布模式。Oehl等[35]对中欧地区(德国、法国、瑞士)AM真菌多样性的研究表明,除去19%的菌种无法鉴定,53%的菌种属于“狭生态幅种”,而28%的菌种属于“广生态幅种”。Öpik等[28]总结26篇全球范围内自然生态系统中菌根真菌多样性的文献,发现有50%的菌种来源于单一的栖息地,而有近乎1/3的菌种来源于单一宿主植株。Öpik等[15]进一步总结了迄今为止基于rDNA SSU的AM真菌多样性研究,发现有2/3的AM菌种来自于单一的气候区和栖息地。
(2)群落相似度衰减
群落间物种组成的相似度 (β多样性) 随地理距离的增加而降低是生物地理学主要模式之一。对于大型生物类群,在不同地理梯度和环境中都表现出了这种关系[84-85]。微生物群落相似度也可能呈现出随地理距离的增加而衰减的模式[86]。对于AM真菌来说,目前的研究表明在全球[31,59]、局域尺度[60]和景观尺度[26]上均表现出类似于植物群落的相似度衰减模式。
(3)耐受因子定律
从生态学的角度来说,影响生物的各种生态因子都有一定的变动范围,而每种生物所能适应的范围却有一定的限度。超出这个限度,生物的生长、发育和繁殖就会受到抑制,甚至引起死亡。美国生态学家Shelford据此提出了耐受性定律(law of tolerance)[87],他认为生物对每一种生态因子都有其耐受的上限和下限,上下限之间既是生物对这种生态因子的耐受性范围。现有研究表明,AM真菌分布对土壤有效磷、有机质、pH值表现出了耐受性定律。笔者认为,在某一特定生态系统或生境内,正是由于AM真菌对于不同生态因子的耐受性存在差异,导致只有少数几个与当地生境息息相关的关键生态因子深刻影响着 AM 真菌多样性及其分布。例如,在我国北方农牧交错带的调查表明,土壤有效磷和土壤质地是驱动AM真菌多样性的最重要的因子[69],这与AM真菌的生理特性以及当地的生态环境密切相关。该研究区域属于干旱-半干旱区,土壤结构疏松、风沙大,表层土壤移动频繁,土壤贫瘠,因而严重影响了AM真菌的定殖及生长。
4 研究展望
目前AM真菌生态分布理论研究还处于起步阶段,AM真菌与环境因子相互关系的复杂性,环境因子之间的相互作用导致的生境复杂性,以及AM真菌不可见性及检测手段的局限性等,使得该方面的研究依然存在着较大的挑战。在后续的研究中,笔者认为可以适当借鉴相对成熟的传统大型生物地理学理论(尤其是植物地理学相关理论),并结合AM真菌自身的生态生理特点,从理论高度上对AM真菌生态分布规律展开进一步研究。开展AM真菌的大尺度实地调查是研究其生态分布规律的一种有效手段,但目前仍然存在着很多困难。系统的大尺度取样难度较大,同时野外调查及AM真菌检测耗费较大,而开展全球尺度国际合作可能是一个非常有效的途径。
与大型动植物不同的是,微生物个体和群落特征具有较大的变异性,其受到环境的过滤作用更加明显,因而使得它的分布规律更加复杂。在以后的研究中,大规模的野外原位调查应该和多因子模拟实验同时进行,从而系统深入地研究不同生态环境中影响AM真菌多样性及分布的关键因子和可能的调控途径。回答AM真菌生物地理学分布基础科学命题将为建立菌根真菌的生态效应图谱打下基础,进一步可为AM真菌的资源管理和生态应用提供理论依据。
[1] Wang B, Qiu Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza, 2006, 16(5): 299- 363.
[2] Van Der Heijden M G A. Arbuscular mycorrhizal fungi as support systems for seedling establishment in grassland. Ecology Letters, 2004, 7(4): 293- 303.
[3] Van Der Heijden M G A, Streitwolf-Engel R, Riedl R, Siegrist S, Neudecker A, Ineichen K, Boller T, Wiemken A, Sanders I R. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland. New Phytologist, 2006, 172(4): 739- 752.
[4] Colla G, Rouphael Y, Cardarell M, Tullio M, Rivera C M, Rea E. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentration. Biology and Fertility of Soils, 2008, 44(3): 501- 509.
[5] Lin A J, Zhang X H, Wong M H, Ye Z H, Lou L Q, Wang Y S, Zhu Y G. Increase of multi-metal tolerance of three leguminous plants by arbuscular mycorrhizal fungi colonization. Environmental Geochemistry and Health, 2007, 29(6): 473- 481.
[6] Zhang L D, Zhang J L, Christie P, Li X L. Effect of inoculation with the arbuscular mycorrhizal fungusGlomusintraradiceson the root-knot nematodeMeloidogyneincognitain cucumber. Journal of Plant Nutrition, 2009, 32(6): 967- 979.
[7] Klironomos J N. Variation in plant response to native and exotic arbuscular mycorrhizal fungi. Ecology, 2003, 84(9): 2292- 2301.
[8] Munkvold L, Kjøller R, Vestberg M, Rosendahl S, Jakobsen I. High functional diversity within species of arbuscular mycorrhizal fungi. New Phytologist, 2004, 164(2): 357- 364.
[9] Börstler B, Raab P A, Thiéry O, Morton J B, Redecker D. Genetic diversity of the arbuscular mycorrhizal fungusGlomusintraradicesas determined by mitochondrial large subunit rRNA gene sequences is considerably higher than previously expected. New Phytologist, 2008, 180(2): 452- 465.
[10] Oliveira R S, Boyer L R, Carvalho M F, Jeffries P, Vosátka M, Castro P M L, Dodd J C. Genetic, phenotypic and functional variation within aGlomusgeosporumisolate cultivated with or without the stress of a highly alkaline anthropogenic sediment. Applied Soil Ecology, 2010, 45(1): 39- 48.
[11] Schüβler A, Schwarzott D, Walker C. A new fungal phylum, theGlomeromycota: phylogeny and evolution. Mycological Research, 2001, 105(12): 1413- 1421.
[12] Redecker D, Schüβler A, Stockinger H, Stürmer S L, Morton J B, Walker C. An evidence-based consensus for the classification of arbuscular mycorrhizal fungi (Glomeromycota). Mycorrhiza, 2013, 23(7): 515- 531.
[13] Börstler B, Renker C, Kahmen A, Buscot F. Species composition of arbuscular mycorrhizal fungi in two mountain meadows with differing management types and levels of plant biodiversity. Biology and Fertility of Soils, 2006, 42(4): 286- 298.
[14] 何新华, 段英华, 陈应龙, 徐明岗. 中国菌根研究60年: 过去、现在和将来. 中国科学: 生命科学, 2012, 42(6): 431- 454.
[15] Öpik M, Vanatoa A, Vanatoa E, Moora M, Davison J, Kalwij J M, Reier Ü, Zobel M. The online database MaarjAMreveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi (Glomeromycota). New Phytologist, 2010, 188(1): 223- 241.
[16] Öpik M, Zobel M, Cantero J J, Davison J, Facelli J M, Hiiesalu I, Jairus T, Kalwij J M, Koorem K, Leal M E, Liira J, Metsis M, Neshataeva V, Paal J, Phosri C, Põlme S, Reier Ü, Saks Ü, Schimann H, Thiéry O, Vasar M, Moora M. Global sampling of plant roots expands the described molecular diversity of arbuscular mycorrhizal fungi. Mycorrhiza, 2013, 23(5): 411- 430.
[17] Finlay B J. Global dispersal of free-living microbial eukaryote species. Science, 2002, 296(5570): 1061- 1063.
[18] Dolan J R. Microbial biogeography. Journal of Biogeography, 2006, 33(2): 199- 200.
[19] O′Malley M A. The nineteenth century roots of ‘everything is everywhere’. Nature Reviews Microbiology, 2013, 5(8): 647- 651.
[20] Soininen J. Macroecology of unicellular organisms - patterns and processes. Environmental Microbiology Reports, 2012, 4(1): 10- 22.
[21] Liu R J, Wang F Y. Selection of appropriate host plants used in trap culture of arbuscular mycorrhizal fungi. Mycorrhiza, 2003, 13(3): 123- 127.
[22] McGuire K L, Henkel T W, De La Cerda I G, Villa G, Edmund F, Andrew C. Dual mycorrhizal colonization of forest-dominating tropical trees and the mycorrhizal status of non-dominant tree and liana species. Mycorrhiza, 2008, 18(4): 217- 222.
[23] Hiiesalu I, Pärtel M, Davison J, Gerhold P, Metsis M, Moora M, Öpik M, Vasar M, Zobel M, Wilson S D. Species richness of arbuscular mycorrhizal fungi: associations with grassland plant richness and biomass. New Phytologist, 2014, 203(1): 233- 244.
[24] Zobel M, Öpik M. Plant and arbuscular mycorrhizal fungal (AMF) communities-which drives which?. Journal of Vegetation Science, 2014, 25(5): 1133- 1140.
[25] Hazard C, Gosling P, Van Der Gast C J, Mitchell D T, Doohan F M, Bending G D. The role of local environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale. The ISME Journal, 2013, 7(3): 498- 508.
[26] Jansa J, Erb A, Oberholzer H R,milauer P, Egli S. Soil and geography are more important determinants of indigenous arbuscular mycorrhizal communities than management practices in Swiss agricultural soils. Molecular Ecology, 2014, 23(8): 2118- 2135.
[27] Smith S E, Read D J. Mycorrhizal Symbiosis. Cambridge, UK: Academic Press, 2008.
[28] Öpik M, Moora M, Liira J, Zobel M. Composition of root-colonizing arbuscular mycorrhizal fungal communities in different ecosystems around the globe. Journal of Ecology, 2006, 94(4): 778- 790.
[29] Treseder K K, Cross A. Global distributions of arbuscular mycorrhizal fungi. Ecosystems, 2006, 9(2): 305- 316.
[30] 刘润进, 焦惠, 李岩, 李敏, 朱新产. 丛枝菌根真菌物种多样性研究进展. 应用生态学报, 2009, 20(9): 2301- 2307.
[31] Davison J, Moora M, Öpik M, Adholeya A, Ainsaar L, BA, Burla S, Diedhiou A G, Hiiesalu I, Jairus T, Johnson N C, Kane A, Koorem K, Kochar M, Ndiaye C, Pärtel M, Reier Ü, Saks Ü, Singh R, Vasar M, Zobel M. Global assessment of arbuscular mycorrhizal fungus diversity reveals very low endemism. Science, 2015, 349(6251): 970- 973.
[32] 王发园, 刘润进. 环境因子对AM真菌多样性的影响. 生物多样性, 2001, 9(3): 301- 305.
[33] Fitter A H, Heinemeyer A, Husband R, Olsen E, Ridgway K P, Staddon P L. Global environmental change and the biology of arbuscular mycorrhizas: gaps and challenges. Canadian Journal of Botany, 2004, 82(8): 1133- 1139.
[34] Lin X G, Feng Y Z, Zhang H Y, Chen R R, Wang J H, Zhang J B, Chu H Y. Long-term balanced fertilization decreases arbuscular mycorrhizal fungal diversity in an arable soil in north China revealed by 454 pyrosequencing. Environmental Science & Technology, 2012, 46(11): 5764- 5771.
[35] Oehl F, Laczko E, Bogenrieder A, Stahr K, Bösch R, Van Der Heijden M, Sieverding E. Soil type and land use intensity determine the composition of arbuscular mycorrhizal fungal communities. Soil Biology and Biochemistry, 2010, 42(5): 724- 738.
[36] Krüger M, Teste F P, LalibertéE, Lambers H, Coghlan M, Zemunik G, Bunce M. The rise and fall of arbuscular mycorrhizal fungal diversity during ecosystem retrogression. Molecular Ecology, 2015, 24(19): 4912- 4930
[37] Tawaraya K, Saito M, Morioka M, Wagatsuma T. Effect of phosphate application to arbuscular mycorrhizal onion on the development and succinate dehydrogenase activity of internal hyphae. Soil Science and Plant Nutrition, 1994, 40(4): 667- 673.
[38] 张旭红, 朱永官, 王幼珊, 林爱军, 陈保冬, 张美庆. 不同施肥处理对丛枝菌根真菌生态分布的影响. 生态学报, 2006, 26(9): 3081- 3087.
[39] Sheng M, Lalande R, Hamel C, Ziadi N. Effect of long-term tillage and mineral phosphorus fertilization on arbuscular mycorrhizal fungi in a humid continental zone of Eastern Canada. Plant and Soil, 2013, 369(1/2): 599- 613.
[40] Chen Y L, Zhang X, Ye J S, Han H Y, Wan S Q, Chen B D. Six-year fertilization modifies the biodiversity of arbuscular mycorrhizal fungi in a temperate steppe in Inner Mongolia. Soil Biology and Biochemistry, 2014, 69: 371- 381.
[41] 刘润进, 刘鹏起, 徐坤, 吕志范. 中国盐碱土壤中AM菌的生态分布. 应用生态学报, 1999, 10(6): 721- 724.
[42] 盖京苹, 刘润进. 土壤因子对野生植物AM真菌的影响. 应用生态学报, 2003, 14(3): 470- 472.
[43] Gai J P, Christie P, Feng G, Li X L. Twenty years of research on community composition and species distribution of arbuscular mycorrhizal fungi in China: a review. Mycorrhiza, 2006, 16(4): 229- 239.
[44] 薛会英, 张永青, 彭岳林. 藏北草原主要植物AM真菌的初步研究. 山地学报, 2007, 25(3): 351- 358.
[45] 张美庆, 王幼珊, 刑礼军. 环境因子和AM真菌分布的关系. 菌物系统, 1999, 18(1): 25- 29.
[46] An G H, Miyakawa S, Kawahara A, Osaki M, Ezawa T. Community structure of arbuscular mycorrhizal fungi associated with pioneer grass speciesMiscanthussinensisin acid sulfate soils: habitat segregation along pH gradients. Soil Science and Plant Nutrition, 2008, 54(4): 517- 528.
[47] Aliasgharzadeh N, Rastin S N, Towfighi H, Alizadeh A. Occurrence of arbuscular mycorrhizal fungi in saline soils of the Tabriz Plain of Iran in relation to some physical and chemical properties of soil. Mycorrhiza, 2001, 11(3): 119- 122.
[48] Escudero V, Mendoza R. Seasonal variation of arbuscular mycorrhizal fungi in temperate grasslands along a wide hydrologic gradient. Mycorrhiza, 2005, 15(4): 291- 299.
[49] García I, Mendoza R, Pomar M C. Deficit and excess of soil water impact on plant growth ofLotustenuisby affecting nutrient uptake and arbuscular mycorrhizal symbiosis. Plant and Soil, 2008, 304(1/2): 117- 131.
[50] Wolfe B E, Mummey D L, Rillig M C, Klironomos J N. Small-scale spatial heterogeneity of arbuscular mycorrhizal fungal abundance and community composition in a wetland plant community. Mycorrhiza, 2007, 17(3): 175- 183.
[51] Hawkes C V, Hartley I P, Ineson P, Fitter A H. Soil temperature affects carbon allocation within arbuscular mycorrhizal networks and carbon transport from plant to fungus. Global Change Biology, 2008, 14(5): 1181- 1190.
[52] Wu Q S, Zou Y N. Beneficial roles of arbuscular mycorrhizas in citrus seedlings at temperature stress. Scientia Horticulturae, 2010, 125(3): 289- 293.
[53] Yang W, Zheng Y, Gao C, He X H, Ding Q, Kim Y, Rui Y C, Wang S P, Guo L D. The arbuscular mycorrhizal fungal community response to warming and grazing differs between soil and roots on the Qinghai-Tibetan Plateau. PLoS One, 2013, 8(9): e76447.
[54] Antunes P M, Koch A M, Morton J B, Rillig M C, Klironomos J N. Evidence for functional divergence in arbuscular mycorrhizal fungi from contrasting climatic origins. New Phytologist, 2011, 189(2): 507- 514.
[55] Gavito M E, Olsson P A, Rouhier H, Medina-Peafiel A, Jakobsen I, Bago A, Azcón-Aguilar C. Temperature constraints on the growth and functioning of root organ cultures with arbuscular mycorrhizal fungi. New Phytologist, 2005, 168(1): 179- 188.
[56] Gai J P, Christie P, Cai X B, Fan J Q, Zhang J L, Feng G, Li X L. Occurrence and distribution of arbuscular mycorrhizal fungal species in three types of grassland community of the Tibetan Plateau. Ecological Research, 2009, 24(6): 1345- 1350.
[57] Liu Y J, He J X, Shi G X, An L Z, Öpik M, Feng H Y. Diverse communities of arbuscular mycorrhizal fungi inhabit sites with very high altitude in Tibet Plateau. FEMS Microbiology Ecology, 2011, 78(2): 355- 365.
[58] Xiang D, Veresoglou S D, Rillig M C, Xu T L, Li H, Hao Z P, Chen B D. Relative importance of individual climatic drivers shaping arbuscular mycorrhizal fungal communities. Microbial Ecology, 2016, doi: 10.1007/s00248-016-0773- 1.
[59] Martiny J B H, Bohannan B J M, Brown J H, Colwell R K, Fuhrman J A, Green J L, Horner-Devine M C, Kane M, Krumins J A, Kuske C R, Morin P J, Naeem S, Øvreås L, Reysenbach A L, Smith V H, Staley J T. Microbial biogeography: putting microorganisms on the map. Nature Reviews Microbiology, 2006, 4(2): 102- 112.
[60] Mangan S A, Adler G H. Consumption of arbuscular mycorrhizal fungi by terrestrial and arboreal small mammals in a panamanian cloud forest. Journal of Mammalogy, 2000, 81(2): 563- 570.
[61] Kivlin S N, Hawkes C V, Treseder K K. Global diversity and distribution of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry, 2011, 43(11): 2294- 2303.
[62] Van Der Heijden M G A, De Bruin S, Luckerhoff L, Van Logtestijn R S P, Schlaeppi K. A widespread plant-fungal-bacterial symbiosis promotes plant biodiversity, plant nutrition and seedling recruitment. The ISME Journal, 2016, 10(2): 389- 399.
[63] Egan C, Li D W, Klironomos J. Detection of arbuscular mycorrhizal fungal spores in the air across different biomes and ecoregions. Fungal Ecology, 2014, 12: 26- 31.
[64] Van Der Gast C J, Gosling P, Tiwari B, Bending G D. Spatial scaling of arbuscular mycorrhizal fungal diversity is affected by farming practice. Environmental Microbiology, 2011, 13(1): 241- 249.
[65] Van Der Heijden M G A, Klironomos J N, Ursic M, Moutoglis P, Streitwolf-Engel R, Boller T, Wiemken A, Sanders I R. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 1998, 396(6706): 69- 72
[66] Zak D R, Holmes W E, White D C, Peacock A D, Tilman D. Plant diversity, soil microbial communities, and ecosystem function: are there any links? Ecology, 2003, 84(8): 2042- 2050.
[67] Bever J D, Richardson S C, Lawrence B M, Holmes J, Watson M. Preferential allocation to beneficial symbiont with spatial structure maintains mycorrhizal mutualism. Ecology Letters, 2009, 12(1): 13- 21.
[68] Lekberg Y, Schnoor T, Kjøller R, Gibbons S M, Hansen L H, Al-Soud W A, Sørensen S J, Rosendahl S. 454-sequencing reveals stochastic local reassembly and high disturbance tolerance within arbuscular mycorrhizal fungal communities. Journal of Ecology, 2012, 100(1): 151- 160.
[69] Xiang D, Verbruggen E, Hu Y J, Veresoglou S D, Rillig M C, Zhou W P, Xu T L, Li H, Hao Z P, Chen Y L, Chen B D. Land use influences arbuscular mycorrhizal fungal communities in the farming-pastoral ecotone of northern China. New Phytologist, 2014, 204(4): 968- 978.
[70] Soteras F, Moreira B C, Grilli G, Pastor N, Mendes F C, Mendes D R, Renison D, Kasuya M C M, De Souza F A, Becerra A. Arbuscular mycorrhizal fungal diversity in rhizosphere spores versus roots of an endangered endemic tree from Argentina: is fungal diversity similar among forest disturbance types?. Applied Soil Ecology, 2016, 98: 272- 277.
[71] Hu J L, Yang A N, Zhu A N, Wang J H, Dai J, Wong M H, Lin X G. Arbuscular mycorrhizal fungal diversity, root colonization, and soil alkaline phosphatase activity in response to maize-wheat rotation and no-tillage in North China. Journal of Microbiology, 2015, 53(7): 454- 461.
[72] Oehl F, Sieverding E, Mäder P, Dubois D, Ineichen K, Boller T, Wiemken A. Impact of long-term conventional and organic farming on the diversity of arbuscular mycorrhizal fungi. Oecologia, 2004, 138(4): 574- 583
[73] Lumini E, Vallino M, Alguacil M M, Romani M, Bianciotto V. Different farming and water regimes in Italian rice fields affect arbuscular mycorrhizal fungal soil communities. Ecological Applications, 2011, 21(5): 1696- 1707.
[74] Alguacil M M, Lumini E, Roldán A, Salinas-García J R, Bonfante P, Bianciotto V. The impact of tillage practices on arbuscular mycorrhizal fungal diversity in subtropical crops. Ecological Applications, 2008, 18(2): 527- 536.
[75] Tchabi A, Coyne D, Hountondji F, Lawouin L, Wiemken A, Oehl F. Arbuscular mycorrhizal fungal communities in sub-Saharan Savannas of Benin, West Africa, as affected by agricultural land use intensity and ecological zone. Mycorrhiza, 2008, 18(4): 181- 195.
[76] König S, Wubet T, Dormann C F, Hempel S, Renker C, Buscot F. TaqMan real-time PCR assays to assess arbuscular mycorrhizal responses to field manipulation of grassland biodiversity: effects of soil characteristics, plant species richness, and functional traits. Applied and Environmental Microbiology, 2010, 76(12): 3765- 3775.
[77] Schnoor T K, Lekberg Y, Rosendahl S, Olsson P A. Mechanical soil disturbance as a determinant of arbuscular mycorrhizal fungal communities in semi-natural grassland. Mycorrhiza, 2011, 21(3): 211- 220.
[78] Stürmer S L, Siqueira J O. Species richness and spore abundance of arbuscular mycorrhizal fungi across distinct land uses in Western Brazilian Amazon. Mycorrhiza, 2011, 21(4): 255- 267.
[79] González-Cortés J C, Vega-Fraga M, Varela-Fregoso L, Martínez -Trujillo M, Carreón-Abud Y, Gavito M E. Arbuscular mycorrhizal fungal (AMF) communities and land use change: the conversion of temperate forests to avocado plantations and maize fields in central Mexico. Fungal Ecology, 2012, 5(1): 16- 23.
[80] Jefwa J M, Okoth S, Wachira P, Karanja N, Kahindi J, Njuguini S, Ichami S, Mung′atu J, Okoth P, Huising J. Impact of land use types and farming practices on occurrence of arbuscular mycorrhizal fungi (AMF) Taita-Taveta district in Kenya. Agriculture, Ecosystems & Environment, 2012, 157: 32- 39.
[81] Dai M L, Bainard L D, Hamel C, Gan Y T, Lynch D. Impact of land use on arbuscular mycorrhizal fungal communities in rural Canada. Applied and Environmental Microbiology, 2013, 79(21): 6719- 6729.
[82] McCann K S. The diversity-stability debate. Nature, 2000, 405(6783): 228- 233.
[83] McGill B J, Etienne R S, Gray J S, Alonso D, Anderson M J, Benecha H K, Dornelas M, Enquist B J, Green J L, He F L, Hurlbert A H, Magurran A E, Marquet P A, Maurer B A, Ostling A, Soykan C U, Ugland K I, White E P. Species abundance distributions: moving beyond single prediction theories to integration within an ecological framework. Ecology Letters, 2007, 10(10): 995- 1015.
[84] Novotny V, Miller S E, Hulcr J, Drew R A I, Basset Y, Janda M, Setliff G P, Darrow K, Stewart A J A, Auga J, Isua B, Molem K, Manumbor M, Tamtiai E, Mogia M, Weiblen G D. Low beta diversity of herbivorous insects in tropical forests. Nature, 2007, 448(7154): 692- 695
[85] Qian H, Ricklefs R E. A latitudinal gradient in large-scale beta diversity for vascular plants in North America. Ecology Letters, 2007, 10(8): 737- 744.
[86] Mazaris A D, Moustaka-Gouni M, Michaloudi E, Bobori D C. Biogeographical patterns of freshwater micro- and macroorganisms: a comparison between phytoplankton, zooplankton and fish in the eastern Mediterranean. Journal of Biogeography, 2010, 37(7): 1341- 1351.
[87] Shelford V E. Elements of Ecology. New York: Harper and Row, 1913: 1- 677.
Ecological distribution of arbuscular mycorrhizal fungi and the influencing factors
XIANG Dan1,2, XU Tianle1,3, LI Huan2, CHEN Baodong1,3,*
1StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2CollegeofResourcesandEnvironment,QingdaoAgriculturalUniversity,Qingdao266109,China3UniversityofChineseAcademyofSciences,Beijing100049,China
Arbuscular mycorrhizal (AM) fungi are ubiquitous soil fungi that can form symbiotic associations with the majority of terrestrial plant. AM fungi play key roles in plant resistance to various environmental stresses, such as nutrient deficiency, drought, and soil contaminations. Through the common mycorrhizal network, AM fungi can regulate plant community structure and succession, influence material cycling, energy flow, and signal transduction, and substantially affect ecosystem stability and function. Because the physiological and ecological functions of AM fungi could be predetermined by their ecological adaptability, understanding the AM fungal biodiversity in different ecosystems and their response to various environmental factors is important for the exploration and utilization of these biological resources. To date, many studies have revealed the influences of different ecological factors on AM fungal diversity, however, systematic studies on the ecological distribution patterns of AM fungi and the underlying mechanisms are still lacking. This paper summarized available knowledge regarding the influences of biotic and abiotic factors on AM fungal diversity and ecological distribution, and discussed AM fungal biogeography compared to macroorganisms. Prospects in this research area were also proposed to promote future research.
arbuscular mycorrhizal fungi; environmental factors; driving force; biodiversity; biogeography
国家自然科学基金项目(41371264,41071178);城市与区域生态国家重点实验室自主方向项目(SKLURE2012- 1-03)
2016- 03- 28; 网络出版日期:2017- 02- 22
10.5846/stxb201603280563
*通讯作者Corresponding author.E-mail: bdchen@rcees.ac.cn
向丹, 徐天乐, 李欢,陈保冬.丛枝菌根真菌的生态分布及其影响因子研究进展.生态学报,2017,37(11):3597- 3606.
Xiang D, Xu T L, Li H, Chen B D.Ecological distribution of arbuscular mycorrhizal fungi and the influencing factors.Acta Ecologica Sinica,2017,37(11):3597- 3606.
