外源β-葡萄糖苷酶处理结合异烟酸-吡唑啉酮分光光度法测定橡胶籽中氰化物含量
2017-07-20刘石生
张 烨,王 珂,刘石生,*
(1.海南大学食品学院,海南 海口 570228;2.海南大学 热带生物资源教育部重点实验室,海南 海口 570228)
外源β-葡萄糖苷酶处理结合异烟酸-吡唑啉酮分光光度法测定橡胶籽中氰化物含量
张 烨1,王 珂2,刘石生1,*
(1.海南大学食品学院,海南 海口 570228;2.海南大学 热带生物资源教育部重点实验室,海南 海口 570228)
研究经不同方法脱毒处理后的橡胶籽分别采用异烟酸-吡唑啉酮分光光度法和加入外源β-葡萄糖苷酶的异烟酸-吡唑啉酮分光光度法检测其氰化物含量。结果表明:采用异烟酸-吡唑啉酮分光光度法检测出的氰化物含量较低或不存在,而加入外源β-葡萄糖苷酶的异烟酸-吡唑啉酮分光光度法检测出的氰化物含量明显高于单独采用异烟酸-吡唑啉酮分光光度法的检出值。再对加入外源β-葡萄糖苷酶的异烟酸-吡唑啉酮分光光度法的应用条件进行优化后得到最优条件为浸泡时间3.35 h、浸泡温度45.06 ℃、加酶量24.11 U/100 mL、浸泡pH 5.56。以上条件下,预测的氰化物含量为28.79 μg/g,加标回收率为85.02%~92.04%,测定结果准确可靠。
异烟酸-吡唑啉酮分光光度法;β-葡萄糖苷酶;橡胶籽;氰苷;热处理
氰化物是含有氰基(—CN)的一类化合物的总称,属于剧毒物[1],这类化合物广泛存在于自然环境中[2],分析化学对其关注已有100多年的历史,至今仍然受到高度关注[3],其毒性大、反应快[4],人们过多摄入此类物质会导致神经疾病或中毒[5]。由于氰化物的毒性极大,因此要求在较低质量浓度(ng/mL)条件下被检出[6]。目前国内较先进的测定氰化物含量的方法多为液相色谱法、气相色谱法[7-8]及离子色谱法[9-10],气相色谱主要用于测定简单氰化物及部分络合物[11],并不能精确测定总氰化物的含量。高效液相色谱虽然能测定络合氰化物,但金属氰化络合物易分解,只有在特定的环境条件下才能较稳定存在[12],离子色谱法受技术条件限制,氰化物的离子色谱分析还尚未完全成熟[13],因此该方法应用条件较为苛刻。而国标中氰化物的主要检测方法GB/T 13084—2006《饲料中氰化物的测定》[14]和GB/T 5009.36—2003《粮食卫生标准的分析方法》[15]中均采用异烟酸-吡唑啉酮分光光度法[16-17],该种测定方法是在植物本身含有β-葡萄糖苷酶的情况下由β-葡萄糖苷酶水解氰苷生成氢氰酸[18-20],才能测出氰化物含量。目前虽然有对木薯、竹笋等食用植物食品中氰苷含量测定的相关研究[21-22],但在实际测定食品中氰化物含量前食品原材料一般都会进行高温处理。虽然高温对脱除植物中所含的部分氰化物有所帮助[23-24],但高温条件同时能导致蛋白质变性失活,使食物本身含有的β-葡萄糖苷酶遭到不同程度地破坏,氰苷不能完全被分解,因此会存在使用国标方法检测出的食品中氰化物含量偏低或不存在,但这并不能说明食物中所含有的氰苷在高温中被完全除去[25-26]。目前还没有将食物热加工后经外源β-葡萄糖苷酶处理后检测其氰化物含量的研究。本实验以橡胶籽为原材料,先通过对橡胶籽进行不同高温脱毒方法处理,再经外源的β-葡萄糖苷酶处理,然后采用异烟酸-吡唑啉酮分光光度法测定其氰化物含量,探究氰苷是否在高温中被完全除去,并跟踪外源β-葡萄糖苷酶的加入对经高温处理后的橡胶籽中氰化物含量测定的影响情况。
1 材料与方法
1.1 材料与试剂
橡胶籽 海南八一农场;β-葡萄糖苷酶由实验室从橡胶籽中提取。
丙酮、乙酸锌、酒石酸、酚酞、磷酸氢二钠、磷酸二氢钠、氢氧化钠溶液、磷酸盐缓冲液、乙醇、氰化钾标准溶液、氯胺T、异烟酸、吡唑啉酮,均为国产分析纯。
1.2 仪器与设备
HH-S26S电热恒温水浴锅 金坛市大地自动化仪器厂;电炉 北京市永光明医疗仪器有限公司;BS124S电子天平德国Sartorius公司;PHS-3C型实验室pH计 上海伟业仪器厂;TG16G离心机 湖南凯达科学仪器有限公司;7230G可见分光光度计 上海精科实业有限公司。1.3 方法
1.3.1 β-葡萄糖苷酶的制备
将橡胶籽外壳敲除,种仁磨碎成粉,用适量丙酮冲洗、抽滤、挥干后制成干粉。称取一定质量的干粉加蒸馏水均质,均质后6 000 r/min离心20 min,取上清液加入适量丙酮产生沉淀,复溶,得到初步纯化的酶,4 ℃保存备用[27-28]。
1.3.2 酶活力的测定
向10 mL比色管中加入0.1 mL适当稀释的酶液,同时加入0.3 mL pH 6.0的磷酸盐缓冲溶液和0.1 mL 10 mmol/L 4-硝基苯基-β-D吡喃葡萄糖苷,42 ℃水浴保温30 min,取出后立即加1 mol/L Na2CO3溶液终止其反应,加蒸馏水至5 mL,于400 nm波长处测定吸光度。空白对照采用0.1 mL蒸馏水代替酶液进行操作,计算酶活力[29-30]。
1.3.3 样品前处理
1.3.3.1 未加入β-葡萄糖苷酶
将橡胶籽外壳敲除,种仁切成小块,取一定质量加入带塞三角瓶中,加入100 mL蒸馏水使试样全部浸没,加塞浸泡3~4 h。
1.3.3.2 加入β-葡萄糖苷酶
将橡胶籽外壳敲除,种仁切成小块,取一定质量加入带塞三角瓶中,加入100 mL蒸馏水使试样全部浸没后加入一定量β-葡萄糖苷酶酶液并调节其pH值在一定范围,加塞后再水浴浸泡一定时间。
1.3.4 氰化物含量的测定
1.3.4.1 测定方法
参考GB/T 5009.36—2003《粮食卫生标准的分析方法》[10]1.3.4节不同热处理方法对橡胶籽中氰化物含量测定的影响。
1.3.4.2 空白实验
取一定量的β-葡萄糖苷酶酶液直接加入到装有100 mL水的三角瓶中并调节其pH值在一定范围,加塞后再水浴浸泡一定时间后测定氰化物含量。
1.3.4.3 煮橡胶籽(煮样)时间对氰化物含量测定的影响
将橡胶籽外壳敲除,种仁切成小块,取一定质量橡胶籽并加入一定质量的水(V(橡胶籽)∶V(水)= 1∶20),分别煮10、20、30、40、60 min后采用1.3.3节中的方法分别做加酶和不加酶的处理,再测定其氰化物。
1.3.4.4 蒸橡胶籽(蒸样)时间对氰化物含量测定的影响
将橡胶籽外壳敲除,种仁切成小块,取一定质量橡胶籽,分别蒸20、40、60、80、100、120、140 min后采用1.3.3节的方法分别做加酶和不加酶的处理,再测定其氰化物。
1.3.4.5 烘烤橡胶籽(烘样)时间对氰化物含量测定的影响
将橡胶籽外壳敲除,种仁切成小块,取一定质量橡胶籽加水浸泡12 h后晒干。取一定量晒干后的橡胶籽,分别在130 ℃烘烤5、10、15、20、25、30、35 min后采用1.3.3节的方法分别做加酶和不加酶的处理,再测定其氰化物。
1.3.5 外源β-葡萄糖苷酶活性对橡胶籽中氰化物含量测定的影响
将橡胶籽外壳敲除,种仁切成小块,高温脱毒处理后,加入100 mL蒸馏水使试样全部浸没后调节浸泡时间、温度、加酶量和pH值得到最优单因素条件再进行响应面分析,得到最优结果后再验证。
1.3.5.1 单因素试验设计
以氰化物含量为指标,进行单因素试验设计为:加酶量(5、10、15、20、25、30 U/100 mL)、酶解温度(常温、35、40、45、50、55、60 ℃)、酶解时间(1、2、2.5、3、3.5、4 h)、pH(4、4.5、5、5.5、6.0、6.5、7.0)。
1.3.5.2 响应面试验设计
根据单因素试验结果,结合响应面试验优化测定条件对测定结果的影响,响应面试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Coded levels and corresponding actual levels of the optimization parameters used in Box-Benhnken design
2 结果与分析
2.1 空白实验结果
直接在100mL水中分别加入0.1 mL的0、10、20、 30 U/100mL β-葡萄糖苷酶液后水浴浸泡一段时间测得氰化物含量分别为0、0.437、0.679、0.749 μg/mL。由空白实验结果可看出,加入外源β-葡萄糖苷酶对氰化物含量的测定值的影响只有零点几,数据较小,因此可排除外源β-葡萄糖苷酶对实验结果的影响。
2.2 煮样时间对氰化物含量测定的影响
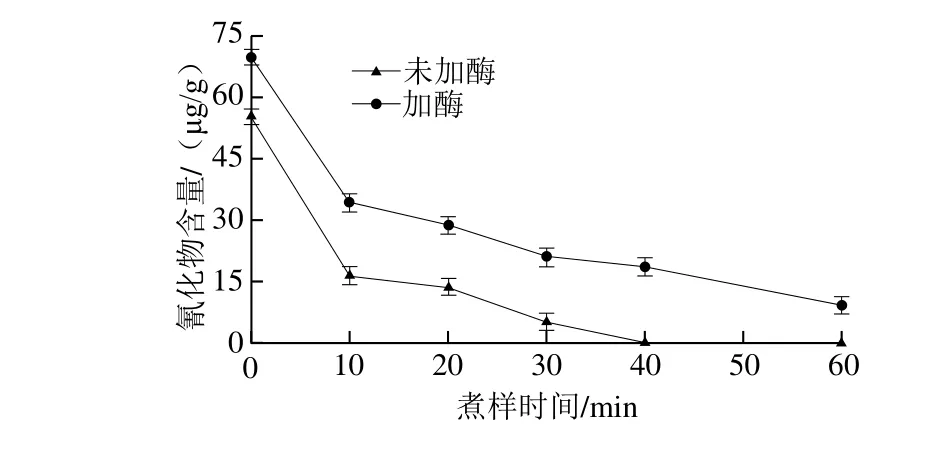
图1 煮样时间对橡胶籽中氰化物含量测定的影响Fig. 1 Effect of boiling time on the cyanide content in rubber seed
如图1所示,在相同的前处理条件下,经水煮后的橡胶籽在检测氰化物过程中加入外源β-葡萄糖苷酶和不加外源β-葡萄糖苷酶两种情况下检出的氰化物含量有明显差别,加入β-葡萄糖苷酶的一组测出来的氰化物残留量更多,说明加入外源β-葡萄糖苷酶对测定结果有一定的影响。水煮40 min后,在不加酶的情况下检测不出氰化物,说明此时橡胶籽内源β-葡萄糖苷酶已经完全失活,但是重新加入外源β-葡萄糖苷酶后,依然能检测出氰化物,说明橡胶籽中的氰苷并没有被充分降解,在外源酶的作用下仍能生成氢氰酸。说明再检测过程中加入外源β-葡萄糖苷酶可使氰化物测定结果更加准确。
2.3 蒸样时间对其氰化物含量测定的影响
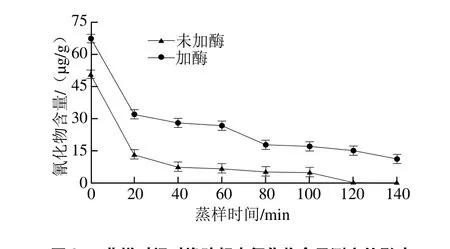
图2 蒸样时间对橡胶籽中氰化物含量测定的影响Fig. 2 Effect of steaming time on the cyanide content in rubber seed
如图2所示,比较图1和图2可知经隔水蒸后的橡胶籽氰化物的检测结果的大体趋势和2.1节水煮橡胶籽的检测结果相同,同样在加入外源β-葡萄糖苷酶和不加外源β-葡萄糖苷酶两种情况下检出的氰化物含量有明显差别,加入β-葡萄糖苷酶的一组测出来的氰化物残留量更多,而水煮橡胶籽氰化物去除所用时间更短效率更高。
2.4 烘样时间对其氰化物含量测定的影响
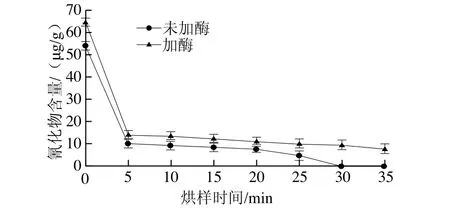
图3 烘样时间对橡胶籽中氰化物含量测定的影响Fig. 3 Effect of baking time on the cyanide content in rubber seed
由图3可知,烘烤样品主要模拟坚果制作工艺进行,在国标法测出氰化物含量在可食用范围内时再在检测过程中加入外源β-葡萄糖苷酶后检测出的氰化物含量会增高,可见加入外源β-葡萄糖苷酶的检测方法在加热条件下更加准确。
由此,不同的热处理方式加工过的原料经外源β-葡萄糖苷酶处理后所测定的氰化物含量均有所增高,证明加入外源β-葡萄糖苷酶对氰化物的测定有积极的影响,可对该方法进行深入探究。
2.5 氰化物标准曲线方程
精确取一定量的氰化钾标准使用溶液,溶解定容稀释成一系列不同已知质量浓度的溶液,测定其吸光度,并绘制标准曲线得到方程y=3.205 1x+0.000 2(y为吸光度,x为氰离子质量浓度/(μg/mL)),R2=0.999 6,说明方程具有良好线性相关性。
2.6 加入外源β-葡萄糖苷酶单因素试验结果
2.6.1 浸泡时间对测定结果的影响
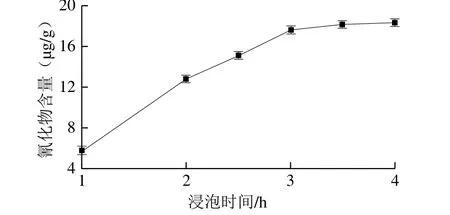
图4 浸泡时间对橡胶籽中氰化物含量测定的影响Fig. 4 Effect of soaking times on the cyanide content in rubber seed
按1.3.5节方法检测外源β-葡萄糖苷酶中的氰化物含量,重复3 次实验检测不出氰化物后,将脱壳后的橡胶籽制成小块后煮沸40 min,得到的样品采用加入外源β-葡萄糖苷酶的异烟酸-吡唑啉酮分光光度法测定其氰化物含量。检测过程中加酶量10 U/100 mL、温度45 ℃、pH 6.5,选择不同的处理时间(1.0、2.0、2.5、3.0、3.5、4.0 h)进行单因素试验,每个处理做2 个重复。由图4可以看出,酶解时间3 h后氰化物含量变化不大,因此浸泡时间选3 h。
2.6.2 加酶量对测定结果的影响
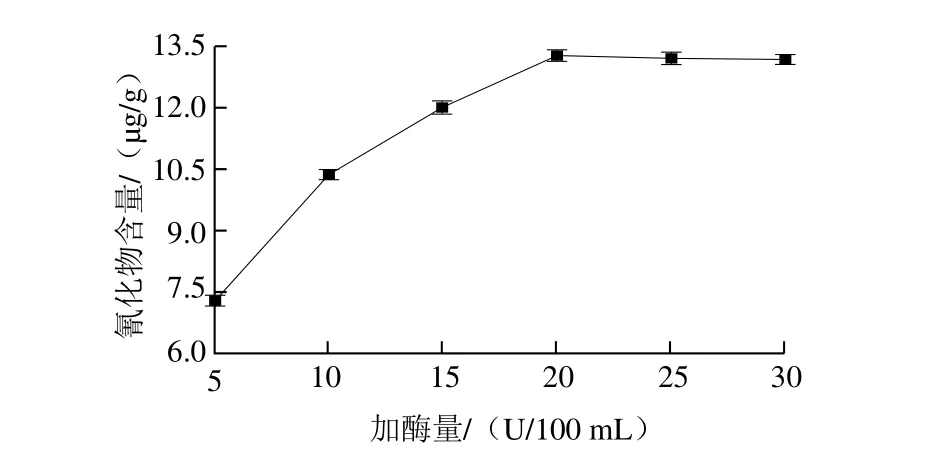
图5 加酶量对橡胶籽中氰化物含量测定的影响Fig. 5 Effect of β-glucosidase concentration on the cyanide content in rubber seed
按1.3.5节方法检测外源β-葡萄糖苷酶中的氰化物含量,重复3 次实验检测不出氰化物后,将脱壳后的橡胶籽制成小块后煮沸40 min,得到的样品采用加入外源β-葡萄糖苷酶的异烟酸-吡唑酮分光光度法测定其氰化物含量。检测过程中浸泡时间3 h、温度45 ℃、pH 6.5,选择不同的加酶量(5、10、15、20、25、30 U/100 mL)进行单因素试验,每个处理做2 个重复。由图5可以看出,加酶量达到20 U/100 mL后氰化物含量变化不大,因此浸泡加酶量选20 U/100 mL。
2.6.3 pH值对测定结果的影响
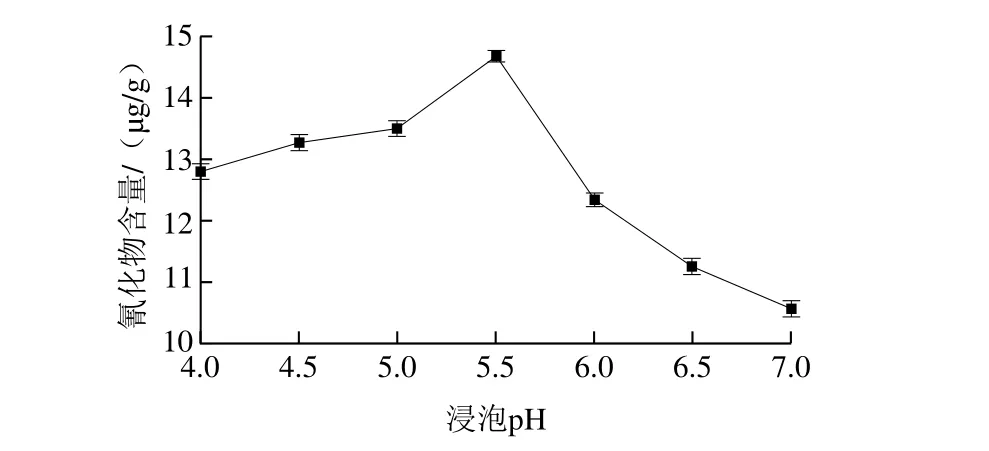
图6 pH值对橡胶籽中氰化物含量测定的影响Fig. 6 Effect of soaking pH on the cyanide content in rubber seed
按1.3.5节方法检测外源β-葡萄糖苷酶中的氰化物含量,重复3 次实验检测不出氰化物后,将脱壳后的橡胶籽制成小块后煮沸40 min,得到的样品采用加入外源β-葡萄糖苷酶的异烟酸-吡唑酮分光光度法测定其氰化物含量。检测过程中浸泡时间3 h、温度45 ℃、加酶量20 U/100 mL,选择不同的pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0)进行单因素试验,每个处理做2 个重复。由图6可以看出,pH值在5.5时氰化物含量达到最大值,因此浸泡pH值选5.5。
2.6.4 浸泡温度对测定结果的影响
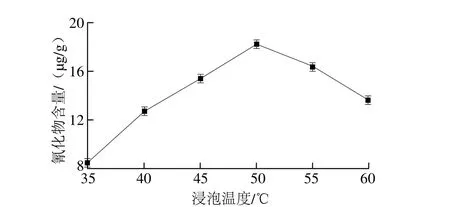
图7 浸泡温度对橡胶籽中氰化物含量测定的影响Fig. 7 Effect of soaking temperature on the cyanide content in rubber seed
按1.3.5节方法检测外源β-葡萄糖苷酶中的氰化物含量,重复3 次实验检测不出氰化物后,将脱壳后的橡胶籽制成小块后煮沸40 min,得到的样品采用加入外源β-葡萄糖苷酶的异烟酸-吡唑酮分光光度法测定其氰化物含量。检测过程中浸泡时间3 h、pH 5.5、加酶量20 U/100 mL,选择不同温度(35、40、45、50、55、60 ℃)进行单因素试验,每个处理做2 个重复。由图7可以看出,浸泡温度在50 ℃时氰化物含量达到最大值,因此浸泡温度选50 ℃。
2.7 响应面优化试验结果
响应面试验设计及结果见表2,方差分析及显著性比较见表3。利用Design-Expert 7.0软件对数据进行回归分析,对各因素进行回归拟合,氰化物含量(Y)的回归方程Y=24.34-1.04A+0.15B+0.94C+0.79D-0.5AB-1.35AC-0.84AD-0.69BC-0.72BD+0.59CD+0.29A2+ 1.15B2+0.69C2+0.76D2。同时,优化4 个影响因素的最佳组合为浸泡时间3.35 h、浸泡温度45.06 ℃、加酶量24.11 U/100 mL、浸泡pH 5.56。以上条件下,预测的氰化物含量为28.79 μg/g。
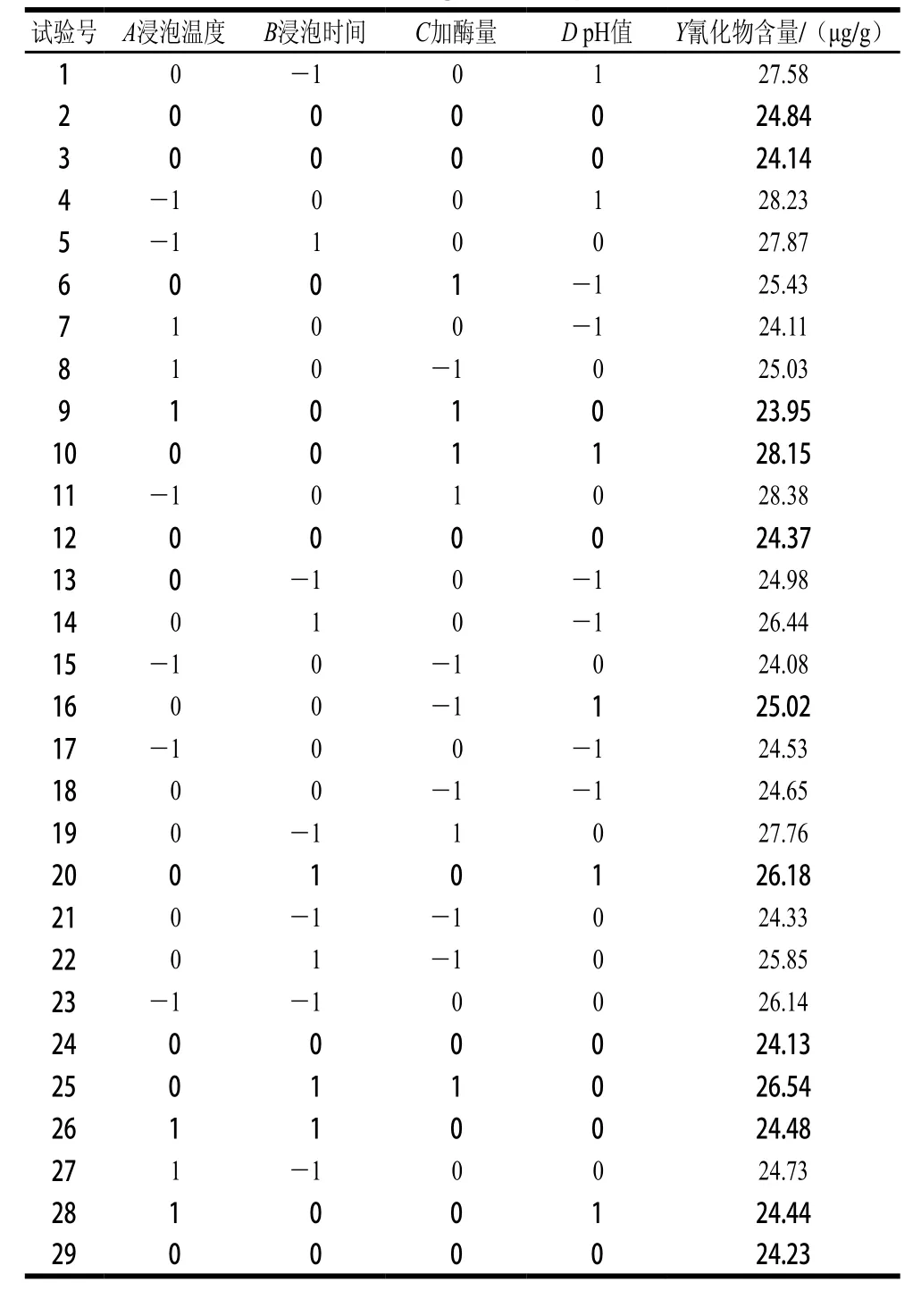
表2 响应面试验设计及结果(n=5)Table 2 Box-Benhnken design with experimental data (n= 5)
由表3可以看出,所得Y的回归方程极显著,且失拟项不显著,说明此模型很理想,用方程Y拟合4 个因素与氰化物含量是可行的。相关系数R2为0.977 4,表明回归方程与实际数据间具有较好的拟合性;为0.954 7,说明可信度较高。从因素A、B、C、D对氰化物含量的影响来看,因素A、C、D为极显著(P<0.01),B不显著;交互项的影响均为极显著(P<0.01);二次项中除A2为显著外(P<0.05),其余均为极显著(P<0.01)。通过比较方程一次项系数绝对值的大小,可以判断因素影响的主次,本实验中因素影响顺序依次为A>C>D>B,且各试验因素对响应值的影响呈二次关系。
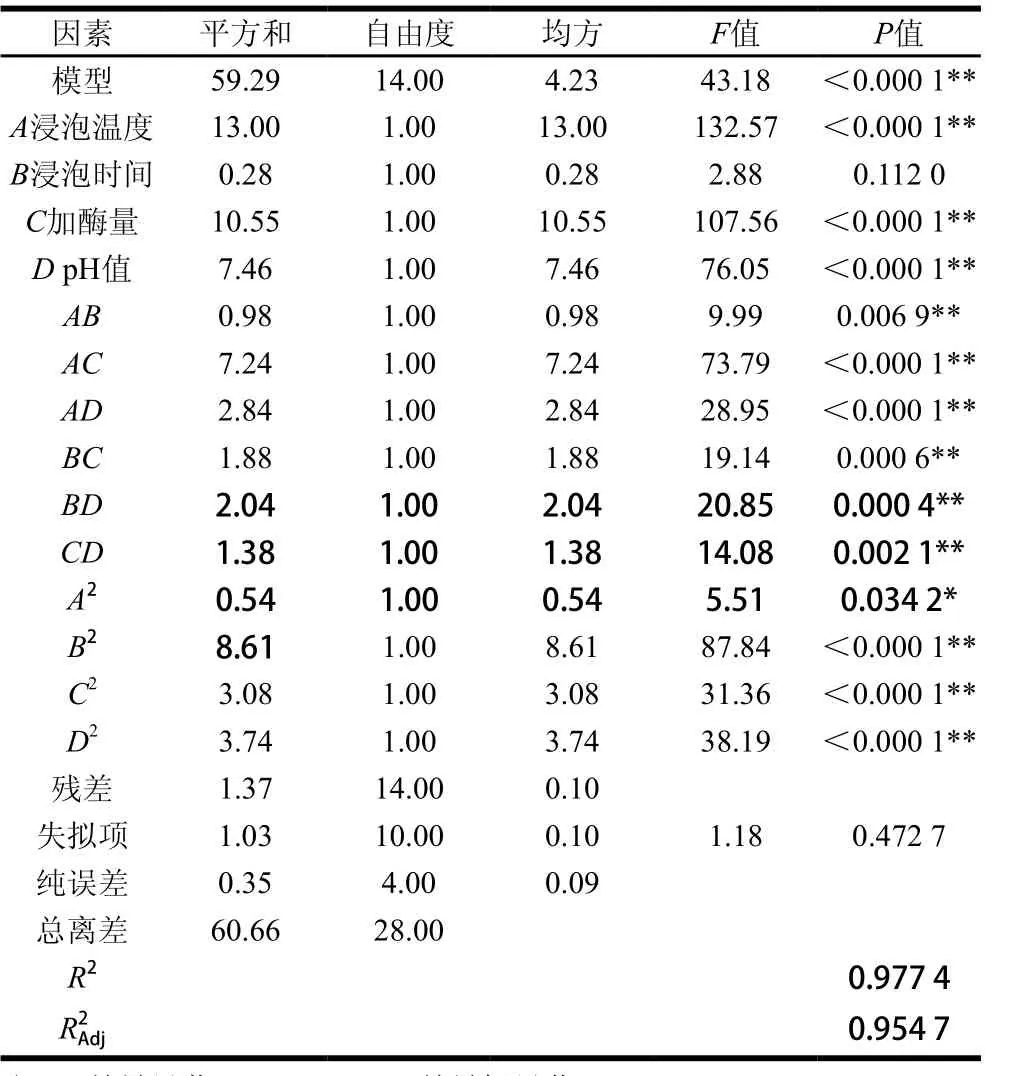
表3 回归模型方差分析Table 3 Analysis of variance of regression equation
分别将模型中A、B、C及D其中2 个因素固定在0水平,得到另外2 个因素间交互作用对氰化物含量Y的子模型,4 个因素间部分两两交互作用对检测氰化物含量的影响的响应面分析结果,如图8所示。
为了检验模型预测的准确性,在最佳条件浸泡时间3.35 h、浸泡温度45.06 ℃、加酶量24.11 U/100 mL,浸泡pH 5.56条件下,测得氰化物含量为28.55 μg/g,与预测值基本接近,表明预测值和真实值间有较好的拟合性,进一步验证了模型的可靠性。

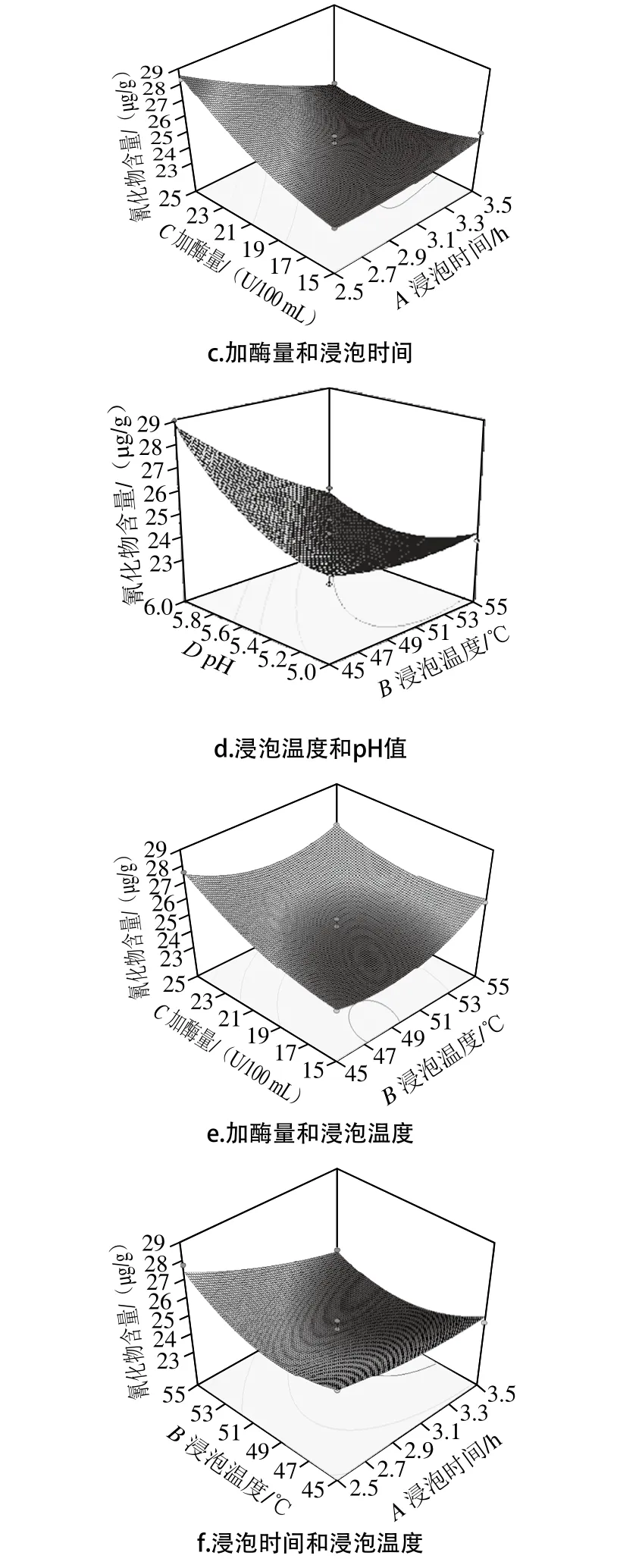
图8 两因素交互作用对氰化物含量的影响Fig. 8 Response surface plots showing the effects of various pretreatment factors on the cyanide content in rubber seed
2.8 加标回收实验
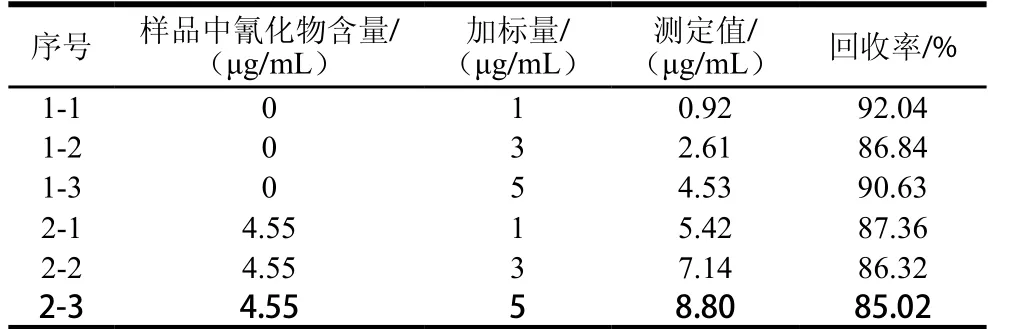
表4 加标回收实验结果Table 4 Recovery of cyanide in spiked samples
为了检验本实验方法的准确性,在样品中加入氰化钾标准使用液,按实验方法对其进行加标回收实验,回收率结果见表4。本实验样品中氰化物的加标回收率为85.02%~92.04%,方法准确度较高,可信度好。
3 结 论
实验结果表明,在不同的热处理条件下橡胶籽内的氰均能去除一半以上,在检测其氰化物含量过程中单纯采用异烟酸-吡唑酮分光光度法所测定出来的氰化物含量较低或不存在,说明一定程度的热处理使橡胶籽本身含有的β-葡萄糖苷酶遭到不同程度地破坏,氰苷不能完全被分解导致测定值较低。在采用加入外源β-葡萄糖苷酶后的异烟酸-吡唑酮分光光度法测定的氰化物含量要更高,说明外源β-葡萄糖苷酶对经热处理未完全释放的氰苷继续作用使其分解得到的测定值更高,可见在内源酶完全失活而没有加入外源酶的情况下测出的总氰结果并不可靠,由此本实验中加入外源β-葡萄糖苷酶后的异烟酸-吡唑酮分光光度法的准确度更高。
[1] 王明国, 李社红, 肖唐付, 等. 氰化物测定研究进展[J]. 地球与环境, 2010, 38(4): 519-526.
[2] 左晨艳, 杨波波, 吴婷, 等. 氰化物中毒及解毒的研究进展[J]. 毒理学杂志, 2016(4): 311-316.
[3] 邸玉敏, 朱军, 常靖, 等. 氰化物测定研究进展[J]. 理化检验: 化学分册, 2011, 47(12): 1491-1494.
[4] 姜珊, 王婷, 王晨. 氰化物测定研究进展[J]. 资源节约与环保, 2015(11): 65.
[5] NGUDI D D, KUO Y H, LAMBEIN F. Cassava cyanogens and free amino acids in raw and cooked leaves[J]. Food and Chemistry Toxicology, 2003, 41: 1193-1197. DOI:10.1016/S0278-6915(03)00111-X.
[6] 叶梅, 吴文林, 郭靓, 等. 离子色谱-脉冲安培检测法快速测定配制酒中的氰化物[J]. 食品科学, 2016, 37(8): 192-195. DOI:10.7506/ spkx1002-6630-201608034.
[7] 邹良平, 起登凤, 李玖慧, 等. 高效液相色谱-蒸发光检测法测定木薯生氰糖苷的含量[J]. 中国农学通报, 2014, 30(24): 47-51. DOI:10.11924/j.issn.1000-6850.2014-0070.
[8] 孟梁, 中贵隽, 张强. 金属配位剂衍生-高效液相色谱法测定粮食及白酒中的游离氰化物[J]. 分析科学学报, 2009, 25(5): 587-589.
[9] CHRISTISON T T, ROHRER J S. Direct determination of free cyanide in drinking water by ion chromatography with pulsed amperometric detection[J]. Journal of Chromatography A, 2007, 1155(1): 31-39. DOI:10.1016/j.chroma.2007.02.083.
[10] 戴安(中国)有限公司. 紫外-离子色谱法直接检测金属氰化物[J].环境化学, 2008, 27(3): 405-407.
[11] SETO Y, TSUNODA N, OHTA H, et al. Determination of blood cyanide by headspace gas chromatography with nitrogenphosphorus detection and using a megabore capillary column[J]. Analytica Chimica Acta, 1993, 276(2): 247-259. DOI:10.1016/0003-2670(93)80391-W.
[12] JERMAK S, PRANAITyTE B, PADARAUSKAS A. Ligand displacement, headspace single-drop microextraction, and capillary electrophoresis for the determination of weak acid dissociable cyanide[J]. Journal of Chromatography A, 2007, 1148(1): 123-127. DOI:10.1016/j.chroma.2007.03.022.
[13] 龙素群, 钟志京, 刘秀华, 等. 离子色谱法测定氰化物方法研究[J].四川大学学报, 2006, 43(6): 1352-1356.
[14] 国家质量监督检验检疫总局. 饲料中氰化物的测定: GB/T 13084—2006[S]. 北京: 中国标准出版社, 2006.
[15] 中国预防医学科学院营养与食品卫生研究所. 粮食卫生标准的分析方法: GB/T 5009.36—2003[S]. 北京: 中国标准出版社, 2003.
[16] 王晓芳, 陈美, 杨春亮. 木薯中氰化物含量的异烟酸-吡唑林酮分光光度法测定[J]. 分析仪器, 2009(1): 32-34. DOI:10.3969/j.issn.1001-232X.2009.01.010.
[17] ABBASI S, VALINEZHAD R, KHANI H. A novel kinetic spectrophotometric method for the determination of ultra trace amount of cyanide[J]. 2010, 77(1): 112-116. DOI:10.1016/j.saa.2010.04.035.
[18] CHEN L, LI N, ZONG M H. A glucose-tolerant β-glucosidase from Prunus domestica seeds: purification and characterization[J]. Process Biochemistry, 2011, 47: 127-132. DOI:10.1016/j.procbio.2011.10.023.
[19] MORANT A V, JORGENSEN K, CHARLOTTE J. β-Glucosidase as detonators of plant chemical defense[J]. Phytochemistry 2008, 69: 1795-1813. DOI:10.1016/j.phytochem.2008.03.006.
[20] HOSEL W, TOBER I, EKLUND S H, et al. Characterization of β-glucosidase with high specificity for the cyanogenic glucoside dhurrin in Sorghum bicolor (L) moench seedings[J]. Archives of Biochemistry and Biophysics, 1987, 252(1): 152-162. DOI:10.1016/0003-9861(87)90019-1.
[21] SORNYOTHA S, KYU K L. Puriification and detection of linamarin from cassava root cortex by high performance liquid chromatography[J]. Food Chemistry, 2007, 104: 1750-1754. DOI:10.1016/j.foodchem. 2006.10.071.
[22] 学京, 陈志霞. 新鲜竹笋中氰化物含量测定及家庭加工方法对其含量的影响[J]. 职业与健康, 2010, 26(5): 514-515.
[23] 陈建新, 刘家运, 刘翠珍. 不同处理方法对木薯氢氰酸含量的影响[J].广东畜牧兽医科技, 1992(4): 13-14.
[24] MLINGI N L V, BAINBRIDGE Z A, POULTER N H, et al. Critical stages in cyanogen removal during cassava processing in southern Tanzania[J]. Food Chemistry, 1995, 53: 29-33. DOI:10.1016/0308-8146(95)95782-2.
[25] 刘畅, 陈宇, 刘石生. 不同处理方法对木薯中氰化物残留的影响[J].食品科技, 2014, 39(12): 190-193.
[26] NARAHARI D, KOTHANDARAMAN P. The influence of processing and storage on hydrogen cyanide and tannin contents of para-rubber seed and its products[J]. Animal Feed Science and Technology, 1983, 9(4): 319-323. DOI:10.1016/0377-8401(83)90025-1.
[27] 王佩环, 杨杰, 刘石生. 橡胶籽β-葡萄糖苷酶水解大豆异黄酮的研究[J].食品科技, 2013, 38(3): 201-205.
[28] 葛云荣. 迷迭香育苗及田间管理[J]. 云南农业, 2001(8): 12.
[29] 李斐然, 刘石生, 王海燕. 橡胶籽中β-葡萄糖苷酶活力测定条件研究[J].食品科技, 2011, 36(5): 264-267.
[30] 李华, 高丽. β-葡萄糖苷酶活力测定方法的研究进展[J]. 食品与生物技术学报, 2007, 26(2): 107-114.
Spectrophotometric Determination of Cyanide Content in Rubber Seeds Using Isonicotinic Acid-Pyrazolone after Exogenous β-Glucosidase Pretreatment
ZHANG Ye1, WANG Ke2, LIU Shisheng1,*
(1. College of Food Science, Hainan University, Haikou 570228, China; 2. Key Laboratory of Tropical Biological Resources, Ministry of Education, Hainan University, Haikou 570228, China)
This study investigated the determination of the residual cyanide content of rubber seeds detoxified by different methods by a spectrophotometric method using isonicotinic acid-pyrazolone with and without exogenous β-glucosidase pretreatment. The results showed that cyanide was undetectable or detectable at a level lower than the actual one by the spectrophotometric method without exogenous β-glucosidase pretreatment, while it was detected at a significantly higher level with the sample pretreatment. The optimized pretreatment conditions were 3.35 h soaking at 45.06 ℃ and pH 5.56 with 24.11 U/100 mL of β-glucosidase added, under which, the predicted cyanide content of rubber seeds was 28.79 μg/g. The recovery of spiked samples ranged from 85.02% to 92.04%. The proposed method was accurate and reliable.
isonicotinic acid-pyrazolone spectrophotometry; β-glucosidase; rubber seed; cyanide; heat treatment
10.7506/spkx1002-6630-201714045
O623.76
A
1002-6630(2017)14-0290-07
张烨, 王珂, 刘石生. 外源β-葡萄糖苷酶处理结合异烟酸-吡唑啉酮分光光度法测定橡胶籽中氰化物含量[J]. 食品科学, 2017, 38(14): 290-296.
10.7506/spkx1002-6630-201714045. http://www.spkx.net.cn
ZHANG Ye, WANG Ke, LIU Shisheng. Spectrophotometric determination of cyanide content in rubber seeds using isonicotinic acid-pyrazolone after exogenous β-glucosidase pretreatment[J]. Food Science, 2017, 38(14): 290-296. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714045. http://www.spkx.net.cn
2016-08-03
国家自然科学基金地区科学基金项目(31460407)
张烨(1991—),女,硕士研究生,研究方向为食品工程。E-mail:1551540220@qq.com
*通信作者:刘石生(1977—),男,教授,博士,研究方向为天然植物资源开发与利用。E-mail:stoneliu77@126.com
