阿奇霉素片的溶出度研究
2017-07-20商鼎
商鼎
摘 要 目的:建立阿奇霉素片的体外溶出度检测方法并进行原研药与仿制药的相似性评价。方法:对该片剂的溶出度测定的基本条件(转速、取样时间、装置、溶出介质)进行筛选,确定溶出参数,用高效液相色谱法测定含量。绘制原研药在不同溶出介质中的溶出曲线。采用f2因子法评价仿制药与原研药的相似性。结果:根据溶出曲线的区分效果将本次溶出介质定为pH 1.2、pH 4.5、pH 6.8和水,阿奇霉素片在四种溶出介质中稳定性良好,RSD小于2%。自制样品与原研药溶出行为相似。结论:该方法可作为处方筛选的依据。
关键词 阿奇霉素片 溶出度 溶出曲线 f2因子
中图分类号:R927.11 文献标识码:A 文章编号:1006-1533(2017)13-0063-04
Study on the dissolution of azithromycin tablets
SHANG Ding*
(Shanghai New Asia Pharmaceutical Co., LTD., Shanghai 201203, China)
ABSTRACT Objective: To establish a method for the dissolution determination of content of azithromycin tablets in vitro and to evaluate the similarity between reference listed drug (RLD) and home-made drug. Methods: The best conditions(rotational speed, sampling time, apparatus and releasing media) for dissolution determination were selected by experiment and the content was measured by HPLC. The dissolution curves in media with different pH value were drawn and the similarity between RLD and home-made drug was evaluated by f2 factor. Results: The dissolution media at pH 1.2, pH 4.5, pH 6.8 value and water were selected based on the distinction effect of the dissolution profile. Azithromycin tablets showed good stability in four dissolution media with RSD less than 2%. The dissolution behavior was similar between RLD and home-made drug. Conclusion: This method can be used as the basis for formulation screening.
KEY WORDS azithromycin; dissolution rate; dissolution curve; f2 factor
阿奇霉素(azithromycin)是第一個十五元环大环内酯类抗生素,也是第一个氮杂内酯类抗生素[1]。它是由南斯拉夫Sour Pliva公司开发研制的,1988年首先上市,后转让给美国辉瑞(Pfizer)公司[2]。其作用机理和红霉素相似,通过抑制细菌蛋白质的合成而起作用[3]。阿奇霉素与红霉素相比最大的特点是对酸稳定,且其在酸中的化学稳定性与其在胃酸中相一致[4]。已有药理学研究发现,阿奇霉素片生物利用率可达37%,其临床给药次数少,疗程短,被认为是一个很有效的大环内酯类抗生素,临床应用广泛,尤其适合于混合感染的治疗[5-7]。文献调研发现不同厂家的阿奇霉素片和原研制剂相比生物利用度具有很大差异[8-11],故对原研制剂和仿制制剂的疗效进行全面的研究是迫切需要的。
阿奇霉素片为普通口服固体制剂,其溶解性和渗透性均较差,属于BCS4类产品,因此需要对其质量进行再评价。由于口服阿奇霉素片后在人体的胃肠道吸收,故本研究模拟人体胃肠道的环境继续了pH 1.2~6.8的范围的溶出条件摸索。目前我国正在开展口服固体制剂质量和疗效一致性评价工作,比较原研品和自制品的溶出曲线是否相似可降低两者出现临床疗效差异的风险。故建立具有区分力的溶出度检测方法是十分重要的工作。本研究中阿奇霉素片溶出方法的建立对指导药物制剂的开发、严格控制制剂的内在质量、保证药物安全性和有效性以及实现仿制药和原研药的可替换具有十分重要的意义。
1 材料和方法
1.1 仪器和试药
708-DS药物溶出仪(安捷伦科技公司);1260高效液相色谱仪(安捷伦科技公司)。阿奇霉素原料:批号160801。阿奇霉素自制片:批号160801、160802、160803。阿奇霉素参比制剂:美国辉瑞公司Zithromax,批号H79644。
1.2 方法
1.2.1 溶出度测定的液相色谱条件
参考欧洲药典阿奇霉素原料质量标准中的含量测定方法[12]。
色谱柱以十八烷基聚乙烯醇为填充剂(Asahipak ODP-50E,4.6×250 mm,5 μm);流动相为6.7 g/L磷酸氢二钾溶液(用10 mol/L氢氧化钾溶液调节pH至11.0)-乙腈(40∶60);波长280 nm;流速1.0 ml/min;柱温40 ℃;进样体积10 μl;溶剂为(6.7 g/L磷酸氢二钾溶液,用磷酸调pH至8.0)-乙腈(40∶60)。按外标法以峰面积计算含量。供试品及对照品溶液浓度为0.53 mg/ml。
1.2.2 溶解度测定
取过量阿奇霉素原料药,置8支具塞试管中,分别精密加入醋酸、磷酸、硼酸、氢氧化钠配置的不同pH缓冲溶液(pH 1.8、pH 2、pH 3、pH 4、pH 5、pH 6、pH 7、pH 8)5 ml,置37 ℃水浴振荡过夜,使之形成过饱和溶液,滤过,取续滤液经HPLC法测得溶解度。
1.2.3 不同介质中稳定性比较
按照普通口服固体制剂溶出曲线测定与比较指导原则,用不同盐配置不同的溶出介质,取适量原料药,按照0.53 mg/ml的浓度分别配置在100 ml量瓶中,于室温放置0、20、40、60、80、100、120、140、240、360、480 min时取样进行HPLC检测。
1.2.4 溶出参数确定
对溶出方法中的取样时间、装置、溶出介质的类型和比例、转速等进行改变调整,并进行HPLC检测。
1.2.5 自制品与原样品溶出行为对比
取原研品和3批自制样品各12片,使用pH 1.2盐酸溶液、pH 4.5磷酸盐缓冲液、pH 6.8磷酸盐缓冲液和含有0.15%的十二烷基硫酸钠的水溶液900 ml为溶出介质,桨法,50 r/min。前三种溶出介质在溶出开始后5、10、15、20、30 min时取样,后面的水溶液介质在溶出开始后5、10、15、20、30、45、60、90、120 min时取样,过滤后取续滤液进行HPLC检测。得到累积溶出度后,绘制累积溶出度曲线,并通过f2因子法与原研品进行对比。
2 结果
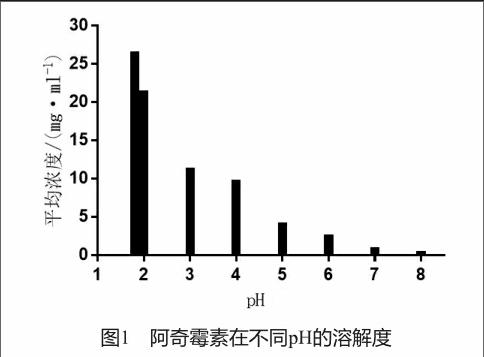
2.1 不同pH介质中溶解度测定
溶解度测定结果见图1。数据显示阿奇霉素是pH依赖型药物,随着pH的增大,溶解度逐渐减小。采用此法,排除了不同酸根和离子强度的影响,现配现测,能比较真实地反应阿奇霉素在不同pH条件下的溶解度。
2.2 在不同盐配制的不同pH介质中的稳定性
发现在pH 3.0磷酸盐缓冲液中,140 min内,峰面积RSD小于2%;在其他介质中,140 min内,峰面积RSD均大于2%,故在pH 3.0磷酸盐缓冲液中,要比在其他介质中稳定。阿奇霉素在相同pH不同酸根溶液中,稳定性也不一样,在醋酸溶液中最不稳定,在磷酸溶液中相对稳定。稳定性顺序:醋酸-醋酸钠缓冲液<醋酸-磷酸-硼酸-氢氧化钠缓冲液<柠檬酸-磷酸氢二钠缓冲液<磷酸二氢钾-磷酸溶液。测定了Zithromax在pH 5.0醋酸盐缓冲液900 ml- 桨法-50 r/min和pH 5.0磷酸盐缓冲液 900 ml- 桨法-50 r/min时,发现他们均在20~30 min内全部溶出,无明显差异,故确定磷酸盐缓冲液为首选溶出介质。
2.3 溶出度试验参数的确定
2.3.1 溶出介质体积和取样时间点
在pH 6.0、pH 6.5、pH 6.8、pH 7.5的磷酸盐缓冲液500 ml-桨法-50 r/min、120 min时不能完全溶出。在pH 6.0磷酸盐缓冲液500 ml-桨法-65 r/min和75 r/min、120 min时仍不能完全溶出,而转速加快至100 r/min时溶出又太快不具有区分力。
对于普通片剂一般采用大杯法,介质体积为900~ 1 000 ml,不建议采用小杯法[13],故溶出介质体积设定为900 ml。取样时间点设置为5、10、15、20、30、45、60、90、120 min。
2.3.2 装置的选择
鉴于篮法与桨法通用性强、耐用性好且广泛普及,故试验了他们对阿齐霉素片溶出度测定的影响。
Zithromax在pH 6.0磷酸盐缓冲液900 ml-桨法-50 r/min和60 r/min、120 min时仍未完全溶出;而在75 r/min、15 min时全部溶出;观察溶出杯内现象,发现片剂崩解后,颗粒沉降在杯底有成堆现象,可能会影响最终溶出度考察,考虑换用篮法。
篮法测试中,片剂崩解后,不溶物从篮内流出,沉降到杯底,未见成堆现象;原研品在pH 6.0磷酸盐缓冲液900 ml-篮法-75 r/min、15 min时全部溶出;而在50 r/min时,约需90 min时全部溶出,但在5~10 min时,RSD偏大;在60 r/min时,45~60min全部溶出,但在5~10 min时,RSD仍偏大。
通過对溶出现象的观察,发现片剂薄膜衣会粘到转篮上,进而影响片剂崩解和溶出,不能比较真实地反映片剂在体内的崩解溶出情况,故仍考虑采用桨法。
2.3.3 溶出条件的确定
在水900 ml-桨法-75 r/min时,不溶物呈絮状漂浮在杯底,无堆积现象,90 min时溶出约22%。添加吐温80后,空白样品中出现杂峰,运行时间由8 min调整到50 min,运行时间太长,考虑换用十二烷基硫酸钠(SDS)。
Zithromax在水介质+0.05%、0.1% SDS 900 ml-桨法-75 r/min条件下,120 min时仍不能完全溶出;在水介质+0.2% SDS 900 ml-桨法-75 r/min条件下,45 min时完全溶出。
Zithromax在水介质+0.15% SDS 900 ml-桨法-75 r/min条件下,60 min时完全溶出;在水介质+0.25% SDS 900 ml-桨法-75 r/min条件下,20 min时完全溶出。
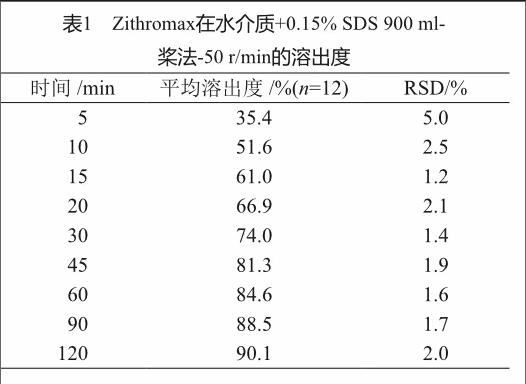
Zithromax在水介质+0.15% SDS 900 ml-桨法-50 r/min条件下,同样约60 min全部溶出(表1);因此选择水介质+0.15% SDS 900 ml-桨法-50 r/min作为最终溶出条件。

基于以上研究,最终确定4条溶出曲线条件为pH 1.2盐酸溶液、pH 4.5磷酸盐缓冲液、pH 6.8磷酸盐缓冲液、水介质+0.15% SDS 900 ml-桨法-50 r/min。
2.4 原研和自制品的溶出曲线
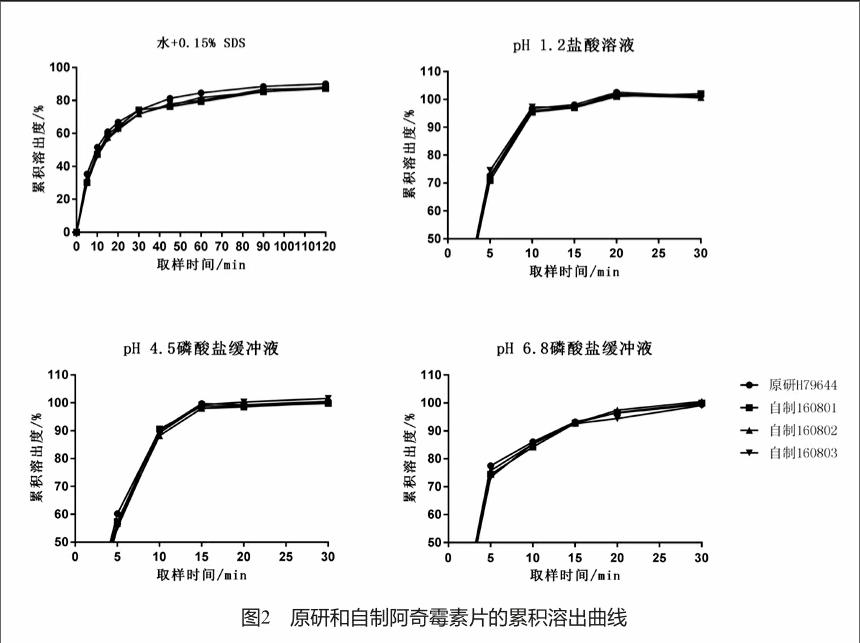
2.4.1 自制品在pH 1.2、pH 4.5、pH 6.8、水+0.15% SDS中的溶出曲线
自制样品在pH 1.2盐酸溶液,pH 4.5、pH 6.8磷酸盐缓冲液900 ml-桨法-50 r/min时,均在15 min内全部溶出,溶出行为同Zithromax相似(图2)。
2.4.2 原研和自制品的f2因子
自制样品在水介质+0.15% SDS 900 ml-桨法-50 r/min条件下,与Zithromax进行溶出行为相似性比较,选取10、20、45、90 min四个点,得到三批自制品f2因子数值分别为为67、72、69,均满足f2因子大于50的要求,RSD符合指导原则要求,自制样品与参比制剂溶出行为相似。
3 讨论
本研究是国内首次对阿奇霉素片的原研制剂和自制制剂进行了四种体外溶出介质对比研究。通过对转速、溶出介质种类和浓度、溶出装置等条件的筛选,对原研品进行溶出条件摸索,最终确定了具有区分力的溶出曲线测定的实验方法和条件,从而建立了阿奇霉素片的体外溶出度测定方法,该方法测定的原研品和自制品溶出数据RSD符合相关指导原则要求,能够真实体现阿奇霉素片的溶出度考查结果。中国药典中阿奇霉素片的溶出度检查法[14]为单点测定,本研究则依据阿奇霉素原研制剂建立了多种溶出介质多点对比的方法。然后对自制样品和参比制剂进行溶出行为相似性研究,计算f2因子,得到的结论是自制样品和原研品的溶出行为相似。该方法的建立为以后阿奇霉素片原研药与仿制药的相似性评价,剖析处方,制备出与原研药具有相同的给药途径、活性成分、剂型和治疗作用的替代药品打下了坚实基础。
参考文献
[1] 李显志, 王浴生. 第一个15 元大环内酯类抗生素Azithromycin[J]. 国外医药(抗生素分册), 1991, 12(2): 118-125.
[2] Lazarova Z, Kazar J, Auxtova S, et al. Azithromycin(Sumamed-Pliva) in the treatment of chlamydial genital tractinfections in infertile marriages[J]. Int J STD AIDS, 1992, 3(6): 448-449.
[3] 刘晓园. Azithromycin的抗菌活性、药代动力学和临床应用[J]. 国外医药(合成药、生化药、制剂分册), 1993, 4(3): 154.
[4] Fiese EF, Steffen SH. Comparison of the acid stability of azithromycin and erythromycin A[J]. J Antimicrob Chemother, 1990, 25 (Suppl A): 39-47.
[5] 高燕霞, 张菁, 张哲峰, 等. 阿齐霉素的两种含量测定方法比较[J]. 中国抗生素杂志, 2000, 25(5): 388-390.
[6] 孙曼琴, 康子胜, 许军, 等. Azithromycin的体内抗菌作用研究[J]. 中国抗生素杂志, 1995, 20(5): 32.
[7] 吴超男, 陈娜娜, 李玉琴, 等. 阿奇霉素研究进展[J]. 泰山医学院学报, 2016, 37(11): 1317-1320.
[8] 黄蓓琳, 吴涓, 王国平, 等. 阿齐霉素片剂的溶出度比较[J]. 同济大学学报(医学版), 2005, 26(1): 32-34.
[9] 吴瀛达, 鲍仕慧, 王建芳, 等. 四厂家阿奇霉素片溶出度考察[J]. 中国药业杂志, 2007, 16(19): 16-17.
[10] 馬素英, 尚校军, 孙祥德, 等. 不同厂家阿奇霉素片溶出度评价[J]. 中国药房, 2008, 19(22): 1734-1736.
[11] 汪华蓉, 余蕾, 易发红, 等. 市售6钟阿奇霉素制剂的人体生物等效性研究[J]. 中国药房, 2011, 22(30): 2822-2824.
[12] The European Pharmacopeia. European Pharmacopeia 8.0[M]. European Directorate for the Quality of Medicines & Health Care, 2013: 1610-1612.
[13] 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946-950.
[14] 国家药典委员会. 中华人民共和国药典(2015版) 二部[M]. 中国医药科技出版社, 2015: 561.
