泛素特异性蛋白酶19对烟熏诱导慢性阻塞性肺疾病大鼠模型骨骼肌萎缩的作用及机制
2017-07-19徐卫国管思彬郭雪君
刘 乾, 刘 松, 徐卫国, 管思彬, 郭雪君
(上海交通大学医学院附属新华医院呼吸科, 上海 200092)
泛素特异性蛋白酶19对烟熏诱导慢性阻塞性肺疾病大鼠模型骨骼肌萎缩的作用及机制
刘 乾, 刘 松, 徐卫国, 管思彬, 郭雪君
(上海交通大学医学院附属新华医院呼吸科, 上海 200092)
目的 通过烟熏制备慢性阻塞性肺疾病(COPD)大鼠模型, 研究泛素特异性蛋白酶-19(USP-19)在COPD相关骨骼肌萎缩中的作用及机制。方法 烟熏诱导大鼠COPD模型,观察肺及骨骼肌组织的组织形态学变化,利用蛋白质印迹法(Western blotting)及实时定量聚合酶链式反应(RT- PCR)观察骨骼肌细胞内USP-19、肌球蛋白重链(MHC)及丝裂原活化蛋白激酶(MAPKs)基因的表达情况。结果 烟熏建立的大鼠COPD模型, 大鼠肺组织呈肺气肿改变, 烟熏12周时, 每高倍镜视野下肌纤维数量增多40%,间接提示骨骼肌发生萎缩; 骨骼肌细胞内MHC表达明显下调,与烟熏时间呈负相关; 萎缩的骨骼肌细胞内USP-19基因的转录和表达均明显上调, 与烟熏时间呈正相关,与MHC表达呈负相关; 萎缩的骨骼肌细胞内MAPKs通路磷酸化水平明显增强 (P<0.05)。结论 USP-19基因参与COPD模型鼠骨骼肌萎缩的发生,起负性调节作用,此作用可能通过MAPKs通路实现。
烟熏; 泛素特异性蛋白酶-19(USP-19); 慢性阻塞性肺疾病(COPD); 骨骼肌萎缩;丝裂原活化蛋白激酶(MAPKs)
目前, 全球慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease, 以下简称COPD)的发病率和死亡率正逐年增高, 吸烟是COPD发生的主要危险因素之一。除呼吸系统的症状及体征外, 营养不良、体质量下降以及骨骼肌萎缩等被视为较为重要的肺外表现。近年来研究表明, 骨骼肌的消耗与肌蛋白降解加速密切相关,其中由泛素介导的蛋白质降解途径发挥了重要作用。目前已有研究多集中在泛素连接过程,对于去泛素化的研究还知之甚少。
本实验采用烟熏制备COPD大鼠模型,对实验大鼠进行了骨骼肌的病理形态学观察,同时选取泛素特异性蛋白酶-19(USP-19)作为研究对象,分别检测烟熏前后股四头肌组织内USP-19基因的表达。试图通过动物实验来探讨模型大鼠如何发生骨骼肌萎缩,以及USP-19参与骨骼肌细胞萎缩的发生过程,为今后临床上USP-19基因用于治疗骨骼肌萎缩提供实验数据。
1 材料与方法
1.1 制备COPD大鼠模型与分组
SPF级15周龄雄性SD大鼠, 平均体质量350 g,购自上海斯莱克实验动物责任公司[SCXK(沪)2007-0005],饲养于上海交通大学医学院附属新华医院实验动物中心[ SYXK(沪)2008-0052]。实验动物分组:随机数字方法将实验动物分为对照组(6只),烟熏4周模型组(6只),烟熏8周模型组(6只)和烟熏12周模型组(6只)。使用烤烟型大前门香烟(购自上海烟草集团公司, 焦油量为11 mg), 模型组每日上午在自制有机玻璃箱(容积为240 L, 长宽高分别为80 cm, 60 cm, 50 cm)内被动吸烟。每6只动物一箱,每次同时燃烧6支香烟,每日4次,每次烟熏间隔时间为2 h。连续烟熏4周、8周和12周。对照组动物正常吸入空气。分别于实验4周、8周和12周称量体质量,用腹腔注射质量分数1%戊巴比妥钠处理动物并取肺组织及股四头肌(骨骼肌)。
1.2 大鼠营养不良的判断
COPD模型组大鼠体质量降低大于预计值的10%,可判断为营养不良。预计值为同等条件下正常对照组同龄大鼠的平均体质量。
1.3 病理组织学分析
将肺组织及股四头肌于体积分数4%多聚甲醛内固定24 h,石蜡包埋,行HE染色后于光学显微镜下观察。
1.4 大鼠各组织内USP-19基因表达情况
取正常大鼠皮肤、大脑、肺脏、肝脏、心脏、股四头肌、血管、脾脏, 提取各组织总RNA。
1.5 实时定量聚合酶链式反应(RT- PCR)
提取的总RNA经逆转录后进行RT- PCR。循环条件如下: 预变性:95℃ 30 s; PCR反应:95℃5 s, 60℃ 34 s,进行40个循环。2-△△Ct法进行相对定量分析, 公式: ΔCt = Cttarget-CtGAPDH; ΔΔCt = Δ Ct (CS) -Δ Ct (CTRL); 基因表达水平= 2-ΔΔCt。引物序列:
GAPDH上游: 5'-AAG GTC GGA GTC AAG GGA TTT-3'
GAPDH下游: 5'-AGA TGA TGA CCC TTT TGG CTC-3'
USP-19上游: 5'-GGC ACA AGA TGA GGA ACG A-3'
USP-19下游: 5'-CAG ATA AAG GAA CGG GTC AA-3'
MHC上游: 5'-GCG GAA AGA AAG GTG GCA AGA-3'
MHC下游: 5'-TGG GAA TGA GGC ATC GGA CAA-3'
MyoG上游: 5'-GCG GAA AGA AAG GTG GCA AGA-3'
MyoG下游: 5'-TGG GAA TGA GGC ATC GGA CAA-3'
1.6 Western blotting
提取细胞总蛋白, 利用十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)进行变性电泳, 转膜, 一抗孵育过夜后二抗孵育2 h; 用ChemiDoc XRS+ Systems远红外成像系统扫描结果, 并通过Image Lab 2.0软件以GAPDH为内参进行分析, 分别进行三次独立实验。
1.7 统计方法
RT- PCR、Western blotting结果进行数据统计, 数值以表示,采用SPSS 13.0软件进行方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 大鼠的一般情况
建模早期(染毒4周)模型组大鼠在染毒箱中吸烟时比较安静,驱散大鼠聚堆时,部分大鼠有轻度喘息,停止吸烟约半小时后饮食与活动恢复正常,与正常对照组无明显区别。继续烟熏,部分大鼠在吸烟以外的时间出现轻度喘息,活动相对减少, 皮毛黄涩, 行动迟钝, 摄食、饮水减少。正常对照组大鼠饮食正常, 活动灵敏, 皮毛清洁有光泽。
2.2 COPD大鼠模型肺组织的病理改变
对照组大鼠气道上皮结构完整,肺泡结构正常(图1A); 烟熏组大鼠细支气管狭窄变形,管腔内有炎症细胞及脱落的上皮细胞; 黏膜下及细支气管周围可见以淋巴细胞为主的炎症细胞浸润; 肺泡壁增厚,有炎症细胞浸润,可见纤维细胞增生,部分肺泡壁破裂,相邻肺泡融合形成肺大泡; 具有慢性细支气管炎及肺气肿的病理改变(图1B)。
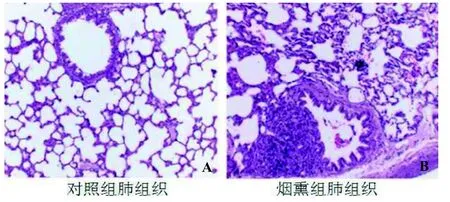
图1 大鼠肺脏组织学形态 (HE×100)Figure 1 Histopathological observation on lung of rat (HE×100)
2.3 大鼠体质量变化
造模前模型组和对照组大鼠体质量差异无统计学意义(P>0.05)。随后烟熏组大鼠体质量增长速度下降。烟熏8周时模型组大鼠体质量明显低于对照组, 但尚未达到营养不良的标准; 烟熏12周时模型组大鼠体质量明显低于对照组(P<0.01), 且体质量下降已超过预计值的10%, 出现营养不良改变(表1)。
2.4 COPD模型大鼠骨骼肌组织形态变化
大体观察见对照组大鼠股四头肌组织饱满、有光泽、弹性佳, 显微镜下见肌纤维排列紧密, 细胞核排列整齐,间质内有少量纤维组织(图2A)。而烟熏大鼠骨骼肌组织暗涩、绵软, 显微镜下观察见肌纤维横截面积较正常对照组减小,间质内纤维组织增多,血管组织增生及部分毛细血管扩张充血(图2B)。高倍镜下每个视野烟熏大鼠肌纤维数量(362.0±17.7个)较正常对照组(257.0±15.1个)明显增多,间接反应出肌纤维发生萎缩。
2.5 大鼠各组织内USP-19基因表达情况
各组织内均有USP-19基因表达,心肌组织骨骼肌组织内表达较高(图3)。
2.6 大鼠骨骼肌内MHC及USP-19基因表达
与对照组相比, 8周及12周的烟熏大鼠骨骼肌组织内USP-19 mRNA和蛋白表达均有所上调(P<0.05),且与烟熏持续时间呈正相关, 烟熏4周后USP-19表达虽上调, 但与对照组相比差异不明显; 4周、8周及12周烟熏后大鼠股四头肌组织内MHC mRNA和蛋白表达均下调(P<0.05), 且与烟熏时间呈负相关与体质量下降呈正相关。提示烟熏引起骨骼肌萎缩是体质量下降、营养不良的原因之一; USP-19蛋白在骨骼肌萎缩过程中可能起到负性调节作用(图4)。
2.7 COPD大鼠模型骨骼肌内MAPKs活性的变化
总ERK和p38水平未发生明显改变,烟熏组大鼠骨骼肌组织内磷酸化ERK和p38水平明显升高, 表明细胞内ERK和p38信号通路被激活(图5)。

表1 大鼠体质量 g
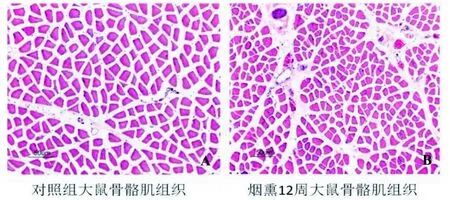
图2 大鼠股四头肌组织学形态 (HE×100)Figure 2 Histopathological features of rats quadriceps femoris (HE×100)
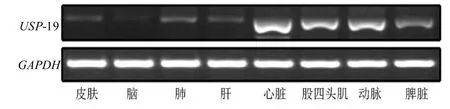
图3 USP-19在组织内的表达Figure 3 USP-19 expression pattern in normal tissues

图4 大鼠骨骼肌组织内MHC和USP-19基因的表达变化Figure 4 MHC and USP-19 gene expression levels

图5 大鼠骨骼肌组织内MAPKs通路表达情况Figure 5 Cigarette smoke affected MAPKs signaling pathways activities in skeletal muscle
3 讨论
近年来, COPD的发病率和病死率逐年增加,COPD可引起广泛的肺外损伤,已知泛素-蛋白酶体系参与骨骼肌萎缩的过程,这一体系是由多种泛素化酶及去泛素化酶构成,目前研究多集中在泛素化过程,对于去泛素化酶的作用及机制还知之甚少[1]。
本文实验证实,通过12周的烟熏可使大鼠肺组织产生肺气肿改变, 且8周及12周的烟熏暴露可诱发显著的体质量减轻及肌肉体积减少。Lee等[2]研究表明, 16周的持续烟熏可导致大鼠肺实质损伤,气肿形成及体质量减轻,与本文结果相似。实验显示,在核酸及蛋白质水平,骨骼肌组织内的MHC发生明显减少,表明骨骼肌组织发生萎缩,烟熏引起骨骼肌萎缩的因素可能包括缺氧,高碳酸血症, 营养耗竭, 全身炎症反应和氧化应激[3]。
骨骼肌细胞内表达多种去泛素化酶,其中部分在骨骼肌内特异性表达[4]。Urso等[5]研究制动48 h后人骨骼肌细胞内基因的表达,表明泛素特异性蛋白酶-6(USP-6)mRNA水平明显升高; Radom-Aizik等[6]对COPD患者进行12周的耐力训练后检测骨骼肌的基因表达,表明泛素特异性蛋白酶-15(USP-15)表达较未参加训练者明显升高; Bosch-Comas等[7]研究表明,USP-25表达增强可以抑制肌球蛋白结合蛋白C1的降解,从而影响肌肉的分化和生长。本文作者研究首次表明, 烟熏可刺激萎缩的骨骼肌组织内USP-19基因的表达。USP-19的表达与体质量,MHC水平呈负相关, 且与烟熏暴露时间呈正相关。这些结果提示,USP-19基因为骨骼肌分解代谢中的负性调节因子。Combaret等[8]研究表明,恶性肿瘤及长期使用糖皮质激素可诱导大鼠发生骨骼肌萎缩, 萎缩的骨骼肌细胞内USP-19基因表达明显上调; Bedard等[9]研究表明,USP-19基因敲除的小鼠在糖皮质激素化过程中,较对照组不易发生骨骼肌萎缩。这些结果与本文结果一致。
本实验中烟熏12周后,骨骼肌细胞内2条主要的MAPKs信号传导通路被激活,分别为p38及ERK通路。这与已有的多项研究结果相似。如Lecker等[10]证实USP-14在骨骼肌萎缩过程中起负向调节作用,而这一作用可能通过刺激细胞内ERK磷酸化水平而实现; Lee等[2]也证实氧自由基,肿瘤坏死因子a(TNF-a)所诱导的肌纤维的降解机制与p38 MAPK有关,p38的磷酸化水平升高有利于骨骼肌细胞萎缩和蛋白质降解。Penna等[11]研究证实,恶性肿瘤诱发的恶病质病程中,大鼠的骨骼肌组织发生明显萎缩,萎缩肌肉内ERK磷酸化水平明显升高; Koistinen等[12]研究表明,2型糖尿病模型大鼠的萎缩骨骼肌组织内p38MAPK通路磷酸化水平明显上调。这些证据均提示MAPKs通路参与骨骼肌萎缩的发生。
总之,本研究初步证实USP-19作为一个负性调节基因,参与了COPD大鼠骨骼肌萎缩的过程。欲证实USP-19基因是否通过MAPKs通路参与骨骼肌细胞的降解,需通过体外实验,利用p38及ERK抑制剂及沉默RNA技术加以论证。本文研究结果将有助于对COPD患者骨骼肌功能障碍/骨骼肌萎缩的发生机制的探索,有助于临床早期发现并避免其高危因素、预防萎缩的发生。
[1] Wing SS. Deubiquitinases in skeletal muscle atrophy[J]. Int J Biochem Cell Biol, 2013, 45(10):2130-2135.
[2] Lee JH, Lee DS, Kim EK,et al. Simvastatin inhibits cigarette smoking-induced emphysema and pulmonaryhypertension in rat lungs[J]. Am J Respir Crit Care Med, 2005, 172(8):987-993.
[3] Man WD, Kemp P, Moxham J, et al. Skeletal muscle dysfunctionin COPD: Clinical and laboratory observations [J]. Clin Sci (Lond), 2009, 117(8):251-264.
[4] Quesada V, Díaz-Perales A, Gutiérrez-Fernández A, et al. Cloning and analysis of 22 novel human ubiquitin-specific proteases[J]. Biochem Biophys Res Commun, 2004 , 314(1): 54-62.
[5] Urso ML, Scrimgeour AG, Chen YW, et al. Analysis of human skeletal muscle after 48h immobilization reveals alterations in mRNAand protein for extracellular matrix components [J]. J Appl Physiol, 2006, 101(4):1136-1148.
[6] Radom-Aizik S, Kaminski N, Hayek S, et al. Effects of exercise training on quadriceps muscle gene expression in chronic obstructive pulmonary disease[J]. J Appl Physiol, 2007, 102(5):1976-1984.
[7] Bosch-Comas A, Lindsten K, Gonzalez-Duarte R, et al. The ubiquitin-specific protease USP25 interacts with three sarcomeric proteins[J]. Cell Mol Life Sci, 2006, 63(6):723-734.
[8] Combaret L, Adegoke OA, Bedard N, et al.USP19 is a ubiquitin-specific protease regulated in rat skeletal muscleduringcatabolic states[J]. Am J Physiol Endocrinol Metab, 2005, 288(4):693-700.
[9] Bédard N, Jammoul S, Moore T, et al. Inactivation of the ubiquitin-specific protease 19 deubiquitinating enzyme protects againstmuscle wasting[J]. FASEB J, 2015, 29(9): 3889-3898.
[10] Liu N, Kong T, Chen X, et al. Ubiquitin-specific protease 14 regulates LPS-induced inflammation by increasing ERK1/2 phosphorylation and NF-kB activation[J]. Mol Cell Biochem, 2017. doi: 10.1007/s11010-017-2978-0. [Epub ahead of print]
[11] Penna F, Costamagna D, Fanzani A, et al. Muscle wasting and impaired myogenesis in tumor bearing mice are preventedby ERK inhibition[J]. PLoS One, 2010, 5:e13640.
[12] Koistinen HA, Chibalin AV, Zierath JR. Aberrant p38 mitogen-activatedprotein kinase signaling in skeletal muscle from Type 2 diabeticpatients[J]. Diabetologia, 2003, 46(10): 1324-1328.
Effect and Mechanism of Ubiquitin-specific Peptidase 19 on Muscle Atrophy of Chronic Obstructive Pulmonary Disease Induced by Cigarette Smoke Exposure in Rats
LIU Qian, LIU Song, XU Wei-guo, GUAN Si-bin, GUO Xue-jun
(Department of Respiration Medicine,Xinhua Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200092)
ObjectiveTo investigate the effects of ubiquitin-specific peptidase 19 (USP-19) on rats bearing chronic obstructive pulmonary disease (COPD) induced by cigarette smoke (CS) exposure .MethodsRats exposed to chronic CS was chosen for the study. For histological examination, lungs and quadriceps femoris muscle were stained with hematozylin and eosin. Total RNA and protein were extracted for Real-time PCR and Western blot analysis to assess the MHC, USP-19 and MAPKs gene expression .ResultsTwelve weeks CS exposure produced lung lesions that morphologically resembled human emphysema, leading to the enlargement of alveolar ducts. Skeletal cell numbers per high-power (HP) lens increased after 12 weeks by 40% in comparison with the control group, suggesting muscle wasting. Chronic CS exposure decreased the mRNA level of MHC. MHC protein content in the quadriceps femoris muscle was decreased in the 8- and 12-week groups. CS significantly stimulated phosphorylation of ERK1/2, p38 without altering the total ERK1/2, p38 content .ConclusionsCigarette smoke-induced skeletal muscle atrophy is associated with up-regulation of USP-19, which via MAPKs probably.
Cigarette smoke exposure; Ubiquitin-specific peptidase 19 (USP-19); Chronic obstructive pulmonary disease (COPD); Muscle atrophy; Mitogen-activated protein kinases (MAPKs)
Q95-33
A
1674-5817(2017)03-0185-06
10.3969/j.issn.1674-5817.2017.03.003
2017-03-20
上海市卫生局青年科研项目(编号: 20134Y015)和国家青年科学基金项目(81400026)
刘 乾(1980-), 女, 医学博士, 呼吸科主治医师, 从事呼吸系统疾病研究。
E-mail: liuqian_1980@hotmail.com
郭雪君(1964-), 男, 医学博士, 呼吸科主任医师, 从事呼吸系统疾病研究。E-mail: snowgen@126.com
