参附注射液联合胸部γ-刀放疗的临床疗效观察
2017-07-19刘建红宋琳琳刘传祥杨爱珍阳文新
申 红,姚 露, 刘建红, 宋琳琳,刘传祥,杨爱珍,阳文新
·论 著·
参附注射液联合胸部γ-刀放疗的临床疗效观察
申 红1,姚 露1, 刘建红2, 宋琳琳1,刘传祥1,杨爱珍1,阳文新1
目的 观察参附注射液联合胸部γ-刀治疗恶性肿瘤的临床疗效。 方法 将解放军第81医院收治的40例有胸部病灶的恶性肿瘤患者随机分成2组,治疗组为参附注射液联合γ-刀放疗,对照组为单纯γ-刀放疗,比较2组临床疗效及毒副作用。 结果 治疗组疾病控制率为65%,对照组为50%,2组疾病控制率差异无统计学意义(P>0.05);2组总生存期差异无统计学意义(P>0.05);治疗组生活质量总改善率明显高于对照组(65%vs40%,P<0.05);治疗后,治疗组体液免疫指标、细胞免疫指标、恶病质细胞因子水平较对照组均有明显改善(P<0.05);治疗组高级别放射性肺损伤发生率为20%,明显低于对照组的60%(P<0.05)。 结论 参附注射液能减轻因γ-刀放疗引起的不良反应,治疗组患者生活质量及免疫功能有显著性改善,具有临床获益。
参附注射液;γ-刀;胸部放疗;临床疗效
γ-刀放射治疗在胸部肿瘤综合治疗中起重要作用,不管是姑息术后或根治术后,均可明显提高高复发患者的疾病控制率和总生存期,减轻患者疼痛,缓解症状。在治疗过程中,也会因放疗引起相应的不良反应。大多胸部放射治疗会引起放射性肺损伤(radiation-induced lung injury,RILI),轻则影响治疗疗效,重则危及患者生命[1-2]。参附注射液主要成分为人参皂苷和水溶性生物碱,两种成分具有益气补阳、活血化瘀、促进骨髓干细胞增殖和改善骨髓造血微循环的作用[3]。本文回顾性分析参附注射液联合γ-刀放疗胸部病灶治疗恶性肿瘤的临床疗效。
1 资料与方法
1.1 一般资料 选取经解放军第81医院自2014年1-12月收治的40例恶性肿瘤患者,随机分成治疗组和对照组,每组各20例。2组患者年龄、性别、卡氏评分(KPS)、病种等差异均无统计学意义(P>0.05)。所有患者均签署知情同意书,审查(批准号:81YY-KYLI-17-03)通过医院伦理委员会要求。病例选入标准:经病理学和影像学诊断确诊胸部病灶需行γ-刀放射治疗;KPS评分≥70分;预计生存期≥3个月;γ-刀治疗距末次治疗时间间隔≥1个月;无历史放射性肺损伤。剔除标准:患者患有严重肝肾功能障碍;全身多发转移。40例患者一般临床资料见表1。
表1 40例恶性肿瘤患者一般临床资料
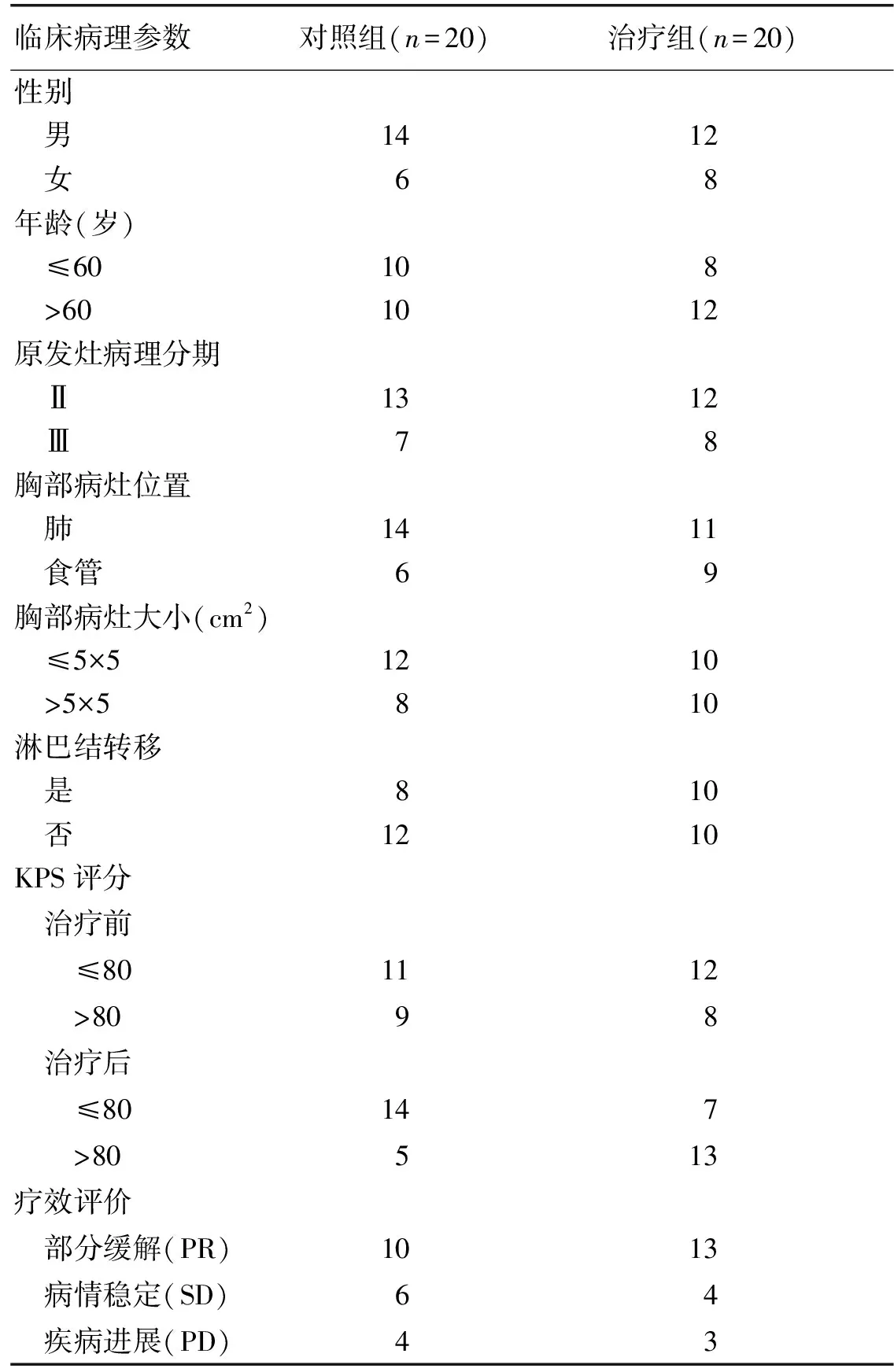
临床病理参数对照组(n=20)治疗组(n=20)性别 男1412 女68年龄(岁) ≤60108 >601012原发灶病理分期 Ⅱ1312 Ⅲ78胸部病灶位置 肺1411 食管69胸部病灶大小(cm2) ≤5×51210 >5×5810淋巴结转移 是810 否1210KPS评分 治疗前 ≤801112 >8098 治疗后 ≤80147 >80513疗效评价 部分缓解(PR)1013 病情稳定(SD)64 疾病进展(PD)43
1.2 治疗方案 2组均采用相同的放疗方案:所有患者采用真空负压袋仰卧位固定,患者保持平静呼吸,行螺旋CT扫描,从颈中线至膈肌下3 cm的全肺组织,层厚3~5 cm,获得定位图像,将所获得的定位图像传输至γ-刀治疗计划系统,在计划系统中对患者体表、靶点、敏感组织等结构进行三维图像重建。治疗师勾画靶区,95%靶体积接受处方剂量辐射,处方剂量为6 Gy,隔天治疗1次,共5次。治疗组在同步放疗基础上给予参附注射液:参附注射液50 mL +5%葡萄糖250 mL,1次/d,连续静滴10 d。10 d为1个疗程,共进行1个疗程治疗。2组患者若出现明显放疗反应,给予对症处理。1个疗程结束1个月后进行疗效评价。
1.3 观察及检测项目 观察患者治疗前后体征变化;治疗前后血变化;治疗前后及随访均进行CT;治疗前后KPS评分;治疗前后T淋巴细胞亚群检测;治疗前后白介素1(IL-1)、白介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平检测。
1.4 疗效评定标准
1.4.1 放疗反应评价 放疗反应判断标准根据RTOG(Radiation Therapy Oncology Group)制定的急慢性放射性损伤分级标准,主要观察放射性肺损伤发生情况以及血液学指标。放射性肺损伤具体标准[4-5]如下:0级,无变化;1级,阵发性轻微咳嗽或活动时伴有气短;2级,持续反复咳嗽,使用麻醉性镇咳药治疗可缓解;3级,使用麻醉性镇咳药无法缓解的严重咳嗽,需临床行间断氧气支持、皮质激素等对症治疗;4级,伴有严重呼吸功能障碍,临床需要进行持续吸氧等对症治疗。血液学评价指标如下:0级,WBC≥4×109/L,HB≥110 g/L,PLT≥100×109/L;1级,WBC∈(3~4)×109/L,HB∈(95~110)g/L,PLT∈(75~100)×109/L;2级,WBC∈(2~3)×109/L,HB∈(75~95)g/L,PLT∈(50~75)×109/L;3级,WBC∈(1~2)×109/L,HB∈(50~75)g/L,PLT∈(25~50)×109/L;4级,WBC<1×109/L,PLT<25×109/L或自发性出血。
1.4.2 疗效评价 治疗1个月后,按RECIST(Response Evaluation Criteria in Solid Tumor)疗效评价标准:疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、病情稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)=CR+PR,疾病控制率(disease control rate,DCR)=CR+PR+SD[6]。
1.4.3 免疫功能评价 治疗前后体液免疫检测指标:免疫球蛋白(IgG)、补体C3、补体C4[7-8]。检测方法为Western-blot。治疗前后细胞免疫检测指标:总T细胞(CD3+)、辅助性T细胞Th(CD4+)、杀伤性T细胞Tc(CD8+)、CD4+/CD8+水平[9]。检测方法为细胞流式。治疗前后恶病质细胞因子水平:IL-1、IL-6、TNF-α[10-11]。检测方法为ELISA。
1.4.4 生活质量评价 以KPS积分为标准,分别于治疗前、后给予评分。显著改善:增加≥20分;改善:增加10~19分;稳定:增减10分之内;减退:减少>10分。总改善率=显著改善率+改善率[12-13]。

2 结 果
2.1 疗效评价结果 治疗组ORR为65%(13/20),DCR为85%(17/20);对照组ORR为50%(10/20),DCR为80%(16/20)。2组疾病控制率差异无统计学意义(P>0.05)。2组患者在治疗前后分别进行KPS评分,治疗组总改善率为65%(13/20),对照组总改善率为40%(8/20),治疗组生活质量总改善率明显高于对照组(P<0.05)。
2.2 免疫功能评价结果 治疗前,治疗组与对照组体液免疫指标IgG、补体C3、补体差异无统计学意义(P>0.05)。治疗后,治疗组补体C3、C4水平明显高于对照组(P<0.05),治疗组IgG较治疗前显著升高(P<0.05)。见表2。
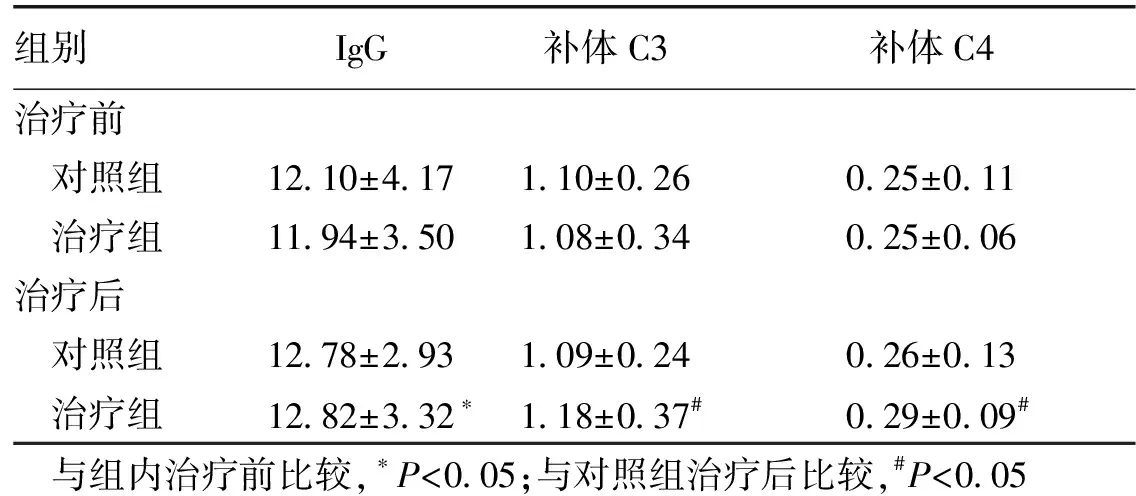
组别IgG补体C3补体C4治疗前 对照组12 10±4 171 10±0 260 25±0 11 治疗组11 94±3 501 08±0 340 25±0 06治疗后 对照组12 78±2 931 09±0 240 26±0 13 治疗组12 82±3 32∗1 18±0 37#0 29±0 09#与组内治疗前比较,∗P<0 05;与对照组治疗后比较,#P<0 05
治疗前,治疗组与对照组细胞免疫指标CD3、CD4、CD8、CD4/CD8差异无统计学意义(P>0.05)。治疗后,治疗组CD3、CD4、CD8水平明显高于对照组(P<0.05),治疗组CD3、CD4水平较治疗前显著升高(P<0.05)。见表3。
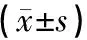
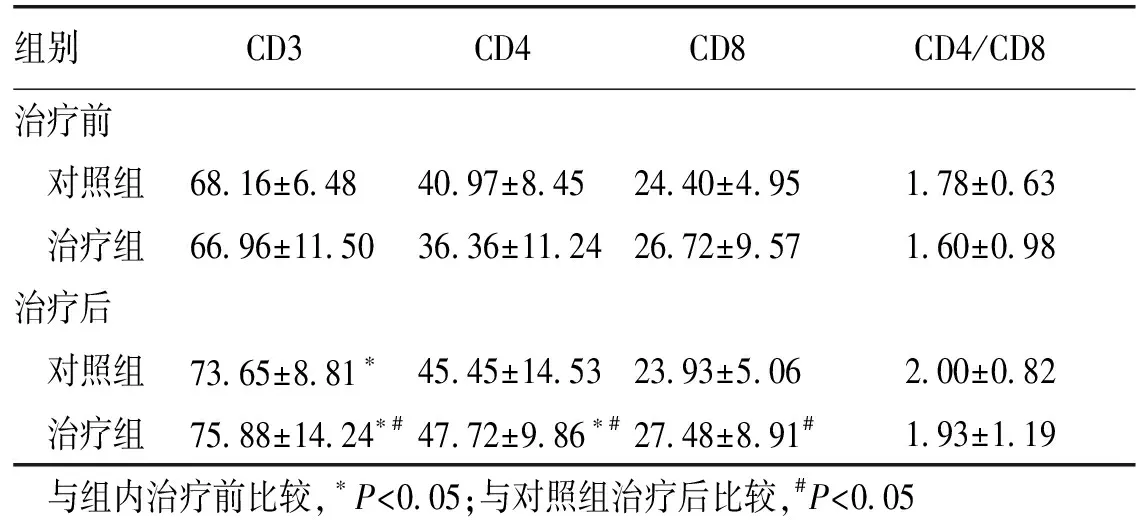
组别CD3CD4CD8CD4/CD8治疗前 对照组68 16±6 4840 97±8 4524 40±4 951 78±0 63 治疗组66 96±11 5036 36±11 2426 72±9 571 60±0 98治疗后 对照组73 65±8 81∗45 45±14 5323 93±5 062 00±0 82 治疗组75 88±14 24∗#47 72±9 86∗#27 48±8 91#1 93±1 19与组内治疗前比较,∗P<0 05;与对照组治疗后比较,#P<0 05
治疗前,治疗组与对照组恶病质因子IL-1、IL-6、TNF-α水平差异无统计学意义(P>0.05)。治疗后,治疗组IL-1、IL-6、TNF-α水平明显低于对照组(P<0.05)。见表4。
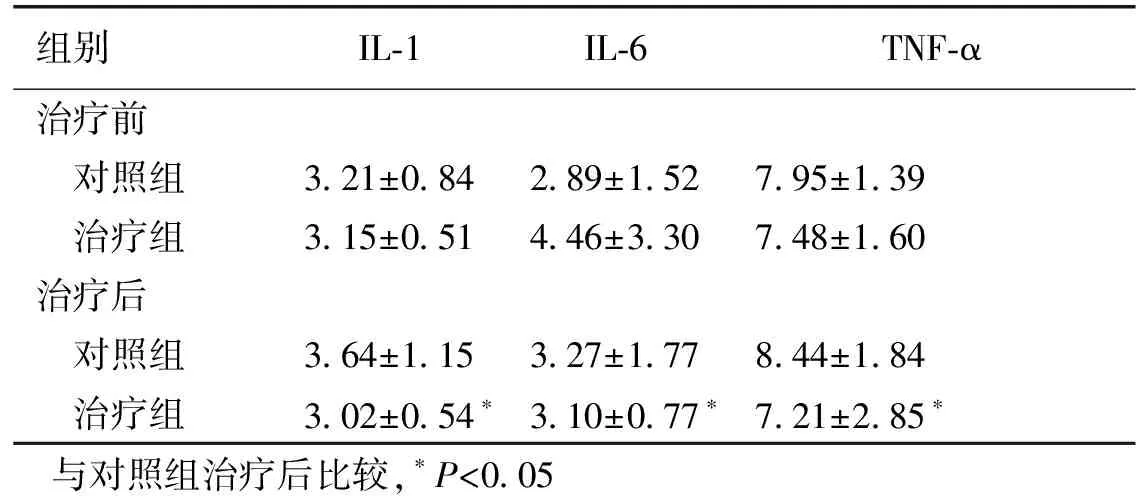
组别IL⁃1IL⁃6TNF⁃α治疗前 对照组3 21±0 842 89±1 527 95±1 39 治疗组3 15±0 514 46±3 307 48±1 60治疗后 对照组3 64±1 153 27±1 778 44±1 84 治疗组3 02±0 54∗3 10±0 77∗7 21±2 85∗与对照组治疗后比较,∗P<0 05
2.3 放疗反应评价结果 治疗后,治疗组患者血象分级低于2级有16例,而对照组患者血象分级处于2级及以上有12例,表明治疗组血象较对照组受放疗损伤程度低。见表5。
表5 各组恶性肿瘤患者治疗后血象比较(n)
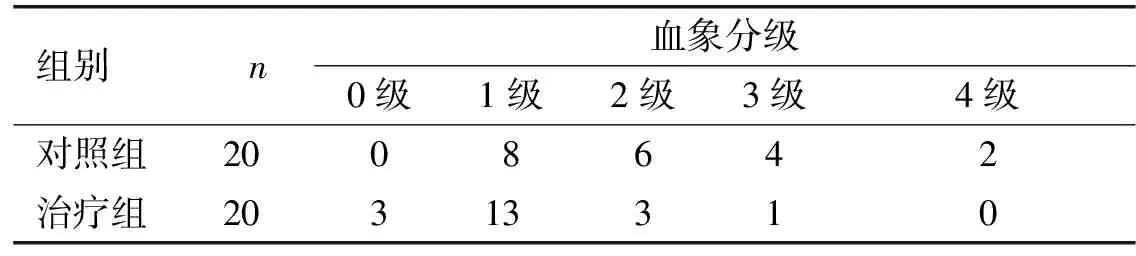
组别n血象分级0级1级2级3级4级对照组2008642治疗组20313310
治疗1个月后,对所有患者进行随访,随访率100%。对照组2级以上放射性肺损伤发生情况[12例(60%)]明显高于治疗组的4例(20%),差异有统计学意义(P<0.05)。见表6。
表6 各组恶性肿瘤患者治疗后放射性肺损伤发生情况(n)
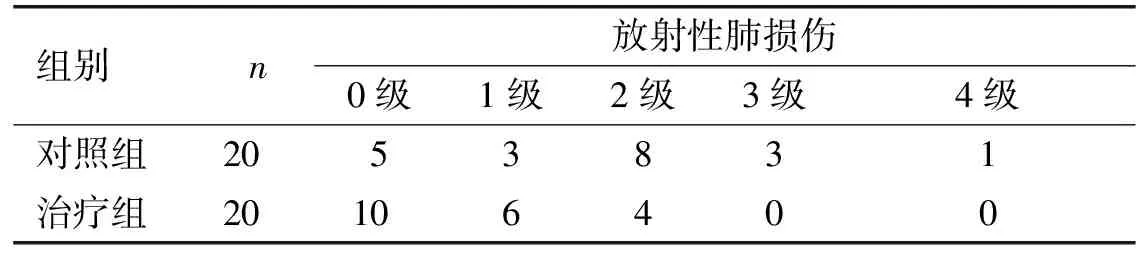
组别n放射性肺损伤0级1级2级3级4级对照组2053831治疗组20106400
3 讨 论
γ-刀放射治疗是目前治疗胸部肿瘤的重要治疗手段,可降低肿瘤的复发转移和死亡率,提高患者的局部控制率,改善患者生活质量。本研究结果显示治疗组和对照组在接受γ-刀治疗后均取得较好的疾病控制率,与相关文献报道结果一致[14-16]。在放射治疗过程中,部分肺组织因受到一定剂量的射线照射而引起不同程度的放射性损伤,一般发生在放疗1个月后,主要表现为急性放射性肺炎和慢性肺间质纤维化。严重的放射性肺损伤会影响患者的治疗疗效、生活质量甚至导致死亡[17-19]。并且因人体造血系统对放射线极其敏感,放射治疗对血变化影响较大,多引起白细胞计数及血小板计数不同程度的下降[20-22]。放疗引起的各类不良反应严重限制了放疗剂量及放疗作用,因此如何有效预防或降低放疗不良反应,是提高放疗疗效和改善患者生活质量的关键。
相关文献报道,参附注射液结合放化疗治疗能减轻放化疗的不良反应,改善机体状况,提高治疗疗效。参附注射液主要成分为人参皂苷和乌头碱类,其具有益气温阳、益气固脱等多重作用,不仅可以提高放化疗疗效,使肿瘤细胞更多凋亡,而且还可以促进造血干细胞的增殖分化,减轻血液中的不良反应。中医认为,放射性肺损伤发病机制为阴伤、气虚、血瘀,故参附注射液的回阴救逆功效可对放射性肺损伤有辩证治疗作用[23-24]。尚无文献报道参附注射液联合γ-刀放疗的临床疗效研究,故本试验创新性地开展这项研究,旨在探讨参附注射液在胸部γ-刀放疗中的临床作用。
本研究结果显示,治疗组高级别放射性肺损伤发生率明显低于对照组。其结果与相关文献报道参附注射液中的人参皂苷可激活蛋白激酶及钙调蛋白,促进肺表面活性物质合成,从而降低肺损伤的结果相符[25-27]。治疗后,对照组血中白细胞、血小板均有不同程度下降,白细胞下降尤为明显,而治疗组无明显下降且各指标水平均明显高于对照组。其结果与相关文献报道参附注射液可促进骨髓干细胞分化增殖和改善骨髓造血微循环,对骨髓抑制有一定的保护作用结果相一致[3,28]。体液免疫测定的3项指标结果显示,治疗后治疗组补体C3、补体C4水平明显高于对照组,IgG水平差异无统计学意义。补体C3、C4主要参与补体传统途径活化作用,其结果提示参附注射液可提高患者补体水平,与相关文献报道参附注射液可明显调节晚期肿瘤患者的补体水平结果相符[7-8]。细胞免疫测定结果显示,治疗后对照组CD3、CD4、CD8水平明显低于治疗组,且治疗组CD3、CD4水平较治疗前显著性升高。其结果说明参附注射液可提高机体细胞免疫功能,改善机体免疫状态,与相关文献报道结果一致[9,29]。恶病质细胞因子测定结果提示,治疗后治疗组各恶病质细胞因子水平均明显低于对照组。已有多项研究表明,IL-1、IL-6、TNF-α在放射性肺损伤中具有重要意义,在发生放射性肺损伤的患者中IL-1、IL-6、TNF-α均表现为高表达[30-31]。对照组在治疗后各指标均有不同程度升高,呈现高表达状态,高级别放射性肺损伤发生率明显高于治疗组,与相关文献报道结果相符。总生存期随访分析结果显示2组患者差异无统计学意义,考虑到试验样本量不多,且1年随访生存期不长,可能影响试验结果。后续考虑扩大样本量,延长随访时间,进行更为深入研究。
本试验旨在研究参附注射液在γ-刀放疗治疗恶性肿瘤的临床作用,其结果初步表明,γ-刀放疗期间联合参附注射液,不仅可降低高级别放射性肺损伤的发生率,减少患者痛苦,提高患者生活质量,而且在一定程度上可以改善患者免疫功能,调节免疫状态,可作为放疗的辅助治疗手段治疗恶性肿瘤,具有临床获益。本试验后期将扩大样本量,选择单病种,延长试验周期,增加总生存期、生存曲线函数等评价指标,更深入研究参附注射液在放射治疗恶性肿瘤过程中的短期及长期效应。
[1] Marks LB.Dosimetric predictors of radiation-induced lung injury[J]. Int J Radiat Oncol Biol Phys,2002,54(2):313-316.
[2] 韩水云,孙晓江,许亚萍.放射性肺损伤的风险预测研究进展[J]. 中华放射肿瘤学杂志,2015,24(2):222-224.
[3] 陈 越,蒋霆辉,孙贤俊, 等.参附注射液治疗肿瘤慢性贫血临床观察及机制初探[J]. 山东医药,2009,49(8):72.
[4] Vasic L,Durdeyic P. Radiation-induced lung damage-etiopathogenesis,clinical features,imaging findings and treatment[J]. Med Pregl,2012,65(7):319-325.
[5] 张 毅,任秦有,郑 瑾,等.放射性肺损伤的研究进展[J]. 现代肿瘤医学,2015,23(5):712-715.
[6] 陈耐华.RECIST1.1标准和RECIST1.0标准对大肠癌肝转移疗效评价的比较[J]. 中国当代医药,2015,22(32):63-65.
[7] 王 亮,王 磊.血清补体C3、C4的表达变化与肝癌患者不同child-pugh分级的关系[J]. 中国误诊学杂志,2012,12(5):1076-1077.
[8] 龚清安,李 媛.直肠癌患者术后疼痛程度与血清补体C3、C4水平的相关性分析[J]. 重庆医学,2014,43(23):3008-3010.
[9] 张仲苗,江 波,郑筱祥.人参皂苷Rg3对肿瘤放疗患者外周血淋巴细胞的体外免疫增强作用[J]. 中国药学杂志,2004,39(4):261-264.
[10] 阳 昕,王志东.巨噬细胞抑制因子-1与癌症相关恶病质[J]. 肿瘤防治研究,2013,40(3):308-311.
[11] 匡唐洪,杨洁文,蒋沈君,等.益气养阴汤多气阴两虚型肺癌恶病质患者细胞因子影响的临床研究[J]. 中国中医药科技,2014,21(1):12-14.
[12] 沈 建,周 徐,涛邓梅.消涨散腹部穴位贴敷联合西药治疗低KPS评分恶性腹腔积液疗效观察[J]. 实用中医药杂志,2015,31(9):798-799.
[13] 麻宏亮,张洪涛.化疗联合中药对中晚期非小细胞肺癌患者免疫红能和KPS评分的影响[J]. 海南医学,2014,25(15):2271-2272.
[14] 王 强,叶 涛,陈宏林,等.参附注射液降低放射性肺损伤的初步研究[J]. 中国中医药咨讯,2011,3(20):90-91.
[15] Bradley J, Graham M, Winter K,etal.Toxicity and outcome results of RTOG9311:A phase Ⅰ-Ⅱ dose-escalation study using three-dimensional conformal radiotherapy in patients with inoperable non-small-cell lung carcinoma[J]. Int J Radiat Oncol Biol Phys,2005,61(2):318-328.
[16] Robnett TJ,Machtay M,Vines EF,etal.Factors predicting severe radiation pneumonitis in patients receiving definitive chemoradiation for lung cancer [J]. Int J Radiat Oncol Biol Phys,2000,48(1):89-94.
[17] 潘丁龙,李建成,杨 燕,等.210例中晚期食管癌放化疗的预后因素分析[J]. 临床肿瘤学杂志,2015,20(2):140-144.
[18] GUPta A,Roy S,Majumdar A,etal. A randomized study to compare sequential chemoradiotherapy with concurrent chemoradiotherapy for unresectable locally advanced esophageal cancer[J]. Indian J Med Paediatr Oncol,2014,35(1):54-59.
[19] van Hagen P, Hulshof MC, van Lanschot JJ,etal. Preoperative chemoradiotherapy for escophageal or junctional cancer[J]. N Engl J Med,2012,366(22):2074-2084.
[20] 赵向飞,康静波,聂 青,等.髓母细胞瘤患者全脑全脊髓放疗的血液学毒性观察[J]. 军事医学,2012,36(5):385-388.
[21] 周向毅,丁 妍,陈邦元,等.复方康复灵对体部伽玛刀治疗非小细胞肺癌引起的急性放射反应的防护作用[J]. 东南国防医药,2015,17(5):455-457.
[22] 赵学梅,崔红霞,张冬梅.姬松茸多糖对荷瘤小鼠放疗后造血系统损伤的保护作用[J]. 齐齐哈尔医学院学报,2009,30(6):666-670.
[23] 杨薇薇,张志刚.参附注射液联合放疗治疗晚期恶性肿瘤的疗效观察[J]. 健康必读杂志,2012(8):74.
[24] 朱 红,中蓖方,涂青松.参附注射液辅助治疗中晚期恶性肿瘤对提高生活质量的临床研究[J]. 中国现代医学杂志,2003,3(6):40.
[25] 胡作为,杨 航.中医药防治放射性肺损伤的研究进展[J]. 湖北中医杂志,2013,35(3):76-77.
[26] Bakkal BH. Effect of ozone oxidative preconditioning in preventingearly radiation induced lung injury in rats[J]. Braz J Med Biol Res,2013,46(9):789-796.
[27] Jang SS. Melatonin reduces X ray radiation induced lunginjury in mice by modulating oxidative stress and cytokine expression[J]. Int J Radiat Biol,2013,89(2):97-105.
[28] Vasic L,Durdeyic P. Radiation induced lung damage-etiopathogenesis,clinical features,imaging findings and treatment[J]. Med Pregl,2012,65(7):319-325.
[29] 李京宁,赵成民,刘渤娜,等.化疗结合参附注射液治疗恶性肿瘤的临床观察[J]. 上海中医药杂志,2005,39(2):21.
[30] 崔 莹,吕 达,乔文波.IL-6、IL-8、IL-10与放射性肺损伤相关性研究[J]. 实用肿瘤学杂志,2014,28(3):202-206.
[31] Crohns M, Saarelainen S, Laine S,etal. Cytokines in bronchoalveolar lavage fluid and serum of lung cancer patients during radiotherapy-Association of interleukin-8 and VEGF with survival[J]. Cytokine,2010,50(1):30-36.
(本文编辑:叶华珍; 英文编辑:王建东)
Clinical effect of shenfu injection combined with γ-knife in chest radiotherapy
SHEN Hong1,YAO Lu1, LIU Jian-hong2, SONG Lin-lin1, LIU Chuan-xiang1, YANG Ai-zhen1, YANG Wen-xin1
(1.EmergencyDepartment,the81thHospitalofPLA,Nanjing210002,Jiangsu,China;2.OutpatientDepartment,theRocketGeneralHospitalofPLA,Beijing100820,China)
Objective To observe the clinical effect of shenfu injection combined with γ-knife in the treatment of chest malignant tumor. Methods 40 malignant tumor patients with chest lesions were randomly divived into 2 groups. The treatment group was given shenfu injection combined with γ-knife radiotherapy, and the control group was given γ-knife radiotherapy. To compare clinical curative effect and side effect of the two groups Results The DCR had no significant difference in the two groups (P>0.05) with the treatment group 65% and the control group 50%. The OS of the two groups was not significantly different(P>0.05). After the therapy, the improvement of the quality of life in the treatment group was significantly higher than that in the control group (P<0.05). The treatment group was 65% and the control group was 40%. After the therapy, the humor immunity, cellular immunity, cachexia cytokine of the treatment group were improved significantly than those of the control group (P< 0.05). The high-level RILI incidence in the treatment was significantly lower than that in the control group (P<0.05). The treatment group was 20% and the control group was 60%. Conclusion The shenfu injection can reduce the side effects caused by γ-knife radiotherapy. The quality of life and the immune function in the treatment group are significant improved. The shenfu injection has a certain clinical benefit.
Shenfu injection; γ-knife; Chest radiotherapy; Clinical effect
1.210002南京,解放军第81医院急诊科;2. 100820北京,火箭军总医院礼士路门诊部
刘建红,E-mail:jhliuluan@sina.com
申 红,姚 露, 刘建红,等.参附注射液联合胸部γ-刀放疗的临床疗效观察[J].东南国防医药,2017,19(3):243-247.
R730.55
A
1672-271X(2017)03-0243-05
10.3969/j.issn.1672-271X.2017.03.005
2017-02-23;
2017-04-12)
