Cs137辐照对甲状腺FRTL细胞RET及RAS-MAPK信号通路的影响
2017-07-19谢红艳唐正午赵维超丁德馨
殷 杰, 胡 南, 李 乐, 谢红艳,唐正午, 赵维超, 丁德馨
(南华大学 药学与生物科学学院,湖南 衡阳 421001)
Cs137辐照对甲状腺FRTL细胞RET及RAS-MAPK信号通路的影响
殷 杰, 胡 南, 李 乐, 谢红艳,唐正午, 赵维超, 丁德馨
(南华大学 药学与生物科学学院,湖南 衡阳 421001)
探讨不同剂量的Cs137对甲状腺FRTL细胞RET蛋白以及下游MAPK信号通路的影响.通过不同剂量 (0.05,0.1,0.15,0.2,0.5,1 Gy) Cs137,对甲状腺FRTL细胞进行辐照,MTT法检测细胞增殖抑制率,Western blot检测未辐照组,辐照敏感组和辐照抗性组中RET及下游RAS、RAF、MEK蛋白表达情况.结果:甲状腺FRTL细胞在0.2 Gy辐照时辐照敏感度增加;而到1 Gy辐照时辐照抗性增加. 在0.2 Gy辐照敏感条件下,诱导RET、RAS、RAF、MEK蛋白表达下调;而当1 Gy 辐照时,RET、RAS、BRAF、MEK蛋白表达上调.不同剂量Cs137辐照能够诱导RET蛋白表达,对后面MAPK信号通路存在影响,最终影响到甲状腺FRTL细胞的细胞增殖抑制率,诱导甲状腺低剂量辐射致癌成为可能.图3,表2,参12.
甲状腺FRTL细胞;低剂量辐射;RET;MAPK信号
甲状腺癌是内分泌系统中最常见的一类癌症.其中甲状腺乳头状癌是发病率最高的甲状腺恶性肿瘤,占甲状腺癌的70%~80%,占全身恶性肿瘤的1%~2%[1],女性多见,近年来其发病率有上升趋势.
目前对甲状腺癌发生的分子机制的研究较少.近年来研究发现,在甲状腺癌中,存在一种原癌基因RET基因,与甲状腺癌的发生、发展有密切的关系[2].辐射可促使DNA的双链断裂,从而引起RET基因激活[4].Collins等[5]研究证实了RET基因激活与放射暴露因素密切相关[6].RET癌基因活化已经确定,其与辐照剂量关系尚未明确,RET受辐射剂量影响诱导甲状腺致癌成为研究的重点.
RAS/RAF/MEK通路是“MAPK”众多信号通路中的一个分支[7-12],该通路与细胞的生长、增殖、分化、凋亡、转移紧密相关.RAS基因的激活,可诱导甲状腺癌细胞异常增殖,侵袭生长和转移.因此,RAS/RAF/MEK信号通路将成为甲状腺癌发生的一个重要通路,该信号传导通路的异常激活与甲状腺癌的发生及恶性进展密切相关.
1 材料与方法
1)甲状腺FRTL细胞(ATCC细胞株)购于上海拜力生物科技有限公司.
2)将辐照细胞密度调整为5×105细胞/mL,再取用5×106个细胞及10 mL细胞溶液移至新培养瓶,待细胞贴壁完全,即可用于辐照.采用不同剂量(0.05,0.1,0.15,0.2,0.5,1,2 Gy)Cs137辐照甲状腺FRTL细胞后将其接种于96孔板,每孔1×104个细胞,八个剂量组(0.05,0.1,0.15,0.2,0.5,1,2 Gy),每组种植10个复孔,分别培养(3,9 h)后,加入cck-8试剂(每孔10 μL)置于37 ℃恒温箱培养3 h后,在酶联免疫仪450 nm波长下测吸光度OD450值,根据公式计算出各组细胞的细胞增殖抑制率.
3)Western Blot检测未辐照组、低剂量辐射敏感组(0.2 Gy)和辐射抗性组(1 Gy)中RET,RAS,RAF和MEK蛋白表达情况.
4)实验数据结果均采用单因素方差分析,并通过SPSS13.0软件系统进行统计分析,显著性标准为P<0.05.
2 结 果
1)甲状腺FRTL细胞生长情况
甲状腺细胞FRTL细胞常规培养于含10 %新生牛血清的DMEM培养液中,置于37 ℃,5 % CO2培养箱培养,细胞经传代和收集,取对数生长期细胞进行实验.生长情况见图1.

图1 甲状腺FRTL细胞观察图(放大倍数:10×和40×)Fig.1 Observation of thyroid FRTL cells (Magnification: 10 × and 40 ×)
2)不同剂量固定辐照的Cs137对甲状腺FRPL细胞增殖抑制率的影响
根据细胞增殖抑制率公式:
IR(inhibitor rate)(%)=(1-辐照组OD450值/未辐照组OD450均值)×100%
计算出辐照6 h和12 h后所对应的细胞增殖抑制率,见表1和图2.

图2 不同剂量Cs137固定辐照甲状腺FRPL细胞6h、12h细胞增殖抑制率(%)Fig 2 Different dose of Cs137 fixed irradiated FRTL cells in cell proliferation inhibition rate after 6 and 12 hours 0.2和0.5 Gy辐照剂量组与其他辐照剂量组比较:细胞增殖抑制率有显著性差异,*P<0.05.
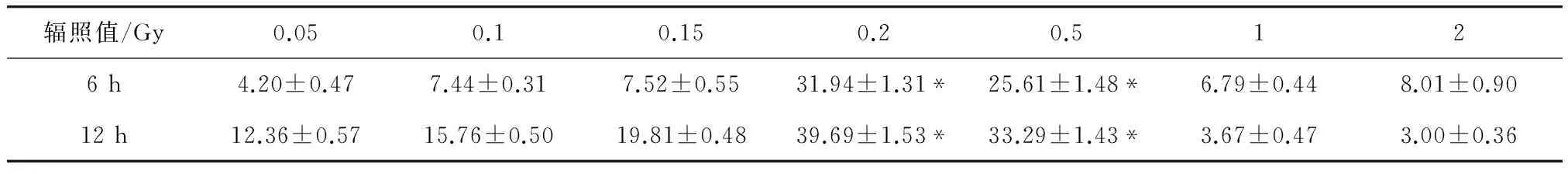
辐照值/Gy0.050.10.150.20.5126h4.20±0.477.44±0.317.52±0.5531.94±1.31*25.61±1.48*6.79±0.448.01±0.9012h12.36±0.5715.76±0.5019.81±0.4839.69±1.53*33.29±1.43*3.67±0.473.00±0.36
0.2和0.5Gy辐照剂量组与其他辐照剂量组比较:细胞增殖抑制率有显著性差异,*P<0.05.
通过对结果分析:细胞辐照敏感性与辐照剂量有直接关系,低剂量超辐射敏感性(HRS)是指细胞在收到单位低剂量辐射时所导致细胞存活分数下降度较大,敏感性增高,一般发生在0.2~0.5 Gy范围内,随着照射剂量增大(0.5~1 Gy)出现敏感下降,即增加辐射抗拒现象(IRR).在低于临界剂量阈值时不足以触发细胞内的修复反应,导致细胞高致死.即HRS,高于该临界值时触发细胞内修复反应,使得细胞存活率增高即IRR.低剂量辐射敏感点和抗性点是研究甲状腺FRTL细胞低剂量辐射敏感性的重要检测点,选定0.2 Gy为甲状腺FRTL细胞低剂量辐射敏感点,1 Gy为甲状腺FRTL细胞辐射抗性点.
3) 不同剂量Cs137对甲状腺FRTL细胞中RET蛋白及RAS,RAF和MEK蛋白影响
Westernblot 检测未辐照组,辐照敏感组(0.2 Gy)和辐照抗性组(1 Gy)中RET、RAS、RAF和MEK蛋白表达情况,结果如下,见图3.

图3 Western blot检测未辐照组,低剂量辐射敏感组(0.2 Gy)和辐射抗性组(1 Gy)中RET、RAS、RAF和MEK蛋白表达情况.Fig 3 Western blot was used to detect the expression of RET,RAS and MEK protein in untreated group,low dose radiation sensitive group (0.2 Gy) and radiation resistant group (1 Gy)
从Western结果:低剂量敏感组(0.2 Gy)RET,RAS,RAF和MEK表达量较未辐照组(0 Gy)和辐射抗性组(1 Gy)表达量低,有显著性差异(P<0.05).说明在0.2 Gy辐照条件下,Cs137抑制RET蛋白表达,从而引起下游RAS、RAF、MEK蛋白表达也相应降低;而当1 Gy 辐照时,Cs137重新激活RET蛋白表达,并引起下游RAS、RAF、MEK蛋白表达增加.说明不同剂量Cs137对RET蛋白及其下游RAS、RAF、MEK蛋白表达不同.

表2 Western Blot检测未辐照组、低剂量辐射敏感组(0.2 Gy)和辐射抗性组(1 Gy)中RET,RAS,RAF,MEK蛋白结果
低剂量辐照敏感组(0.2 Gy)与未辐照组和辐射抗性组(1 Gy)比较: RET、RAS、RAF和MEK蛋白均有显著性差异,*P<0.05.
3 讨 论
RET 作为原癌基因,能够编码跨膜的酪氨酸蛋白激酶受体,RET蛋白的酪氨酸激酶功能区发生自动磷酸化而激活,通过RAS/有丝分裂原激活蛋白激酶(MAPK)途径,从而对细胞进行调节.而RAS是调节细胞生长的重要蛋白,其中RAS与肿瘤有紧密相关,它在肿瘤细胞表达可高达80%,RAS高表达会引起辐射抗性,说明抗辐射作用与RAS活性相关.RAS基因改变可以影响细胞对辐射的敏感度,RAS通过哪些信号转导途径介导细胞的辐射抗性还不完全清楚.RAS-MAPK信号通路是细胞与辐射抗性相关的重要信号途径,它在多种致瘤性疾病中通常是上调的.同样,该信号传导通路的异常激活与甲状腺癌的发生及恶性进展密切相关.RAS-MAPK通路在正常细胞中表达式如何的?它的上游因子是谁?它的表达高低与辐射剂量之间到底存在什么样的关系?这些都是丞待解决的问题.
通过实验发现在低剂量0.2 Gy辐照时,可以抑制RET蛋白表达,从而抑制下游RAS/RAF/MEK蛋白表达,引起甲状腺FRTL细胞对辐照敏感度增加;而在1 Gy辐照时,刺激RET蛋白高表达,并诱导下游RAS/RAF/MEK蛋白表达,甲状腺FRTL细胞对辐照产生抗性. 说明RET蛋白是RAS-MAPK上游的一个很重要的调控因子,不同剂量Cs137通过调控RET及其下游RAS-MAPK相关蛋白表达,最终影响甲状腺FRTL细胞辐射敏感性.另外RET,RAS蛋白作为原癌基因被广泛被关注,低剂量辐射致癌成为当前研究的一项重要热点,在1 Gy固定辐照后RET、RAS蛋白高表达,甲状腺低剂量辐射致癌成为可能.
总之,RET和RAS-MAPK信号途径 与正常细胞辐射致癌之间关系紧密相关.从分子水平揭示正常细胞低剂量辐射致癌的机制至关重要,有望为正常细胞辐射防护开拓新的思路.
[1] Ain K B. Etiology assessment and therapy papillary thyroid carcinoma [J]. Endocrinal Metab Clin North Am,1995,24:711-60.
[2] Eng C. Ret proto-oncogene in the development of human cancer [J]. J Clin Oneol,1999,17(l):380-93.
[3] TakahashiM,Ritz J,Cooper G M. Activation of a novel hum an transforming gene retby DNA rearrangement [J].Cell,1985,42 (2):581- 588.
[4] Sun J F,Sui J L,Zhou P K,et al. Decreased Efficiency ofC-ray- induced DNA Double- strand Break Rejoining in MalignantTransformants of Human Bronchial Epithelial CellsGenerated by Alpha- particle Exposure[J].Int Radiat Biol,2002,78(9): 773.
[5] Collins B,Chiappetta G,Schneider A. RET expression in papillary thyroid cancer from patients irradiated in childhood for benign conditions [J].J Clin Endocrinal Metah,2002,87(8):3941-3946.
[6] Ciampi R,Knauf J A,Kerler R,et al. Oncogenic AKAP9-BRAF fusion is a novel mechanism of MAPK pathway of activation in thyroid cancer[J] The Lancet 2001,357(9255):539-545.
[7] Cramer J D,Fu P,Harth K C,et al. Analysis of the rising incidence ofthyroid cancer using the Surveillance,epidemiology and end resultsnational cancer data registry[J].Surgery,2010,148(6):11-47-152.
[8] Tang K T,Lee C H. BRAF mutation in papillary thyroid carcinoma:pathogenic role and clinical implications[J]. J Chin Med Assoc,2010,73(3):113-128.
[9] Henderson Y C,Shellenberger T D,Williams M D,et al. High rate of BRAF and RET/PTC dual mutations associated with recurrent papillarythyroid carcinoma[J]. Clin Cancer Res,2009,15(2): 485- 491.[10] Zafon C,Obiols G. The mitogen -activated protein kinase (MAPK)signaling pathway in papillary thyroid cancer. From the molecular basesto clinical practice[J]. Endocrinol Nutr,2009,56(4): 176 -186.
[11] Stanojevic B,Dzodic R,Saenko V,et al. Mutational and clinico-pathological analysis of papillary thyroid carcinoma in Serbia [J]. EndocrJ,2011,58(5) : 381-393.
[12] Kang D Y,Kim K H,Kim J M,et al. High prevalence of RET,RAS,and ERK expression in Hashimoto's thyroiditis and in papillary thyroidcarcinoma in the Korean population[J].Thyroid,2007,17(11):1031- 1038.
Biography: YIN Jie,male,born in 1981,master,research direction: radioprotection
Cs137on RET and RAS-MAPK Signaling Pathway in FRTL Cells
YIN Jie, HU Nan, LI Le, XIE Hong-yan, TANG Zheng-wu,ZHAO Wei-chao, DING De-xin
(College of Pharmacy and Biological Sciences,University of South China,Hengyang,421001 China)
Objective: To investigate the effect of different doses of Cs137on RET protein and MAPK signaling pathway in FRTL cells. Methods: Thyroid FRTL cells were irradiated with different doses (0.05,0.1,0.15,0.2,0.5,1 Gy) Cs137. MTT assay was used to detect the cell proliferation inhibition rate. The expression of RET,RAS,RAF and MEK protein in untreated group,irradiated sensitive group and irradiated resistant group were detected by Western blot. Results: The irradiation sensitivity of thyroid FRTL cells decreased at 0.2 Gy,while the irradiation resistance increased when irradiated at 1 Gy. The expression of RET,RAS,RAF and MEK protein was down-regulated under 0.2 Gy irradiation,while the expression of RET,RAS,RAF and MEK was up-regulated when 1 Gy was irradiated. Conclusion: Different doses of Cs137can induce the expression of RET protein,which may affect the subsequent MAPK signal pathway,and ultimately affect the cell proliferation inhibition rate of FRTL cells and induce the thyroid cancer.3figs.,2tabs.,12refs.
Thyroid FRTL cells; low dose radiation; RET; MAPK signal
2017-04-18
湖南省教育厅项目(编号:14C0998);湖南省研究生创新项目(编号:CX2015B386);衡阳市科技局项目(编号:2014KJ07)
殷杰(1981-),男,湖南长沙人,硕士,研究方向:辐射防护.
10.3969/j.issn.2095-7300.2017.02-031
R144.1,R146
A
